3种益生菌分离、鉴定及水质净化和抑菌功能研究
2024-10-12杨宁李金香臧学运翟凯旋



摘要:为筛选可用于微生态制剂的益生菌,从养殖池底泥成功筛选出3株微生物,深入探讨了它们的生物特性、对病原菌的抑制效果以及对水环境的净化能力。分离菌株后,通过形态学观察和16S rRNA基因序列比对分析鉴定,结果显示3株菌株均为芽孢杆菌。测定了3株菌株的生长性能,并分析其耐药性及抑菌效果。结果表明,3株菌株具有抑制大肠杆菌(Escherichia coli)和溶藻弧菌(Vibrio alginolyticus)能力,并且对阿莫西林、硫氰酸红霉素、盐酸多西环素、氨苄西林等9种抗生素敏感。水体中亚硝酸盐(NO-2-N)和氨氮(NH+4-N)含量测定结果显示, 3株菌株具有一定的水质净化作用。筛选出来的3株菌株展现出作为水产饲料添加剂所需的生物学特性,并具备改善水质的潜力。
关键词:芽孢杆菌;菌株鉴定;水质净化;抑菌分析
随着水产养殖规模的不断扩大,养殖过程中不可避免地会产生大量的废弃物,如残饵、排泄物和动物遗体。这些物质会成为病原微生物繁衍的温床,进而破坏水体的微生态平衡,导致水质逐渐恶化[1]。因此,探寻有效方法以改善水质、修复并保持水体微生态平衡变得尤为重要[2]。近年来,微生态添加剂作为抗生素替代产品受到越来越广泛的关注。微生态制剂,又称微生态调节剂,对于改善养殖环境、维持养殖水体微生态平衡以及促进水生动物生长具有重要作用[3]。
芽孢杆菌作为一类既可好氧又可兼性厌氧的细菌,在水产养殖中扮演着至关重要的角色。它们通过促进宿主生长、改善水质和预防疾病,被广泛认为是一种具有广阔应用前景的益生菌[4-5]。芽孢杆菌可以通过多种方式抑制病原菌在肠道内定植,其中包括营养竞争、空间竞争或产生抑制作用的胞外产物[6]。Vaseeharan等[4]研究显示枯草芽孢杆菌BT23对哈维氏弧菌(Vibrio harveyi)有较强的抑制作用,且能够提高斑节对虾的存活率。胡毅等[7]分别用枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(B. licheniformis)及复合益生菌饲喂凡纳滨对虾,发现这些益生菌都能降低肠道弧菌数,且均可提高消化酶和溶菌酶活力。此外,芽孢杆菌可分泌多种高活性水解酶类,有助于促进水产养殖系统中的物质循环和水质净化[8]。刘慧玲等[9]通过分析枯草芽孢杆菌对罗非鱼幼鱼生长环境的影响,观察到该菌种能有效改善水质,显著减少氨态氮和亚硝酸盐的浓度。张庆华等[10]从大黄鱼肠道中提取出地衣芽孢杆菌,经过氨氮和未消化饲料的降解能力测试,证实了该菌种在降解氨氮、蛋白质和淀粉方面的能力。本试验从养殖池塘底泥筛选出3株具有潜力的益生菌,对其生物学特性、对病原菌的抑制作用以及对水质的净化效果进行了深入研究。这些研究成果不仅为开发新型饲料添加剂提供了科学依据,也为芽孢杆菌类微生物制剂的创新开发提供了宝贵的种质资源。
1材料与方法
1.1主要试剂和仪器
主要试剂:蛋白胨、牛肉膏、琼脂粉、氯化钠、氢氧化钠、TCBS琼脂、结晶紫染色液、革兰氏碘液、脱色液、沙黄复染液等。
主要仪器:紫外分光光度计、显微镜、立式压力蒸汽灭菌器、生化培养箱、超净工作台、振荡培养箱等。
1.2采样及菌株的分离培养
从东营市河口区仙河镇的对虾养殖池塘中取底泥和养殖污水置于无菌试剂瓶中,密封低温储存。在无菌条件下,取50 g底泥于100 mL无菌水,振荡摇匀,置于80 ℃水浴10 min,冷却后取5 mL上清液于100 mL LB液体培养基中。37 ℃恒温培养24 h,取1 mL菌液梯度稀释,吸取100 μL菌液涂布于LB琼脂平板上(每个梯度3个平行),将平板放置于37 ℃下培育24 h,观察细菌生长情况。依据单菌落形态,挑取生长良好、菌落形态相似且数目最多的菌落作为目的菌株,分离纯化3次以上,直至菌落形态一致。
1.3菌株鉴定
用显微镜观察单菌落形态,选取3株分离株进行革兰氏染色,分别将其命名为菌株BS-1、BPS-2和BAS-3,将菌液均匀涂在载玻片上,并在酒精灯火焰上进行固定,染色过程包括初步染色、媒染剂处理、脱色和复染色,并镜检观察菌体形态、排列方式、有无芽孢,鉴定其生理特性。
采用16S rRNA技术对微生物进行鉴定是一种常规手段。将分离并纯化后的菌株提交至华大基因进行基因测序。通过在NCBI数据库中比对所得的基因序列,挑选出具有一定相似性且有效生物学命名的16S rRNA序列。随后,使用MEGA7软件构建系统发育树,以评估不同菌株之间的同源性。
1.4生长曲线测定
挑取上述分离纯化的单菌落,接种到LB液体培养基中,37 ℃、120 r/min培养24 h。吸取1 mL活化的菌液接种于100 mL LB液体培养基中,于37 ℃、120 r/min恒温振荡培养,每隔2 h使用紫外分光光度计(上海精科752N)测定菌液OD600值,绘制生长曲线。
1.5抗生素抗性测定
取100 μL分离纯化后的菌液均匀涂布在LB琼脂平板上,将药敏片贴于培养基上,置于37 ℃恒温培养24 h,测量抑菌圈直径。
1.6抑菌性测定
采用溶藻弧菌和大肠杆菌这两种典型病原菌作为检测对象,将1 mL的活性病原菌液与100 mL LB琼脂培养基混合,然后迅速倒入培养皿中形成检测平板。待平板冷却并凝固后,将100 μL的分离菌液注入牛津杯中,接着在37 ℃的恒温条件下培养24 h,最后测量形成的抑菌圈的直径大小。
1.7水质净化效果测定
取养殖池塘污水置于锥形瓶中进行水质净化试验,试验组分别添加的3株菌株浓度维持在105 CFU/mL,对照组不添加任何菌液,每组3个重复。置于37 ℃、120 r/min摇床中培养,每24 h测定NH+4-N、NO-2-N的浓度。采用纳氏试剂分光光度法和N-(1-萘基)-乙二胺光度法,对模拟养殖污水在不同时间段内氨态氮(NH+4-N)、亚硝酸盐(NO-2-N)含量进行测定。
2结果与分析
2.1菌株形态鉴定
将菌株BS-1、BPS-2和BAS-3接种于LB固体培养基,37 ℃培养24 h后,BS-1菌落呈灰白色,形态为圆形,大而扁平,不透明,有异味;BPS-2灰黄色,形状不规则,菌落扁平,边缘不整齐,多缺刻,粗糙多褶,有异味;BAS-3淡黄色,形态为圆形,明显小于普通圆形菌落,不透明,菌体整体黏稠且有异味,表面饱满隆起,边缘整齐,表面湿润、光滑,易挑取。见封二图1。
2.2镜检结果
革兰氏染色结果表明,3株分离菌均为革兰氏阳性菌。BS-1在显微镜下观察菌体呈棒状,多数成链排列,少部分单独存在;BPS-2在显微镜下观察菌体形态为细长的杆状,多数单独存在,少部分成链排列;BAS-3在显微镜下观察菌体形态为短杆状,同样多数单独存在,少部分成链排列。见封二图2。
2.3测序结果
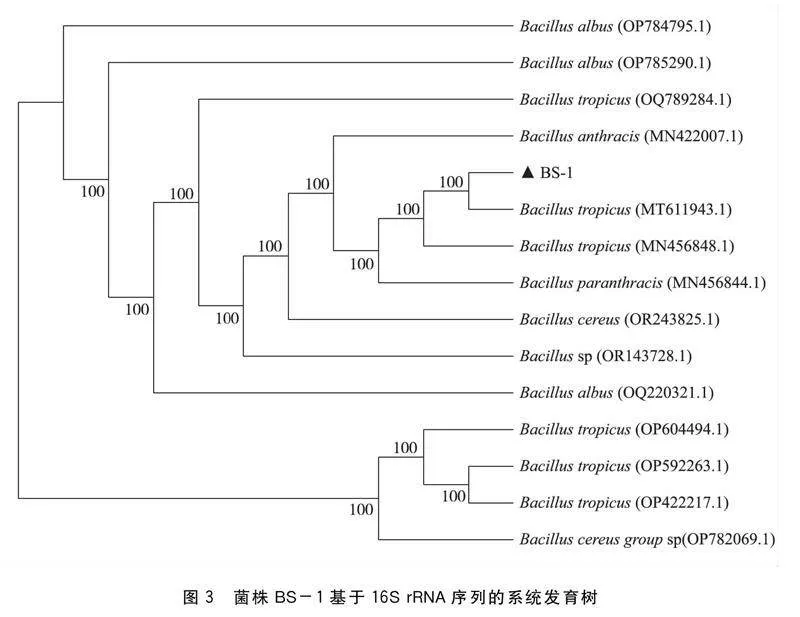
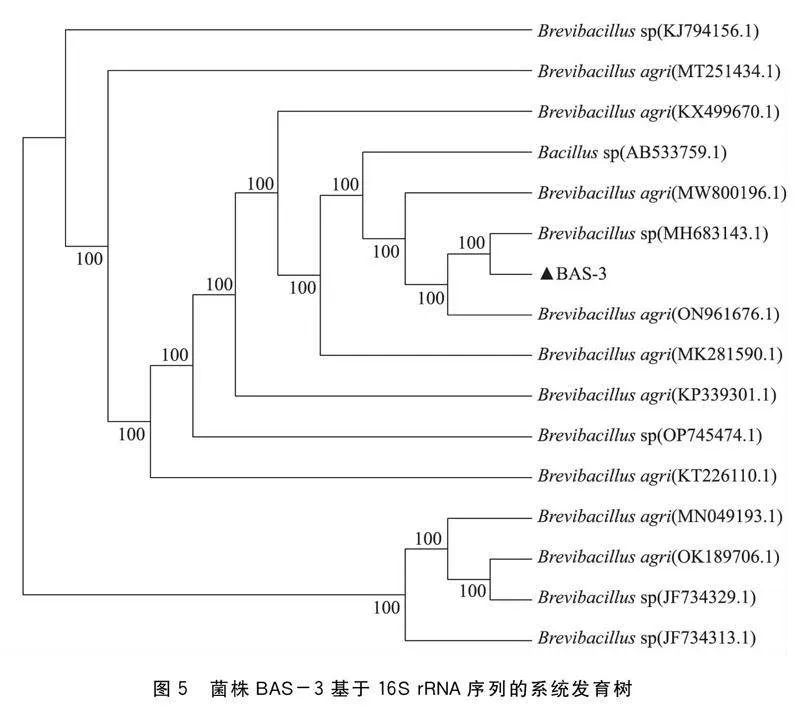
分别将菌株BS-1、BPS-2和BAS-3的16S rRNA测序所得的基因序列在GenBank中进行同源性检索。通过同源性比对(表1),结果表明BS-1与热带芽孢杆菌聚为一簇,其相似性为100%(图3)。BPS-2与短短芽孢杆菌聚为一簇,其相似性为100% (图4)。BAS-3与土壤芽孢杆菌聚为一簇,其相似性为100%(图5)。经综合分析鉴定结果,确定3种菌株均属于芽孢杆菌属。
2.4三种菌株生长曲线分析
3株芽抱杆菌以1%的接种量均能在 37 ℃ LB液体培养基中生长并达到较高浓度(封二图6)。其中菌株BAS-3长势最好,具有较强的环境适应能力,1~10 h迅速繁殖,28 h OD600值达到最大;菌株BPS-2、BS-1的生长曲线较为一致,在培养 2 h 时就开始进入快速增长期,在培养 14 h 后浓度增长放缓,培养26 h后菌株生长进入衰亡期。
2.5耐药试验结果
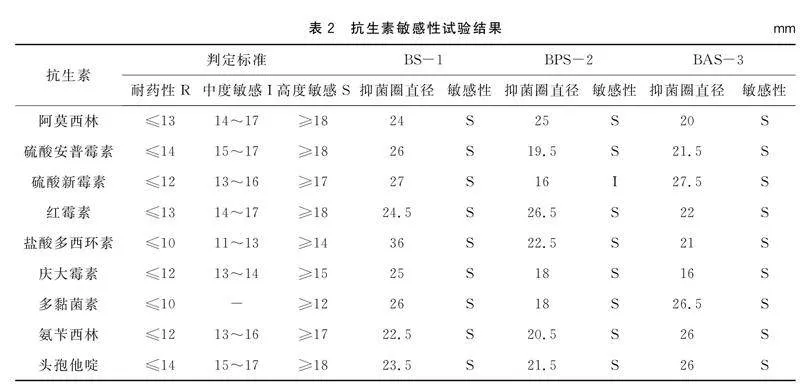
由表2可以看出,BS-1菌株对阿莫西林、硫氰酸红霉素、盐酸多西环素、氨苄西林等9种抗生素高度敏感;BPS-2菌株对硫酸新霉素中度敏感,对阿莫西林、庆大霉素、氨苄西林、多黏菌素等8种抗生素高度敏感;BAS-3菌株对头孢他啶、庆大霉素、多黏菌素、氨苄西林等9种抗生素高度敏感。
2.6抑菌试验结果
3株芽孢杆菌对溶藻弧菌和大肠杆菌的抑制效果见表3。对溶藻弧菌的抑制效果为:BS-1菌株> BAS-3菌株> BPS-2菌株;对大肠杆菌的抑制效果为:BS-1菌株> BAS-3菌株> BPS-2菌株。
2.7水质净化试验结果
2.7.1对养殖水体中NH+4-N 含量的影响图7(封二)显示了3株菌株对养殖水体氨态氮(NH+4-N)含量变化的影响,各试验组菌株浓度均保持在105 CFU/mL。其中对照组氨态氮浓度持续处于较高水平波动,而试验组在第2天就观察到水体中氨态氮浓度下降。经过连续7 d的监测,试验组水体中的NH+4-N含量一直维持在较低水平。结果表明,3株菌株均能有效降低养殖水体中氨态氮浓度。
2.7.2对养殖水体中NO-2-N含量的影响图8(封二)显示了3株菌株对养殖水体亚硝酸盐(NO-2-N)浓度变化的影响,各试验组菌株浓度均保持在105 CFU/mL。与对照组相比,试验组水体中的NO-2-N浓度在第 2天开始下降。在3种菌株中,BAS-3菌株对亚硝酸盐的去除效果最好,其去除率最高可达到 69.09%。结果表明,这3株菌株均具有降低养殖水体中NO-2-N浓度的潜力。
3讨论
芽孢杆菌通过其高效的胞外酶分泌机制,能够直接分解或转化养殖环境中的残余饲料和代谢产物。这一过程有效减少了水体中的氨态氮和亚硝酸盐等有害化学物质,同时抑制了病原微生物的增殖,从而改善水质[11]。大量研究证明,芽孢杆菌作为水质改良剂在净化水质方面起着重要作用,有助于为水生动物提供更多有益的微生物。热带芽胞杆菌为革兰氏阳性菌,形态为圆形,不透明,有异味,为芽孢杆菌属细菌。以菌株BS-1的DNA为模板,经通用引物进行PCR扩增,成功获得长度为1 400 bp的DNA片段。序列比对分析表明,该菌株的16S rRNA序列与B. tropicus strain ISP161A的序列完全一致,相似度达到100%。热带芽孢杆菌对水质具有明显的净化作用,可使人工废水中的化学需氧量、氨氮、亚硝酸盐的去除率高达90%[12]。吴海武[13]从海南海水养殖系统的底泥中筛选得到3株热带芽孢杆菌,对其进行复方和规模化发酵培养,测定该芽孢杆菌制剂对凡纳滨对虾养殖水质的净化效果,结果表明该芽孢杆菌制剂对养殖水质的净化效果很明显,不仅对氨氮、亚硝酸盐和硝酸盐有去除效果,而且对弧菌有抑制效果。本研究结果表明芽孢杆菌对养殖水体有积极影响,能够帮助净化水质。推测菌株BS-1可能具有降解氨和解毒的作用,同时维持菌藻平衡。益生芽孢杆菌作为饲料添加剂具有稳定的特点,对水生动物无不良影响,且不会对环境造成污染。未来可进一步研究和应用BS-1菌株,将其作为芽孢杆菌水质净化有益微生物制剂进行开发。
短短芽胞杆菌为革兰氏阳性菌,具有较强的蛋白分泌能力,能产芽孢,分布广泛,生命力强[14]。该菌在多个领域显示着巨大的应用潜力,不同环境下的短短芽胞杆菌会呈现不同的特征,同时也有不同的应用,其中在生物防治领域,短杆菌肽的抗菌特性引起了广泛关注,成为近年来研究的热点[15-16]。研究表明,短杆菌肽是短短芽孢杆菌抑制细菌生长的关键活性成分之一。这种细菌主要通过释放短杆菌肽(gramieidin)和短杆菌酪肽(tyrocidine)来抑制其他微生物的代谢活动[17]。此外,短短芽孢杆菌显示出对疟原虫的抑制效果,Rautenbach等[18]研究发现,该细菌能够产生一种环状短杆菌肽,这种肽不仅能有效阻止疟原虫的侵袭,还能中断其生命周期,从而达到消灭疟原虫的目的。Kondejewski等[19]在对短杆菌肽S的进一步研究中发现,它对革兰氏阴性菌、革兰氏阳性菌和真菌均表现出抗菌作用。在探究短短芽孢杆菌对番茄灰霉病菌的抑制作用时,Edwards等[16]发现该菌通过分泌短杆菌肽S来实现对灰霉菌的抑制。同时,Li等[20]从短短芽孢杆菌中分离出一种新几丁质酶,该酶具有优异的热稳定性和对蛋白水解酶的抵抗力,显示出作为生物防治剂的潜力。关于芽孢杆菌作为抗菌物质产生菌的许多报道已使其在水产养殖方面得到广泛应用。本研究对养殖池塘底泥中分离出来的菌株进行培养,并对其抗菌特性进行初步探究,结果发现BPS-2菌株对溶藻弧菌有良好的抑制效果。BPS-2菌株和其它芽孢杆菌相比,在抗菌防病方面都存在一定的潜力,后期可继续对BPS-2菌株的抑菌机制进行探索。
众多研究表明芽孢杆菌在可持续水产养殖中扮演重要角色,它们不仅能够促进宿主生物的增长和提升其品质,还有助于改善水体环境和减少病害风险,被认为是一种有发展前景的益生菌[4-5]。因此对芽孢杆菌的研究对健康养殖的发展具有重大意义。
4结论
本研究成功从养殖池塘底泥中分离出3株芽孢杆菌,通过分离鉴定,最终确定菌株BS-1为热带芽孢杆菌、菌株BPS-2为短短芽孢杆菌、菌株BAS-3为土壤芽孢杆菌。通过弧菌抑制试验和水质净化试验,结果显示3株益生菌在抑制有害菌及降低NH+4-N、NO-2-N方面有显著作用,有利于水质净化。后期可将3株菌株复方并进行规模化培养,将其作为水质净化有益微生物制剂进行开发,可起到全方位净化水质作用。
参考文献:
[1] 何敏,汪开毓,张宇,等. 复合微生物制剂对重口裂腹鱼生长、消化酶活性、肠道菌群及水质指标的影响[J].动物营养学报,2008,20(5):6.
[2] 付保荣,刘梦琦,张润洁,等. 短短芽孢杆菌(Brevibacillus brevis)对鲤鱼养殖水质及其生长特性的影响[J].生态科学,2018,37(5):6.
[3] 孙璐君. 微生态制剂在水产养殖中的应用[J].河南水产,2017(2):2.
[4] VASEEHARAN B,RAMASAMY P.Control of pathogenic Vibrio spp. by Bacillus subtilis BT23,a possible probiotic treatment for black tiger shrimp Penaeus monodon[J].Letters in applied microbiology,2003,36(2):83-87.
[5] 王新,吴逸飞,姚晓红,等. 微生态制剂对养殖后期虾池水质及细菌群落的影响[J].浙江农业学报,2014,26(1):40-47.
[6] MOMBELLI B,GISMONDO M R.The use of probiotics in medical practice[J].Int J Antimicrob Agents,2000,16(4):531-536.
[7] 胡毅,谭北平,麦康森,等. 饲料中益生菌对凡纳滨对虾生长,肠道菌群及部分免疫指标的影响[J].中国水产科学,2008,15(2):244-251.
[8] KOZASA M.Toyocerin (Bacillus toyoi) as growth promotor for animal feeding[J].Microbiol Aliment Nutrition,1986(4):121-135.
[9] 刘慧玲,黄翔鹄,李长玲,等. 不同浓度的枯草芽孢杆菌对罗非鱼鱼苗的养殖水体水质及其抗病力的影响[J].水产养殖,2009,30(10):5-9.
[10] 张庆华,封永辉,王娟,等.地衣芽孢杆菌对养殖水体氨氮、残饵降解特性研究[J].水生生物学报,2011,35(3):6.
[11] 李佳骏,张秀霞,冼健安,等. 芽孢杆菌在水产养殖中的应用研究进展[J].现代畜牧科技,2023(4):63-66.
[12] 吴海武,郭聪,朱彦博,等.热带芽孢杆菌的筛选及对人工废水效果研究[J].水产科学,2014(11):723-727.
[13] 吴海武. 净化水质热带芽孢杆菌的筛选、复方研制及效果研究[D].海口:海南大学,2014.
[14] 罗进贤,王凌,张添元,等.短小芽孢杆菌degQ基因的克隆与鉴定[J].中国生物化学与分子生物学报,1997(2):125-129.
[15] 邱孙全,杨红,赵春安,等. 一株内生短短芽孢杆菌的鉴定及其抗菌活性研究[J].天然产物研究与开发,2009,21(B05):4.
[16] EDWARDS S G,SEDDON B. Mode of antagonism of Brevibacillus brevis against Botrytis cinerea in vitro[J].Journal of Applied Microbiology,2010,91(4):652-659.
[17] 马桂美,车建美,刘波,等. 短短芽胞杆菌功能基因的研究及其应用[J].生物技术进展,2012,2(2):92-97.
[18] RAUTENBACH M,VLOK N M,STANDER M,et al.Inhibition of malaria parasite blood stages by tyrocidines,membrane-active cyclic peptide antibiotics from Bacillus brevis[J].Biochimica et Biophysica Acta (BBA) - Biomembranes,2007,1768(6):1488-1497.
[19] KONDEJEWSKI L H,FARMER S W,WISHART D S,et al. Gramicidin S is active against both Gram-positive and Gram-negative bacteria[J].International journal of peptide and protein research,1996,47(6):460-466.
[20] LI S,ZHAO Z A,LI M,et al.Purification and characterization of a novel chitinase from Bacillus brevis[J]. Sheng wu hua xue yu sheng wu wu li xue bao Acta biochimica et biophysica Sinica,2002,34(6):690-696.
Isolation and identification of three probiotics and analysis of their
bacteriostatic effect on aquatic pathogens and water purification
YANG Ning, LI Jinxiang, ZANG Xueyun, ZHAI Kaixuan
(Qingdao Zhongren Animal Pharmaceutical Co., Ltd., Jiaozhou 266100,China)
Abstract:In order to screen probiotics that can be used in microecological preparations, three strains of microorganisms were successfully screened from the bottom mud of aquaculture ponds. Their biological characteristics, inhibition effect on pathogenic bacteria and purification ability on water environment were deeply discussed. The isolated strains were identified by morphological observation and 16S rRNA gene sequence comparison. The results showed that all the three strains were Bacillus. The growth performance of the three strains was measured, and the drug resistance and antibacterial effect were analyzed. The results showed that the three strains had the ability to inhibit Escherichia coli and Vibrio alginolyticus, and were sensitive to 9 antibiotics such as amoxicillin, erythromycin thiocyanate, doxycycline hydrochloride and ampicillin. The content of nitrite (NO-2-N) and ammonia nitrogen (NH-4-N) in water was determined. The results showed that the three strains had a certain effect on water purification. The three selected strains showed the biological characteristics required as aquatic feed additives and had the potential to improve water quality.
Key words:Bacillus; strain identification; water purification; bacteriostatic analysis
(收稿日期:2024-07-13)
