响应面法优化糙米总黄酮提取工艺
2024-10-09李悦程建峰罗彤段依婧


摘要:以胚芽糙米为材料,采用乙醇溶液提取总黄酮,先后开展单因素试验和响应面试验,考察提取温度、乙醇浓度、提取时间和液料比4个因素对糙米总黄酮提取率的影响。结果表明,乙醇提取糙米总黄酮的最佳条件为液料比20∶1、乙醇浓度80%、提取温度40 ℃和提取时间16 min,在此条件下,总黄酮得率为2.550%,与预测得率2.591%相比,相对误差仅为1.58%。优化后的方法比优化前更科学准确、操作简单、高效快捷和环保廉价,适用于大批量糙米总黄酮的提取。
关键词:糙米;黄酮;乙醇提取法;响应面法
中图分类号:TQ914.1 文献标识码:A
文章编号:0439-8114(2024)09-0167-06
DOI:10.14088/j.cnki.issn0439-8114.2024.09.028 开放科学(资源服务)标识码(OSID):
Optimization of the extraction of total flavonoids from brown rice by response surface methodology
LI Yue, CHENG Jian-feng, LUO Tong, DUAN Yi-jing
(College of Agronomy, Jiangxi Agricultural University, Nanchang 330045, China)
Abstract: Using germ brown rice as the material, ethanol solution was used to extract total flavonoids, and single factor test and response surface test were carried out successively to investigate the influence of extraction temperature, ethanol concentration, extraction time and liquid material ratio on the extraction rate of total flavonoids from brown rice. The results showed that the best condition for ethanol extraction of total flavonoids from brown rice was the liquid material ratio of 20∶1, ethanol concentration of 80%, extraction temperature of 40 ℃ and extraction time of 16 min. Under this condition, the total flavonoids yield was 2.550%, and the relative error was only 1.58% compared with the predicted yield of 2.591%. The optimized method was more scientific, more accurate, simpler, more efficient,more environment-friendly and cheaper than before, and was suitable for large-scale extraction of total flavonoids from brown rice.
Key words: brown rice; flavonoids; ethanol extraction method; response surface methodology
食物供应的营养性、功能性和安全性是21世纪生命科学、食品科学、医学和公众营养共同关注的课题[1,2]。水稻是世界上种植面积第二、总产第一的粮食作物,中国约60%和全球30%以上的人口以稻米为主食[3]。过去,人们食用稻米的目的主要以摄取淀粉来获取能量,但随着生活水平的不断提高,对自身健康越来越重视,对主食的营养保健功能要求越来越高,功能型水稻便应运产生[4-8]。功能型水稻是一类具有特殊遗传背景的水稻,在胚乳、胚和米糠等部分中富含某种或多种具有高效生理调节功能的活性成分,可满足不同消费群和特殊消费群需求的专用或保健性水稻,其稻米既能满足日粮需求,又兼有补充营养和调节各种人体生理代谢、辅助治疗疾病及增进人体健康等多种功能[4-8]。水稻中包含的功能性成分有功能性的蛋白质、肽、活性多糖、油脂、维生素、黄酮类化合物、必需微量元素、自由基清除剂和必需氨基酸九大类[4,8]。因此,功能型水稻研究和开发是21世纪促进高质量水稻生产和消费的切入点,为中国21世纪的分子农业开辟了全新和广阔的发展空间,对“健康中国”等国家战略的实施具有重要意义。
黄酮类化合物是许多药用植物的有效成分[9],能降低人体血糖,治疗糖尿病[10,11],改善血液的流动,具有降血脂、降血压和治疗心脑血管疾病的作用[12-16],还能捕捉生物体内膜脂质过氧化自由基,具有抗氧化和抗衰老功能[17-20]。故研究和开发高黄酮含量的功能型稻米,可使人们在主食中补充黄酮,实现“药食同源”和“医食同源”,达到健康及延年益寿的效果。黄酮类化合物广泛存在于许多植物和浆果中,但在糙米中其含量甚微,这给简便快速、准确廉价和高通量的提取测定带来了诸多困难[21]。现常用的总黄酮提取方法有酶提取法[22,23]、超声或微波辅助酶提法[24-26]、超声或微波辅助醇提法[27-31]和溶剂提取法[32-38]等。不同方法各有自身的优缺点,酶提取法的酶使用成本较高,酶解后需再次调节pH、高温灭酶,操作步骤较繁杂,不适用于生产领域的大量样品提取[22,23];超声和微波辅助醇提法提取时间相对较短,总黄酮得率高,杂质较少,易于分离,但需大量仪器设备的投入,耗费能量资源,在大批量提取时不够节能和经济[27-31];溶剂提取法因操作简便和经济节能等优点被广泛应用于植物组织中黄酮提取,但在糙米黄酮的提取中存在耗时长、效率低和溶剂残留等弊端[32-38],故有必要对其进行系统地优化。为此,本试验先围绕提取温度、乙醇浓度、提取时间和液料比4个关键因素进行优化,后以单因素优化结果配置组合因素开展响应面法优化,以期寻求到一种科学可靠、操作简便、高效快捷和节能廉价并适用于大批量提取糙米总黄酮的方法,为筛选高黄酮含量的稻种资源、研究糙米中总黄酮的代谢机制及开发高黄酮功能稻米提供切实可行的技术途径。
1 材料与方法
1.1 试验材料
胚芽糙米,购于上海聚香楼食品有限公司。留胚率≥94%,每100 g所含营养成分为蛋白质8.9 g、脂肪2.2 g、碳水化合物76.7 g、膳食纤维3.6 mg、维生素E 0.93 mg、叶酸25 μg、钾138 mg、镁95 mg、钙27 mg、铁2.7 mg、锌1.52 mg。
1.2 试验设计
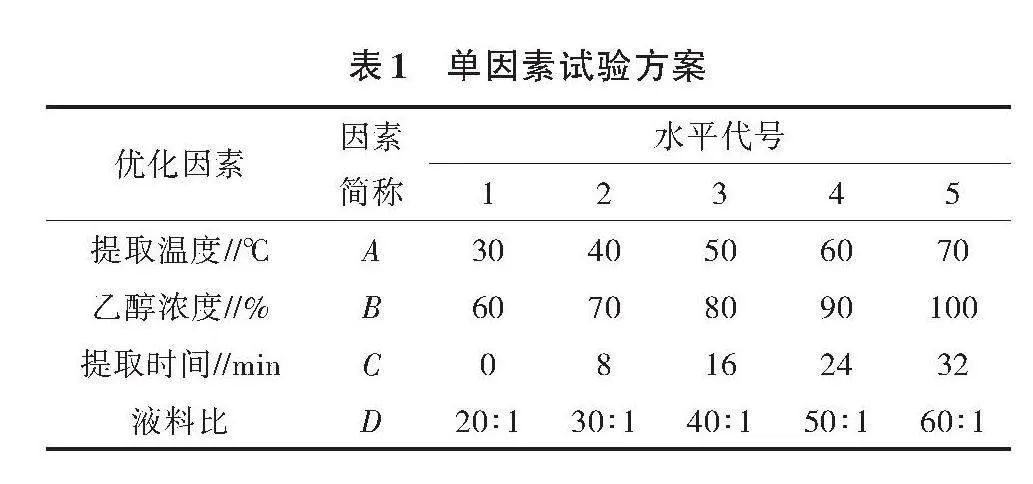
1.2.1 单因素试验 在众多乙醇提取黄酮法[32,33,36-38]的基础上,结合叶宁等[37]提取有色稻糙米中总黄酮方法,设置提取温度、乙醇浓度、提取时间和液料比4个单因素试验(表1)。以提取的胚芽糙米中总黄酮得率最大为标准,确定最佳提取条件。总黄酮得率(%)=稀释倍数×总黄酮浓度(mg/mL)×提取液体积(mL)÷糙米质量(g)÷1 000×100%。
1.2.2 响应面优化试验 在单因素试验的基础上,分别选取提取温度、乙醇浓度、提取时间和液料比4因素3水平,通过Design Expert (version 6.0.5)设计响应面试验,具体设计方案见表 2。
1.3 数据处理
单因素试验数据经Excel整理后,进行单因素方差分析和F检验,并在SPSS 20.0软件中采用SSR法对平均数据进行多重比较(P<0.01)。同样,响应面试验数据经Excel整理后,再通过Design Expert软件进行方差分析和回归模型的建立。
2 结果与分析
2.1 糙米中乙醇提取总黄酮法的单因素试验
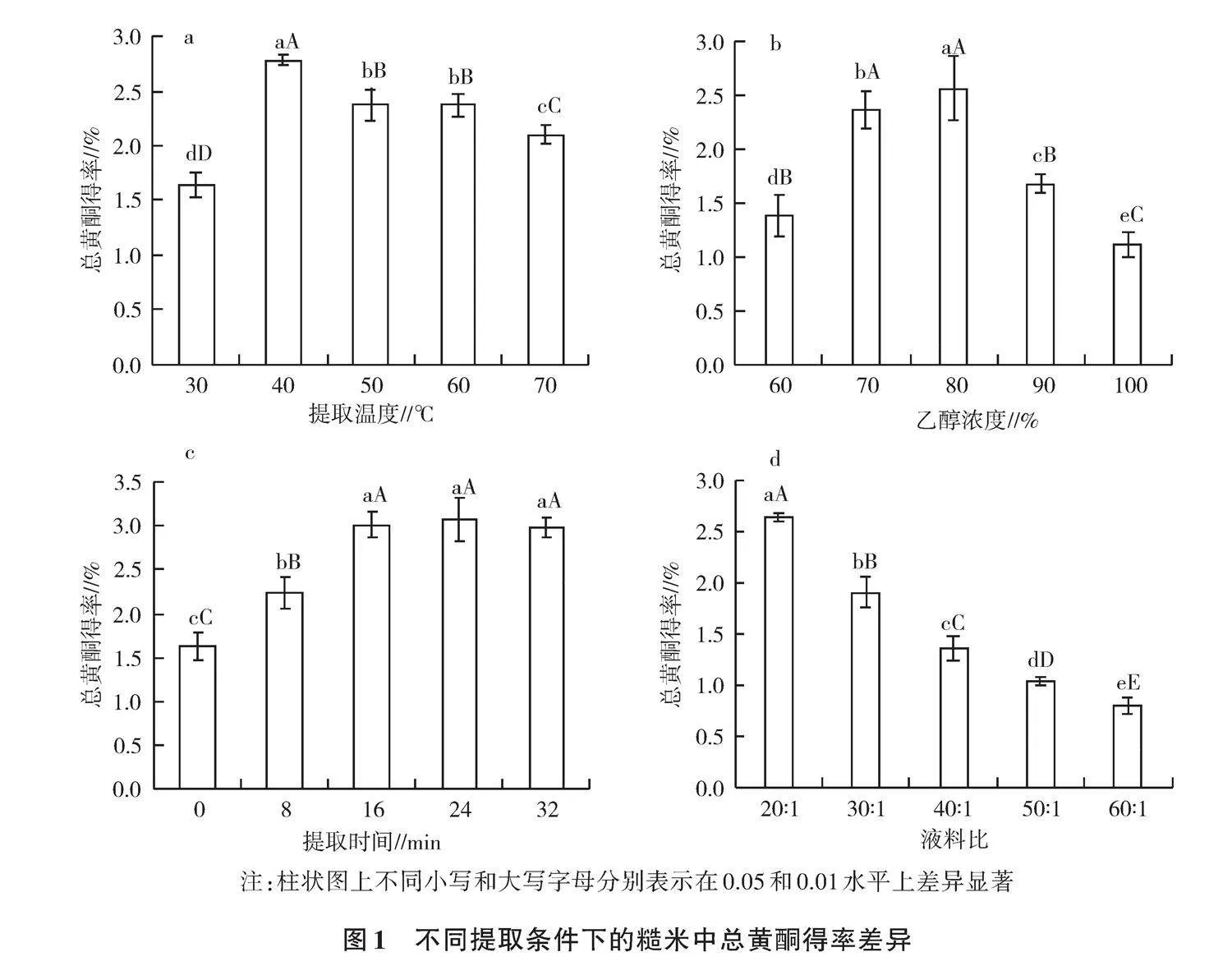
由图1a可知,总黄酮得率随提取温度的升高呈先增后减的变化,40 ℃下的总黄酮提取率最高(2.785%),极显著高于50 ℃(2.372%)和60 ℃(2.378%),后两者又极显著高于70 ℃(2.100%),30 ℃(1.636%)下最低。这可能是一定程度的温度升高增大了黄酮类物质在提取剂中的溶解度,促进其向提取剂释放,但过高的温度会使已提取出来的黄酮类物质被氧化和破坏而降低总黄酮含量。故40 ℃应为乙醇提取糙米总黄酮的最适温度。
由图1b可知,总黄酮得率随乙醇浓度的升高呈先增后减的趋势,80%乙醇浓度下的总黄酮得率最高(2.565%),显著高于70%(2.367%),70%乙醇浓度又极显著高于90%(1.682%)和60%(1.383%),100%乙醇浓度下最低(1.117%)。一般来说,溶剂浓度越高越有利于样品成分的提取,但溶剂超过一定浓度后会导致样品中的其他生物成分溶出,影响黄酮的溶解度,且会导致资源上的浪费。从提高效率和节约资源角度考虑,溶剂浓度不宜过高。因此,选择80%作为提取糙米总黄酮的最佳乙醇浓度。
由图1c可知,总黄酮得率在0~16 min随提取时间延长而极显著增加,0 min最低(1.630%),8 min为2.239%,16 min为3.018%,而16 min(3.018%)、24 min(3.069%)和32 min(2.984%)下三者无显著差异。这一现象表明,一定时间内,黄酮类物质在溶剂中的溶出量增加,但时间过长会使黄酮类物质氧化加剧,结构被破坏,导致总黄酮含量减少;且时间越长,糙米粉糊化越大,使得米粉和提取液的接触面积减小,总黄酮提取效率降低。故可认定16 min为乙醇提取糙米总黄酮的最优时间。
由图1d可知,总黄酮得率随液料比的升高呈极显著降低趋势,20∶1液料比下的总黄酮提取率最高(2.865%),极显著高于30∶1(1.905%),30∶1又极显著高于40∶1(1.354%),再又极显著高于50∶1(1.032%),60∶1(0.648%)液料比下最低。造成上述现象的原因可能是,较高的液料比导致样品中的其他生物成分溶出,挤占了糙米中黄酮的溶出量或影响检测结果,且会导致乙醇试剂的浪费。因此,选择20∶1作为乙醇提取糙米总黄酮的最适液料比。
2.2 糙米中乙醇提取总黄酮法的响应面优化
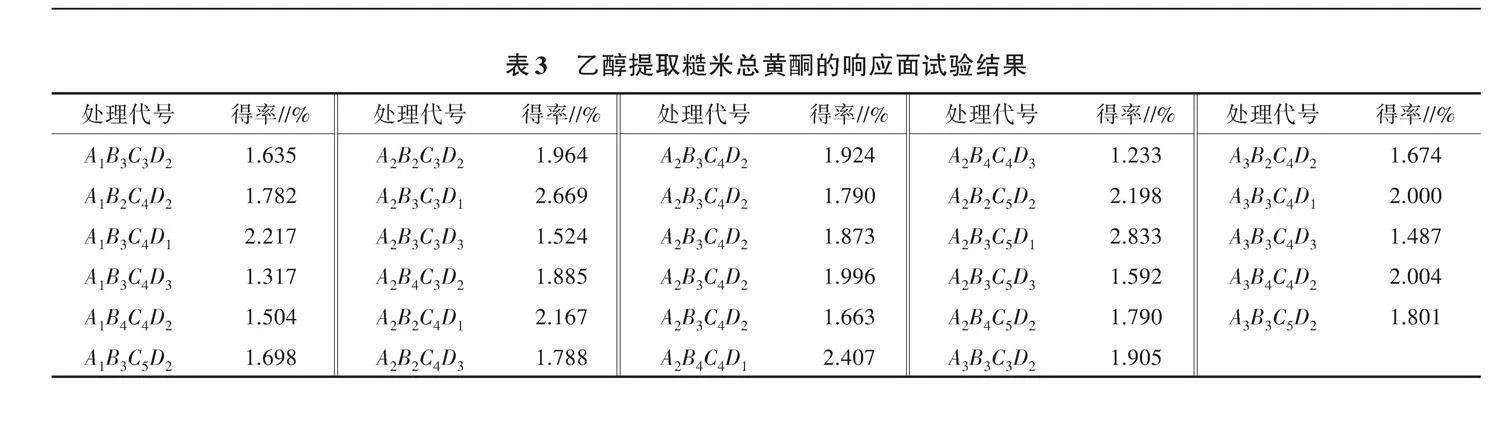
2.2.1 响应面试验结果 在单因素试验结果的基础上,采用Box-Behnken原理对糙米总黄酮的乙醇提取法进行响应面优化试验(表2),结果见表3。通过Design Expert软件处理数据,将响应值与各因素进行回归拟合,可得回归模型为Y=1.85 + 0.059 8A - 0.062 5B+0.027 5C-0.446 0D+0.152 0AB-0.041 7AC+0.096 8AD - 0.082 2BC - 0.024 0CD - 0.174 7A2 -
0.003 2B2+0.134 1C2+0.101 6D2。
2.2.2 方差分析及回归模型的建立 由表4可知,该模型P<0.000 1,回归模型方程的R2=0.905 0>0.9,说明模型影响显著,对数据进行了很好的拟合,试验方法可靠。模型失拟不显著,说明模型可以用于实际值的预测。一次项中液料比P<0.000 1,达极显著水平;交互项中只有乙醇浓度及液料比的交互影响显著,其余项影响均不显著;二次项中,A2项和C2项影响显著。依据系数估计值及各因素P值,可知各因素对糙米总黄酮得率的影响大小顺序依次为液料比、乙醇浓度、提取温度、提取时间。剔除影响不显著的交互项及二次项,可得优化模型方程为Y=1.85+0.446 0D-0.198 7BD-0.174 7A2+0.134 1C2。
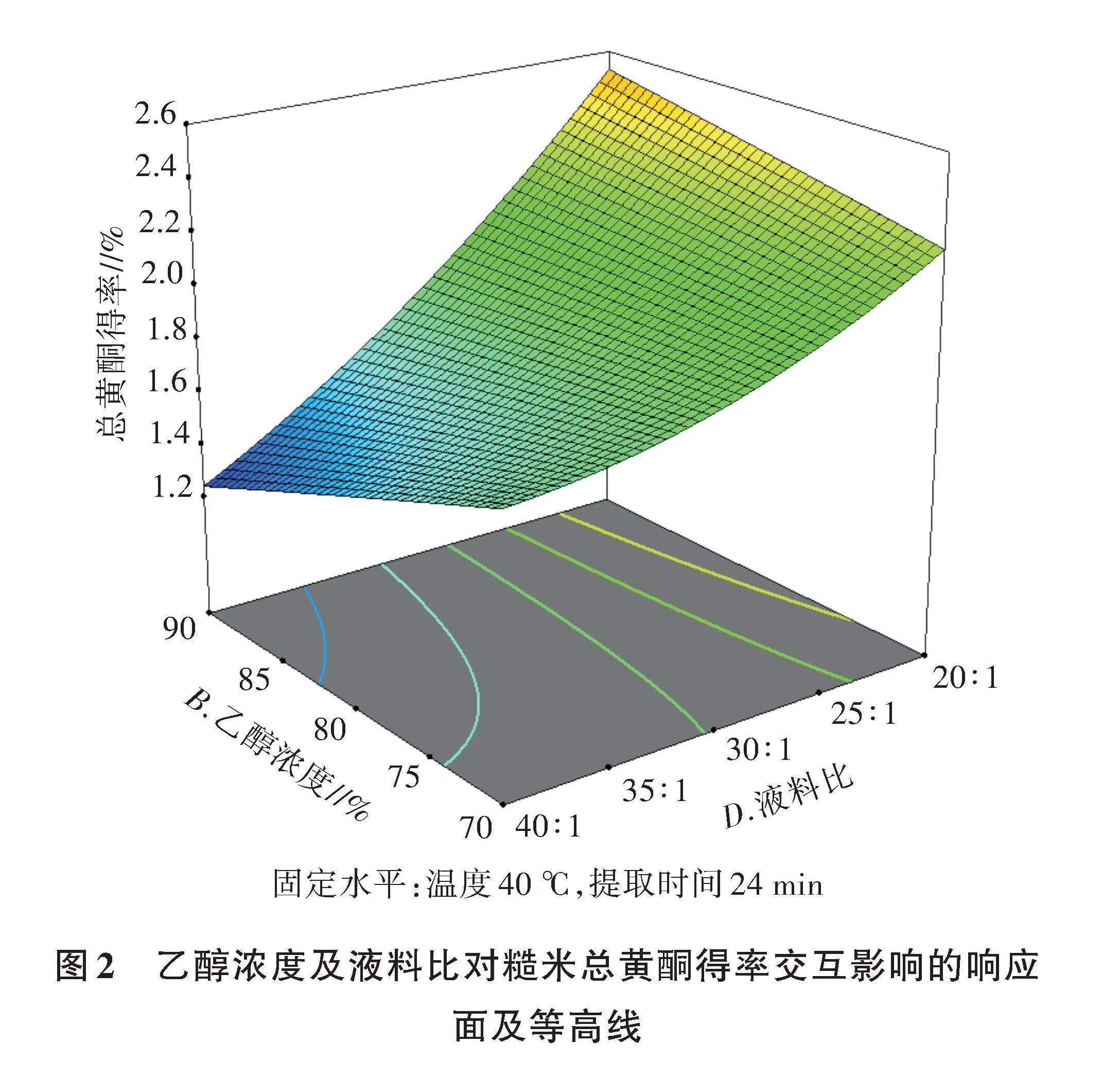
2.2.3 响应面分析及工艺优化 交互项中只有乙醇浓度及液料比的交互影响显著,因此根据回归模型绘制出BD 交互项影响的响应面及等高线(图2)。由图2可知,当固定液料比后,总黄酮得率随乙醇浓度的升高而逐渐增大,随液料比的增大则逐渐减小。
通过Design Expert软件分析可知,乙醇提取糙米总黄酮的最佳试验条件为提取温度37.80 ℃、乙醇浓度80%、提取时间32 min和液料比20∶1。为了高效便捷地进行试验操作,调整为提取温度40 ℃、乙醇浓度80%、提取时间16 min和液料比20∶1,在此条件下平行试验3次,测得平均总黄酮得率为2.550%,与预测得率2.591%相比,相对误差仅为1.58%,说明该模型与实际情况拟合好,即模型可靠。
[2.6][总黄酮得率//%][2.4][2.2][2.0][1.8][1.6][1.4][1.2][90][85][80][70][75][B.乙醇浓度//%][40∶1][35∶1][30∶1][25∶1][20∶1][D.液料比]
固定水平:温度40 ℃,提取时间24 min
3 讨论与结论
溶剂提取法是利用目标成分在不同溶剂中溶解度的差异而对物质进行分离的一种提取方法,其在食品、医药及保健品领域均得到广泛应用[28,39,40]。但此方法因提取材料不同而导致普适性较差,迫使科技人员需根据自己的测定对象和测定目的进行系统优化。因糙米中的总黄酮含量较少,缺乏相关研究,而且乙醇提取糙米中总黄酮的方法更是极少有人关注,偶尔涉及黄酮提取时大多是直接采用黄酮在其他材料中的提取方法,是否科学、可靠和准确均有待于探究。
3.1 提取温度
黄酮的提取温度与提取材料有着密切的关系,这可能与提取材料的理化性质有关。研究发现,胡柚皮[41]、费约果叶[42]和黑米“紫糯 1 号”[37]的黄酮最佳提取温度为50 ℃;黑桑叶[43]、旋覆花[44]、金银忍冬果[45]和柑橘[46]的最佳提取温度均为60 ℃;辣木叶[47]和脱脂草果干粉[48]的最佳提取温度均为61 ℃;马兰[49]、马铃薯皮[50]、脱脂火龙果种子[51]和桑葚[52]的最适提取温度均为70 ℃;银杏叶[53]和苦荞的[54]的最适提取温度均为80 ℃;文冠果[55]、青稞叶[56]、灵菊七叶[57]和米糠[58]的最适提取温度分别为84、90、92 ℃和94.9 ℃。本研究优化的最佳提取温度为40 ℃,比报道结果均偏低,这可能是因为以往方法中优化材料主要为纤维素等惰性物质,而本研究的糙米中70%以上为淀粉,温度高于53 ℃会显著糊化,阻止溶剂渗入内部,使得提取剂与其接触面积减小,从而大大降低提取效率,故糙米中黄酮的提取需要相对较低的温度。提取温度较低,还有利于节约能源。
3.2 乙醇浓度
不同植物材料中总黄酮提取时的乙醇浓度差别较小,一般都在50%~80%,如对旋覆花[44]、雪莲[59]和灵菊七叶[57]提取时分别采用50%、54%和55%的乙醇溶液,对黑桑叶[43]、苦荞麦[54]和白芍[60]分别选用59.92%、60.00%和62.93%的乙醇溶液,对费约果叶[42]、辣木叶[47]、脱脂草果干粉[48]、马铃薯皮[50]和银杏叶[53]提取时均采用70%乙醇溶液,对金银忍冬果[45]、米糠[58]和马兰[49]提取时分别采用71%、74%和75%乙醇溶液,对脱脂火龙果种子[51]、桑葚[52]和文冠果花[55]提取时均采用80%乙醇溶液,当然也有少数例外的,如青稞叶采用30%乙醇溶液[56]、糙米选用40%乙醇溶液[30]、柑橘选用90%乙醇溶液[46]。本试验优化的乙醇浓度为80%,属正常范围,偏高的原因可能与提取温度40 ℃明显低于其他研究有关,低温下需要更高浓度的乙醇来协助较短时间内的黄酮提取。
3.3 提取时间
不同植物材料中乙醇提取总黄酮的提取时间参差不齐,但大部分集中在60~300 min [41-56,59,60],尤其是90~150 min[37, 41,42,46-50,52-54,56];当然也有较短时间的提取,如灵菊七叶[57]为30 min、米糠[58]为41.6 min和脱脂火龙果种子[51]为45 min。本试验优化的提取时间只需16 min,远低于以往文献中的报道,这可能与糙米中主要成分为淀粉有关,而非其他文献中的材料所含主要物质为纤维素或木质素等惰性物质,且对黄酮的固持力较大,使其黄酮的提取效率较低,所需时间更长。同时,还可能与乙醇浓度偏高有关,有利于糙米黄酮溶出,使得黄酮的提取效率更高,导致提取时间更短。
3.4 液料比
不同植物材料中乙醇提取黄酮的液料比相差较大。研究表明,提取苦荞麦[54]和胡柚皮[41]总黄酮采用最适液料比4∶1和5∶1,提取银杏叶[53]、旋覆花[44]和金银忍冬果[45]总黄酮时分别采用液料比10∶1、 15∶1和18.6∶1,提取黑桑叶[43]、柑橘[46]、脱脂草果干粉[48]和马铃薯皮[50]的总黄酮时均采用液料比20∶1,提取白芍[60]总黄酮时的最佳液料比为24.86∶1,叶宁等[37]和李侠等[30]提取糙米总黄酮的最优液料比分别为25∶1和30∶1,提取费约果叶[42]和马兰[45]总黄酮时均采用液料比30∶1,提取文冠果花[55]、灵菊七叶[57]、辣木叶[43]、雪莲[59]和青稞叶[50]总黄酮时分别采用液料比37∶1、50∶1、51∶1、54∶1和60∶1。本结果优化的液料比为20∶1,相对偏小,可能因为糙米米粉中主要为淀粉,相比其他材料中的主要成分纤维素和脂质等物质来说,淀粉对黄酮的溶出阻碍更小,更易提取出来。液料比较小,还可节约试剂和试验成本,降低溶剂残留,适用于大批量样品的提取和测定。
参考文献:
[1] SERAGELDIN I. Biotechnology and food security in the 21st century[J]. Science, 1999, 285(5426): 387-389.
[2] POTRYKUS I. Golden rice and beyond[J].Plant physiology,2001, 125(3):1157-1161.
[3] GOYAL L, BHATIA D, KAUR H, et al. Strategies and prospects of haploid induction in rice (Oryza sativa)[J]. Plant breeding, 2022, 141(1): 1-11.
[4] 苏 宁,万向元,翟虎渠,等. 功能型水稻研究现状和发展趋向[J]. 中国农业科学, 2007, 40(3): 433-439.
[5] 陈 浩. 功能性水稻研究思路和前景分析[J]. 生命科学, 2016, 28(10): 1279-1286.
[6] 程芳艳,王继亮,孟巧霞,等. 功能型水稻的研究成果及进展[J]. 北方水稻, 2011, 41(6): 76-80.
[7] 胡时开, 胡培松. 功能稻米研究现状与展望[J]. 中国水稻科学, 2021, 35(4): 311-325.
[8] 刘传光,周新桥,陈达刚,等. 功能性水稻研究进展及前景展望[J]. 广东农业科学, 2021, 48(10): 87-99.
[9] LIU W X, FENG Y, YU S H, et al. The flavonoid biosynthesis network in plants[J]. International journal of molecular sciences, 2021, 22(23): 12824.
[10] MOSAWY S,JACKSON D E,WOODMAN O L,et al. The flavonols quercetin and 3’,4’- dihydroxyflavonol reduce platelet function and delay thrombus formation in a model of type 1 diabetes[J]. Diabetes & vascular disease research,2014,11(3):174-181.
[11] BONDONNO N P, DALGAARD F,?MURRAY K, et al. Higher habitual flavonoid intakes are associated with a lower incidence of diabetes[J]. The journal of nutrition,2021,151(11):3533-3542.
[12] RODRIGUEZ-MATEOS A, RENDEIRO C, BERGILLOS-MECA T, et al. Intake and time dependence of blueberry flavonoid-induced improvements in vascular function: A randomized, controlled, double-blind, crossover intervention study with mechanistic insights into biological activity[J]. American journal of clinical nutrition, 2013, 98(5): 1179-1191.
[13] MACREADY A L, GEORGE T W, CHONG M F, et al. Flavonoid-rich fruit and vegetables improve microvascular reactivity and inflammatory status in men at risk of cardiovascular disease——FLAVURS: A randomized controlled trial[J]. The American journal of clinical nutrition, 2014, 99(3):479-489.
[14] LAJOUS M, ROSSIGNOL E, FAGHERAZZI G, et al. Flavonoid intake and incident hypertension in women[J]. American journal of clinical nutrition, 2016, 103(4): 1091-1098.
[15] ROSARIO V, CHANG C, SPENCER J, et al. Anthocyanins attenuate vascular and inflammatory responses to a high fat high energy meal challenge in overweight older adults: A cross-over, randomized, double-blind clinical trial[J]. Clinical nutrition (Edinburgh, Scotland), 2021, 40(3): 879-889.
[16] CAO Y, XIE L, LIU K, et al. The antihypertensive potential of flavonoids from Chinese Herbal Medicine: A review[J]. Pharmacological research, 2021, 174: 105919.
[17] NILE S H, KHOBRAGADE C N. Antioxidant activity and flavonoid derivatives of Plumbago zeylanica[J]. Journal of natural products, 2010, 3: 130-133.
[18] PANAT N A, MAURYA D K, GHASKADBI S S, et al. Troxerutin, a plant flavonoid, protects cells against oxidative stress-induced cell death through radical scavenging mechanism[J]. Food chemistry, 2016, 194: 32-45.
[19] CHEN X M, TAIT A R, KITTS D D. Flavonoid composition of orange peel and its association with antioxidant and anti-inflammatory activities[J]. Food chemistry, 2017, 218: 15-21.
[20] RUSIL R,NINGSIH B A,RAHMADANI A,et al. Isolation and evaluation of antioxidant and antibacterial activity of flavonoid from Ficus variegata Blume[J]. Nature reviews cancer,2019, 19(2): 538-543.
[21] WEN W W, ALSEEKH S, FERNIE A R. Conservation and diversification of flavonoid metabolism in the plant kingdom[J]. Current opinion in plant biology, 2020, 55: 100-108.
[22] 王 磊, 王红梅, 刘长姣, 等. 酶法提取黑米中黄酮及抑菌性检测[J]. 中国食品添加剂, 2017(12): 79-85.
[23] 杨 曦, 孙汉巨, 涂李军, 等. 黑米花青素酶法提取工艺优化及颜色稳定性测定[J]. 食品与营养科学,2019,8(2): 115-127.
[24] KE L Q, CHEN H Y. Enzymatic-assisted microwave extraction of total flavonoids from bud of Chrysanthemum indicum L. and evaluation of biological activities[J]. International journal of food engineering, 2016, 12(6): 607-613.
[25] YAO X J, XU J C, ADHIKARI B, et al. Microwave-assisted enzymatic extraction of flavonoids from Armeniaca mume Sieb. blossom and their immunomodulating effect in mice with DSS-induced colitis[J]. Molecules, 2021, 26(4): 855.
[26] ZHENG Q H, TAN W J, FENG X L, et al. Protective effect of flavonoids from mulberry leaf on AAPH-induced oxidative damage in sheep erythrocytes[J]. Molecules, 2022, 27(21): 7625.
[27] HUANG W, XUE A, NIU H, et al. Optimised ultrasonic-assisted extraction of flavonoids from Folium eucommiae and evaluation of antioxidant activity in multi-test systems in vitro[J]. Food chemistry, 2009, 114(3):1147-1154.
[28] 杨志刚, 张燕萍, 杨海定. 超声波辅助提取常熟黑米类黄酮及其抗氧化活性分析[J]. 食品科学, 2013, 34(18): 118-122.
[29] LIU B, MA Y X, LIU Y, et al. Ultrasonic-assisted extraction and antioxidant activity of flavonoids from Adinandra nitida leaves[J]. Tropical journal of pharmaceutical research,2014,12:1045-1051.
[30] 李 侠, 徐 博, 孙 江, 等. 糙米黄酮的提取及对羟自由基的清除作用[J]. 吉林农业大学学报, 2014, 36(3): 347-351.
[31] 王 磊, 韦雅玲, 刘长姣. 超声波辅助醇提黑米中黄酮的工艺优化[J]. 粮食与油脂, 2018, 31(4): 24-28.
[32] CHI R A, TIAN J, GAO H, et al. Kinetics of leaching flavonoids from Pueraria lobata with ethanol[J]. Chinese journal of chemical engineering, 2006, 14(3): 402-406.
[33] CAI W R, GU X H, TANG J. Extraction, purification, and characterization of the flavonoids from Opuntia milpa alta skin[J]. Czech journal of food sciences, 2010, 28(2): 108-116.
[34] 蔡金星, 刘秀凤, 贾文沦,等. 甲醇浸提法提取荠菜黄酮工艺优化[J]. 河北科技师范学院学报, 2012, 26(1): 54-57.
[35] 王广慧, 魏雅冬, 于德涵. 高压热水浸提法提取金针菇黄酮的优化研究[J]. 食品科技, 2015, 40(3): 241-244.
[36] 王丽霞,陈永胜,穆莎茉莉,等. 乙醇浸提法提取蓖麻饼粕总黄酮的工艺研究[J]. 食品工业科技,2015, 36(4): 282-285, 309.
[37] 叶 宁, 程朝平, 杨德卫, 等. “紫糯1号”糙米中总黄酮提取工艺研究[J]. 福建稻麦科技, 2019, 37(2): 35-37.
[38] 程时劲, 余 渤, 毛 博,等. 乙醇浸提法提取红叶李中总黄酮工艺优化[J]. 湖北农业科学, 2021, 60(2): 134-136.
[39] IGNAT I,VOLF I,POPA V I. A critical review of methods for characterization of polyphenolic compounds in fruits and vegetables[J]. Food chemistry, 2011, 126(4): 1821-1835.
[40] NUR SYUKRIAH A R, LIZA M S, HARISUN Y, et al. Effect of solvent extraction on antioxidant and antibacterial activities from Quercus infectoria (Manjakani)[J]. International food research journal, 2014, 21(3): 1067-1073.
[41] 赵雪梅, 叶兴乾, 席玙芳. 胡柚皮中黄酮类化合物提取工艺优化研究[J]. 中国食品学报, 2004, 4(2): 19-24.
[42] 丁振柱, 黄仁华, 王 丹. 费约果叶片总黄酮提取工艺优化及其抗氧化活性研究[J]. 食品与生物技术学报, 2011, 30(3): 371-375.
[43] RADOJKOVIC M, ZEKOVIC Z, JOKIC S, et al. Optimization of solid-liquid extraction of antioxidants from black mulberry leaves by response surface methodology[J]. Food technology and biotechnology, 2012, 50(2): 167-176.
[44] GUO C Y, WANG J, HOU Y, et al. Orthogonal test design for optimizing the extraction of total flavonoids from Inula helenium[J]. Pharmacognosy magazine, 2013, 9(35): 192-195.
[45] LI L, FENG Z L, WANG F L, et al. Optimization for extraction of flavonoids from fruits of Loniera Maackii using response surface methodology[J]. Chemical engineering (China), 2014, 42(1): 1-5.
[46] MA?KOVI? P Z, DIAMANTO L D, CVETANOVI? A, et al. Optimization of the extraction process of antioxidants from orange using response surface methodology[J]. Food analytical methods, 2016, 9: 1436-1443.
[47] 孙 朦, 王鸿飞, 李艳霞, 等. 辣木叶总黄酮提取工艺优化及抗氧化能力研究[J]. 核农学报, 2018, 32(9): 1772-1780.
[48] 王婉愉, 李 姣, 张晓峰, 等. 响应面法优化乙醇提取草果黄酮的工艺研究[J]. 中国调味品, 2018, 43(10): 164-169.
[49] 郑和权,周守标,朱肖锋, 等. 马兰总黄酮提取工艺优化及不同部位含量测定[J]. 食品与发酵工业, 2008, 34(11): 185-189.
[50] 江震宇, 陈佳静, 葛宇飞, 等. 马铃薯皮黄酮提取工艺优化及其抗氧化性研究[J]. 中国粮油学报, 2018, 33(8): 69-74.
[51] ZULKIFLI S A, GANI S S A, ZAIDAN U H, et al. Optimization of total phenolic and flavonoid contents of defatted pitaya (Hylocereus polyrhizus) seed extract and its antioxidant properties[J]. Molecules, 2020, 25(4): 787.
[52] 李 慧, 刘俊果, 冯方圆, 等. 桑葚中黄酮提取方法比较与优化及稳定性研究[J]. 应用化工, 2021, 50(10): 2770-2774.
[53] 李志平, 李护护. 银杏叶中黄酮类化合物的提取和分离[J]. 中国油脂, 2021, 46(2): 131-134.
[54] 徐 浪, 梅 菊, 王 玉, 等. 苦荞黄酮提取及分离纯化工艺研究[J]. 农产品加工, 2022(5): 34-38.
[55] ZHANG H H, WANG X L, HE D L, et al. Optimization of flavonoid extraction from Xanthoceras sorbifolia Bunge flowers, and the antioxidant and antibacterial capacity of the extract[J]. Molecules, 2021, 27(1): 113.
[56] 李玉林, 杜玉枝, 沈裕琥. 正交试验法优化青稞叶黄酮的提取工艺[J]. 天然产物研究与开发, 2009, 21(B10): 509-511,398.
[57] LIU W, YU Y Y, YANG R Z, et al. Optimization of total flavonoid compound extraction from Gynura medica leaf using response surface methodology and chemical composition analysis[J]. International journal of molecular sciences,2010,11(11): 4750-4763.
[58] GAM D H, JO J M, JUNG H J, et al. Optimization of extraction conditions of antioxidant activity and bioactive compounds from rice bran by response surface methodology[J]. Applied chemistry engineering, 2018, 29(6): 726-733.
[59] DAI C Y,LIAO P R, ZHAO M Z, et al. Optimization of ultrasonic flavonoid extraction from Saussurea involucrate, and the ability of flavonoids to block melanin deposition in human melanocytes[J]. Molecules, 2020, 25(2): 313.
[60] SHI G Q, SHEN J X, WEI T, et al. UPLC-ESI-MS/MS analysis and evaluation of antioxidant activity of total flavonoid extract from Paeonia lactiflora seed peel and optimization by response surface methodology (RSM)[J]. BioMed research international, 2021, 19: 1-11.
收稿日期:2023-02-13
基金项目:国家大学生创新创业训练计划项目(202210410004);江西省大学生创新创业训练计划项目(S202010410005)
作者简介:李 悦(2001-),女,江西安福人,研究方向为水稻品质改良,(电话)13879666811(电子信箱)Lily2406942646@163.com;通信作者,
程建峰(1972-),男,江西横峰人,教授,博士,主要从事功能植物与代谢研究,(电话)15879196148(电子信箱)jfcheng@jxau.edu.cn。
李 悦,程建峰,罗 彤,等. 响应面法优化糙米总黄酮提取工艺[J]. 湖北农业科学,2024,63(9):167-172,215.
