一株鸭疫里氏杆菌的分离、鉴定与生物学特性分析
2024-10-09王博焘郭云清张腾飞张文婷卢琴胡巧罗青平翟新国







摘要:为确定引起2022年湖北省襄阳市某规模化鸭场的鸭急性死亡病因,对病料进行病原菌分离、对分离株进行生化特性鉴定、耐药性测定、动物回归试验及全基因组测序。结果表明,急性死亡的鸭病原菌仅有鸭疫里氏杆菌(Riemerella anatipestifer)分离鉴定为阳性。药敏结果显示分离菌株对药物敏感性较高,仅对环丙沙星、氧氟沙星耐药;动物回归试验结果显示分离菌株可引起雏鸭急性死亡,剖检可见典型的浆膜炎症状。组织病理学切片显示心脏、肝脏被膜有明显纤维性渗出,心肌细胞有炎性浸润、脾脏实质内可见淋巴细胞数量明显减少、脑组织可见较多的血管淤血扩张。毒力测定显示分离菌株的半数致死量为3.06×106 CFU/mL。
关键词:鸭疫里氏杆菌(Riemerella anatipestifer);生化特性;回归试验;病理变化;毒力
中图分类号:S858.32 文献标识码:A
文章编号:0439-8114(2024)09-0156-05
DOI:10.14088/j.cnki.issn0439-8114.2024.09.026 开放科学(资源服务)标识码(OSID):
Isolation, identification and biological characterization of a strain of Riemerella anatipestifer
WANG Bo-tao1,2,GUO Yun-qing2,ZHANG Teng-fei2,ZHANG Wen-ting2,
LU Qin2,HU Qiao2,LUO Qing-ping2,3,ZHAI Xin-guo1
(1. College of Life Science and Food Engineering, Hebei University of Engineering, Handan 056000, Hebei, China; 2. Key Laboratory of Creation of Preparations for the Prevention and Control of Bacterial Diseases of Livestock and Poultry, Ministry of Agriculture and Rural Affairs/Hubei Provincial Key Laboratory of Livestock and Poultry Pathogenic Microbiology/Institute of Animal Husbandry and Veterinary, Hubei Academy of Agricultural Sciences,Wuhan 430064, China; 3. Hubei Hongshan Laboratory, Wuhan 430064, China)
Abstract:In order to determine the cause of acute death of ducks in a large-scale duck farm in Xiangyang City, Hubei Province in 2022, the pathogenic bacteria were isolated, and the biochemical characteristics, drug resistance, animal regression tests and whole genome sequencing of the isolated strain were identified. The results showed that only Riemerella anatipestifer was isolated and identified as positive in acute dead duck pathogens. The drug susceptibility results showed that the isolated strains had high sensitivity to antibiotics and were resistant to ciprofloxacin and ofloxacin. The results of animal regression experiments showed that isolated strains could cause acute death of ducklings, typical symptoms of serositis were seen on autopsy. Histopathological sections showed obvious fibrous exudation of the heart and liver envelope, inflammatory infiltration of cardiomyocytes, a significant decrease in the number of lymphocytes in the spleen parenchyma, and more vascular congestion and expansion in brain tissue. Virulence assays showed that the half lethal dose of isolated strains was 3.06×106 CFU/mL.
Key words:Riemerella anatipestifer; biochemical properties; regression testing; pathological changes; virulence
鸭传染性浆膜炎是由鸭疫里氏杆菌(Riemrella anatipestifer,RA)感染鸭、鹅和火鸡等家禽后引起的传染病[1-3]。RA是革兰氏阴性、不产生芽孢、无鞭毛的细菌[4]。RA主要侵害1~8周龄雏鸭,RA的感染会导致高死亡率[5],因此在养鸭业受到了较大的关注。目前报道的RA血清型至少有21种,中国流行的血清型主要为血清1型、2型和10型[6],各血清型交叉保护力较低,临床上仍主要依赖抗生素对该病进行治疗,细菌耐药性问题也日益严重。顾庆林等[7]、吴征卓等[8]研究发现RA对环内酯类和氨基糖苷类抗生素的耐药性较强,增加了该病的防治难度,严重危害养鸭业的健康发展。
2022年湖北省襄阳市某规模化鸭场3周龄左右蛋鸭发生疾病,主要有精神症状,剖检可见纤维素性渗出,疑似为鸭疫里氏杆菌感染。本研究对病死鸭进行病原菌分离与鉴定,并对分离株开展了生化特性、耐药性、致病性等研究,旨在为临床上该病的防治提供理论依据。
1 材料与方法
1.1 检测病料
病鸭来源于湖北省襄阳市某规模化鸭场。
1.2 主要试剂
TSA培养基、TSB培养基,购自美国BD公司;革兰氏染液,购自北京索莱宝科技有限公司;病毒核酸提取试剂盒,购自南京诺唯赞生物科技股份有限公司;细菌DNA提取试剂盒,购自天根生化科技(北京)有限公司。
1.3 病毒的分离及鉴定
取病鸭的肝脏、气管、肺脏、脾脏、大脑,破碎后冻融3次,10 000 r/min离心2 min,使用病毒核酸提取试剂盒抽提总核酸。根据文献[9]合成引物(表1),引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为2×Taq PCR Master Mix 12.5 μL、上下游引物各1.0 μL、cDNA 2.0 μL、ddH2O 8.5 μL。PCR反应程序为95 ℃变性5 min;95 ℃变性15 s,52 ℃退火15 s,72 ℃延伸 15 s,35个循环;72 ℃延伸 5 min。
1.4 细菌分离培养
无菌采集肝脏、脾脏、大脑,分别接种于TSA和伊红美蓝培养基,于37 ℃下5% CO2培养箱培养24~48 h。挑取单菌落接种于TSB培养基中,37 ℃下180 r/min振荡培养过夜,并进行革兰氏染色,显微镜观察菌落形态。
1.5 16S rRNA基因序列的扩增与鉴定
取制备好的菌液,利用试剂盒提取基因组,
-20 ℃备用。根据文献[10]合成引物(表2)。PCR体系和程序同“1.3”。
1.6 生长曲线测定
取制备好的菌液转接TSB培养基培养,用培养基调整菌液OD600 nm为1.0,按1∶1 000转接在含有50 mL TSB的细菌瓶,3个重复。每2 h测量OD600 nm,每次重复测量3次。
1.7 生化试验
挑取单菌落接种于微量生化鉴定管内,按照试剂盒说明书观察并记录结果。
1.8 药敏试验
采用纸片扩散法进行药物敏感性测定。取制备的菌液均匀涂布于TSA培养基,并以ATCC 25922作为质控菌株,将药敏片贴于平板上,参考抗微生物药物敏感性试验执行标准(CLSI)判定结果。
1.9 动物回归试验
取制备的菌株以1%的比例转接至TSB培养基中调节OD600 nm为1.0,活菌计数。将48只2周龄雏鸭随机分为6组(表3)。采取腿部肌肉注射,以感染后7 d为一个观察周期,记录鸭群发病情况及发病症状,使用寇氏改良法计算菌株对雏鸭的半数致死量(LD50)。另外取15只2周龄的雏鸭,腿部肌肉注射分离菌株1.29×108 CFU/mL,在感染后48 h,随机抽取4只雏鸭,利用抗凝管采集血清后剖杀,取心脏、肝脏、脾脏、大脑,测定组织载菌量。并取1 cm×1 cm的组织,置于4%多聚甲醛溶液中固定,常规石蜡切片,HE染色,光学显微镜下观察。
1.10 全基因组测序
将提取的分离菌株的基因组,利用TBS-380荧光仪(Turner BioSystems Inc,Sunnyvale,CA)进行定量。采用优质DNA(OD260 nm/280 nm=1.8~2.0,浓度>1 ng/μL)送至上海美吉生物科技有限公司进行二代全基因组测序。
2 结果与分析
2.1 病原菌的分离与鉴定
病毒的鉴定结果均为阴性。细菌培养结果显示伊红美蓝培养基上无菌落生长,在TSA培养基生长出大小1~3 mm的半透明、圆形光滑菌落。分离菌株革兰氏染色镜检形态为革兰氏阴性短小杆菌,符合鸭疫里氏杆菌的菌落特征(图1)。
PCR扩增目的片段为1 480 bp(图2)。同源性比对显示与已报道的鸭疫里氏杆菌同源性大于99%,提示引起规模化养鸭场急性死亡的病原菌为鸭疫里氏杆菌,并将菌株命名为XY820。
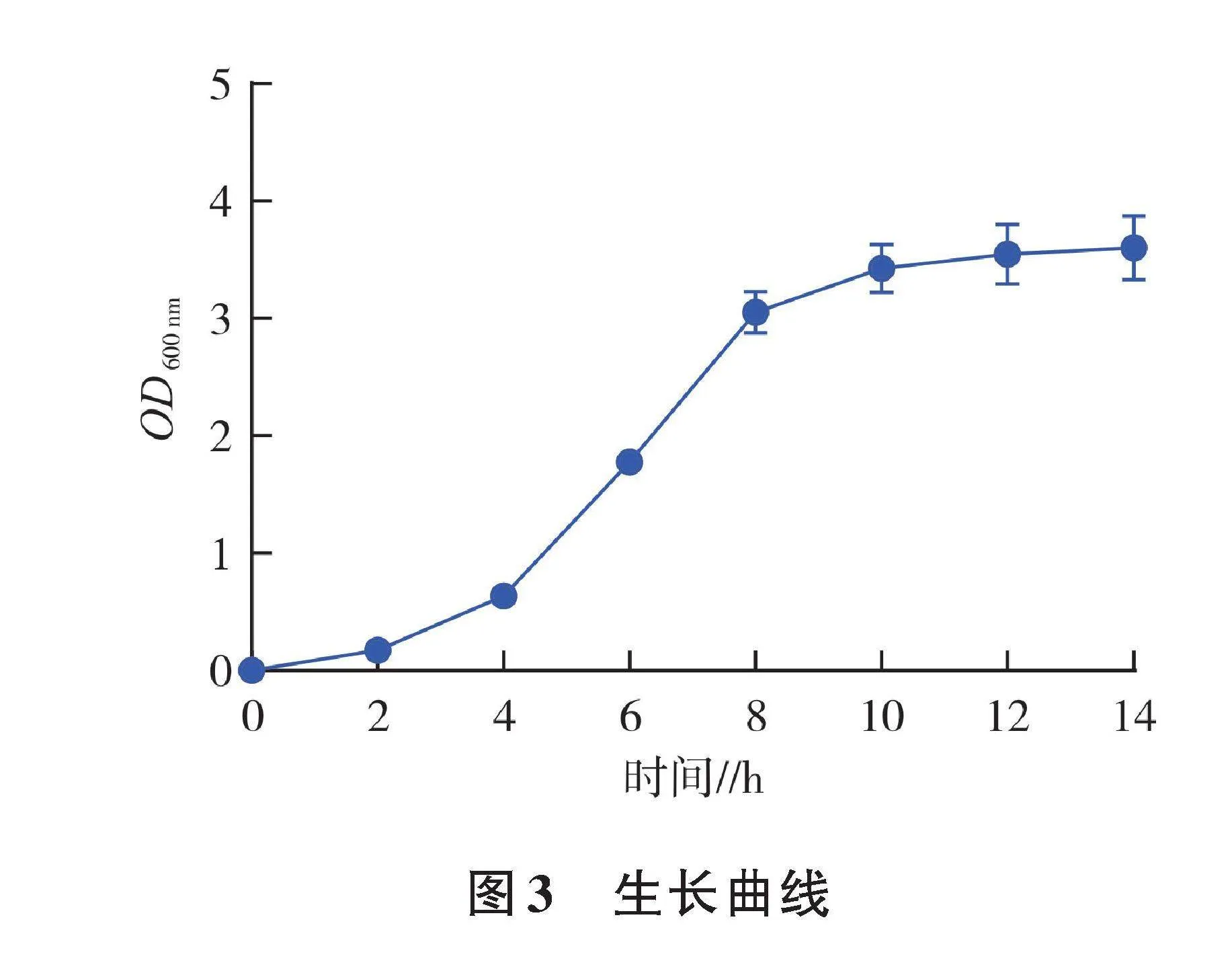
2.2 生长曲线测定
分离菌株的生长曲线如图3所示,分离菌株在4~8 h进入对数生长期,10 h后达到平台期。
2.3 生化试验
参照《伯杰细菌鉴定手册》判定反应,表明该分离菌株不能发酵乳糖、甘露醇、甘露糖、葡萄糖、蔗糖、麦芽糖、β-半乳糖苷,不产生苯丙氨酸,可以分解明胶。
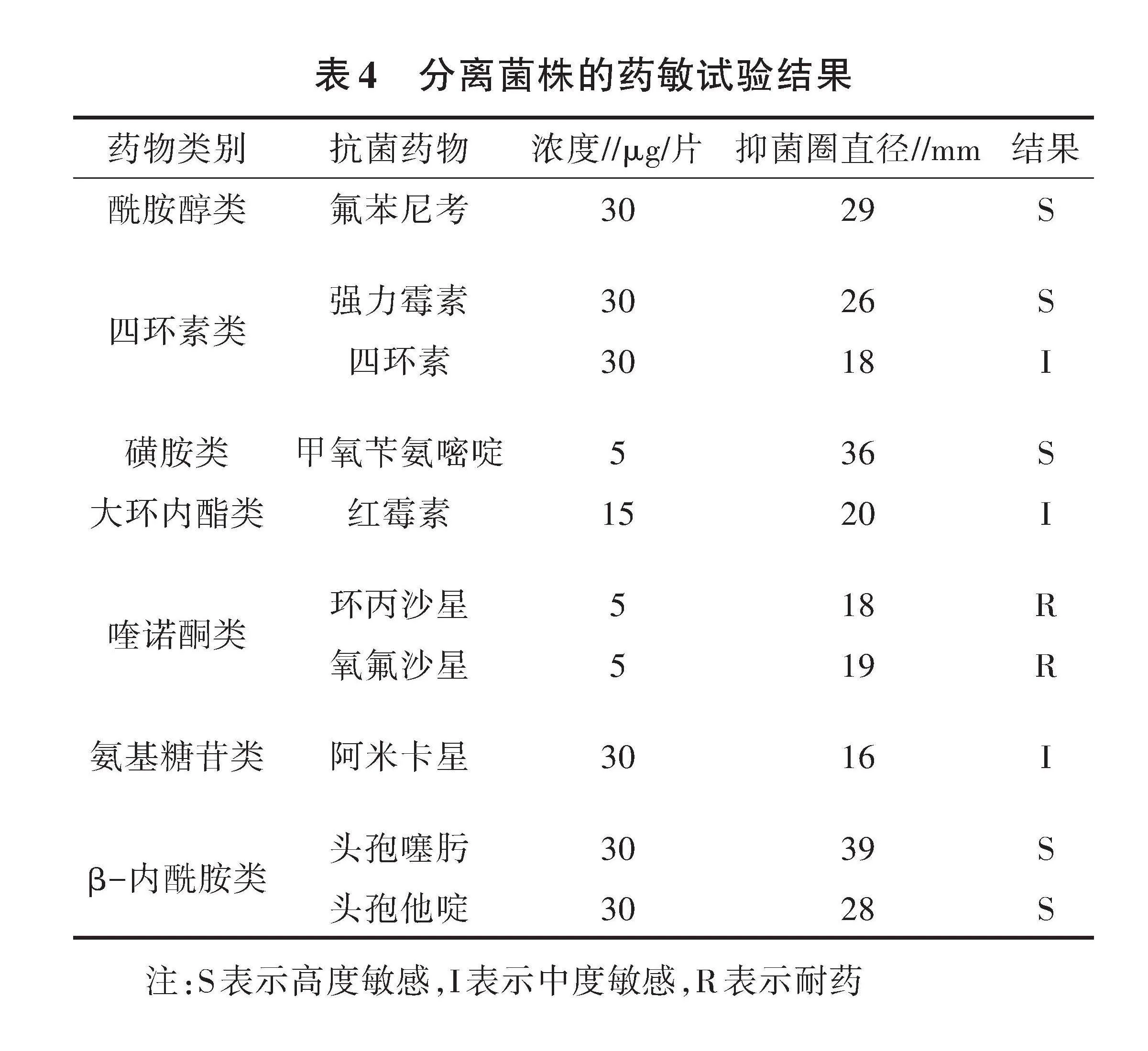
2.4 药敏试验
利用(K-B)法对分离菌株进行药物敏感性测试,结果如表4所示。分离菌株对环丙沙星、氧氟沙星耐药,对四环素、红霉素、阿米卡星中度敏感,对其他抗生素高度敏感。
2.5 动物回归试验
利用2周龄雏鸭进行分离菌株的回归试验,在7 d的观察期内,感染组低剂量组雏鸭出现扎堆趴卧,食欲不振、排白色或绿色水样稀粪、精神沉郁。高剂量组雏鸭出现死亡、头脑震颤、共济失调、仰卧双腿划水等典型的精神症状。菌株的生存曲线如图4所示,表明分离菌株可造成2周龄雏鸭的急性死亡。使用寇氏改良法计算分离菌株的LD50为3.06×106 CFU/mL。
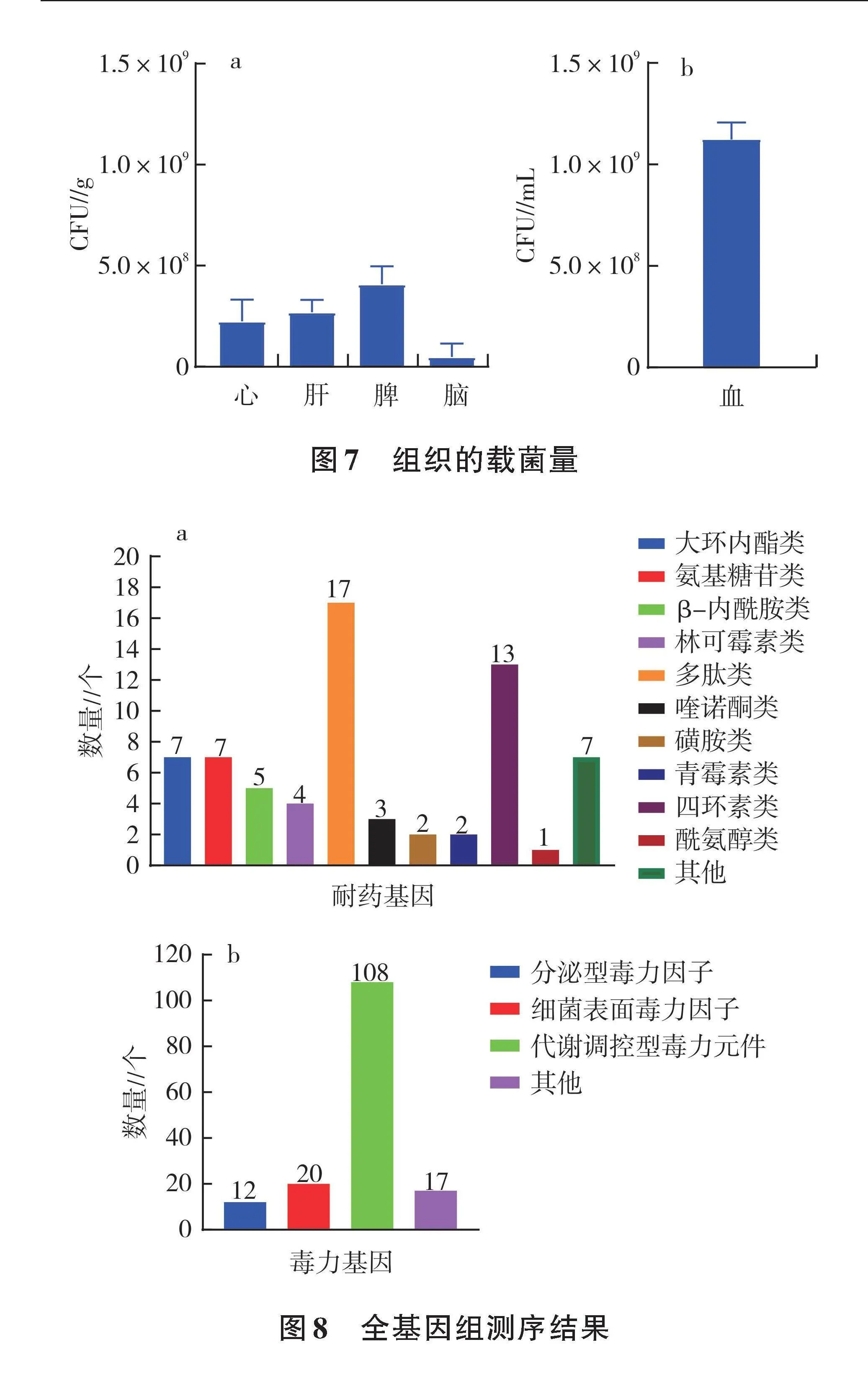
感染48 h后,观察1×108 CFU/mL感染组的病理变化并测定组织载菌量,结果如图5所示。感染组雏鸭剖检可见心脏、肝脏出现明显的纤维素性渗出形成的假膜,脾脏呈现大理石状花纹,脑部充血(图5A)。由图6可以看出,HE染色后感染组的心脏组织可见心外膜轻度水肿,结构疏松,血管扩张(黄箭头),可见少量的炎性细胞浸润(红箭头)。肝脏组织可见被膜明显增厚(黑箭头),肝实质内可见广泛性的肝细胞脂肪变性,胞质内可见圆形空泡(黄箭头),大量肝窦轻度淤血扩张(蓝箭头)。脾实质内可见淋巴细胞数量明显减少,脾脏实质结构疏松(黑箭头),未见明显的淋巴小结。脑组织局部可见较多的血管淤血扩张(黄箭头),伴有胶质细胞增生(红箭头)。对照组无明显的病理变化。组织载菌量测定结果如图7所示,血液、心脏、肝脏、脾脏和大脑均有鸭疫里氏杆菌的定植。
2.6 全基因组测序结果分析
全基因组测序结果见图8。共检测到68个耐药基因,其中酰氨醇类1个(floR)、四环素类13个[oqxA、tet36、tetB(P)等]、磺胺类2个(sul4、cfrC)、大环内酯类7个(ErmD、macB、oleC等)、喹诺酮类3个(oprA、TLA-1、MexF)、氨基糖苷类7个(smeS、vmlR、vgaB等)、β-内酰胺类5个(optrA、mecC、OXA-209等)、其他类30个。
XY820编码157个毒力相关基因,根据文献[11]将毒力因子分为三大类,其中分泌型毒力因子12个(eccA1、ricA、escN等);细菌表面毒力因子20个(algC、ompA、cpsB等);代谢调控型毒力元件108个(mgtB、phzH、bplF等);其他类17个。
3 小结与讨论
雏鸭出现大量死亡,且伴有精神沉郁、头脑震颤、共济失调、仰卧双腿划水等精神症状。病理剖检可见包心、包肝现象,其大脑严重充血。对可疑病原禽流感病毒、腺病毒和鸭疫里氏杆菌进行分离鉴定。结果表明,禽流感病毒、腺病毒分离结果为阴性,细菌分离结果为阳性,16S rRNA基因序列测定结果显示分离菌为鸭疫里氏杆菌。并利用2周龄雏鸭对鸭疫里氏杆菌分离株进行动物回归试验,鸭疫里氏杆菌感染组出现了急性死亡、共济失调、仰卧双腿划水等精神症状。剖检可见明显的浆膜炎症状,且在病死鸭的心脏、肝脏、脾脏等组织内分离到鸭疫里氏杆菌,表明鸭疫里氏杆菌是该病例的主要病因。
抗生素的过度使用,导致RA产生多种抗生素的耐药性,多重耐药菌株对人类健康也造成了威胁[12]。祝希辉等[13]的研究发现RA对喹诺酮类和氨基糖苷类等12种抗生素出现了不同耐药情况。本试验发现分离菌株对喹诺酮类(环丙沙星和氧氟沙星)出现耐药性,而对大多数抗生素敏感,较减抗限抗前有较明显的耐药性下降,其原因可能是因为抗生素的限制使用导致菌株的耐药性降低,降低多重耐药菌株的出现,在养殖过程中应严格注意抗生素的使用及停药周期,既能降低养殖成本也能降低耐药菌株的出现。本试验发现菌株部分耐药基因与耐药表型存在不相符的情况如酰氨醇类(氟苯尼考)和磺胺类(甲氧苄胺嘧啶),在分离株基因组中检测到这两种耐药基因,但不具备这两种抗生素的耐药表型。张旭财等[14]对14株RA进行耐药基因检测和药敏试验,酰氨醇类耐药基因检测率为100%,但对酰氨醇类药物表现耐药表型的菌株仅有3株,也存在耐药基因与耐药表型不对应的情况。其原因可能是发现的耐药基因不是控制RA耐药的关键基因。
本试验检测到分泌型毒力因子12个(eccA1、ricA、escN等),沈如玉[15]的研究发现Ⅸ型分泌系统(T9SS)组分基因突变株毒力与野生株相比显著降低,且其分泌蛋白中有9个T9SS效应分子与野生株差异表达。细胞表面毒力因子20个(algC、ompA、cpsB等),Hu等[16]的研究发现,RA的OmpA基因缺失株对雏鸭的致死力较野生株下降了90%。荚膜多糖(Capsular polysaccharide,CPS)可保护细菌细胞免受宿主免疫机制的影响,包括抗吞噬和抗溶菌活性、免疫逃避和免疫调节[17]。代谢调控型毒力元件108个(mgtB、phzH、bplF等),Guo等[18]的研究发现fur缺失后导致菌株的半数致死量由2.0×106 CFU/mL降低为1.6×108 CFU/mL。
本研究从爆发传染性浆膜炎的鸭场中成功分离到1株鸭疫里氏杆菌,具有较强的致病力。分离菌株对多种抗生素敏感,仅对喹诺酮类抗生素(环丙沙星和氧氟沙星)耐药,临床利用敏感药物进行治疗以后效果显著,还对分离菌株进行了全基因组测序,共检测到68个耐药基因和157个毒力相关基因,为鸭疫里氏杆菌的流行病学调查及临床治疗提供了理论支撑。
参考文献:
[1] 陈国权, 吴征卓, 姚碧琼, 等. 两株鸭疫里默氏杆菌的分离鉴定及生物学特性分析[J]. 中国预防兽医学报, 2020,42(12):1226-1232.
[2] WANG Y, ZHANG Y, CUI Y, et al. Identification of an integrase that responsible for precise integration and excision of Riemerella anatipestifer genomic island[J]. Frontiers in microbiology, 2019, 20:10:2099.
[3] ZHU D, WAN J, YANG Z, et al. First report of integrative conjugative elements in Riemerella anatipestifer isolates from ducks in China[J]. Frontiers in veterinary science, 2019, 24:6:128.
[4] DOU Y,YU G,WANG X,et al. The Riemerella anatipestifer M949_RS01035 gene is involved in bacterial lipopolysaccharide biosynthesis.[J]. Veterinary research, 2018,17; 49(1): 93.
[5] HU Q, QI J, BO H, et al. Complete genome sequence of Riemerella anatipestifer serotype 10 strain HXb2.[J]. Genome announcements, 2017,5(18):e00278-17.
[6] HU Q H, HAN X G, ZHOU X J, et al. Characterization of biofilm formation by Riemerella anatipestifer[J]. Veterinary microbiology, 2010,144(3-4):429-436.
[7] 顾庆林, 包涛涛, 鲜思美, 等. 23株鸭疫里默氏杆菌贵州株的耐药及耐消毒剂基因分析[J]. 中国预防兽医学报, 2023,45(1):95-99.
[8] 吴征卓, 陈国权, 姚碧琼, 等. 贵州省三穗县鸭疫里默氏杆菌的分离鉴定、毒力基因检测及耐药性分析[J]. 中国畜牧兽医, 2021,48(11):4274-4283.
[9] 何家辉,胡泽中,李鸿鑫, 等. 免疫失败鸡群中H9N2亚型禽流感病毒的分离鉴定与分子特征分析[J]. 中国家禽, 2022,44(3):27-37.
[10] 包涛涛, 鲜思美, 包细明, 等. 六株鸭疫里默氏杆菌贵州株的分离鉴定及其耐药性分析[J]. 中国兽医科学, 2020,50(10):1278-1285.
[11] 高继业, 黎容红, 黄 伟, 等. 鸭疫里默杆菌表型相关基因在重庆、四川分离株中的分布及遗传多样性分析[J]. 中国兽医学报, 2020,40(7):1311-1318.
[12] HUANG L, WANG M S, MO T, et al. Role of LptD in resistance to glutaraldehyde and pathogenicity in Riemerella anatipestifer[J]. Frontiers in microbiology, 2019,10:1443.
[13] 祝希辉,李艳兰,王志伟,等. 1株鸭疫里默氏杆菌的全基因组测序及耐药性与遗传进化分析[J]. 中国畜牧兽医,2023,50(3):1140-1149.
[14] 张旭财, 李燕红, 陆毅兴, 等. 广东肇庆地区鸭疫里氏杆菌耐药性和毒力基因分析及ERIC-PCR分型研究[J]. 中国动物传染病学报, 2022, 30(4):39-47.
[15] 沈如玉. 鸭疫里默氏杆菌Ⅸ型分泌系统效应分子Endonuclease Ⅰ的生物学特性研究[D]. 江苏扬州:扬州大学, 2022.
[16] HU Q H, HAN X G, ZHOU X J, et al. OmpA is a virulence factor of Riemerella anatipestifer[J]. Veterinary microbiology, 2011,150(3-4):278-283.
[17] 李林林, 孙敏华, 董嘉文, 等. 鸭疫里默氏菌毒力相关因子研究进展[J]. 动物医学进展, 2021,42(12):92-96.
[18] GUO Y, HU D, GUO J, et al. The role of the regulator fur in gene regulation and virulence of Riemerella anatipestifer assessed using an unmarked gene deletion system[J]. Frontiers in cellular and infection microbiology, 2017,7:382.
收稿日期:2023-09-05
基金项目:重要家禽疫苗效力评价用菌毒种筛选与研究(2022YFD1800602);湖北省农业科技创新2020年重大科技研发专项(2020-620-000-002-04;2020-620-000-002-01);国家肉鸡产业技术体系(CARS-41);湖北省科技重大专项-主要动植物品种选育及生物制品研发项目(2020ABA016)
作者简介:王博焘(1999-),男,河北邯郸人,在读硕士研究生,研究方向为家禽细菌病流行病学调查,(电话)17349805675(电子信箱)
954724079@qq.com;通信作者,翟新国(1966-),男,副教授,主要从事重要动物传染病防控研究,(电子信箱)zhaixg1966@163.com;
罗青平(1971-),女,研究员,主要从事禽病防控研究,(电子信箱)qingping0523@163.com。
王博焘,郭云清,张腾飞,等. 一株鸭疫里氏杆菌的分离、鉴定与生物学特性分析[J]. 湖北农业科学,2024,63(9):156-160,166.
