山豆根菌核病病原菌鉴定及室内药剂筛选
2024-10-09宋利沙蒋妮张占江韦树根丘卓秋黄琦詹鑫婕潘丽梅



摘要:采用常规组织分离法分离山豆根(Sophora tonkinensis Radix)菌核病病原菌,利用柯赫式法则进行致病性测定,基于形态特征、菌丝融合群测定、细胞核荧光染色以及rDNA-ITS序列分析进行病原菌的鉴定,并利用菌丝生长速率法测定5种杀菌剂对病原菌的抑制活性。结果表明,山豆根菌核病的病原菌为立枯丝核菌(Rhizoctonia solani),属于融合群AG-1。98%恶霉灵可溶性粉剂(SP)、75%肟菌·戊唑醇水分散粒剂(WG)、250 g/L吡唑醚菌酯乳油(EC)、10亿/g哈茨木霉菌悬浮剂(SC)、50%多菌灵可湿性粉剂(WP)对病原菌菌丝的生长均有较好的抑制效果,抑制中浓度(EC50)分别为0.061 1、0.575 7、0.074 8、0.284 3、0.740 5 mg/L。
关键词:山豆根(Sophora tonkinensis Radix);菌核病;病原菌鉴定;室内药剂筛选;立枯丝核菌(Rhizoctonia solani)
中图分类号:S432.1;S432.4 文献标识码:A
文章编号:0439-8114(2024)09-0089-06
DOI:10.14088/j.cnki.issn0439-8114.2024.09.016 开放科学(资源服务)标识码(OSID):
Identification of pathogen of sclerotinia on Sophora tonkinensis Radix and screening of laboratory agents
SONG Li-sha, JIANG Ni, ZHANG Zhan-jiang, WEI Shu-gen, QIU Zhuo-qiu,HUANG Qi, ZHAN Xin-jie, PAN Li-mei
(Guangxi Botanical Garden of Medicinal Plants/Guangxi Key Laboratory of High-Quality Formation and Utilization of Dao-Di Herbs/Guangxi Traditional Chinese Medicine Breeding Technology Innovation Center/ National Center for Traditional Chinese Medicine Inheritance and Innovation, Nanning 530023,China)
Abstract: The pathogens from Sophora tonkinensis Radix were isolated by conventional tissue separation method, the pathogenicity was determined by Koch’s formula, and the pathogens were identified based on morphological characteristics, mycelium fusion group determination, nuclear fluorescence staining and rDNA-ITS sequence analysis. The inhibitory activities of 5 fungicides against pathogens were measured by the mycelium growth rate method. The results showed that the pathogen was Rhizoctoniao0gamISRjf/xf8MQbjjZmuiBd0thfBlc66y3uhDkKjg= solani, belonging to the fusion group AG-1. 98% hymexazol soluble power (SP), 75% oxime ·pentazolol water dispersible granule (WG), 250 g/L pyraclostrobin emulsifiable concentrate (EC), 1 billion /g Trichoderma harziana suspension concentrate (SC), and 50% carbendazim wettable power (WP) all had good inhibitory effects on the growth of pathogenic fungi mycelia. The inhibitory medium effective concentrations (EC50) were 0.061 1, 0.575 7, 0.074 8, 0.284 3, 0.740 5 mg/L, respectively.
Key words:Sophora tonkinensis Radix; sclerotinia; identification of pathogen; screening of laboratory agents; Rhizoctonia solani
山豆根(Sophora tonkinensis Radix)为豆科(Leguminosae)槐属(Sophora)越南槐(Sophora tonkinensis Gagnep)的干燥根及根茎,是中国传统的中药材,具有消肿化瘀、清热利咽、解毒去火的作用,历年收录在《中华人民共和国药典》[1]。广西是山豆根的道地主产区[2,3],山豆根原材料的需求日益增大,其在广西的种植面积近667万m2[4]。随着栽培面积的日益扩大,山豆根根腐病、炭疽病、圆斑病等病害陆续有报道[5-7],2021年7月,广西壮族自治区药用植物园在广西河池市山豆根产区首次发现山豆根菌核病,该病害多从山豆根近地面茎部开始发病,后沿着主茎逐渐侵染枝条、叶柄、叶片,后期茎干枝条枯黄,叶片变黄脱落,整个植株枯萎死亡。湿度高时,在发病处可见白色菌丝体,后期可形成典型的菜子粒至鼠粪状大小的黑褐色菌核。该病害早期症状较为隐蔽,如温湿度适宜,特别是高温大雨的天气,很容易在田间发生流行,植株从感病到整株枯死只需3~5 d。通常引起植物菌核病的病原菌多为核盘菌或丝核菌,但目前鲜见有报道山豆根菌核病的病原菌种类,鉴于该病害的危害性极大,通过病原菌的分离、致病性测定、病原菌的形态及分子鉴定,明确山豆根菌核病的病原种类,进而开展室内药剂筛选试验,以期为病害的有效防治提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样品 2021年9月采集自广西河池金城江区感病的山豆根枝叶。
1.1.2 室内杀菌剂原药 5种供试药剂详细信息及使用浓度见表1。
1.1.3 融合群的标准菌株 立枯丝核菌由中国医学科学院北京协和医学院药用植物研究所李勇研究员惠赠。
1.2 方法
1.2.1 病原菌的分离和纯化 采用常规组织法进行样品分离,先用清水对山豆根感病的枝叶清洗干净,用滤纸吸干表面水分。参照方中达[8]《植病研究方法》进行操作,取病健交界处的枝叶,先用75%乙醇消毒30 s,再用0.1%的氯化汞消毒2.5 min,最后用无菌水漂洗3次,用灭菌滤纸吸干水,然后剪取直径5 mm茎段,置于PDA平板上,28 ℃恒温培养,待菌落长出,挑取尖端菌丝纯化培养。
1.2.2 致病性测定 采用叶片离体试验和整株活体试验进行致病性测定。整株活体试验步骤:取直径6 mm的菌饼10个,用无菌研钵棒捣碎菌饼,然后与500 mL无菌水混匀,作为接种液。将长势一致的 1年生山豆根苗移栽至直径为18 cm的花盆中,把接种液从上到下均匀喷洒有刺伤的整个植株的叶片和茎,并用自封袋封住保湿,直到开始发病取下自封袋。对照接种无菌水,每处理重复3次。
叶片离体致病性试验步骤:将直径6 mm的菌饼接种至长势一致的1年生山豆根健康的叶片上,以接种直径6 mm的PDA培养基组织块为对照,每处理重复3次。
1.2.3 形态特征观察 将纯化培养的菌株接种到PDA培养基上28 ℃培养5~7 d,观察记录病菌的菌落特征、颜色、质地等以及菌核产生情况;利用光学显微镜观察菌丝形态特征。
1.2.4 菌丝融合群测定 参照参考文献[9,10]的玻片对峙法培养,取待测菌株和标准菌株的菌饼分别置于PDA培养基的载玻片(无菌)上,两菌饼间隔 2 cm左右,于28 ℃培养箱黑暗培养2~3 d。待2个菌株的菌落前端菌丝重叠5 mm左右时,取出载玻片于光学显微镜下观察融合情况。
1.2.5 细胞核数目观察 将菌株接种于PDA培养基中央,灭菌的盖玻片XgEq98gYgaJK1BZIY5UK6ThB8T2cvkeD+WxfnEPl9o8=45°斜插在接种点的四周,待菌丝长满盖玻片取出。参照参考文献[11,12]的方法,用荧光染色剂Calcofluor(10 μg/mL)和Hoechst33258(0.8 μg/mL)或DAPI(0.8 μg/mL)对菌丝染色,置于荧光显微镜下观察菌丝细胞核数目。并结合电镜操作观察菌丝隔膜和细胞核的形态。
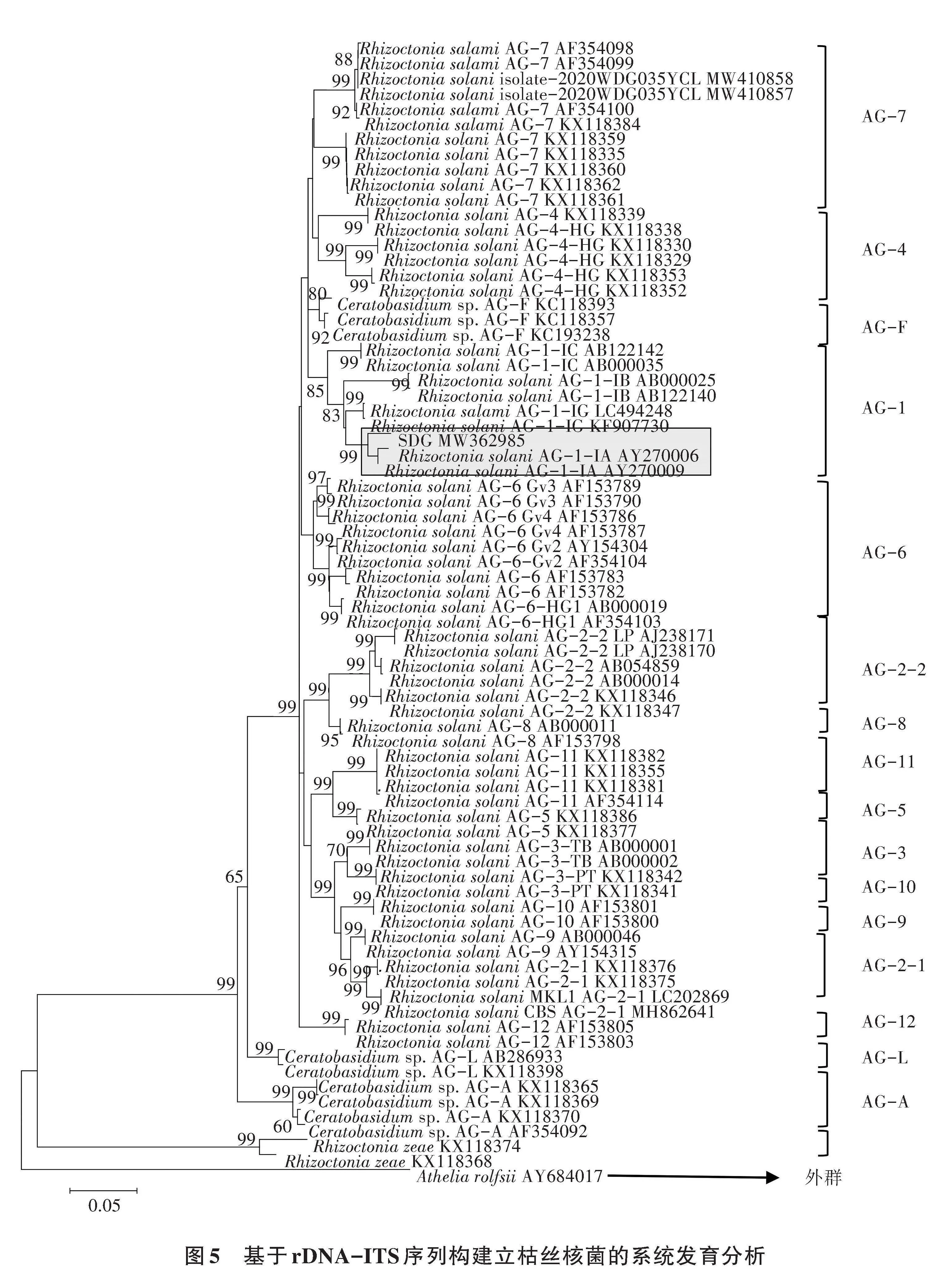
1.2.6 致病菌鉴定 参考方中达[8]的方法记录菌落形态,参考魏景超[13]的方法进行菌落形态初步鉴定。参考 Kumar等[14]的方法,采用MightyAmp DNA PolymeraseVer.3(1.25 U/50 μL)试剂盒(Takara Bio Inc.,Japan,cat.no.R076A),挑取山豆根菌核病菌的菌丝作为模板直接用于PCR反应,采用真菌ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TC CTCCGCTTATTGATATGC-3′)通用引物进行PCR扩增。反应体系50.0 μL:2×MightyAmp Buffer 25.0 μL,10×Addtitive for High Specificity 5.0 μL,引物ITS1和ITS2(15 pmoL/L)各1.5 μL,加ddH2O定容至50.0 μL。扩增程序:98 ℃预变性2 min;98 ℃ 10 s,60 ℃ 15 s,68 ℃ 60 s,进行35个循环;68 ℃延伸10 min。用凝胶成像法检测目的条带,将有目的条带的PCR产物送至生工生物工程(上海)股份有限公司测序;测序结果与NCBI的GenBank中的序列进行BLAST比对,利用MEGA7.0的邻位连接法构建ITS rDNA系统发育进化树,进行分子生物学鉴定。
1.2.7 杀菌剂的抑菌作用测定 采用菌丝生长速率法[15],将病原菌接种到PDA培养基上培养5 d后,按照供试药剂母液设定的浓度比例加入到已融化冷却至50 ℃左右的PDA培养基中,混匀后倒入无菌培养皿中,制成含药平板,将直径为6 mm的菌饼置于含药平板上,以不加入杀菌剂的PDA作为对照。
选5种杀菌剂进行EC50毒力测定。将菌饼接种于稀释不同倍数农药的PDA平板中央,每个处理重复3次,于28 ℃光照培养箱下培养7 d。按时观察并用十字交叉法测量菌落直径,计算不同农药的抑制率。供试EC50浓度参照表1。
抑菌率计算公式[15]如下。
ω=(N-M)/(N-菌饼直径)×100% (1)
式中,ω为抑菌率;N为对照菌落增长直径;M为处理菌落增长直径。
采用Excel 2019软件对数据进行统计分析,计算毒力回归方程(y=a+bx),先把抑制率换算为几率值,以自变量x为浓度的对数值,y为几率值,再用此方程求EC50,利用SPSS 19.0软件计算斜率标准误差、卡方值、自由度和P。
1.3 数据分析
数据采用SPSS 19.0软件进行单因素ANOVA分析。
2 结果与分析
2.1 病害发生症状
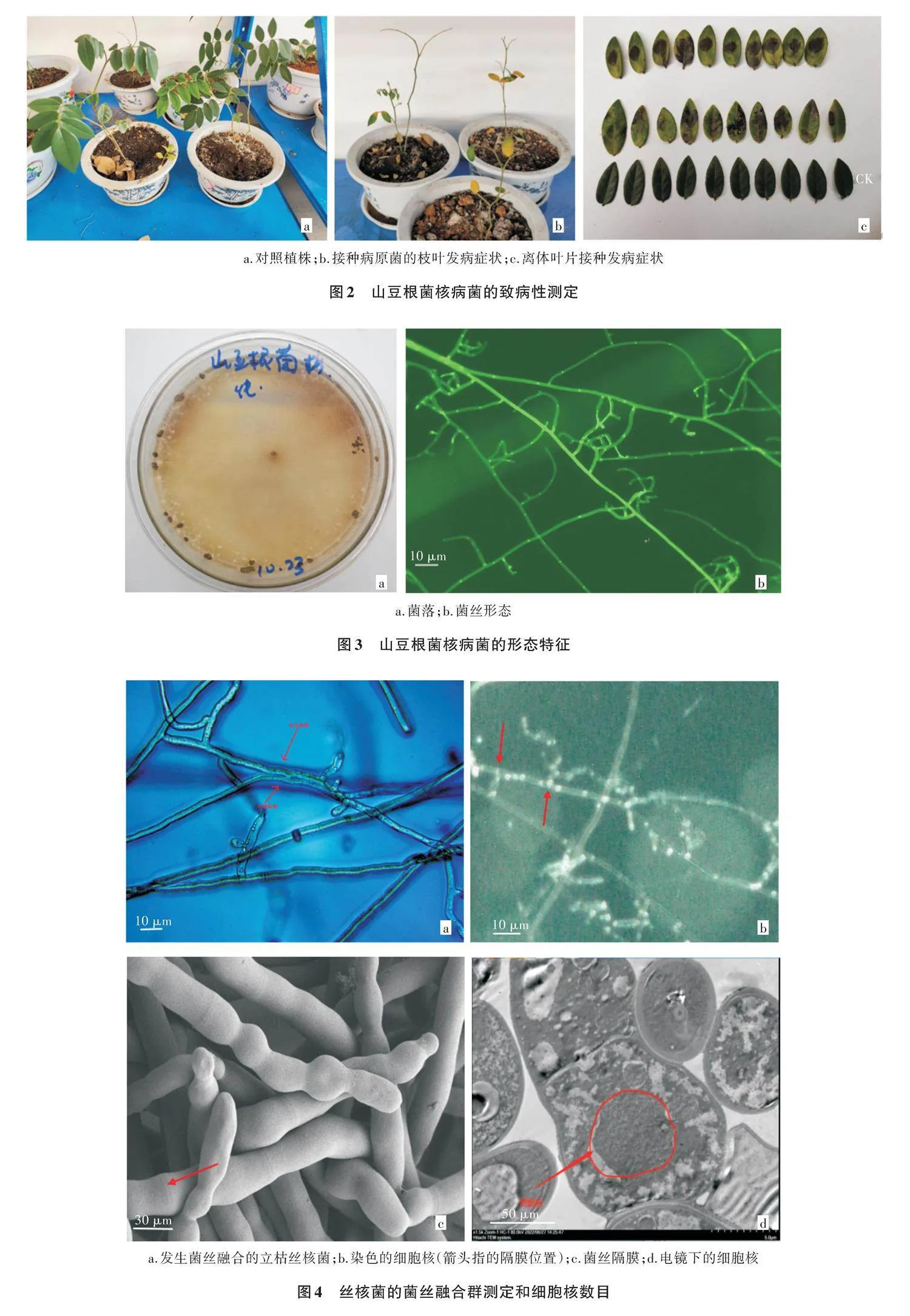
山豆根菌核病主要发生在2~3年生植株。每年6—7月南方雨季,为病害高发期。多从近地面茎部开始发病,侵染点初期不规则形,灰褐色,水渍状凹陷,后沿着主茎逐渐侵染枝条、叶柄、叶片,后期茎干枝条枯黄,叶片变黄脱落,植株枯萎(图1a)。湿度高时,在发病处可见白色菌丝体,后期可形成菌核。菌核开始为淡黄色菜子状(直径0.5~1.0 mm),后期变大(直径3.0~4.0 mm),棕褐色(图1b)。
2.2 病原菌分离和致病性测定
从发病植株的茎和叶片组织分离出的大部分菌株形态一致,经纯化保留了1个代表菌株,编号为SDG。接种3 d后山豆根叶片逐渐退绿变黄,9 d后枯萎脱落,茎也随着时间的推移逐渐退绿,15 d后枯萎,而对照则无此现象(图2)。对SDG接种的茎叶再次进行分离,均可分离出同样的丝核菌。从而确定接种的菌株为山豆根菌核病的病原菌。
2.3 菌株SDG的形态学鉴定
致病菌株SDG在PDA培养基上呈辐射状生长。初期菌丝体呈白色,气生菌丝生长迅速,随着培养时间的推移,气生菌丝逐渐变为棕褐色,15 d左右在菌落周围或中部产生大量的菌核,菌核表面粗糙,暗褐色,形状不规则(图3a)。菌丝呈近直角或锐角分枝,近分枝处形成隔膜及分枝处多有缢缩(图3b)。
2.4 菌株SDG的菌丝融合群及细胞核数目
根据待测菌株与标准菌株的对峙培养观察和鉴定标准,菌株SDG与标准菌株发生菌丝融合(图4a)。经过荧光染色剂处理后,荧光显微镜下观察菌丝细胞核数目为多个,多数为3个(图4b)。在扫描电镜和透射电镜下明显看到菌丝桶状隔膜(图4c)和细胞核(图4d)。根据形态特征和细胞核数目,确定山豆根菌核病菌为立枯丝核菌(Rhizoctonia solani)。
2.5 病原菌的分子生物学鉴定
病原菌菌株SDG经ITSrDNA序列进行测定并与AG融合群菌株构建系统发育树。结果(图5)表明,菌株SDG与Rhizoctonia solani AG-1-IA(AY270006和AY270009)聚为同一个系统发育分支,同源性达99%。因此将该菌株鉴定为立枯丝核菌Rhizoctonia solani AG-1-IA。菌株SDG序列已提交GenBank数据库,登录号(Accession number)为MW362985。
2.6 杀菌剂对病原菌的抑制作用和室内毒力测定
选用表2中5种杀菌剂进行EC50试验,发现98%恶霉灵SP和250 g/L吡唑醚菌酯EC对山豆根菌核病菌菌丝生长抑制效果较好,其EC50分别为0.061 1、0.074 8 mg/L;其次为10亿/g哈茨木霉菌SC、75%肟菌·戊唑醇WG和50%多菌灵WP,其EC50分别为0.284 3、0.575 7、0.740 5 mg/L。
3 讨论与小结
立枯丝核菌属于半知菌类无孢目丝核菌属,其有性态为担子菌门瓜亡革菌(Thanatephorus cucumeris)[16]。立枯丝核菌在自然界中多以无性态存在,很难发现有性态。此外,在田间危害也是以无性态为主。立枯丝核菌的分类通常以菌丝融合类群来划分,目前其融合群已有14个(AG-1至AG-13,AG-B1)[17]。同时前人又在融合群的基础上划分亚群,目前发现18个亚群,可在不同作物上引起不同的病害[18-25]。
山豆根菌核病在广西河池为害枝叶严重,经分离和致病性测定以及分子生物学鉴定为立枯丝核菌;根据菌丝细胞内细胞核的状态和融合群测定,确定该病菌为多核丝核菌AG-1-IA类群,这是国内对立枯丝核菌引起山豆根菌核病的首次报道。根据文献检索,国内尚未发现由立枯丝核菌AG-1-IA类群引起山豆根菌核病菌的报道。立枯丝核菌寄主范围广泛,仅AG-1融合群可侵染多科植物,如禾本科、菊科、豆科、十字花科等植物[19-25],它还能引起多种植物的立枯和叶枯,由此据菌株不同寄主的致病性又分为IA、IB、IC亚群[19]。AG-1-IA类群能够引起水稻和玉米的纹枯病,造成严重的危害和产量损失[26,27],虽AG-1-IA类群暂时未见在豆科上报道,但也有文献指出AG-1-IA类群中存在适应不同宿主感染的基因库调控[28]。本研究仅对广西河池金城江区山豆根菌核病的丝核菌鉴定,其他山豆根产区是否存在不同的丝核菌种类及融合群,仍需进一步检测和研究。
通过5种杀菌剂室内对山豆根菌核病菌的抑菌作用和EC50毒力测试,发现98%恶霉灵SP和250 g/L吡唑醚菌酯EC对山豆根菌核病菌菌丝生长抑制效果较好,其EC50分别为0.061 1、0.074 8 mg/L。这些杀菌剂可作为防治山豆根菌核病的候选药剂,可进一步进行田间药效试验。本研究明确了山豆根菌核病的病原菌为立枯丝核菌AG-1-IA,该结果可为病害综合防控提供重要参考依据。
参考文献:
[1] 国家药典委员会.中华人民共和国药典 一部[M].北京:中国医药科技出版社,2020.
[2] 彭 成.中华道地药材[M].北京:中国中医药出版社,2011.
[3] 姚绍嫦,凌征柱,蓝祖栽,等.广西道地药材山豆根的适宜气候条件分析[J].中国农业气象,2013,34(6): 673-677.
[4] 蒋 妮,宋利沙,陈乾平,等.越南槐圆斑病病原鉴定[J].植物病理学报,2021,51(3):460-463.
[5] SONG L S,JIANG N,TAN G Y,et al. First report of round leaf spot on Sophora tonkinensis Caused by Didymella glomerata in China[J].Plant disease,2021,105(2):498.
[6] SONG L S,JIANG N,CHEN Q P,et al. First report of leaf spot caused by Colletotrichum siamense on Sophora tonkinensis[J].Australasian plant disease notes,2021,16:11.
[7] 唐小迪,魏升华,秦 睿,等.贵州山豆根根腐病病原菌鉴定[J].南方农业学报,2021,52(8):2140-2147.
[8] 方中达.植病研究方法[M].北京:中国农业出版社,1998.
[9] 陈延熙,张敦华,段霞瑜,等.关于Rhizoctonia solani菌丝融合分类和有性世代的研究[J].植物病理学报, 1985,15(3):139-143.
[10] 张敦华,陈延熙.双核丝核菌的菌丝融合[J].植物病理学报,1986,16(3):13-18.
[11] HARRIS S D,MORREL J L,HAMER J E. Identification and characterization of Aspergillus nidulans mutants defective in cytokinesis[J].Genetics,1994,136(2):517-532.
[12] XU J R,HAMER J E. MAP kinase and cAMP signaling regulate infection structure formation and pathogenic growth in the rice blast fugus Magnaporthe grisea[J].Genes and development,1996,10(21):2696-2706.
[13] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[14] KUMAR S,STECHER G,TAMURA K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Molecular biology and evolution,2016,33(7):1870-1874.
[15] 张凯东,强 遥,刘 冰,等.猕猴桃叶斑病病菌生物学特性及室内药剂筛选[J].江苏农业科学,2021,49(18): 106-110.
[16] 邵力平,沈瑞祥,张素轩.真菌分类学[M].北京:中国林业出版社,1984.
[17] CARLING D E,BAIRD R E,GITAITIS R D,et al. Characterization of AG-13 a newly reported Anastomosis Group of Rhizoctonia solani[J].Phytopathology,2002,92(8):893-899.
[18] 李 菊.中国东北地区玉米纹枯病菌融合群鉴定及遗传多样性研究[D].山东泰安:山东农业大学,2011.
[19] OGOSHI A. Ecology and pathogenicity of anastomosis and intraspecific groups of Rhizoctonia solani Kühn [J].Annual review of phytopathology,1987,25(1):125-143.
[20] GONZ?LEZ G V,PORTAL O M A,RUBIO V. Review. Biology and systematics of the form genus Rhizoctonia[J].Spanish journal of agricultural research,2006,4(1):55-79.
[21] GODOY-LUTZ G,KUNINAGA S,STEADMAN J R, et al. Phylogenetic analysis of Rhizoctonia solani subgroups associated with web blight symptoms on common bean based on ITS-5.8S rDNA[J].Journal of general plant pathology,2008,74(1):32-40.
[22] SHARON M,KUNINAGA S,HYAKUMACHI M,et al. The advancing identification and classification of Rhizoctonia spp. using molecular and biotechnological methods compared with the classical anastomosis grouping[J].Mycoscience,2006,47(6):299-316.
[23] CARLING D E,KUNINAGA S,BRAINARD K A. Hyphal anastomosis reactions, rDNA-internal transcribed spacer sequences, and virulence levels among subsets of Rhizoctonia solani anastomosis group-2 (AG-2) and AG-BI[J].Phytopathology,2002,92(1):43-50.
[24] HYAKUMACHI M,MUSHIKA T,OGISO Y,et al. Characterization of a new cultural type (LP) of Rhizoctonia solani AG2-2 isolated from warm-season turfgrasses, and its genetic differentiation from other cultural types[J].Plant pathology,1998,47(1):1-9.
[25] GONZ?LEZ D,CARLING D E,KUNINAGA S,et al. Ribosomal DNA systematics of Ceratobasidium and Thanatephorus with Rhizoctonia anamorphs[J].Mycologia,2001,93(6):1138-1150.
[26] KANEMATSU S,NATIO S. Genetic characterization of Rhizoctonia solani AG-2-3 by analyzing restriction fragment length polymorphisms of nuclear ribosomal DNA internal transcribed spacers[J].Japanese journal of phytopathology,1995,61(1):18-21.
[27] SCHNEIDER J H M,SCHILDER M T,DIJST G. Characterization of Rhizoctonia solani AG 2 isolates causing bare patch in field grown tulips in the Netherlands[J].European journal of plant pathology,1997,103(3): 265-279.
[28] HYAKUMACHI M,PRIYATMOJO A,KUBOTA M,et al. New anastomosis groups, AG-T and AG-U, of binucleate Rhizoctonia spp. causing root and stem rot of cut-flower and miniature roses[J].Phytopathology, 2005,95(7):784-792.
收稿日期:2023-06-19
基金项目:广西中医药适宜技术开发与推广项目(GZSY21-03);广西卫生健康委员会重点实验室建设项目(ZJC2020003);中医药多学科交叉创新团队项目(GZKJ2305)
作者简介:宋利沙(1987-),女,河南淇县人,副研究员,博士,主要从事药用植物病虫害防治工作,(电话)18587575152(电子信箱)lishasong@126.com;通信作者,蒋 妮,(电子信箱)jiangni292@126.com。
宋利沙,蒋 妮,张占江,等. 山豆根菌核病病原菌鉴定及室内药剂筛选[J]. 湖北农业科学,2024,63(9):89-94,101.
