臭椿canthin-6-one对禾谷镰刀菌的抑菌作用
2024-10-09赵美荣李永春李春颖

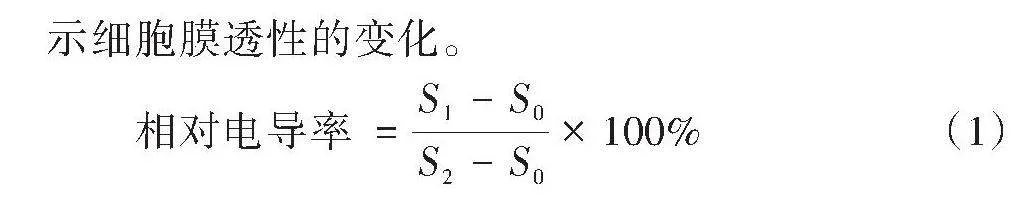


摘要:为进一步研究臭椿(Ailanthus altissima)canthin-6-one生物碱对禾谷镰刀菌(Fusarium graminearum)的抑菌效果及其作用机制,采用微量稀释法、菌丝生长抑制法测定其抑菌活性,并通过测定胞外相对电导率、内容物释放量、丙二醛含量、过氧化氢含量以及保护酶活性,从细胞膜角度分析其抑菌作用机制。结果显示,canthin-6-one对禾谷镰刀菌具有显著的抑菌作用,其最小抑菌浓度(MIC)为8.0 μg/mL,半数有效浓度(EC50)为1.85 μg/mL。处理后的菌体胞外相对电导率和内容物释放量显著增加,同时菌体丙二醛和过氧化氢含量亦有显著升高。这表明canthin-6-one引起了禾谷镰刀菌细胞膜氧化损伤,导致膜完整性丧失及透性增强,从而抑制菌丝生长。
关键词:臭椿(Ailanthus altissima); 禾谷镰刀菌(Fusarium graminearum); 生物碱; 抑菌作用; 细胞膜
中图分类号:S482.2 文献标识码:A
文章编号:0439-8114(2024)09-0084-05
DOI:10.14088/j.cnki.issn0439-8114.2024.09.015 开放科学(资源服务)标识码(OSID):
Antifungal effec4804a2e9f911061f7c10de1021136242t of canthin-6-one from Ailanthus altissima on Fusarium graminearum
ZHAO Mei-rong, LI Yong-chun, LI Chun-ying
(College of Chemistry and Life Science, Chifeng University, Chifeng 024000, Inner Mongolia, China)
Abstract: To further study the fungicidal effect and mechanism of canthin-6-one alkaloid from Ailanthus altissima on Fusarium graminearum, the inhibitory activity was determined by microdilution and mycelial growth inhibition methods. The antifungal mechanism of canthin-6-one was analyzed from the point of view of cell membrane by detecting the extracellular relative conductivity, content release, malondialdehyde content, hydrogen peroxide content and protective enzyme activity. The results showed that canthin-6-one had a significant inhibitory effect on Fusarium graminearum, with a minimum inhibitory concentration of 8.0 μg/mL and a half-effective concentration of 1.85 μg/mL. The extracellular relative conductivity and the content release amount of the treated mycelia were significantly increased, while malondialdehyde and hydrogen peroxide contents were also significantly elevated. It was indicated that canthin-6-one induced oxidative damage to the cell membrane of Fusarium graminearum, resulting in the loss of membrane integrity and increased permeability, thus inhibiting mycelial growth.
Key words: Ailanthus altissima; Fusarium graminearum; alkaloid; antifungal effect; cell membrane
禾谷镰刀菌(Fusarium graminearum)是主要侵染玉米、小麦、大麦等禾本科作物的病原真菌,能对作物产量和品质造成严重影响,危害粮食安全[1,2]。禾谷镰刀菌引起病害的主要防治手段是施用化学农药,然而由于化学农药的残留、降解周期以及真菌耐药性等问题,给生态环境和生态安全带来不利影响。因此,天然植物源抑菌剂成为解决此类问题的有效途径[3]。臭椿(Ailanthus altissima)作为一种重要的资源植物,其提取物能够抑制多种植物病原真菌,具有开发植物源抑菌剂的潜力[4,5]。canthin-6-one是从臭椿中提取的生物碱化合物,具有抗菌、抗病毒、抗肿瘤等作用,其抑菌性能倍受关注[6,7]。当前,国内外对臭椿canthin-6-one的研究主要集中于医学领域,对其抑制植物病原真菌作用及机制的研究报道较为鲜见[8-10]。李永春等[11]的研究表明从臭椿茎皮中分离出的canthin-6-one能够对禾谷镰刀菌、黄瓜枯萎病菌、冬瓜枯萎病菌等表现出较强的抑制作用,尤其对禾谷镰刀菌的抑制效果在几种供试真菌中最强。为深入研究canthin-6-one的抑菌作用及其开发价值,本研究以禾谷镰刀菌为供试菌,分析并评价臭椿canthin-6-one抑菌活性,并从细胞膜透性、保护酶活性变化等角度分析其抑制病原菌生长的生理生化机制,为canthin-6-one在植物真菌病害防治中的应用提供理论参考。
1 材料与方法
1.1 材料
1.1.1 试验材料 禾谷镰刀菌由赤峰学院化学与生命科学学院微生物学实验室提供。
1.1.2 试验试剂 canthin-6-one(实验室自制,含量大于98%),PDA培养基、PDB培养基(均购于青岛海博生物技术有限公司),其余试剂均为分析纯。
canthin-6-one抑菌剂的配制:将25 mg的canthin-6-one以1%的DMSO溶液结合超声波溶解定容于25 mL的容量瓶中,4 ℃冷藏,备用。
1.2 方法
1.2.1 孢子悬浮液的制备 参考毕亚琪等[12]的方法。在培养6 d(25 ℃,PDA培养基)的禾谷镰刀菌菌落边缘打取菌饼(直径为6 mm),接种于羧甲基纤维素(CMC)培养基中,于25 ℃、220 r/min条件下振荡培养10 d,得孢子悬浮液,孢子浓度为106个/ mL。
1.2.2 最小抑菌浓度(MIC)的测定 采用微量稀释法[13]测定MIC。配制含有不同浓度canthin-6-one抑菌剂(0.125~64.000 μg/mL,共10个梯度)的带药PDB培养基,各吸取100 μL加入至96孔板中,以不含抑菌剂的PDB培养基为对照。吸取孢子悬浮液10 μL接种于各PDB培养基中,置于25 ℃条件下培养。观察,待对照PDB中有菌丝生长时,将完全无菌丝生长的最低抑菌剂浓度确定为最小抑菌浓度。
1.2.3 canthin-6-one抑菌效果测定 采用生长速率法[11]测定canthin-6-one的抑菌效果。配制含有系列浓度(0.25、0.5、1.0、2.0、4.0、8.0 μg/mL)canthin-6-one的带药PDA培养基,倒入90 mm培养皿,以无药剂PDA为对照。按“1.2.1”的方法挑取菌饼接种于上述PDA培养基,每个浓度梯度重复3次,于25 ℃培养72 h,测定菌落直径(十字交叉法)。菌丝生长抑制率计算方法参照李永春等[11]的方法。将抑制率换算成几率值(Y)、药剂浓度(μg/mL)换算成对数值(X),求出毒力回归方程和相关系数,计算canthin-6-one对病菌的半数有效浓度(EC50)。
1.2.4 供试菌细胞外电导率测定 参考李永春[14]的方法测定电导率。将在PDB培养基中培养48 h(25 ℃、150 r/min)的菌丝过滤、冲洗、沥干,称取0.3 g菌丝置于锥形瓶中,然后加入canthin-6-one溶液30 mL进行处理,2个处理canthin-6-one的浓度分别为1/2 MIC、MIC,以不含canthin-6-one的无菌水处理为对照(CK),25 ℃振荡培养,每个处理重复3次。取0、2、4、8、12、24 h的上清液,测定其电导率(S1),以未加菌丝的溶液为空白对照(S0),最终样品经沸水浴10 min后测定终电导率(S2),用相对电导率表示细胞膜透性的变化。
[相对电导率=S1-S0S2-S0×100%] (1)
1.2.5 供试菌细胞内容物外渗测定 参考Zhou等[15]的细胞内容物测定方法并稍作修改。菌丝培养及处理按照“1.2.4”的方法,分别在0、2、4、8、12、24 h取100 μL培养液,于12 000 r/min离心5 min,取上清液,以未加菌丝的溶液作空白对照,在260 nm处测定吸光度,计算内容物释放量。
1.2.6 供试菌丙二醛、过氧化氢含量及相关酶活性测定 菌丝培养及处理按照“1.2.4”的方法,分别在菌丝处理0、3、6、12、24 h取供试菌丝0.5 g,液氮研磨至粉末状。分别按照相应的测试试剂盒(南京建成生物工程研究所)说明书测定过氧化氢(H2O2)、丙二醛(MDA)含量和超氧化物歧化酶(SOD)、过氧化物酶(POD)活性。
1.2.7 数据处理与分析 利用Excel 2019软件和DPS 15.10软件进行数据处理,采用Duncan’s新复极差法和one-way ANOVA进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 canthin-6-one对禾谷镰刀菌的最小抑菌浓度
采用微量稀释法对禾谷镰刀菌进行培养,当培养至48 h时,对照PDB培养基中已有明显菌丝生长,在含有0.125~64.000 μg/mL系列浓度canthin-6-one的PDB培养基中,无菌丝生长的最低浓度为8.0 μg/mL,因此,canthin-6-one对禾谷镰刀菌的MIC为8.0 μg/mL。
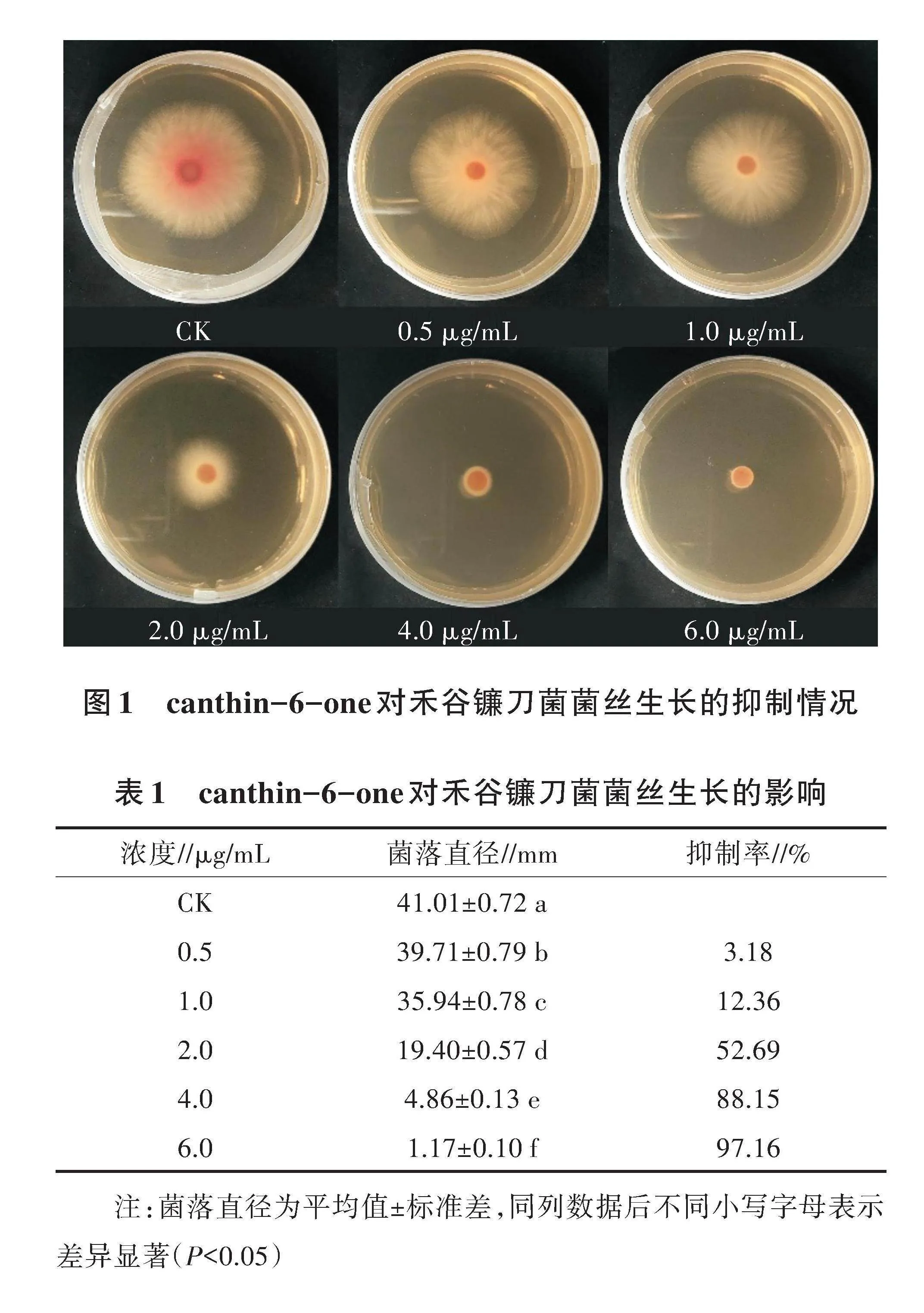
2.2 canthin-6-one对禾谷镰刀菌菌丝生长的影响
菌丝生长抑制法测定结果(图1)显示,canthin-6-one对禾谷镰刀菌菌丝生长抑制作用与其浓度呈正相关,随着浓度的增加,canthin-6-one的抑菌效果越明显。当canthin-6-one浓度为6.0 μg/mL时,对菌丝生长的抑制率达97.16%(表1),得毒力回归方程:Y=1.550 9X+4.042 7,R2=0.992 2,计算得EC50为1.85 μg/mL。
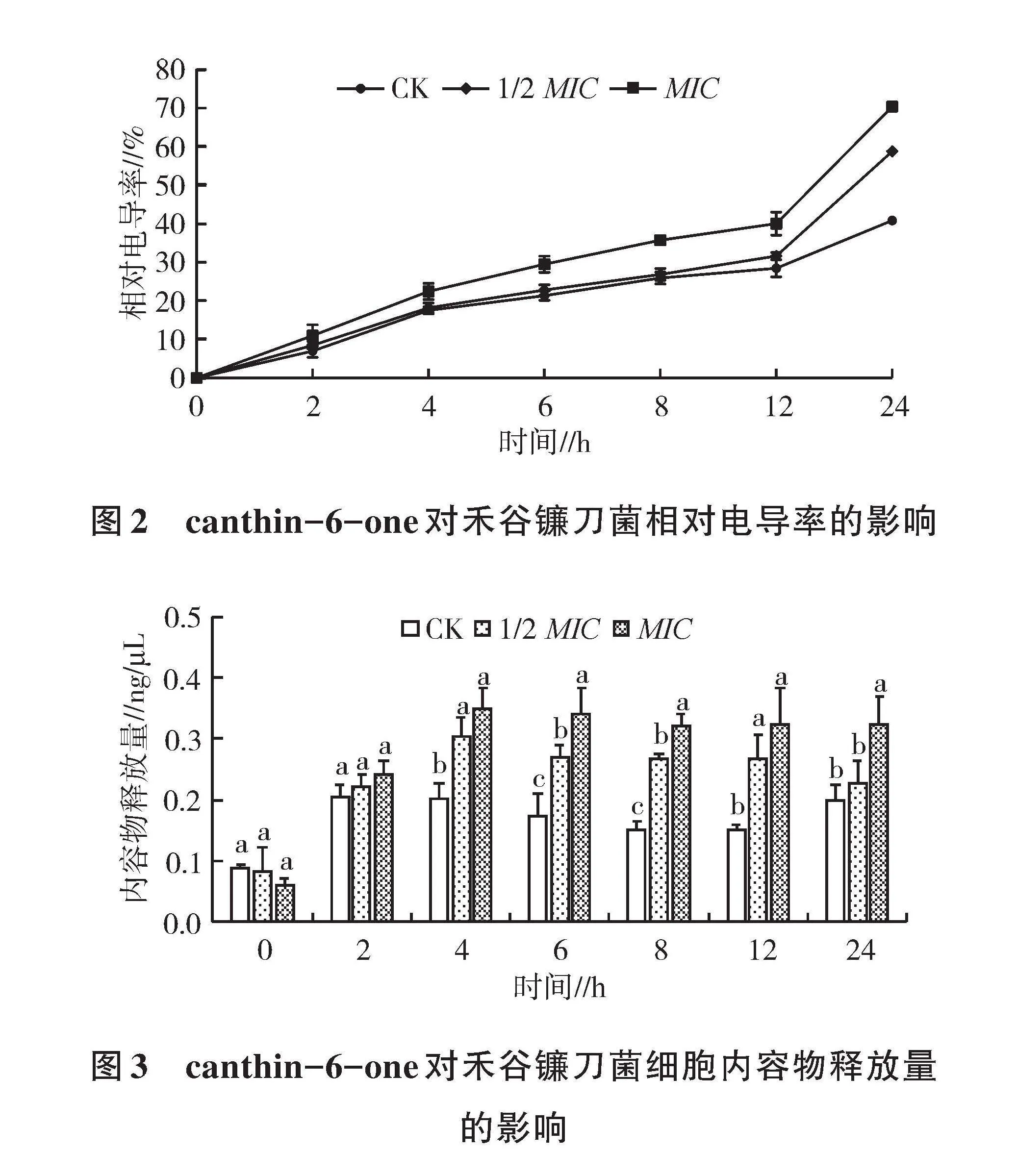
2.3 canthin-6-one对禾谷镰刀菌胞外电导率的影响
细胞外相对电导率测定结果如图2所示,与对照相比,经canthin-6-one处理后,禾谷镰刀菌菌丝膜外电导率增加,12 h内,处理时间越长,电导率增加幅度越大,在12 h时,1/2 MIC和MIC的相对电导率分别达31.61%±1.52%和40.01%±0.73%,与对照(28.45%±1.52%)差异极显著(P<0.01)。24 h时,MIC和1/2 MIC与对照相比,相对电导率分别提高了29.55、17.95个百分点。这一结果说明,canthin-6-one处理使禾谷镰刀菌组织内电解质外渗量增加,可能是菌丝细胞膜的完整性被破坏,增加了细胞膜的透性。
2.4 canthin-6-one对禾谷镰刀菌细胞内容物外渗的影响
通过测量260 nm处的吸光值来检测细胞内容物的释放量,结果如图3所示,在0~6 h,内容物释放量随着处理时间的延长而增加,4 h之前,处理与对照差异不显著,4 h后,处理菌丝内容物的外渗显著增加,在6 h时,1/2 MIC和MIC的内容物释放量分别为(0.27±0.01) ng/μL和(0.34±0.04) ng/μL,分别比对照[(0.18±0.03) ng/μL]提高了54.86%和94.48%,且差异显著(P<0.05)。这一结果说明canthin-6-one能破坏菌体细胞膜的完整性,细胞膜透性增加。
2.5 canthin-6-one对丙二醛和过氧化氢含量的影响
细胞膜氧化损伤程度可通过MDA含量高低来反映,H2O2浓度变化则又可以影响细胞膜脂质过氧化过程[16,17]。由图4可知,0~3 h,canthin-6-one处理使MDA含量没有明显变化,6 h时,1/2 MIC、MIC浓度的canthin-6-one处理使菌丝MDA含量分别比对照增加了37.80%和67.07%,且差异显著(P<0.05)。菌丝H2O2含量变化与MDA含量变化表现出相类似的趋势(图5),短时间处理,H2O2含量变化不明显,在6 h时,处理H2O2含量与对照相比,明显增加,差异显著,在12 h和24 h时,两个处理之间差别不大,但都显著高于对照。以上结果表明,canthin-6-one处理可能使禾谷镰刀菌细胞膜受到了氧化损伤,发生脂质过氧化。
2.6 canthin-6-one对保护性酶活性的影响
真菌受到氧化损伤时,一些保护性酶如过氧化物酶(POD)、超氧化物歧化酶(SOD)等通常产生应激变化[18]。本试验对菌丝POD、SOD活性进行了分析,结果见图6、图7。由图6可见,POD活性随着canthin-6-one的处理先升高后降低,12 h内,处理后菌体POD活性升高,经1/2 MIC和MIC浓度的canthin-6-one处理3 h时,POD活性较对照分别增加了19.00%和38.49%,24 h时,处理POD活性降低,低于对照。SOD活性的变化如图7所示,经1/2 MIC和MIC浓度的canthin-6-one处理6 h时,菌丝SOD活性高于对照,且差异显著,24 h时,处理SOD活性降低。
3 讨论与小结
臭椿生物碱的抑菌活性使其具有开发成植物源抑菌剂的潜力。本研究抑菌活性表明,从臭椿中分离的生物碱canthin-6-one对禾谷镰刀菌具有较强的抑制作用,且抑制效果与抑菌剂浓度呈正相关,当浓度为6.0 μg/mL时,canthin-6-one对菌丝生长的抑制率达97.16%,EC50为1.85 μg/mL。
细胞膜作为真菌的基本结构,具有维持真菌正常形态、调节体内环境平衡等作用,常作为抗真菌药物的作用靶点[19]。许多研究表明生物碱可通过破坏细胞膜结构抑制菌丝生长。Luo等[20]研究发现木兰花碱破坏红色毛癣菌(Trichophyton rubrum)细胞膜,引起核酸泄露。Zhao等[21]研究发现血根碱破坏细胞膜的结构,从而抑制稻瘟病菌(Magnaporthe oryzae)的生长。细胞膜是否受到损伤的主要标志之一是MDA含量的变化,其含量大小可反映膜损伤的程度[17]。生物体内的一些氧化代谢的产物,如过氧化氢、超氧自由基等活性氧通常会引起膜脂、蛋白质、DNA及其他细胞成分的氧化损伤,活性氧浓度变化可反映出对膜脂质氧化的影响[22]。本研究测定了canthin-6-one处理后供试菌的胞外相对电导率、内容物外渗以及菌体MDA和H2O2含量变化,结果表明,canthin-6-one使菌体细胞膜的透性增加,造成内容物泄漏。MDA含量在canthin-6-one处理后显著增加,且与药液浓度呈正相关,说明canthin-6-one可能引起禾谷镰刀菌的细胞膜氧化损伤,从而造成膜透性增加。H2O2含量与MDA含量变化趋势一致,表明canthin-6-one增加了活性氧含量,进而引起细胞膜氧化损伤。
真菌受到损伤后,通常会激活相关保护性酶来防御。魏立强等[23]的研究发现,旱芹粗提物能够引起棉花枯萎病菌(Fusarium oxysporum f. sp. vasinfectum)MDA含量增加,破坏膜系统完整性,SOD、POD等保护性酶被激活,其活性先升后降。王欣等[24]发现川芎石油醚萃取物能干扰和破坏蓝莓叶斑病菌(Pestalotiopsis clavispora)菌丝体内的防御酶系统。本研究结果与之相似,供试真菌经canthin-6-one处理后,细胞膜受到氧化损伤,菌体的SOD、POD等保护酶被激活,其活性在初期增加,处理后期真菌受损伤程度加剧,酶的活性下降。
综上所述,臭椿canthin-6-one生物碱对禾谷镰刀菌产生较强的抑制作用,其作用机制初步研究表明,canthin-6-one通过诱导禾谷镰刀菌产生活性氧,扰乱菌体内防御酶系统原有的动态平衡,进而损伤细胞膜,破坏其完整性,菌丝生长因而受到抑制。本研究主要从细胞膜角度对canthin-6-one抑制禾谷镰刀菌作用进行了初步分析,然而,抑菌机制往往是一系列生化反应综合作用的结果,因此,还需要从多个角度进一步探索canthin-6-one的抑菌机制。
参考文献:
[1] JIMENEZ-QUIROS C,OKECHUKWU E C,HONG Y G,et al. Comparison of antifungal activity of Bacillus strains against Fusarium graminearum in vitro and in planta[J].Plants,2022,11(15):1999.
[2] ZHANG W J,GAO F K,CHENG C H,et al. Evaluation of sulfonated oxidized chitosan antifungal activity against Fusarium graminearum[J].Journal of biomaterials science, polymer edition,2022,33(12):1495-1510.
[3] NGUVO K J,GAO X Q. Weapons hidden underneath: Bio-control agents and their potentials to activate plant induced systemic resistance in controlling crop Fusarium diseases[J].Journal of plant diseases and protection,2019,126(3):177-190.
[4] 潘 漫,盛园园,程傲星,等.8种中药提取物对植物病原真菌的抑制活性[J].资源开发与市场, 2011,27(5):394-396.
[5] 周江鸿,夏 菲,车少臣.16种园林植物粗提物对黄栌枯萎病菌的抑制作用[J].园林科技,2015(4):30-34.
[6] 胡苗芬,宋新波,张丽娟.臭椿吲哚生物碱成分及其生物活性研究进展[J].药物评价研究,2012, 35(6):469-472.
[7] 邵 青,权 伟,高 凯,等.臭椿生物碱canthin-6-one对小鼠镇静催眠作用的研究[J].现代生物医学进展,2020,20(1):46-49,67.
[8] THOUVENEL C,GANTIER J C,DURET P,et al. Antifungal compounds from Zanthoxylum chiloperone var. angustifolium[J].Phytotherapy research,2003,17(6):678-680.
[9] GAZONI V F,BALOGUN S O,ARUNACHALAM K,et al. Assessment of toxicity and differential antimicrobial activity of methanol extract of rhizome of Simaba ferruginea A. St.-Hil. and its isolate canthin-6-one[J].Journal of ethnopharmacology,2018,223(15):122-134.
[10] LI Y C,ZHAO M R,ZHANG Z. Quantitative proteomics reveals the antifungal effect of canthin-6-one isolated from Ailanthus altissima against Fusarium oxysporum f. sp. cucumerinum in vitro[J]. PLoS one,2021,16(4):e0250712.
[11] 李永春,赵美荣,张 智.臭椿生物碱对5种植物病原真菌的抑制作用[J].福建农业学报,2021, 36(1):53-58.
[12] 毕亚琪,王禹贺,罗泗川,等. MB和CMC液体培养基对禾谷镰孢产孢水平的影响[J].植物保护, 2020,46(6):155-158.
[13] LIU X M,OUYANG C B,WANG Q X,et al. Evaluation of antibacterial and antifungal properties of 9-oxo-10,11-dehydroageraphorone extracted from Eupatorium adenophorum[J].Journal of plant diseases and protection,2016,123:93-99.
[14] 李永春.臭椿canthin-6-one的提取分离及对尖孢镰刀菌抑菌机制研究[D].哈尔滨:东北林业大学,2021.
[15] ZHOU H E,TAO N G,JIA L. Antifungal activity of citral, octanal and α-terpineol against Geotrichum citri-aurantii[J].Food control,2014,37:277-283.
[16] BALLESTER A R,LAFUENTE M T,GONZáLEZ-CANDELAS L. Spatial study of antioxidant enzymes, peroxidase and phenylalanine ammonia-lyase in the citrus fruit-Penicillium digitatum interaction[J].Postharvest biology & technology,2006,39(2):115-124.
[17] CHOWHAN N,SINGH H P,BATISH D R,et al. β-Pinene inhibited germination and early growth involves membrane peroxidation[J].Protoplasma,2013,250(3):691-700.
[18] 区敏仪,李海涛,杨蓉娅.真菌抗氧化酶的研究进展[J].国际皮肤性病学杂志,2017,43(1):50-53.
[19] 刘晓环,张朝晖.抗真菌药物作用靶点机理及新药研发进展[J].药物分析杂志,2015,35(2):193-202.
[20] LUO N X,JIN L,YANG C Q,et al. Antifungal activity and potential mechanism of magnoflorine against Trichophyton rubrum[J].The journal of antibiotics,2020,74(3):206-214.
[21] ZHAO Z M,SHANG X F,LAWOE R K,et al. Anti-phytopathogenic activity and the possible mechanisms of action of isoquinoline alkaloid sanguinarine[J].Pesticide biochemistry and physiology,2019,159:51-58.
[22] MARTINEZ-FINLEY E J,GAVIN C E,ASCHNER M,et al. Manganese neurotoxicity and the role of reactive oxygen species[J].Free radical biology and medicine,2013,62:65-75.
[23] 魏立强,谢慧琴,杨德松,等.旱芹粗提物对棉花枯萎病菌丙二醛含量、电导率及保护酶活性的影响[J].植物保护,2012,38(3):28-31.
[24] 王 欣,沈亚伦,李云鹏,等.川芎萃取物对蓝莓叶斑病菌的抑制作用[J].中国植保导刊,2022, 42(6):5-9.
收稿日期:2023-04-20
基金项目:内蒙古自治区高等学校科学研究项目(NJZY21137;NJZZ22150);赤峰学院一流学科建设项目(CFXYYLXKB202102);蒙东地区生物资源开发利用创新团队项目(FXYKYCXTD202008)
作者简介:赵美荣(1981-),女,山东嘉祥人,副教授,博士,主要从事植物次生代谢物质开发利用研究,(电话)15047639680(电子信箱)
738532543@qq.com。
赵美荣,李永春,李春颖. 臭椿canthin-6-one对禾谷镰刀菌的抑菌作用[J]. 湖北农业科学,2024,63(9):84-88.
