化学学科理解导向的教学实践探索
2024-10-08刘臣黄满霞郭玉林








摘 要:以高中化学选择性必修2《物质结构与性质》中“微粒间的相互作用与物质性质”主题为例,从“理解什么”“如何理解”和“理解结果”三个维度,深刻认识微粒之间存在不同类型的相互作用及物质性质与微粒结构之间的关系;结合实例重点探讨了共价键的形成过程、共价键中原子的电负性对物质性质的影响等,开展教学实践,并给出了教学建议。
关键词:高中化学; 学科理解; 微粒间相互作用; 分子结构; 共价键
文章编号:1005-6629(2024)09-0055-07
中图分类号:G633.8
文献标识码:B
1 问题的提出
《普通高中化学课程标准(2017年版)》(以下简称“化学新课标”)在课程实施建议中首次提出了“化学学科理解”的概念,并对其基本内涵进行了阐释。化学学科理解是指教师对化学学科知识及其思维方式和方法的一种本源性、结构化的认识,它不仅仅只是对化学知识的理解,还包括对具有化学学科特质的思维方式和方法的理解[1]。对化学学科知识的本源性认识,可以理解为对学科知识的形成、内涵、功能和局限性等多方面的认识;对化学学科知识的结构化认识,可以理解为对学科知识之间相互关系的认识;对化学学科思维方式和方法的结构化认识,可以理解为具有学科特质的化学认识视角和化学认识思路的形成。化学新课标将“学科理解”作为破解“由知识教学向素养发展教学转变”这一难题的突破口,通过学科理解凝练化学知识的素养功能,以发展学生的化学学科核心素养[2]。
课堂教学的构建,依赖于教师对学科知识本质的把握,以及依此形成的对学生知识理解、思维发展和能力培养的期待及系统考虑[3]。“微粒间的相互作用与物质性质”是化学学科的核心内容,对认识物质构成的规律及化学变化的微观实质具有不可替代的作用。与此同时,不同类型微粒间相互作用及其相关概念具有高度的概括性和抽象性等特点,教师和学生在教材各阶段的教学和学习中均存有一定的困难。必修课程中曾用电子式表示NaCl、HCl等化学键的形成过程,使学生初步认识最外层电子在成键过程中的关键作用;在选择性必修课程中,通过实验事实和相关数据等关键证据,引导学生从原子轨道重叠、电子间相互作用等视角理解化学键的本质和特征,将成为教学中的重点和难点。以共价键为例,由此引发的知识关联与融合,化学反应中共价键的类型与反应热效应的关系、电负性对物质性质及化学反应的影响等,都要求教师具有较高层次的化学学科理解能力。据此,笔者从教学实践的视角对相关问题展开研究,旨在提升教师对“微粒间的相互作用与物质性质”的认识水平,并通过教学改变学生的学习方式,帮助学生逐步建立结构与性质之间的联系,发展学生的化学学科核心素养。
2 关于学科理解的层级及内涵
从教学设计来看,化学学科理解的贡献在于为教学内容分析提供“学科视角”,基于学科视角进行学科功能分析[4]。围绕“微粒间的相互作用与物质性质”展开教学内容的分析,从学科理解视角,主要剖析知识结构中所蕴含的本源性问题(理解什么)、认识视角与认识思路(如何理解)、知识结构化和知识应用(理解结果)三个层级,如图1所示。
2.1 加强对知识本源性的认识
微粒之间存在不同类型的相互作用,包括原子间相互作用和分子间相互作用,高中阶段学生主要认识化学键和分子间作用力。其学科本源性问题,即微粒间相互作用的方式是怎样的、其形成过程又如何?原子间的相互作用,可分为离子键、共价键和金属键,配位键在形成后其键能、键长等键参数与共价键无异,仍隶属于共价键范畴。分子间的相互作用,其本源性问题聚焦在“分子是通过何种方式聚集成各种物质的”,其中包含范德华力、氢键、π-π堆积和疏水作用等。
2.2 明晰认识视角与认识思路
认识视角是对物质变化规律及其特征的认识切入点或维度。科学家们对原子结构的认识经历了漫长的过程,从无核原子结构模型(实心带电球原子模型)到有核原子结构模型(太阳系模型),再到玻尔模型(核外轨道量子化),进而研究并揭示“微粒间通过何种作用力结合到一起”。其认识视角可归纳为静电作用、电子得失和共用、原子轨道有效重叠使分子能量降低等,具体阐释如表1所示。
据此,对“微粒间的相互作用”的认识思路要将上述三个视角融合起来。首先,原子与原子间(或分子与分子间)普遍存在着静电作用:库仑力或静电力(分子间作用力称之为取向力、诱导力和色散力);其次,原子间通过电子的得失或共用,以达到自身相对稳定的结构,即形成了化学键;最后,理解化学键的本质是带有相同电荷的电子进行配对,即原子轨道的重叠,使体系能量降低。
2.3 逐步形成知识结构化
核心素养导向的化学教学,在教学内容的选取与组织上,要注重大概念的抽提[6]。大概念可分为跨学科大概念、学科大概念、单元大概念和重要概念等[7]。据此,将“微粒间的相互作用”抽提为学科大概念,则其本源性认识“微粒间的相互作用方式”——化学键和分子间作用力为单元大概念,重要概念是“离子键、共价键、金属键、范德华力和氢键”,继续发展的相关概念还有与之对应的晶体类型和结构特点(见图1)。
与此同时,学科理解的结果不仅关注学生对相关概念的辨识和记忆,更要关注学生能否根据微粒的种类及微粒之间的相互作用方式,认识物质的性质与微观结构的关系,主动建构相关概念之间的联系,并基于实验事实等证据,从微观视角对物质表现出的宏观性质或反应规律等进行合理解释。
3 教学实践
3.1 改变学习方式,增强学习体验
化学新课标倡导“素养为本”的教学,改变学生的学习方式。教学中“微粒间的相互作用”所涉及的“键”“静电作用”“轨道重叠”“分子构型”“微粒聚集”等相关概念较为抽象,由于“看不见、抓不住”,学生不易进行联想或类比,在学习中存有畏难情绪。在课堂教学中,教师采用“读→看→画→做”的教学方法,使学生对“微粒间的相互作用”的学习体验更加直接。如在共价键π键的教学中,学生先阅读教材有了初步感知,然后通过教师的模型展示进一步理解两个原子的p轨道如何进行“肩并肩”重叠,再到学生分组绘制重叠图像及用橡皮泥做出实物形状,逐步加深对成键方式的理解;又如认识晶体中微粒的空间排布存在周期性时,让学生动手搭建晶体模型,提升了学生对晶胞具有无隙并置特点的认识,如图2~图4所示。
3.2 建立知识关联,提升主题间的融合性
在探讨“微粒间相互作用”关于化学键的断裂与形成这一内容时,学生未能直观想象原子间的成键和断键过程,难以深刻理解不同原子间所形成的共价键的强度有所不同。故教学中宜采用“基于学科思想的知识关联和迁移”的教学策略,教师要“跳出结构看结构”,选取学生比较熟悉的宏观概念或事实作为证据,建立知识间的联系,应用“结构决定性质”及“性质反映结构”的学科思想,基于宏观证据解释微观实质,使学生融合已经学过的相关主题有逻辑地理解所学内容。
案例1 从能量变化的视角认识共价键的强度
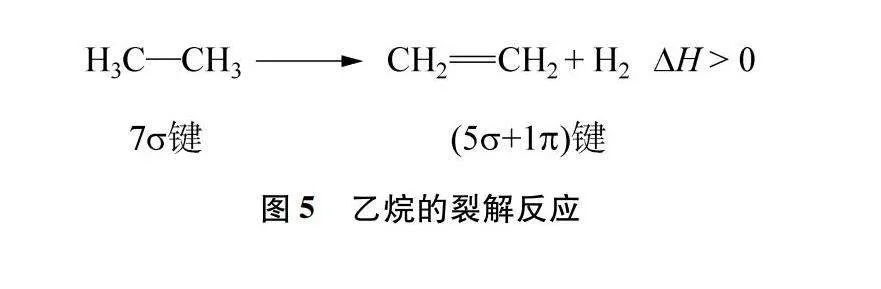
人教版教材中对σ键和π键的形成和类型描述为:σ键是由两个原子的p轨道“头碰头”重叠形成的,π键是由两个原子的p轨道“肩并肩”重叠形成的,π键和σ键的强度不同[8],并以乙烯、乙炔分子为例,说明π键不如σ键牢固,容易断裂。那么,如何让学生更深层次地理解π键和σ键的强度差异呢?
教师可从化学反应中能量变化的视角,引导学生认识两种共价键的不同牢固程度。如烷烃的裂解反应(图5),当反应中有σ键转变为π键时,通常表现为吸热反应。查阅相关共价键的键能数据[9]进行计算,反应的ΔH=+123.5kJ·mol-1,说明断裂σ键吸收的能量大于形成π键释放的能量,证明σ键比π键更加牢固。
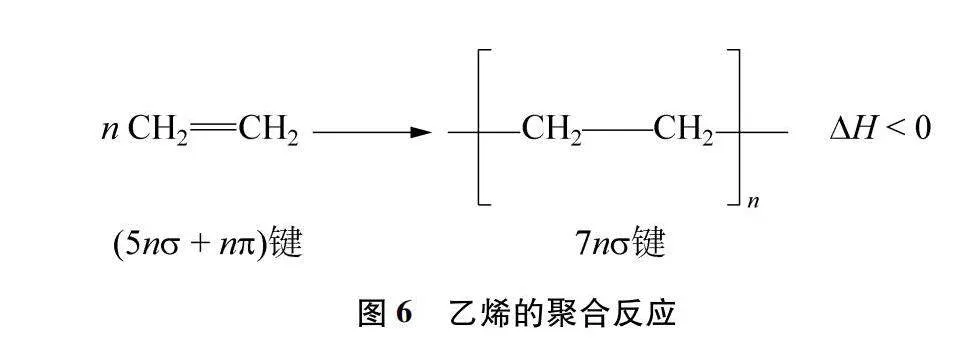
同理,当反应中有π键转变为σ键时,通常为放热反应,如烯烃的聚合反应(图6),说明断裂π键吸收的能量小于形成σ键释放的能量,同样证明σ键比π键更加牢固。
不难发现,当反应中没有发生σ键和π键的相互转变时,如酯化反应,一般反应热都很小。据此,通过引导学生关注化学反应中σ键转变为π键或π键转变为σ键时的能量变化,结合化学反应原理的相关知识,可以从微观视角认识化学反应的某些特点及变化规律。
案例2 从“成键三要素”的视角,认识氢卤酸的酸性强弱
现代价键理论的基本要点包含电子配对原理和最大重叠原理,分别体现了共价键的饱和性和方向性。从成键三要素的视角看,原子轨道“对称性匹配”是能否成键的首要因素,在数学计算中可用重叠积分进行度量。考虑学习的阶段性,高中阶段不做讨论。“轨道能量相近”和“最大重叠”原则可衡量成键的有效性。那么,在课堂教学中,如何结合具体实例,使学生更为深刻地理解以上两个因素呢?
例如,可通过比较第ⅦA族气态氢化物在水中的酸性依次增强(HF<HCl<HBr<HI),从成键三要素的视角引导学生展开讨论:由F到I,其原子外层p轨道能量依次增大,与H原子的1s轨道能量差值逐渐增大,轨道重叠程度逐渐降低,成键的有效性也逐渐降低,故氢卤酸的酸性逐渐增强。相较于从键长(或键能)的视角进行分析,从原子轨道重叠的视角分析更为本质,也使学生更加深刻地理解原子轨道能量与共价键形成的关系。
3.3 应用“结构决定性质”解释问题,全面提升问题解决能力
“元素的电负性”“化学键的极性”是本主题的重要核心概念,教学中可采用“基于核心概念进行思维建构”的教学策略,由特殊到一般、由静态到动态,基于核心概念间的因果关系对陌生物质的性质进行分析、解释或预测;开展综合应用相关核心概念进行分析推理等课堂教学活动,逐步深化学生的认识视角,全面提升学生解决实际问题的能力。
案例3 从物质性质的视角,认识“电负性”及其内涵
元素的电负性是指分子中的某一元素的原子吸引电子的能力,电负性的大小总是表示分子中的原子而非孤立原子。电负性是化学中非常重要的概念,在分子结构中由电负性差异引起的形式电荷及分子中的部分电荷等,将对化学反应产生一定的影响。中学阶段,可应用电负性相关知识判断元素的金属性和非金属性的相对强弱、预测键的极性和分子的极性、键角的大小、判断共价化合物中元素化合价的正负、一些含氧酸的酸性强弱、有机反应类型等等。现行四套教材(人教版、鲁科版、苏教版、沪科版)中与“电负性”及其应用相关的教学素材罗列于表2。
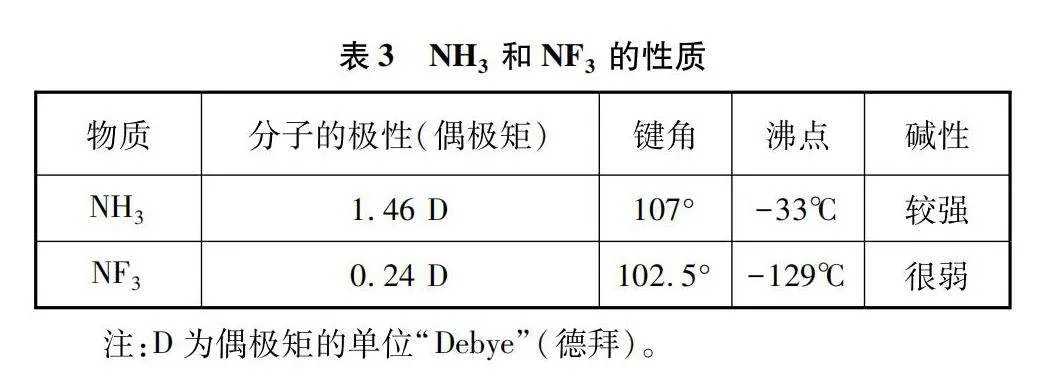
通过比较与分析不难看出,四套教材中涉及与电负性相关的教学素材在化学新课标学业要求的基础上均有一定程度的拓展与延伸,其中涉及分析解释与推论预测等应用层次的要求居多。在课堂教学中,教师可给出物质的相关性质,并设计系列问题串,引发学生的思考。如已知NH和NF的部分性质如表3所示,从微粒间的相互作用(分子结构)角度进行分析并解释原因。
应用“结构决定性质”这一基本观念,首先从分子结构入手展开分析:NH和NF分子的空间结构均为三角锥形,有一对孤电子对。由于元素电负性的大小为:F>N>H。故NH分子中,N原子带部分负电荷;NF分子中,N原子带部分正电荷(图7)。因此,NF中的孤电子对与中心原子结合更为紧密,电子不易给出,NF的碱性弱于NH。在NF中孤电子对对成键电子的斥力大,其键角小于NH。由于NF中键的极性与孤电子对的极性相反,故NF分子的极性小于NH。在NH中存在氢键,分子间作用力大,其沸点高于NF。
案例4 从“共价键的极性”看有机分子间的相互作用
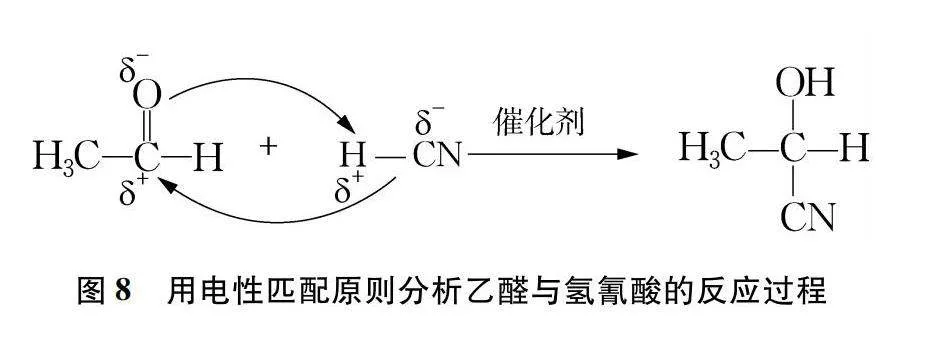
人教版化学选择性必修3《有机化学基础》指出:由于不同的成键原子间电负性的差异,共用电子对会发生偏移。偏移的程度越大,共价键极性越强,在反应中越容易发生断裂。因此,有机化合物的官能团及其邻近的化学键往往是发生化学反应的活性部位[10]。在新课程中,结构化学与有机化学的融合是大势所趋。在学习了结构化学的相关知识后,学生要能够应用结构化学的知识对有机物的性质和反应进行预测与剖析,发挥理论对实践的指导作用。例如,乙醛和HCN的加成反应,通过对反应物中羰基和HCN中化学键的极性进行分析,找到正电荷和负电荷的分布情况,通过“电性匹配原则”找到断键部位并预测产物,使静态的结构化学知识动起来,学以致用。分析过程如图8所示。
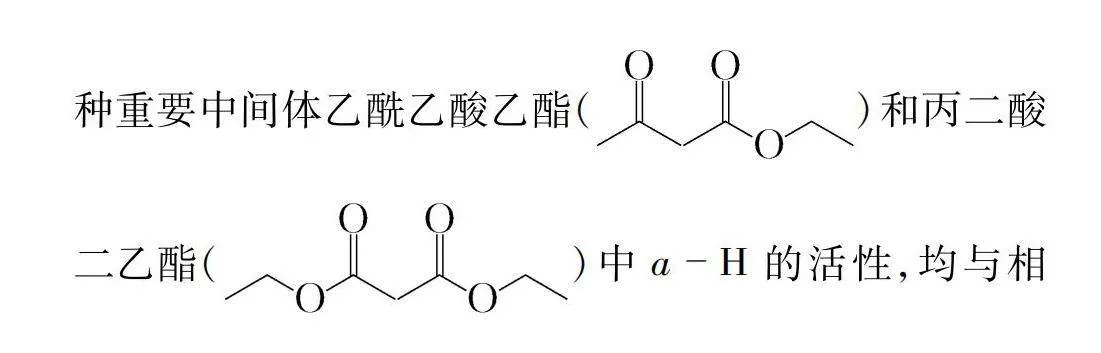
鲁科版教材化学选择性必修3从电荷分布的角度,对能与醛、酮中的羰基发生加成反应的试剂及加成产物进行了总结[11]。在有机反应中,由于成键元素电负性差异导致在一定条件下化学键的异裂,通过电性作用促使反应发生的实例比比皆是,如有机反应中两种重要中间体乙酰乙酸乙酯()和丙二酸二乙酯()中a-H的活性,均与相邻基团间的电子效应而使键的极性增强有关。现另举几例加以说明,如表4所示。
4 结束语
在新课标、新教材、新课程、新高考实施的“四新”背景下,对教师的业务能力及专业素养提出了更高的要求,教师对“学科主题内容及其教学价值的理解能力”是教师的核心教学能力之一[12]。诚然,在课堂教学中,教什么、什么知识值得去教,是每位教师需要永恒思考和讨论的话题。诸如“结构决定性质”是指何种结构,是原子结构、分子结构还是电子结构?“电离能和电负性两者有何区别”“微观是什么”等问题在新课程背景下引发了教师新的思考。中学教师的化学水平不能停留在中学阶段。立足课堂教学,增强学科理解,还需要广大一线教师勇于做出更多的探索与实践。
参考文献:
[1]中华人民共和国教育部制定.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020:76.
[2]张笑言,郑长龙.基于学科理解的化学教学策略研究[J].课程·教学·教法,2023,(12):124~130.
[3]何彩霞.化学学科核心素养导向的大概念单元教学探讨[J].化学教学,2019,(11):44~48.
[4][6]郑长龙.核心素养导向的化学教学设计[M].北京:人民教育出版社,2021:63~65.
[5]华彤文等编著.普通化学原理(第6版)[M].北京:北京大学出版社,2013:276~277.
[7]刘臣,何彩霞.基于化学学科大概念的单元整体教学设计[J].化学教学,2023,(11):34~38.
[8][9]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中教科书·物质结构与性质[M].北京:人民教育出版社,2020:5,34~38.
[10]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中教科书·有机化学基础[M].北京:人民教育出版社,2020:5,7.
[11]王磊,陈光巨主编.普通高中教科书·有机化学基础[M].济南:山东科学技术出版社,2019:12,75.
[12]王磊,魏艳玲,胡久华等.教学能力系统构成及水平层级模型研究[J].教师教育研究,2018,30(6):16~24.
