癌症早期筛查技术的研究进展
2024-09-30张甜张友航李明程菲史玮玮



文章编号10005269(2024)05000908 DOI:10.15958/j.cnki.gdxbzrb.2024.05.02
摘要:癌症是全球最常见死亡原因之一,已成为当前全球共同面对的持续性公共卫生挑战。癌症患者的治疗难度大、死亡率较高,最主要的原因就是大多数患者在确诊时已经处于中晚期。癌症早期患者的5年生存率要远远高于中晚期患者。因此,实现癌症的早筛查、早发现、早诊断、早治疗是提高患者治疗率和生存率的重要手段。本文介绍了癌症早期筛查技术的现状,主要分为有创检测和无创检测两大类,包括组织学活检、影像学检查、标记物检测、呼出气体检测以及新兴的液体活检等,旨在提高早期癌症诊断和治疗的成功率,探索可行有效的早期筛查策略,降低癌症的死亡率。
关键词:癌症;早期筛查;有创检测;无创检测 中图分类号:O657.1;Q7 文献标志码:A
癌症是全球死亡的最常见原因,癌症相关问题是一个全球性的公共卫生问题。2020年,全球新增癌症患者约1930万,死亡人数预计到达1000万人[1]。而我国新增癌症患者达457万人,占全球新增人数的237%,中国已经成为名副其实的“癌症大国”。常见的癌症中肺癌、结直肠癌、乳腺癌的发病率、死亡率相对较高,且它们都有着不同的生物学特征。癌症的总死亡率很高,很大程度上是因为约75%的患者发现较晚,5年相对生存率仅为174%,这是因为一半以上的患者在被确诊时就已经处于癌症的中晚期,肿瘤细胞可能已经转移,此时的治疗成功率大大降低[2]。而癌症的存活率又因癌症分期而异,研究表明,非小细胞肺癌(nonsmallcelllungcarcinoma,NSCLC)Ⅰ期和Ⅱ期的5年生存率在53%至92%之间,而Ⅲ期和Ⅳ期的5年生存率为36%及以下[3]。因此,如果可以较早地完成筛查并发现癌症,就可以对侵袭性肿瘤进行更有效的治疗[4]。这不仅可以提高癌症患者的生活质量,减少患者的经济负担,还可以提高许多癌症患者的生存率。因此,癌症的早期筛查具有十分重要的意义。近年来,随着影像学检查、标记物检测、组织活检、液体活检及呼出气体检测等有创和无创技术的不断深入发展,国内外关于癌症早期筛查的研究取得了一定的进展(如图1)。本文就癌症早期筛查技术的现状进行综述,旨在探索可行有效的癌症早期筛查技术,减少癌症给全球带来的危害。
1有创检测
组织学活检又称为外科病理学检查,是一种有创伤的检测方式。它WfQ78Fxdtp0YnYLl0skTifoOgt13nYQK9hjd+Xxg6xk=是根据诊断的需要,从患者体内取出病变的组织,进行病理学检查的技术,主要包括经皮穿刺活检和支气管内镜成像技术两种。其中,将经皮穿刺活检技术和CT结合用于癌症的早期筛查,不仅准确率和安全系数高,而且有效的减少了患者治疗中的痛苦。尽管经皮穿刺活检在肺周围病变的诊断中比支气管镜检查表现更好,但是当该项技术应用于临床实践时,在确诊的90%的肺癌患者中有20%~30%为假阴性[5]。这是受到组织样本获取困难、灵敏度和准确性差、手术成本高的限制,而且由于肿瘤存在异质性,单个活检不能反应整个肿瘤的状况,因此,容易出现误诊的情况。
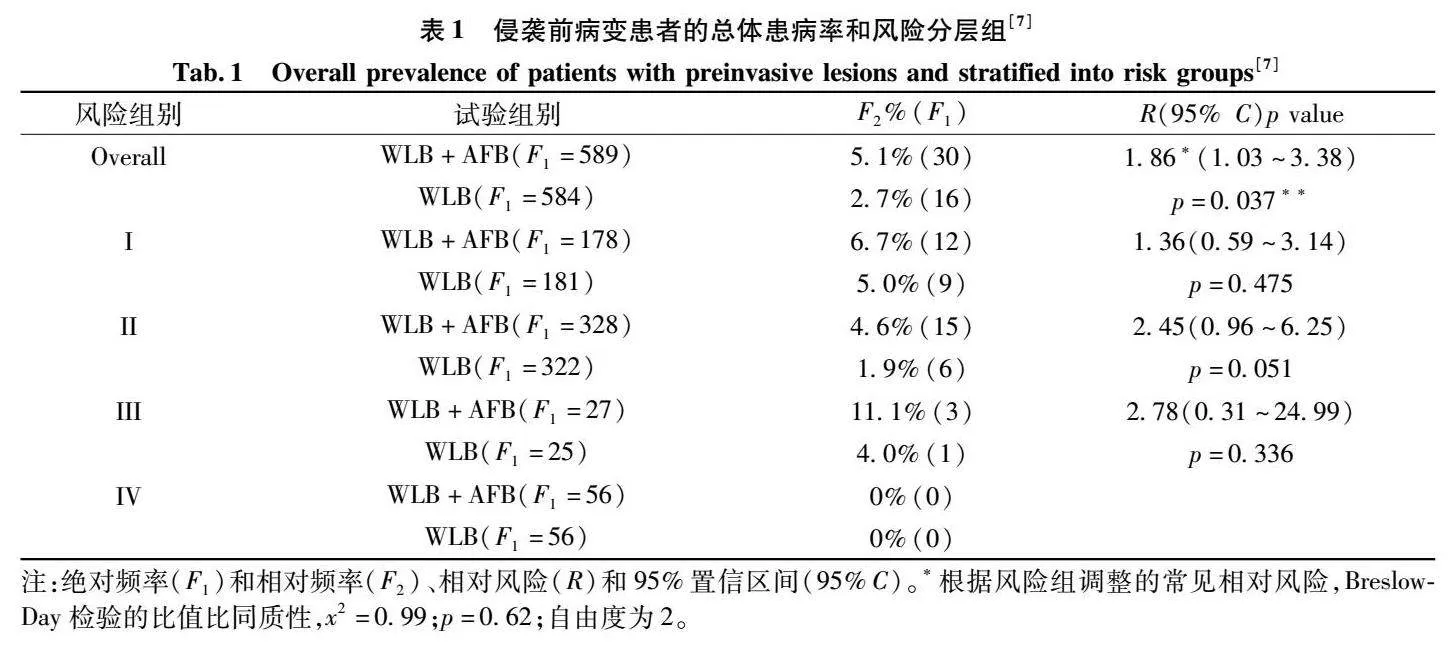
目前可用于临床实践的支气管镜成像技术,包括常规白光支气管镜(whitelightbronchoscopy,WLB)、自体荧光支气管镜(autofluorescencebronchoscopy,AFB)和窄带成像(narrowbandimaging,NBI)等。常规的WLB技术可以肉眼直接观察中央气道,主要用于一些中央型癌症的早期诊断,但检测灵敏度比较低。而AFB是利用了正常组织、癌变前的组织和肿瘤组合的生化代谢以及结构组成的不同,从而观察正常和异常的支气管黏膜之间的荧光表达的差异[6],为早期癌症的检测提供了重要的手段。在一项欧洲的前瞻性随机对照试验中,将吸烟者分为4个不同的风险组,分别采用AFB+WLB联合检测或WLB单独检测进行调查[7]。结果如表1所示,在对于IIIII型发育不良,WLB组的检出率为27%,而WLB+AFB组的检出率为51%,WLB+AFB联合检测的检出率提高了21倍。但该优势仅仅在风险组Ⅱ中表现明显,对不同人群的检出率差异明显,这使AFB在临床实践的应用受到限制。NBI是一种新兴的内窥镜下成像的诊断技术,可以显示血管形态和黏膜结构,能发现普通内镜下无法显示的病变。在一项中山人民医院的研究中,LIU等[8]选取200名来医院进行结直肠镜检测的患者进行早期筛查,对照组(100例)使用常规支气管镜,试验组使用NBI进行筛查。结果显示,试验组检出77个病变(770%),对照组检出28个病变(280%)。研究结果证明,相比于WLB和AFB,NBI进行癌症的筛查,能尽早发现肿瘤病变及早期癌,有效提高早期结直肠癌及癌前病变的诊断率,对结直肠癌及癌前病变的检测具有重要意义。
2无创检测
21影像学检查
211胸部X射线检查
胸部X射线检查(chestxray,CXR)可以生成肺、气道、心脏、血管、胸部以及脊柱骨骼的图像,此外还可显示肺部周围的液体和空气。X射线检查是最早的、比较经典的癌症早期筛查手段,早在1960年就被英国用于肺癌的相关研究中[9]。它的优点是能够粗略地观察胸部结构的整体情况,而且价格便宜、操作简单[1011]。1992年,云南锡业公司进行了一次为期8年的肺癌筛查研究,参与者为40岁或40岁以上且至少有10年的地下氡或砷暴露史的锡矿工,每年对他们进行一次肺癌的筛查[12]。结果表明,在9274名至少接受过一次CXR筛查的参与者中,确认了1345名癌症病例。尽管异常的CXR筛查也可能是肺部长期炎症所导致的,但是至少表明异常的CXR是癌症的前兆。由于胸部X射线检查容易出现重叠成像和成像差的情况,使得检查过程中发生病变的身体部位很容易被胸骨、肋骨或其他组织的影像遮挡,从而影响医生对病情的判断。相比于CXR正常的参与者,CXR出现异常的参与者患癌的风险显著提高。因此,不推荐将它单独作为筛查手段。由于CXR异常与患肺癌的风险具有一定的相关性,它可以作为潜在患病人群分层的工具,即癌症早期筛查的辅助手段。
212低剂量螺旋CT
电子计算机断层扫描(computedtomography,CT),是目前最为常用的肺癌早期筛查的影像学检查。相比于胸部X射线,CT具有图像清晰、分辨率高、可抗重叠干扰、能检测出部分隐蔽部位的病灶且能有效显示等优点,明显优于胸部X射线[1314]。但CT辐射会让筛查者承担更大的安全风险,这也是医生、监管机构、媒体十分关注的问题。因此,常规的CT并不推荐用于癌症的早期筛查。低剂量螺旋CT(lowdosecomputedtomography,LDCT)作为一种新的CT技术,仅需屏气20s就可获得整个胸部的图像,对病变部位扫描时间更短,是近几年被各个国家和地区推行的一种新的癌症早期筛查手段。JACOBS等[15]对一家社区医院中2014年6月至2015年12月期间接受LDCT检查的680例患者进行了调查研究,结果表明,患者LDCT扫描的辐射剂量约为标准CT胸部检查的1/5。1993年,在国家癌症中心研究小组的提议下,反肺癌癌症协会在一个癌症筛查项目中使用胸部X射线检查、痰液细胞学检查和LDCT进行为期三天的研究[16]。此外,国家肺部筛查试验报告表明,在高危吸烟者中使用LDCT扫描,与CXR筛查相比,肺癌死亡率降低了15%~20%。肺癌死亡率的这种降低相当于在65年的随访期间每千名接受筛查的人中减少3人死亡。在1993—1995年期间,KANEKO等[17]对1369名参与者(他们分别进行LDCT和CXR检查)的检查结果进行了比较,研究结果表明,LDCT在癌症早期筛查方面明显优于CXR。此外,KIM等[18]分析了2003年5月至2019年12月在韩国一家三级中心接受LDCT肺癌筛查的52615名成年人,结果352例(281例筛查出肺癌,71例未筛查出肺癌)被诊断为肺癌。结果表明,LDCT筛查检测显著降低了周围型肺癌的晚期诊断风险和死亡率,但对中心型肺癌的预后没有显著影响。而且LDCT在肺癌筛查中存在假阳性率过高的问题,给筛查者带来了较大的心理负担,同时大大地增加了肺癌筛查的成本。但尽管如此,在AHSAN等[19]对来自纽约州西部八个县的临床医生进行访谈时发现,约92%医生仍然推荐LDCT作为肺癌的早期筛查的重要手段,因为LDCT用于早期癌症筛查的准确率仍相对较高。综上所述,低剂量螺旋CT对癌症的早期筛查有重大的意义,但仍然需要进一步完善才能更好地应用于临床实践。
22标记物检测
肿瘤标志物是指那些特征性存在于恶性肿瘤细胞或由恶性肿瘤细胞异常产生的物质。当体内出现肿瘤时,这些物质就有上升的可能性,而这很有可能是癌症的发生引起的。不同类型的癌症对应的特异性肿瘤标志物也会有所不同,其中与肺癌相关度较高的血清肿瘤标志物主要有癌胚抗原(carcinoembryonicantigen,CEA)、糖类抗原125(carbohydrateantigen125,CA125)、细胞角蛋白19片段抗原211(Cytokeratin19fragmentantigen211,CYFRA211)、神经元特异性烯醇(neuronspecificenolase,NSE)等[20]。CEA是一种胚胎性致癌抗原,在血清中含量较低,在肺癌、乳腺癌等癌症患者中高度表达,多项研究指出CEA与肺癌、乳腺癌存在很大的相关性[2122]。ZHOU等[23]构建了一种基于电介导原子转移自由基聚合和聚乙烯亚胺双信号放大的电化学生物传感器(如图2),CEA适配体1(Apt1)通过“AuS”键自组装在电极上,以特定的识别方式捕获CEA,在优化条件下,线性检测范围为10-3~102ng/mL,检出限为7017fg/mL,实现了CEA的高灵敏度检测。血清中CEA等标志物的含量升高与肺癌的严重程度呈正相关。张宁等[24]选取36例肺癌患者和36例接受体检的健康者分别检测血清中CEA、CA125、CYFRA211、NSE4种标记物的水平,结果发现,当这4种肿瘤标志物单独作为阳性的评估标准时,阳性率分别为611%、667%、694%、861%。由此可以看出,当这4种标记物单独应用于癌症筛查时效果并不明显,而在同一项研究中,4种标志物联合检测时的阳性率高达917%,提高早期癌症的检出率,对后续的治疗具有重要的意义。除此之外,乳腺癌的肿瘤标记物还有骨桥蛋白(osteopontin,OPN)、血管内皮生长因子、恶性肿瘤特异生长因子等[2526]。其中,OPN是一种酸性糖蛋白,它有助于侵略性细胞的行为以及肿瘤的进展和转移。虽然OPN不是在肿瘤中特异性存在的,但它仍然具有成为恶性肿瘤的特异性标志物的潜力,其中就包括乳腺癌[2729]。颜廷俊等[26]对2016年至2018年的98位初步判定为乳腺癌的患者进行研究,检测了患者血清中CA125、CA153、OPN的含量,并对它们单独和联合检测的诊断结果进行比较,OPN单独检测乳腺癌的准确度为6554%,而与CA125、CA153进行联合检测时准确度提高至9122%。由此可以得出,OPN对乳腺癌早期筛查具有一定的价值,但需要和其他肿瘤标志物联合检测才能确保准确度。除了上述标志物外,CA242、CA199等糖蛋白联合CEA检测对结直肠癌检测具有很大的诊断价值,同时,还可以为患者后续治疗提供有效的价值[30]。
23呼出气体检测
许多患者都不愿意接受结肠镜的检查,因为它具有侵入性且会让患者感到不适。尽管事实证明接受结肠镜的检查有好处,但是平均只有40%~50%的成年人接受了筛查[31]。乳房X射线摄影作为一种可靠的乳腺癌早期筛查的方法,但对于乳房组织较密的女性而言检测效果较差[32]。上述方法存在局限性且临床实践效果不理想,而呼出气体检测因为具有快速、无创、廉价以及容易被患者接受等优点,引起了人们的兴趣。由于癌细胞必须靠改变代谢来支持自身的快速生长,而呼出气体中挥发性有机化合物(volatileorganiccompounds,VOCs)的组成正好可以反映了身体的代谢状态,因此,呼出气体中的VOCs检测为癌症的早期筛查提供了机会。目前,分析呼出气体的方法已证明对肺癌诊断具有很高的敏感性和特异性,这些综合方法包括电子鼻检测或气相色谱/质谱法分析检测或对VOCs进行综合分析等[3335]。CHO等[36]从肺癌细胞株和正常肺细胞株的顶空气体中收集VOCs,采用固相微萃取然后进行气相色谱/质谱法分析(原理如图3),从肺癌细胞株的顶空气体中检测到2乙基1己醇,并将其确定为肺癌潜在的生物标志物之一。PHILLIPS等[37]收集了108例胸片异常患者的呼吸样本,并通过气相色谱和质谱法进行分析,最终鉴别出了肺癌患者与非肺癌患者的VOCs的差异。研究表明,无论患者处于什么阶段,利用22种挥发性有机化合物(主要由烷烃、烷烃衍生物和苯衍生物组成)的特征就可以将癌症患者与非癌症患者区分开来。在另一项研究中,根据9种挥发性有机化合物的特征,鉴定出癌症患者的敏感性为851%,特异性为805%[38]。综上所述,呼吸分析足够敏感,容易区分患者样本,从而为癌症的早期筛查以及基于个体代谢分析的个性化药物提供了机会。但目前为止,针对某一特定类型的癌症,其特异性VOCs生物标志物还未完全统一,而是多种挥发性有机化合物的组合。因此,针对不同的癌症,我们需要建立不同的呼气分析体系。由此看来,呼吸分析的临床应用尚处于早期阶段。
24液体活检
液体活检是一种简单、微创的诊断工具,通过提供癌症发展不同阶段肿瘤异质性和动力学更全面的数据来克服传统组织活检的局限性,作为常规组织活检的替代品,它们在改善癌症诊断和监测方面有巨大潜力。液体活检是指从癌症患者身上获取一些生物液体,并进行广泛分析,以分离指示恶性肿瘤的生物标记物。其中的液体样本包括各种生物液体(如血液、尿液、胸腔积液、腹水、痰或脑脊液等),但比较常用的是外周血。液体活检可以对外周血或其他体液中的肿瘤源性物质进行取样,以非侵入性的方式检测体液中的肿瘤生物标志物。液体活检常见的生物标志物主要包括循环肿瘤基因(circulatingtumorDNA,ctDNA)、循环肿瘤细胞(circulatingtumorcell,CTC)、外泌体(exosome)、微小RNA等。ctDNA和CTC作为侵袭性较小的生物标记物,可以从血液样本中识别出来,对癌症的早期诊断、预后以及监测具有重大的意义。
241循环肿瘤细胞
1869年发现的第一个血液循环肿瘤标志物是CTC,它发现于一个转移性癌症患者中。CTC是外周血中发现的原发性或转移性肿瘤的癌症细胞,它们起源于多个肿瘤部位。原发性肿瘤释放的CTC可以在血液中检测到,这是一种有吸引力的诊断方法。通过对CTC的检查,不仅可以进行肿瘤的形态学分析,而且还可以获得DNA、RNA和蛋白质信息。但由于CTC在血液中的含量特别低,故CTC的鉴定需要基于物理或生物特征的特定富集方法。目前,CellSearch是美国食品和药物管理局批准的唯一的一种富集CTC的方法。但由于CellSearch依赖上皮细胞黏附分子和资源密集型的性质,它存在一些缺点,为解决这一缺点,VASANTHARAJAN等[39]对现有的方法进行优化提出了MetaCell的方法,从结直肠癌患者的血液中富集CTC,并对该方法的富集能力进行了评估。结果证明,MetaCell平台富集CTC细胞具有高回收率(细胞系的回收率>85%)。根据这一系列的方法可以从非小细胞肺癌患者的血液中分离出足够数量的CTC,并确定其各种生物标记物,有助于早期筛查检测,还可以实时监测癌症的进展、治疗效果和预后。
242循环肿瘤DNA
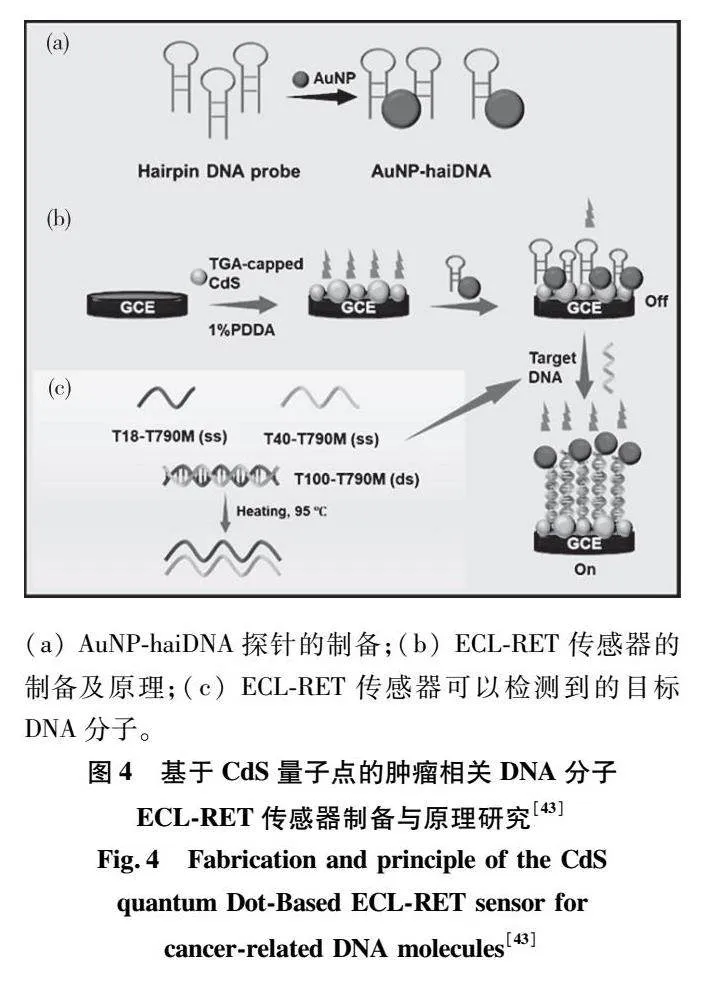
1948年,MANDEL等[40]首次描述了健康受试者血液样本中的无细胞DNA(cellfreeDNA,cfDNA),它主要来源于淋巴细胞和骨髓细胞。而ctDNA是一种从肿瘤细胞释放到外周血中特异性突变的DNA片段,代表了肿瘤细胞在某些病理生理过程(包括坏死、凋亡和排泄)后发生的基因组信息。ctDNA作为一种特异性和敏感性的生物标志物,它在癌症的监测治疗和预后的作用是毋庸置疑的,但是目前对于ctDNA是否可以用于早期癌症检测存在争议[41]。癌症中突变的DNA与正常DNA的比例(以百分比表示)被称为“突变等位基因分数”(minorallelefrequency,MAF),例如,01%的MAF意味着在循环中每1000个DNA分子中就有一个由癌细胞贡献,999个由正常细胞贡献。已知肿瘤体积越大,突变等位基因比例越高,提取的DNA分析越容易[42]。显然地,当MAF非常低(<01%或<001%)时,就需要特殊和高度敏感的技术来分析ctDNA。然而,近年来,DNA分析技术的进步,如数字化聚合酶链式反应(polymerasechainreaction,PCR)和下一代测序(nextgenerationsequencing,NGS),使得检测微量DNA成为可能。此外,YANG等[43]开发了一种基于共振能量转移(electrochemiluminescenceresonanceenergytransfer,ECLRET)的电化学生物传感器(设计及原理如图4),通过调控能量供体(CdS量子点)和受体(Au纳米颗粒)之间距离,实现了非小细胞肺癌表皮生长因子受体中T790M突变位点的ctDNA高灵敏度检测。
作为基于ctDNA突变的替代方案,最近的研究集中在ctDNA的其他特征上,如甲基化、片段长度、末端基序和拷贝数畸变。ctDNA甲基化的变化被认为是乳腺癌症发生的早期事件,这使其有希望作为癌症早期筛查的生物标记物。但由于血液中cfCNA的干扰和甲基化信号低的局限性,ctDNA在癌症早期筛查的应用仍然极具挑战性。HAI等[44]在QIAamp循环核酸试剂盒提取ctDNA的基础上,利用EDTA(抑制核酸酶对ctDNA的降解)和蛋白酶K(释放蛋白结合的ctDNA)的特点,获取到了高产量、高质量的ctDNA,实现了传统方案的优化。同时他们建立了一个来自不同阶段乳腺癌的全基因组亚硫酸盐测序(wholegenomebisulfitesequencing,WGBS)文库,通过对74名乳腺癌患者和7名正常人的DNA甲基化数据进行了比较,筛选出了26个候选的DNA甲基化CpG位点的生物标志物,它们在乳腺癌患者中具有较高的准确性。通过他们改进的ctDNAWGBS方法,获得的ctDNA甲基组可以很好地区分不同亚型的乳腺癌,有望被应用于临床实践中。
3结论与展望
在上述介绍的癌症早期筛查技术中,经皮穿刺活检是有创检测且易引起并发症,而支气管镜检查在直接观察管腔内病变方面有更大的优势,可以用作诊断工具。而在无创伤的筛查技术中,不建议单独使用胸部X射线进行筛查。相比较而言,LDCT具有更明显的优势,是癌症早期筛查中最有前景的影像学技术。单独的标记物检查用于癌症早期筛查时效果并不明显,多种血清肿瘤标记物联合检测可大大提高成功率。针对不同类型的癌症,使用对应的特异性肿瘤标记物进行联合检测,也可有效地提升检出率。呼出气体的检测简单但体系并未完善,临床应用仍处于早期阶段。而液体活检具有几乎无创、快捷、筛查准确率更高等优势,是近几年来癌症早期筛查的研究热点和未来的研究方向,有望实现癌症的早期筛查以对患者病情实时反馈。目前,肺癌早期筛查已经开展了大量的研究,相关技术取得了一定的进展,但想要实现大规模的癌症筛查仍面临着许多问题。
1)组织学活检、胸部X射线等技术不适合大规模的癌症早期筛查,相比之下,LDCT更适合。但低剂量螺旋CT易出现假阳性的情况,还需要进一步临床实践提高筛查的准确率。血清肿瘤标志物的联合检测可以提高筛查的准确率,但其灵敏度和特异性仍需进一步研究。
2)呼出气体检测的临床应用仍处于早期阶段,针对不同癌症的呼出气体标志物仍未统一,系统还未完善。而液体活检作为新兴的癌症早期筛查技术,克服了传统技术局限性,在癌症筛查和诊断方面更具潜力。但需要不断总结经验,提高检测的准确性和灵敏性,更好地应用于临床实践。
3)目前的癌症筛查检测技术存在易引起并发症、有创伤或辐射、假阳性率高、灵敏度低、筛查成本高等局限性,而电化学传感器的检测和分析不仅背景信号低、特异性强、灵敏度高、检测限低,而且检测费用低廉、操作便携。电化学传感器在标志物检测和液体活检已取得了一定进展,有望应用于临床实践。
4)将电化学技术与智能手机、微流控芯片结合实现传感器的便携性,不仅可以降低检测的成本,而且有望实现大规模的癌症早期筛查,建立癌症早期筛查和诊断的大数据平台,降低癌症的发病率和死亡率。
参考文献:
[1]FERLAYJ,COLOMBETM,SOERJOMATARAMI,etal.Cancerstatisticsfortheyear2020:anoverview[J].InternationalJournalofCancer,2021,149(4):778789.
[2]JETTJR.Currenttreatmentofunresectablelungcancer[J].MayoClinicProceedings,1993,68(6):603611.
[3]HUSTABC,KALCHIEMDEKELO,BEATTIEJA,etal.Mediastinalstagingwithendobronchialultrasoundinearlystagenonsmallcelllungcancer:isitnecessary?[J].SeminarsinRespiratoryandCriticalCareMedicine,2022,43(4):503511.
[4]ADASHEKJJ,JANKUF,KURZROCKR.Signedinblood:circulatingtumorDNAincancerdiagnosis,treatmentandscreening[J].Cancers,2021,13(14):3600.
[5]SHIBUYAK,HOSHINOH,CHIYOM,etal.Highmagnificationbronchovideoscopycombinedwithnarrowbandimagingcoulddetectcapillaryloopsofangiogenicsquamousdysplasiainheavysmokersathighriskforlungcancer[J].Thorax,2003,58(11):989995.
[6]张霞,杨志彦,李艳红,等.荧光支气管镜在肺癌诊断中的应用价值[J].实用癌症杂志,2013,28(5):507509.
[7]HUSSINGERK,BECKERH,STANZELF,etal.Autofluorescencebronchoscopywithwhitelightbronchoscopycomparedwithwhitelightbronchoscopyaloneforthedetectionofprecancerouslesions:aeuropeanrandomisedcontrolledmulticentretrial[J].Thorax,2005,60(6):496503.
[8]LIUQY,RUANWS,LIUZS,etal.Applicationofnarrowbandimaginginearlyscreeningofcolorectalcancer[J].FoodScienceandTechnology,2022,42:55221.
[9]金发光.我国肺癌早期筛查现状分析[J].医学与哲学,2017,38(1):1418.
[10]鲍婷,王佑娟,唐怀蓉,等.肺癌早期筛查高危人群选择,筛查技术及成本效益的研究进展[J].医学综述,2018,24(1):6670.
[11]王祥,廖鹏强,李强,等.肺癌的早期筛查现状及进展[J].肿瘤预防与治疗,2022,35(11):10501054.
[12]FANY,SUZ,WEIMN,etal.Lungcancerriskfollowingpreviousabnormalchestradiographs:a27yearfollowupstudyofaChineselungscreeningcohort[J].ThoracicCancer,2021,12(24):33873395.
[13]HENSCHKECI,MCCAULEYDI,YANKELEVITZDF,etal.Earlylungcanceractionproject:asummaryofthefindingsonbaselinescreening[J].Theoncologist,2001,6(2):147152.
[14]HENSCHKECI,YANKELEVITZDF,LIBBYDM,etal.SurvivalofpatientswithstageIlungcancerdetectedonCTscreening[J].NewEnglandJournalofMedicine,2006,355(17):17631771.
[15]JACOBSCD,JAFARIME.EarlyresultsoflungcancerscreeningandradiationdoseassessmentbylowdoseCTatacommunityhospital[J].ClinicalLungCancer,2017,18(5):327331.
[16]NAWAT,NAKAGAWAT,MIZOUET,etal.LowdosecomputedtomographyscreeninginJapan[J].JournalofThoracicImaging,2015,30(2):108114.
[17]SOBUET,MORIYAMAN,KANEKOM,etal.Screeningforlungcancerwithlowdosehelicalcomputedtomography:antilungcancerassociationproject[J].JournalofClinicalOncology,2002,20(4):911920.
[18]KIMYW,JEONM,SONGMJ,etal.Differencesindetectionpatterns,characteristics,andoutcomesofcentralandperipherallungcancersinlowdosecomputedtomographyscreening[J].TranslationalLungCancerResearch,2021,10(11):41854199.
[19]AHSANA,ZIMMERMANE,RODRIGUEZEM,etal.Examininglungcancerscreeningbehaviorsintheprimarycaresetting:amixedmethodsapproach[J].JournalofCancerTreatmentandResearch,2019,7(1):18.
[20]杨希萍.血清肿瘤标记物,相关抗原及联合检测在肺癌患者诊断中的意义[J].实用癌症杂志,2017,32(8):12791282.
[21]陈登云.血清CA153、CEA、HER2及BXTM联合检测在乳腺癌早期诊断中应用研究[J].中外医学研究,2022,20(26):7578.
[22]TASF,BILGINE,TASTEKIND,etal.Clinicalsignificanceofserumlamininlevelsinpatientswithlungcancer[J].BiomedicalReports,2016,4(4):485488.
[23]ZHOUY,LIM,WANGH,etal.DualsignalamplifiedelectrochemicalbiosensorbasedoneATRPandPEIforearlydetectionoflungcancer[J].Bioelectrochemistry,2022,148:108224.
[24]张宁.血清肿瘤标记物CEA、CA125、CYFRA211、NSE联合检测对肺癌的诊断价值[J].河南外科学杂志,2017,23(2):3637.
[25]王柏田,王笑峰.血清肿瘤标记物联合动态检测在乳腺癌诊断和监控治疗中的应用价值[J].中国医学创新,2021,18(3):611.
[26]颜廷俊.血清肿瘤标记物联合动态检测对乳腺癌诊疗的临床应用[J].中国医学创新,2019,16(32):146149.
[27]TUCKAB,CHAMBERSAF,ALLANAL.Osteopontinoverexpressioninbreastcancer:knowledgegainedandpossibleimplicationsforclinicalmanagement[J].JournalofCellularBiochemistry,2007,102(4):859868.
[28]WEBERGF,LETTGS,HAUBEINNC.Categoricalmetaanalysisofosteopontinasaclinicalcancermarker[J].OncologyReports,2011,25(2):433441.
[29]WEBERGF,LETTGS,HAUBEINNC.Osteopontinisamarkerforcanceraggressivenessandpatientsurvival[J].BritishJournalofCancer,2010,103(6):861869.
[30]蔺海福,李学圆.肿瘤标记物联合检测与结直肠癌术后患者预后和疗效的关系[J].世界最新医学信息文摘,2019,19(4):125,139.
[31]DAWSONSJ,TSUIDWY,MURTAZAM,etal.AnalysisofcirculatingtumorDNAtomonitormetastaticbreastcancer[J].NewEnglandJournalofMedicine,2013,368(13):11991209.
[32]RICHARDSONLC,RIMSH,PLESCIAM.Vitalsigns:colorectalcancerscreeningamongadultsaged5075yearsUnitedStates,2008[J].MorbidityandMortalityWeeklyReport,2010,59(26):808812.
[33]HEXX,CHAIHF,LUOYF,etal.Metaloxidesemiconductorgassensingmaterialsforearlylungcancerdiagnosis[J].JournalofAdvancedCeramics,2023,12(2):207227.
[34]KONONOVA,KOROTETSKYB,JAHATSPANIANI,etal.Onlinebreathanalysisusingmetaloxidesemiconductorsensors(electronicnose)fordiagnosisoflungcancer[J].JournalofBreathResearch,2019,14(1):16004.
[35]SCHEEPERSMHMC,ALDIFAIEZ,BRANDTSL,etal.Diagnosticperformanceofelectronicnosesincancerdiagnosesusingexhaledbreath:asystematicreviewandmetaanalysis[J].JamaNetworkOpen,2022,5(6):2219372221937.
[36]CHOSW,KOHJ,PARKTH.Identificationofalungcancerbiomarkerusingacancercelllineandscreeningofolfactoryreceptorsforbiomarkerdetection[J].BiotechnologyandBioprocessEngineering,2021,26:5562.
[37]PHILLIPSM,GLEESONK,HUGHESJMB,etal.Volatileorganiccompoundsinbreathasmarkersozflungcancer:acrosssectionalstudy[J].TheLancet,1999,353:19301933.
[38]VAIDYANATHANR,SOONRH,ZHANGP,etal.Cancerdiagnosis:fromtumortoliquidbiopsyandbeyond[J].LabonaChip,2019,19(1):1134.
[39]VASANTHARAJANSS,BARNETTE,GRAYES,etal.Assessmentofasizebasedmethodforenrichingcirculatingtumourcellsincolorectalcancer[J].Cancers,2022,14(14):3446.
[40]MANDELP,METAISP.Lesacidesnucleiquesduplasmasanguinchezl'homme[J].CRAcadSciParis,1948,142:241243.
[41]LAMS,KENNEDYT,UNGERM,etal.Localizationofbronchialintraepithelialneoplasticlesionsbyfluorescencebronchoscopy[J].Chest,1998,113(3):696702.
[42]CORCORANRB,CHABNERBA.ApplicationofcellfreeDNAanalysistocancertreatment[J].NewEnglandJournalofMedicine,2018,379(18):17541765.
[43]YANGF,GONGJB,LIM,etal.ElectrochemiluminescentCdSquantumdotsbiosensorforcancermutationdetectionatdifferentpositionsonlineardnaanalytes[J].AnalyticalChemistry,2023,95(37):1401614024.
[44]HAIL,LIL,LIUZ,etal.WholegenomecirculatingtumorDNAmethylationlandscaperevealssensitivebiomarkersofbreastcancer[J].MedComm,2022,3(3):134.
(责任编辑:于慧梅)
Abstract:
Cancerisoneofthemostcommoncausesofdeathinover100countriesworldwideandhasbecomeapersistentpublichealthchallengethattheworldiscurrentlyfacing.Thetreatmentdifficultyandhighmortalityrateofcancerpatientsaremainlyduetothefactthatmostpatientsarealreadyinthemiddleandlatestagesofthedisease.Atthispoint,the5-yearsurvivalrateofearlycancerpatientsismuchhigherthanthatofmidtolatestagepatients.Earlyscreening,detection,diagnosis,andtreatmentofcancerareimportantmeanstoimprovetreatmentandsurvivalrates.Amongthem,earlyscreeningforcanceriscrucial.Thisarticleintroducesthecurrentdevelopmentofearlycancerscreeningtechnology,whichismainlydividedintotwocategories,invasivedetectionandnon-invasivedetection,includinghistologicalbiopsy,imagingexamination,markerdetection,exhaledgasdetection,andemergingliquidbiopsy.Theaimistoimprovethesuccessrateofearlycancerdiagnosisandtreatment,explorefeasibleandeffectiveearlyscreeningstrategies,andreducethemortalityrateofcancer.
Keywords:
cancer;earlyscreening;invasivetesting;non-invasivetesting
收稿日期:20231009
基金项目:国家中组部“千人计划”青年资助项目(40127002);三亚崖州湾科技城海南专项博士研究生科学研究基金资助项目(HSPHDSRF202203024)
作者简介:张甜(1979—),女,教授,博士,研究方向:材料与新型生物电化学技术的开发与应用研究,Email:tzhang@whut.edu.cn.
*通讯作者:张甜,Email:tzhang@whut.edu.cn.