核心素养导向的无机化合物高效复习备考
2024-09-25秦磊
无机化合物知识涵盖必修和选择性必修课程的大部分内容,具体包括化学语言与概念、物质结构与性质、反应变化与规律、物质转化与应用、实验原理与方法等.核心素养指向“正确价值观、必备品格和关键能力”.高考是对学生的核心素养表现水平的量化评价,因此以核心素养为导向的复习才能瞄准方向,进而达到高效备考.
1 聚焦“价—类—用”促进知识结构化
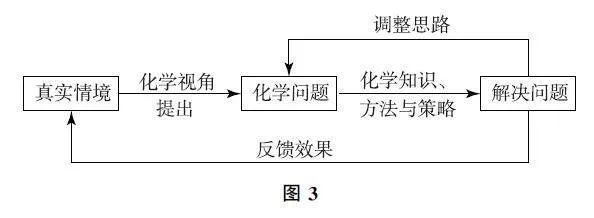
无机化合物知识零碎而且分散,复习时常常不易找到抓手.通过建构“价—类—用”三维关系图,可以使知识结构化和功能化.现以氮单质及其化合物为例进行说明(如图1).
含氮元素的物质间转化,有的发生氧化还原反应(价变),有的发生非氧化还原反应(价不变),而它们共同决定或影响了含氮元素的不同类别物质的应用价值.
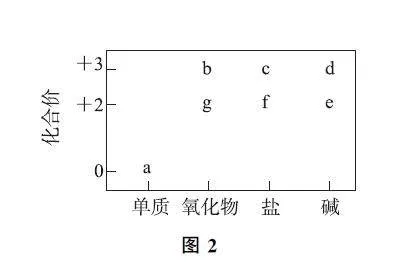
例1 (2024年广东卷)部分含Mg或Al或Fe物质的分类与相应化合价关系如图2所示.下列推断合理的是( ).
A.若a在沸水中可生成e,则a→f的反应一定是化合反应
B.在g→f→e→d转化过程中,一定存在物质颜色的变化
C.加热c的饱和溶液,一定会形成能产生丁达尔效应的红棕色分散系
D.若b和d均能与同一物质反应生成c,则组成a的元素一定位于周期表p区
分析 本题给出“价—类”二维图,需理解与辨析3种金属元素不同价态物质间的转化关系.若a在沸水中可生成e,此时a为Mg,e为Mg(OH)2,f为镁盐,a→f的反应有多种,可能为Mg+2HCl=MgCl2+H2↑,该反应属于置换反应;也可能为Mg+Cl2点燃=MgCl2,该反应属于化合反应,故a→f的反应不一定是化合反应,选项A错误.
e能转化为d,此时e为白色沉淀Fe(OH)2,d 为红褐色沉淀Fe(OH)3,说明在g→f→e→d转化过程中,一定存在物质颜色的变化,选项B正确.
如果c是铝盐,加热饱和的铝盐溶液,可得白色Al(OH)3 胶体;如果c是铁盐,持续加热饱和的铁盐溶液,也可能直接得到Fe(OH)3 沉淀,选项C错误.
假设b 为Al2O3,则d 为Al(OH)3,c为铝盐,Al2O3、Al(OH)3 与稀盐酸反应均生成铝盐,此时组成a的元素为Al,位于周期表p区;假设b为Fe2O3,则d为Fe(OH)3,c为铁盐,Fe2O3、Fe(OH)3 与稀盐酸反应均生成铁盐,此时组成a的元素为Fe,位于周期表d区,选项D错误.
答案 B.
例2 (2024年6月浙江卷)利用CH3OH 可将废水中的NO- 3 转化为对环境无害的物质后排放.反应原理为H+ +CH3OH+NO- 3 →X+CO2+H2O(未配平).下列说法正确的是( ).
A.X表示NO2
B.可用O3替换CH3OH
C.氧化剂与还原剂物质的量之比为6∶5
D.若生成标准状况下的CO2气体11.2L,则反应转移的电子数为2N A (N A 表示阿伏加德罗常数的值)
分析 从价态角度分析,应用CH3OH 将NO- 3中+5价N 元素还原为0价N 元素,即NO- 3 转化为无害的N2,体现了“类”“价”决定生态保护的“用”.由分析可知,X表示N2,NO2仍然是大气污染物,选项A不正确.CH3OH 中C元素由-2价升高到+4价,故CH3OH 是该反应的还原剂,O3有强氧化性,不可替换CH3OH,选项B不正确.该反应中,氧化剂NO- 3 中N 元素由+5 价降低到0 价,降低5 价,还原剂CH3OH中C元素由-2价升高到+4价,升高6价,由电子转移守恒可知,氧化剂与还原剂的物质的量之比为6∶5,若生成标准状况下的CO2气体11.2L,即0.5mol,转移的电子数为0.5×6=3N A,选项C 正确,选项D不正确.
答案 C.
2 分析真实情境,解决实际问题
以化学学科核心素养为导向的命题坚持以真实情境为测试载体,以实际问题为测试任务,以化学知识为解决问题的工具.高考试题精心遴选情境素材,注重联系生产生活实际,体现学科社会功能,彰显化学学科的价值.高考试题通过日常生活、生产环保、实验探究、化学史料、学术探索等情境问题的解决,实现对无机化合物的不同内容、不同水平学科素养的测评.分析真实情境到解决实际问题的思维模型如图3所示.
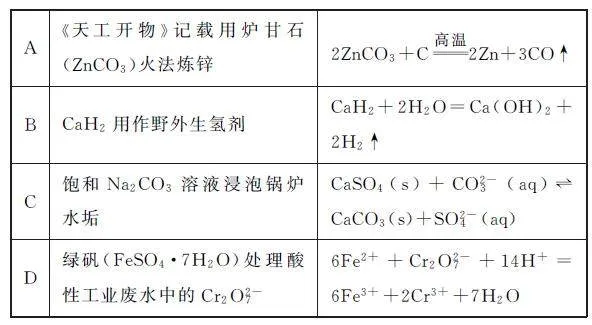
例3 (2024年湖南卷)下列过程中,对应的反应方程式错误的是( ).
分析 情境是连接生产生活与化学知识的桥梁,通过分析真实情境,推理其中蕴含的反应方程式.火法炼锌过程中C 作还原剂,ZnCO3 在高温条件下分解为ZnO、CO2,CO2 与C在高温条件下生成还原性气体CO,CO 还原ZnO 生成Zn,因此总反应为ZnCO3+2C 高温=Zn+3CO↑,选项A 方程式错误.CaH2 为活泼金属氢化物,因此能与H2O 发生归中反应生成碱和氢气,反应方程式为CaH2+2H2O=Ca(OH)2+2H2↑,选项B方程式正确.锅炉水垢中含有CaSO4,由于溶解性:CaSO4>CaCO3,因此向锅炉水垢中加入饱和Na2CO3 溶液,CaSO4 可以转化为CaCO3,反应方程式为CaSO4(s)+CO23-(aq)⇌CaCO3(s)+SO24-(aq)选项C方程式正确.Cr2O27- 具有强氧化性,加入具有还原性的Fe2+ ,二者发生氧化还原反应生成Fe3+ 、Cr3+ ,离子反应方程式为6Fe2++Cr2O27-+14H+=6Fe3++2Cr3++7H2O,选项D方程式正确.
答案 A.
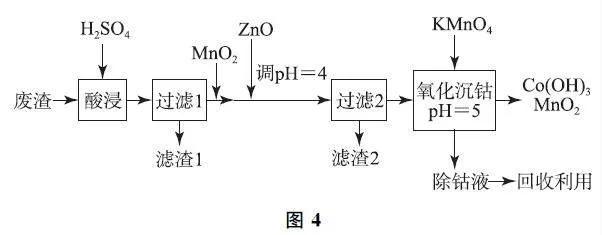
例4 (2024年全国新课标卷,节选)钴及其化合物在制造合金、磁性材料、催化剂及陶瓷釉等方面有着广泛应用.一种从湿法炼锌产生的废渣(主要含Co、Zn、Pb、Fe的单质或氧化物)中富集回收得到含锰高钴成品的工艺如图4所示.
已知溶液中相关离子开始沉淀和沉淀完全(c≤1.0×10-5mol·L-1)时的pH 如表1所示.
回答下列问题:
(1)“过滤1”后的溶液中加入MnO2 的作用是____.取少量反应后的溶液,加入化学试剂____检验____,若出现蓝色沉淀,需补加MnO2.
(2)“氧化沉钴”中氧化还原反应的离子方程式为____、____.
分析 本题涉及解决除杂、检验和物质转化等实际化工流程中的工艺问题.向滤液中加入MnO2 将Fe2+ 氧化为Fe3+ ,然后加入ZnO 调节pH=4,使Fe3+ 完全转化为Fe(OH)3,则“滤渣Ⅱ”的主要成分为Fe(OH)3,滤液中的金属离子主要是Co2+ 、Zn2+ 和Mn2+ ;最后“氧化沉钴”,加入强氧化剂KMnO4,将溶液中的Co2+ 氧化为Co3+ ,在pH=5 时,Co3+ 形成Co(OH)3 沉淀,而KMnO4 则被还原为MnO2,KMnO4 还会与溶液中的Mn2+ 发生归中反应生成MnO2,得到Co(OH)3 和MnO2 的混合物.
答案 (1)将溶液中的Fe2+ 氧化为Fe3+ ,以便在后续调pH 时除去Fe 元素;K3 [Fe(CN)6 ]溶液;Fe2+ .
(2)3Co2+ +MnO- 4 +7H2O=3Co(OH)3 ↓ +MnO2↓+5H+ ;3Mn2+ +2MnO- 4 +2H2O=4H+ +5MnO2↓.
3 关联必备知识注重迁移应用
高考试题精心遴选最有发展价值的知识,注重知识的综合性和应用性,体现知识迁移应用的价值.课程标准的内容要求主要涉及钠、铁、硫、氯、氮等元素,但近年高考高频出现磷、溴、锂、锰、铜、钴等陌生元素,它们与学过的元素同族或同周期,需要利用元素周期律推测已知元素与陌生元素间的关联性.同时,无机物转化涉及物质结构与性质的相关知识,像蒸馏、萃取等分离提纯实验操作也要关注溶质和溶剂的结构.因此要打破知识之间的界限,融合各个模块,形成知识关联的结构化.
例5 (2024年全国新课标卷)我国科学家最近研究的一种无机盐Y3[Z(WX)6]2纳米药物具有高效的细胞内亚铁离子捕获和抗氧化能力.W、X、Y、Z的原子序数依次增加,且W、X、Y 属于不同族的短周期元素.W 的外层电子数是其内层电子数的2倍,X 和Y的第一电离能都比左右相邻元素的高.Z的M 层未成对电子数为4.下列叙述错误的是( ).
A.W、X、Y、Z4种元素的单质中Z的熔点最高
B.在X的简单氢化物中X 原子轨道杂化类型为sp3
C.Y 的氢氧化物难溶于NaCl溶液,可以溶于NH4Cl溶液
D.Y3[Z(WX)6]2中WX- 提供电子对与Z3+ 形成配位键
分析 本题的解题关键是抓住元素周期表中原子结构的周期性变化和元素性质的相似性与递变性.W、X、Y、Z的原子序数依次增加,且W、X、Y 属于不同族的短周期元素.W 的外层电子数是其内层电子数的2倍,则W 为C元素;每个周期的第ⅡA 和第ⅤA的元素的第一电离能都比左右相邻元素的高,由于配合物Y3[Z(WX)6]2中Y 在外界,Y 可形成简单阳离子,则Y属于金属元素,故X 和Y 分别为N 元素和Mg元素;Z的M 层未成对电子数为4,则其3d轨道上有4个不成对电子,其价层电子排布式为3d64s2,Z为Fe元素,Y3[Z(WX)6]2为Mg3[Fe(CN)6]2.
答案 A.
4 培育关键能力发展创新思维
高考化学试题突出关键能力的考查,提出“理解与辨析”“分析与推测”“归纳与论证”“实验与探究”四大学科关键能力.关键能力是发展学科核心素养、培育核心价值的能力基础,因此要注意关键能力培育的进阶性,既要在无机化合物性质与转化的“理解与辨析”能力中夯实基础,也要在“实验与探究”能力中培育高阶水平的关键能力,从而促进创新思维的发展,最终达成化学学科核心素养.
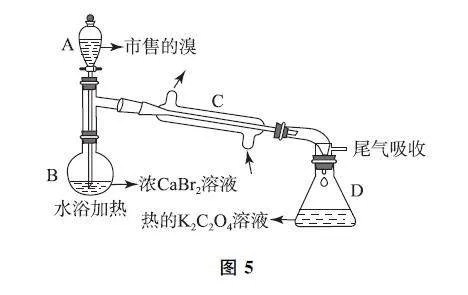
例6 (2024年河北卷,节选)市售的溴(纯度99%)中含有少量的Cl2和I2,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴.回答下列问题:
(1)装置如图5所示(夹持装置等略),将市售的溴滴入盛有浓CaBr2溶液的B中,水浴加热至不再有红棕色液体馏出.CaBr2溶液的作用为____;D 中发生的主要反应的化学方程式为____.
(2)将D 中溶液转移至____(填仪器名称)中,边加热边向其中滴加酸化的KMnO4溶液至出现红棕色气体,继续加热将溶液蒸干得固体R.该过程中生成I2的离子方程式为____.
(3)利用图示相同装置,将R和K2Cr2O7固体混合均匀放入B中,D中加入冷的蒸馏水.由A 向B中滴加适量浓H2SO4,水浴加热蒸馏.然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴.D 中蒸馏水的作用为____和____.
分析 本题设计新颖的情境和陌生的化学反应,既要求依据氧化还原反应原理书写反应方程式,又涉及实验仪器的选择和装置使用,综合考查高阶水平的分析推测和归纳论证等关键能力.市售的溴滴入浓CaBr2 溶液中,Cl2 可与CaBr2 发生氧化还原反应而被除去,I2 与Br2 一起蒸馏进入草酸钾溶液中,并被草酸钾分别还原为I- 和Br- ,并向溶液中滴加酸性的高锰酸钾溶液氧化I- ,加热蒸干所得固体R 的主要成分为KBr,将KBr固体和K2Cr2O7 固体混合均匀,同时滴加适量浓H2SO4,Br- 被氧化为Br2,由于溴单质易挥发,故水浴加热蒸馏,得到的液体分液、干燥、蒸馏,即可得高纯度的溴.
答案 (1)除去市售的溴中少量的Cl2;Br2 +K2C2O4=△=2KBr+2CO2↑.
(2)蒸发皿;2MnO4-+10I-+16H+=△=2Mn2++5I2+8H2O.
(3)液封;降低温度.
