探索新高考中有机化合物的应用方式
2024-09-25高雅文高源





近年高考形势变动较大,新的考查方式也层出不穷.综观近年新高考试题可以发现,有机化合物不仅是考查的主体,还成了其他化学知识的考查背景,让师生耳目一新的同时,也为新一年的高考指明了复习方向.本文意在探索新高考中有机化合物的应用方式,以期弥补学生在复习过程中存在的不足.
1 以有机化合物为背景考查化学实验
化学实验每年都是高考的重点,以最新科研成果及有机化合物为背景进行考查是一种新的尝试,虽然涉及的有机知识较少也较为简单,但对于学生的综合实践能力的考查是种很好的方式,能体现出他们对知识的灵活应用能力及对化学理论知识的理解.
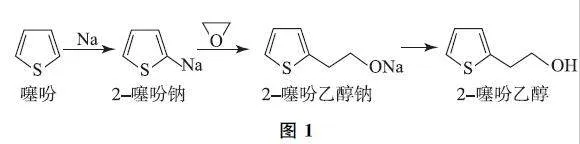
例1 (2023年辽宁卷)2G噻吩乙醇(Mr=128)是抗血栓药物氯吡格雷的重要中间体,其制备方法如图1所示.
Ⅰ.制钠砂.向烧瓶中加入300 mL 液体A 和460g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现.
Ⅱ.制噻吩钠.降温至10℃,加入25mL噻吩,反应至钠砂消失.
Ⅲ.制噻吩乙醇钠.降温至-10℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30min.
Ⅳ.水解.恢复室温,加入70mL水,搅拌30min;加盐酸调pH 至4~6,继续反应2h,分液;用水洗涤有机相,二次分液.
Ⅴ.分离.向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品17.92g.
回答下列问题:
(1)步骤Ⅰ中液体A 可以选择____(填字母).
a.乙醇 b.水 c.甲苯 d.液氨
(2)噻吩沸点低于吡咯( )的原因是____.
(3)步骤Ⅱ的化学方程式为____.
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是____.
(5)步骤Ⅳ中用盐酸调节pH 的目的是____.
(6)图2 所示仪器在步骤Ⅴ 中无须使用的是____(填名称);无水MgSO4 的作用为____.
(7)产品的产率为____(用Na计算,精确至0.1%).
解析
(1)A 液体不能和钠发生反应,乙醇和钠反应生成乙醇钠和氢气,a错误;水和钠反应生成氢氧化钠和氢气,b错误;甲苯和钠不反应,故c正确;液氨和钠反应生成NaNH2 和H2,d错误.
(2)吡咯分子具有N—H 的结构,分子间可形成氢键,所以噻吩沸点低于吡咯.
(3)步骤Ⅱ的化学方程式为
(4)在加入环氧乙烷溶液时,应先将环氧乙烷溶于四氢呋喃中,向烧瓶中缓缓滴加环氧乙烷溶液.
(5)步骤Ⅳ中用盐酸调节pH,可以促进2G噻吩乙醇钠水解完全,生成2G噻吩乙醇.
(6)向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,涉及的操作为过滤、蒸馏,据此分析可知,不需要的仪器有球形冷凝管、分液漏斗,硫酸镁的作用是吸收水分,起到干燥作用.
(7)4.60g钠的物质的量为0.2mol,理论上得到2G噻吩乙醇的质量为25.6g,产品的产率为17.92g/25.6g×100%=70.0%.
点评 本题涉及实验的基本操作以及物质性质的理解应用.解答这类试题时要求学生掌握有机物之间的转化关系,理解实验操作的基本原理.相比于无机实验的反应原理,有机实验的反应原理更加复杂,操作步骤烦琐,且需要学生结合已知信息及已学知识综合分析操作步骤.因此,学生在复习有机化合物时,要注重同类物质性质的相似性,结合物质性质分析实验操作,并掌握常见试剂在实验操作中的作用.
2 以有机化合物为背景考查化学反应原理
化学反应原理是高中化学的重点和难点,特别是与有机化合物知识的结合,使得试题的难度大大增加,同时也赋予试题更高的新颖度.在解答这类试题时,我们需要排除有机化合物对化学反应原理的干扰,专注于理解有机化合物之间的转化本质.
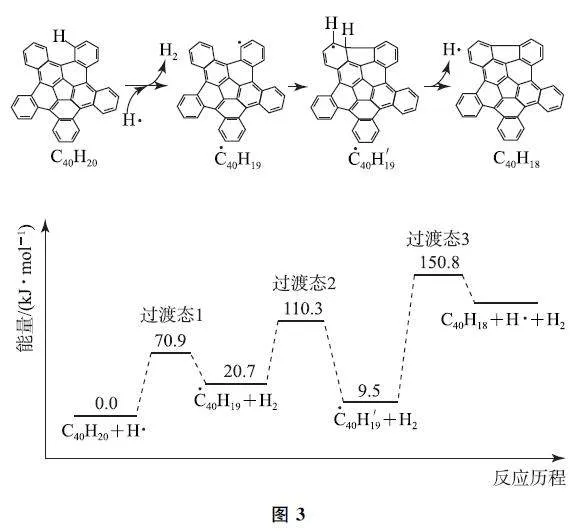
例2 (2023年湖北卷)纳米碗C40H10是一种奇特的碗状共轭体系.高温条件下,C40H10可以由C40H20分子经过连续5 步氢抽提和闭环脱氢反应生成.C40H20(g)H··→C40H18(g)+H2(g)的反应机理和能量变化如图3所示.
回答下列问题:
(1)已知C40Hx 中的碳氢键和碳碳键的键能分别为431.0kJ·mol-1和298.0kJ·mol-1,H—H 键键能为436.0kJ·mol-1.估算C40H20 (g)⇌C40H18(g)+H2(g)的ΔH =____ kJ·mol-1.
(2)图示历程包含____个基元反应,其中速率最慢的是第____个.
(3)C40H10纳米碗中五元环和六元环结构的数目分别为____、____.
(4)1 200 K 时,假定体系内只有反应C40H12(g)⇌C40H10(g)+H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp 为____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(5)C.40 H19 (g)⇌C40 H18 (g)+ H· (g)以及C.40H11(g)⇌C40H10(g)+H· (g)反应的lnK (K 为平衡常数)随温度倒数的关系如图4所示.已知本实验条件下,lnK =-ΔH/RT +c(R 为理想气体常数,c 为截距).图中两条线几乎平行,从结构的角度分析其原因是____.
(6)下列措施既能提高反应物的平衡转化率,又能增大生成C40H10的反应速率的是____(填字母).
a.升高温度 b.增大压强 c.加入催化剂
解析
(1)分析反应历程可知,整个过程中断裂2个C—H 键,形成1 个H—H 键和1 个C—C键,则C40H20(g)⇌C40H18(g)+H2(g)的ΔH 为2×431.0kJ·mol-1-436.0kJ·mol-1-298.0kJ·mol-1=+128kJ·mol-1.
(2)分析图示历程可知,反应包含3个基元反应,其中速率最慢的是第3个.
(3)C40H20中含有1个五元环,10个六元环,由反应机理可知,每脱2个氢形成1个五元环,六元环数目不变,则C40H10总共含有6个五元环,10个六元环.
(4)设开始时C40H12的物质的量为1mol,结合三段式列式计算:
(5)图中2条线几乎平行,根据lnK =-ΔH/RT +c可知,斜率近似相等,即两反应的焓变基本相等,原因是两反应均断开1个碳氢键,形成1个碳碳键.
(6)由图像可知,该反应为吸热反应,升高温度,能增大反应速率,平衡正向移动,提高反应物的平衡转化率,故a正确;增大压强,能加快反应速率,平衡逆向移动,不能提高反应物的平衡转化率,故b错误;加入催化剂加快反应速率,不改变化学平衡,不能提高反应物的平衡转化率,故c错误.
点评 本题涉及的化学反应原理知识较为全面,解题的难点在于如何将有机物之间的转化应用于其中.从本质上讲,有机物之间的转化也是一种反应原理,学生在复习过程中可适当融入有机反应原理,弱化转化过程中官能团的变化,强化有机物分子式的不同.
有机物官能团之间复杂的转化关系为其命题方式提供了无限可能,微观分析及宏观应用都会成为考查的内容.随着新高考对于学生核心素养及关键能力的重视,高考题型会不断创新,学生在学习相关知识时要开阔眼界、拓展延伸、深化本质、强化应用,把“知其所以然”作为基本能力.
(完)
