硫代葡萄糖苷浸种对青花菜种子萌发及生理特性的影响
2024-09-24邹宜芯李慧任玉欣赵凯文












收稿日期:2023-10-16
基金项目:天津市科技计划种业科技重大专项(18ZXZYNC00160);天津市大学生创新训练计划项目(202210061104)
作者简介:邹宜芯(1999-),女,四川成都人,硕士研究生,主要从事蔬菜栽培生理研究。(E-mail)913788290@qq.com
通讯作者:李 慧,(E-mail)lihui@tjau.edu.cn
摘要: 以青花菜种子为试验材料,采用培养皿进行发芽试验,设置蒸馏水、200 mmol/L NaCl和15% PEG-6000 3种培养条件,研究不同质量浓度[0 μg/mL(CK)、0.94 μg/mL、1.88 μg/mL、3.75 μg/mL、7.50 μg/mL、15.00 μg/mL]硫代葡萄糖苷浸种对青花菜种子萌发指标、幼苗形态指标及生理指标的影响。研究结果表明,与CK相比,蒸馏水培养下,硫代葡萄糖苷浸种对青花菜种子的发芽率和发芽势没有显著影响,7.50 μg/mL硫代葡萄糖苷浸种的青花菜根冠比显著提高;1.88~7.50 μg/mL硫代葡萄糖苷浸种的青花菜POD活性显著高于对照,其中3.75 μg/mL硫代葡萄糖苷浸种能显著提高青花菜的SOD和CAT活性,且MDA含量显著低于对照。盐胁迫下,7.50 μg/mL硫代葡萄糖苷浸种能显著提高青花菜的SOD、POD活性,显著降低MDA含量。干旱胁迫下,硫代葡萄糖苷浸种均能显著提高青花菜种子萌发指标,显著降低青花菜MDA含量;0.94 μg/mL硫代葡萄糖苷浸种能显著增加青花菜的主根长,1.88 μg/mL和3.75 μg/mL硫代葡萄糖苷浸种能显著提高青花菜的根冠比;15.00 μg/mL硫代葡萄糖苷浸种能显著增加青花菜的POD活性。隶属函数分析结果表明,蒸馏水培养和干旱胁迫下3.75 μg/mL硫代葡萄糖苷浸种及盐胁迫下7.50 μg/mL硫代葡萄糖苷浸种的隶属函数值最高。综上所述,硫代葡萄糖苷浸种能有效缓解青花菜种子萌发期和幼苗期旱害和盐害,干旱胁迫下浸种最适质量浓度为3.75 μg/mL,盐胁迫下浸种最适质量浓度为7.50 μg/mL。
关键词: 青花菜;硫代葡萄糖苷;种子萌发;生理特性;抗逆性
中图分类号: S635.3 文献标识码: A 文章编号: 1000-4440(2024)08-1379-10
Effects of soaking seeds with glucosinolates on seed germination and physiological characteristics of broccoli
ZOU Yixin, LI Hui, REN Yuxin, ZHAO Kaiwen
(College of Horticulture and Landscape Architecture, Tianjin Agricultural University, Tianjin 300392, China)
Abstract: In this study, broccoli seeds were used as experimental materials, and germination experiments were carried out using culture dishes. Three culture conditions of distilled water, 200 mmol/L NaCl and 15% PEG-6000 were set up. Six different concentrations of glucosinolates were set as 0 μg/mL (CK), 0.94 μg/mL, 1.88 μg/mL, 3.75 μg/mL, 7.50 μg/mL and 15.00 μg/mL. The effects of different mass concentrations of glucosinolates on seed germination indices, seedling morphological indices and physiological indices of broccoli were studied. The results showed that compared with CK, soaking seeds with glucosinolates had no significant effect on the germination rate and germination potential of broccoli under distilled water culture, but the root-shoot ratio of broccoli in the treatment of soaking seeds with 7.50 μg/mL glucosinolates was significantly increased. The POD activity of broccoli in the treatment of soaking seeds with 1.88-7.50 μg/mL glucosinolates was significantly higher than that in the control, and the SOD and CAT activities of broccoli in the treatment of soaking seeds with 3.75 μg/mL glucosinolates were significantly increased, and the MDA content was significantly lower than that in the control. Under salt stress, soaking seeds with 7.50 μg/mL glucosinolates could significantly increase the activities of SOD and POD, and significantly reduce the content of MDA in broccoli. Under drought stress, soaking seeds with glucosinolates could significantly improve the germination indices of broccoli seeds and significantly reduce the MDA content of broccoli. Soaking seeds with 0.94 μg/mL glucosinolates could significantly increase the main root length of broccoli, and soaking seeds with 1.88 μg/mL and 3.75 μg/mL glucosinolates could significantly increase the root-shoot ratio of broccoli. Soaking seeds with 15.00 μg/mL glucosinolates could significantly increase the POD activity of broccoli. The results of membership function analysis showed that the membership function values of 3.75 μg/mL glucosinolate soaking treatment under distilled water culture and drought stress and 7.50 μg/mL glucosinolate soaking treatment under salt stress were the highest. In summary, soaking seeds with glucosinolates can effectively alleviate the drought and salt damage of broccoli during seed germination and seedling stage, the optimum concentration of glucosinolates for soaking seeds under drought stress is 3.75 μg/mL, and the optimum concentration of glucosinolates for soaking seeds under salt stress is 7.50 μg/mL.
Key words: broccoli;glucosinolates;seed germination;physiological characteristics;stress resistance
青花菜(Brassica oleracea var. italica)是十字花科芸薹属植物,又名西兰花,原产于意大利,19世纪末传入中国,现世界各地皆有栽培[1]。其口感清脆、营养价值高且富含抗癌活性成分萝卜硫素,被誉为“蔬菜皇冠”[2]。硫代葡萄糖苷是青花菜中一类重要次生代谢产物,在内源黑芥子酶的作用下水解生成多种活性物质。硫代葡萄糖苷及其降解物具有抗癌、抗菌等活性[3-4],可作为防御性物质广泛参与十字花科植物体内的防御反应,在植物应对环境改变的过程中具有重要作用[5]。
已有研究结果表明,拟南芥在干旱胁迫下可通过诱导IAA5/6/19蛋白使体内硫代葡萄糖苷水平提高,调控气孔在干旱胁迫响应中发挥重要作用[6]。在高盐、高温胁迫下,十字花科植物可以通过提高体内硫代葡萄糖苷的含量,进而提高对高盐、高温的耐受能力[7-8]。李向果等[9]对青花菜中硫代葡萄糖苷的降解产物异硫氰酸酯(isothiocyanates, ITCS)进行抗菌试验,结果表明ITCS具有一定的体外和体内抗菌作用。张睿等[10]对青花菜中硫代葡萄糖苷的主要存在形式萝卜硫代葡萄糖苷(GRAE)的抑菌及体外免疫活性进行了初步探究,结果表明GRAE对3株致病菌均有一定的抑制作用,且对大肠杆菌和沙门氏菌的抑制效果优于金黄色葡萄球菌。而有关硫代葡萄糖苷对青花菜种子萌发、幼苗生长及抗逆性影响方面的研究较少。
种子萌发是植物积累活性物质和次生代谢产物的重要手段之一,萌发不仅会改变种子形状,并且会在种子中不断合成新的物质[11]。研究发现NaCl胁迫是最常见的非生物胁迫方式之一 [12];聚乙二醇(PEG)是模拟干旱胁迫的一种生物大分子,通常被用作干旱机理研究及植物抗旱性评价[13]。高盐和干旱胁迫对青花菜的萌发和生长极为不利,可导致青花菜种子的发芽率和发芽势降低,抑制根系活力,bYKBfwKJPij7+Axlaeknow==严重影响青花菜的生长发育[14]。基于此,本研究以青花菜种子为材料,研究不同浓度硫代葡萄糖苷浸种对青花菜种子萌发及幼苗生理特性的影响。通过测定种子发芽指标(发芽率、发芽势、发芽指数)、幼苗形态指标(根冠比、主根长、茎粗)及生理指标(抗氧化酶活性、丙二醛含量)筛选最适的硫代葡萄糖苷浸种浓度,以期为利用硫代葡萄糖苷浸种提升青花菜综合抗逆性提供理论依据。
1 材料与方法
1.1 试验材料
青花菜为天津科润农业科技股份有限公司蔬菜研究所江汉民博士惠赠,品种为KJ-18,试验在天津农学院园艺中心实验室进行。外施所用硫代葡萄糖苷为实验室提取所得。
1.2 试验设计
将健康的青花菜种子浸于2%次氯酸钠中消毒10 min,用蒸馏水冲洗6遍,每遍2 min。所有种子分成6份,分别在加入0 μg/mL、0.94 μg/mL、1.88 μg/mL、3.75 μg/mL、7.50 μg/mL、15.00 μg/mL的硫代葡萄糖苷溶液(记为CK、T1、T2、T3、T4、T5)中浸种24 h,后置于直径9 cm的玻璃培养皿中,每皿放2层滤纸和30粒青花菜种子进行萌发试验。萌发试验设置蒸馏水(正常条件)、200 mmol/L NaCl溶液(盐胁迫)、15% PEG-6000溶液(干旱胁迫)3种培养条件下的不同处理,即蒸馏水条件下CK、T1、T2、T3、T4、T5处理,200 mmol/L NaCl溶液盐胁迫下CK、T1、T2、T3、T4、T5处理和15% PEG-6000溶液干旱胁迫下CK、T1、T2、T3、T4、T5处理,每个培养皿内加5 mL对应溶液,每个处理4次生物学重复,3次技术重复。将处理好的培养皿置于25 ℃、光照16 h/黑暗8 h的培养箱中培养并每天更换滤纸和溶液。连续10 d统计发芽数,用于计算种子萌发相关指标,并在10 d结束时,将植株用液氮速冻后存放于-80 ℃环境下用于测定相关生理指标。
1.3 测定项目与方法
1.3.1 种子萌发指标的测定 参照《农作物种子检验规程》[15]对种子萌发指标进行统计,从培养皿放入培养箱培养24 h后开始统计,直至萌发第10 d。按照下列公式计算发芽率(GR)、发芽势(GP)和发芽指数(GI)。
GR=n/N×100%。式中,n为前n d萌发种子数;N为供试种子数。
GP=SNm/SNo×100%。式中,SNm为前5 d萌发种子数;SNo为供试种子数。
GI=∑(Gt/Dt)。式中,Gt为前t d种子发芽数;Dt为发芽天数。
1.3.2 形态指标的测定 参照《农作物种子检验规程》[15]测定培养10 d后各处理组青花菜幼苗的主根长和茎粗,每个处理组测量不少于30株。
称量法测定鲜重,并计算其根冠比。
根冠比=地下部重量/地上部重量。
1.3.3 幼苗生理指标的测定 取培养至第10 d的青花菜幼苗测定生理指标,MDA含量采用硫代巴比妥酸法测定[16];SOD活性采用氮蓝四唑光还原法测定[17];POD活性采用愈创木酚法测定[18];CAT活性采用紫外分光光度法测定[19]。
1.3.4 隶属函数计算 隶属函数计算公式:U(x)=(x-xmin)/(xmax-xmin);反隶属函数计算公式:U(x)=1-(x-xmin)/(xmax-xmin)。式中,x表示各指标值;xmin表示对应指标的最小值;xmax表示对应指标的最大值。其中MDA含量采用反隶属函数计算,其余指标均采用隶属函数计算。
1.4 数据分析
采用SPSS 26.0对试验数据进行分析;采用单因素方差分析各处理间差异的显著性,使用Duncan’s法进行不同处理间均值的显著性差异比较(P<0.05);应用Origin 2021软件进行图形绘制。
2 结果与分析
2.1 硫代葡萄糖苷浸种对青花菜种子发芽进度的影响
由图1可知,蒸馏水培养条件下,发芽早期,与CK相比低浓度T1、T2处理硫代葡萄糖苷处理发芽率增速快,高浓度T3、T4和T5处理硫代葡萄糖苷处理发芽率增速相对较慢,第2 d时各处理发芽率在92.5%左右,第2~10 d各处理发芽率与CK相比没有显著差异(图1A)。盐胁迫下发芽第1 d T2处理的发芽率显著高于CK和其他处理;发芽第2~4 d,与CK相比,T2~T4处理均能提高青花菜种子发芽率;发芽第4~10 d,T2处理发芽率最高,显著高于CK和其他处理,T4处理的发芽率次之,显著高于CK以及T1、T3、T5处理(图1B)。干旱胁迫下,发芽第2 d,T1~T5处理的发芽率及其增速都高于CK,其中T2处理的发芽率增速最快;发芽中后期,与CK相比,各处理均能提高青花菜种子的发芽率,且后续随着发芽时间的增长,效果愈发明显,第6 d后各处理发芽率趋于稳定(图1C)。
2.2 硫代葡萄糖苷浸种对青花菜种子萌发指标的影响
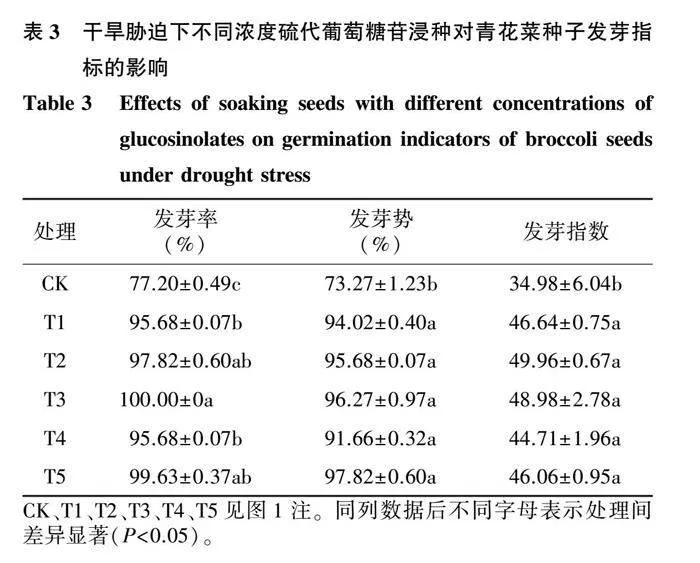
蒸馏水培养下,不同浓度硫代葡萄糖苷浸种对青花菜种子的发芽率和发芽势均没有显著性影响(表1)。盐胁迫下,T2处理的发芽率、发芽势和发芽指数均显著高于CK(表2)。干旱胁迫下,各处理的发芽率、发芽势和发芽指数均显著高于CK,其中T3处理的发芽率最高,比CK提高了29.53%(表3)。
2.3 硫代葡萄糖苷浸种对青花菜幼苗形态指标的影响
izxeHEiAyS4Fz4sSqLiQsUA6H4cjik3HqMg9hQj7IF0=由图2可以看出,不同培养条件下青花菜幼苗形态差异较大。由表4~表6可知,蒸馏水培养下,与CK相比,T4处理的根冠比显著增加;各处理间茎粗无显著性差异(表4)。盐胁迫下,各处理根冠比及茎粗与CK无显著性差异,但T1和T3处理的主根长显著低于CK(表5)。干旱胁迫下,T2和T3处理的根冠比显著高于CK,其他处理与CK没有显著性差异;T1处理的主根长显著高于CK;T1处理茎粗显著低于CK和其他处理(表6)。
2.4 硫代葡萄糖苷浸种对青花菜幼苗抗氧化酶活性的影响
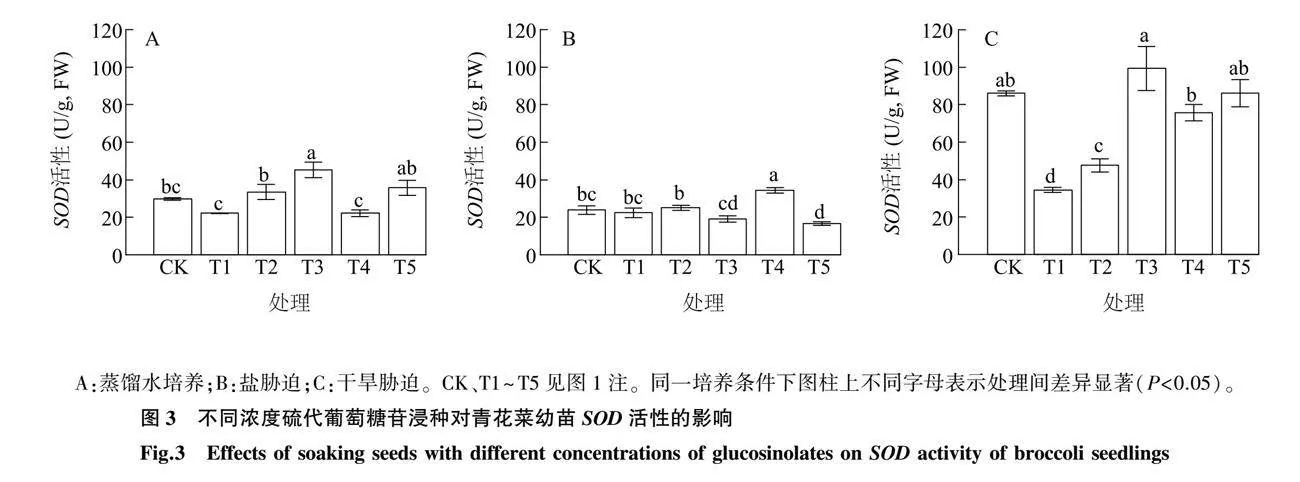
eQaFvY1kiaf+Qc42eZaRcGZw76GXjtpkrZ6jf4Bsds4=2.4.1 硫代葡萄糖苷浸种对青花菜幼苗SOD活性的影响 由图3可知,蒸馏水培养下,T3处理的SOD活性显著高于CK、T1、T2和T4处理,比CK提高了52.55%。盐胁迫下,T4处理SOD活性显著高于CK和其他处理,且T4处理SOD活性比CK提高了44.28%。干旱胁迫下,T3处理SOD活性显著高于T1、T2和T4处理,而与CK和T5处理没有显著性差异。由此表明,蒸馏水培养条件下,3.75 μg/mL硫代葡萄糖苷浸种(T3处理)和盐胁迫下7.50 μg/mL硫代葡萄糖苷浸种(T4处理)分别较对照(CK)能显著提高青花菜SOD活性。
2.4.2 硫代葡萄糖苷浸种对青花菜幼苗POD活性的影响 由图4可知,蒸馏水培养下,T3处理的POD活性显著高于CK和其他处理,且比CK的POD活性高79.80%。盐胁迫下,T4处理POD活性显著高于CK、T1、T2和T5处理。干旱胁迫下,T5处理的POD活性显著高于CK和其他处理。由此表明,中高浓度的硫代葡萄糖苷浸种可提高青花菜POD活性。
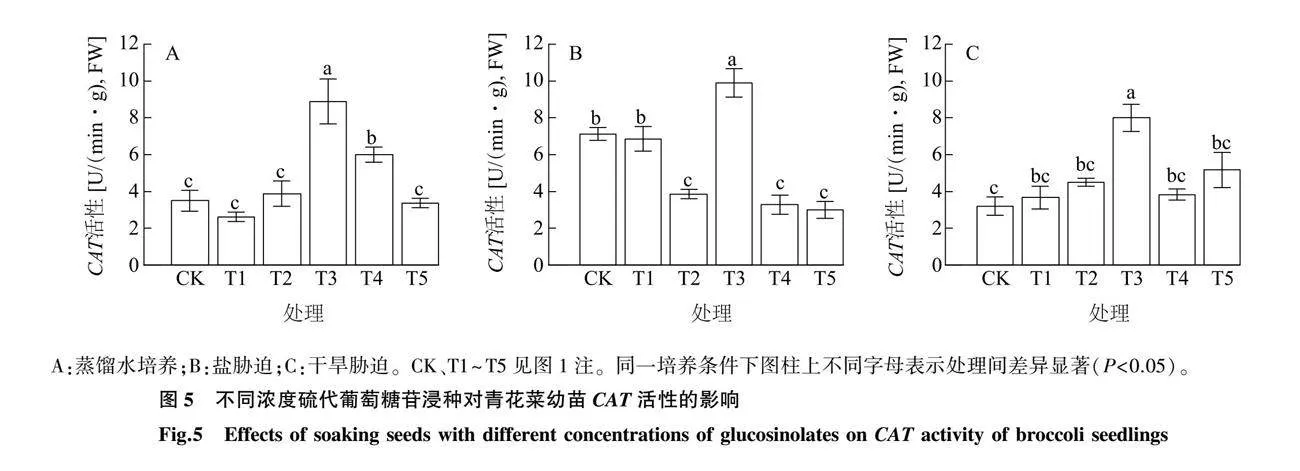
2.4.3 硫代葡萄糖苷浸种对青花菜幼苗CAT活性的影响 由图5可知,蒸馏水培养下,T3处理的CAT活性显著高于CK和其他处理,且比CK提高153.97%;T4处理的CAT活性显著高于CK、T1、T2和T5处理。盐胁迫下,T3处理CAT活性显著高于CK和其他处理,且比CK活性提高了38.79%。干旱胁迫下,T3处理CAT活性显著高于CK和其他处理,且比CK高了150.00%。由此表明,应用3.75μg/mL硫代葡萄糖苷浸种(T3处理)可显著提高青花菜CAT的活性。
2.5 硫代葡萄糖苷浸种对青花菜幼苗MDA含量的影响
由图6可知,蒸馏水培养下,T3、T4和T5处理的MDA含量显著低于CK和其他处理组,且T3、T4、T5处理间MDA含量差异不显著。盐胁迫下,T4处理MDA含量显著低于CK和其他处理。干旱胁迫下,T3和T4处理MDA含量显著低于CK和其他处理,且T3处理MDA含量比CK低了46.26%。由此可见,3种培养条件下,7.50 μg/mL硫代葡萄糖苷浸种(T4处理)均能显著降低青花菜MDA含量。
2.6 隶属函数分析硫代葡萄糖苷浸种对青花菜种子萌发、幼苗形态及生理指标的影响
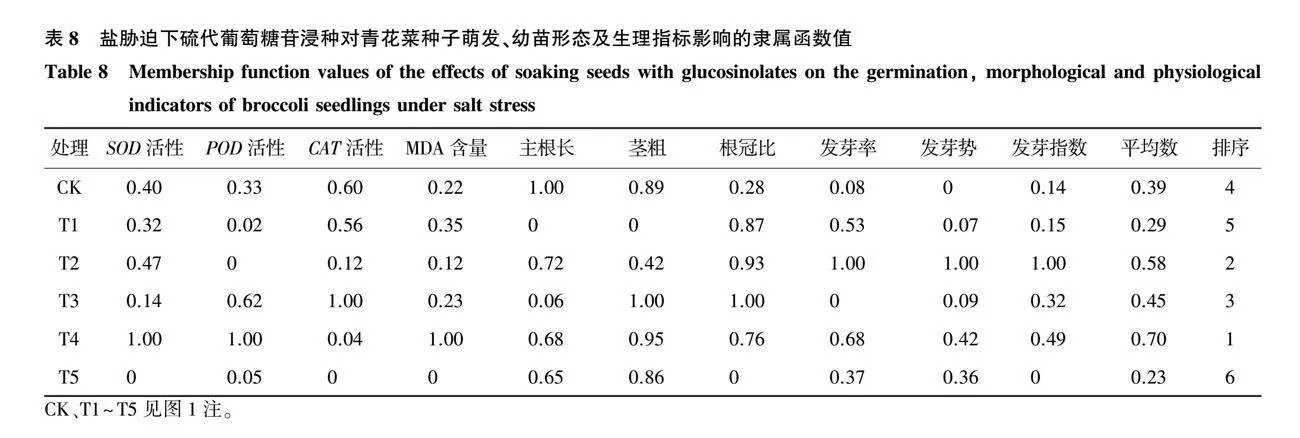
通过隶属函数分析发现,蒸馏水培养下硫代葡萄糖苷浸种的T2、T3、T4和T5处理的平均隶属函数值均高于CK,且T3处理的平均隶属函数值最高(表7);盐胁迫下T2、T3和T4处理的平均隶属函数值高于CK,且T4处理的平均隶属函数值最高(表8);干旱胁迫下各处理的平均隶属函数值均高于CK,其中T3处理的平均隶属函数值最高(表9)。
3 讨论
硫代葡萄糖苷是广泛存在于十字花科植物中的一类富含氮、硫元素的次生代谢产物。次生代谢产物调控是植物应对胁迫的主要方法之一,当植物受到不利因素胁迫时,会产生更多的次生代谢产物来应对[20]。硫代葡萄糖苷在应对生物胁迫和非生物胁迫中都具有重要作用[21]。
种子的萌发对植物的生长和产量形成有重大影响。种子萌发是植物生命史上的一个重要阶段,也是衡量植物抗逆性的重要时期之一[22]。本研究结果表明,蒸馏水培养下,青花菜发芽率为99.79%,明显高于盐和干旱胁迫下的发芽率,说明盐和干旱胁迫对种子的萌发有明显抑制作用[23-26]。蒸馏水培养下,硫代葡萄糖苷浸种对青花菜种子的发芽率和发芽势未有显著影响,7.50 μg/mL(T4处理)硫代葡萄糖苷浸种的根冠比显著高于对照;盐胁迫下,硫代葡萄糖苷浸种应控制在一定的质量浓度下,其中1.88 μg/mL硫代葡萄糖苷浸种(T2处理)的萌发指标显著高于对照,这与胡竞渝等[27]发现盐胁迫下腐胺浸种对菜豆种子萌发的影响和苏金强等[28]发现盐胁迫下赤霉素浸种对百香果种子萌发的影响结果相似。干旱胁迫下,硫代葡萄糖苷浸种均能显著提高青花菜种子的萌发指标,这与干旱胁迫下不同浓度的5-氨基乙酰丙酸浸种对紫花苜蓿种子萌发[29]和不同浓度CaCl2浸种对干旱胁迫下花生种子萌发[30]等研究结果相似。
通过长期的系统进化,植物细胞内形成防御活性氧(ROS)和自由基毒害的保护机制,SOD、POD、CAT是酶促防卫体系的主要成员[31-32]。盐胁迫下,植物体内过量的活性氧积累会导致细胞大分子功能和细胞膜系统受损,增加细胞膜的通透性并产生大量MDA,加大胁迫的破坏力[33]。过量O2·-和H2O2的增加激活了清除ROS的保护酶系统,从而增强SOD、POD和CAT的活性[34],SOD催化O2·-反应生成H2O2,POD催化H2O2与酚类反应间接清除胁迫产生的大量ROS,而CAT可直接催化H2O2生成H2O和O2,防止活性氧对细胞膜造成损伤[35]。植物体内MDA的含量可反映植物抗逆水平,在逆境胁迫下,植物体内MDA含量越低,表明植物抗逆性越强[36]。
蒸馏水培养下,与CK相比,中等质量浓度3.75 μg/mL硫代葡萄糖苷浸种(T3处理)显著提高了青花菜SOD、POD和CAT的活性,显著降低了MDA含量,提高了青花菜的抗逆能力,这与卢环等[37]研究不同质量浓度烯效唑浸种对绿豆SOD、POD活性及MDA含量影响的结果相似。盐胁迫下,与CK相比3.75 μg/mL(T3处理)硫代葡萄糖苷浸种的青花菜CAT活性显著提高,7.50 μg/mL(T4处理)硫代葡萄糖苷浸种的青花菜SOD和POD活性显著提高且MDA含量显著降低,表明7.50 μg/mL硫代葡萄糖苷浸种可通过SOD催化O2·-反应生成H2O2,POD催化H2O2与酚类反应间接清除胁迫产生的大量ROS,清除因盐胁迫累积的过量O2·-和H2O2,膜脂过氧化程度降低,从而使MDA含量显著下降。试验结果表明,在盐胁迫下硫代葡萄糖苷可通过提高抗氧化酶活性,有效清除植物体内过量的ROS。张成冉等[38]发现盐胁迫下中等浓度的糖(葡萄糖、果糖等)浸种能明显提高玉米SOD和POD活性,且显著降低MDA含量;张亮等[39]发现盐胁迫下中等浓度的异甜菊醇浸种明显提高了油菜的SOD、POD和CAT活性,这均与本试验结果相似。干旱胁迫下,硫代葡萄糖苷浸种处理能显著降低青花菜MDA含量,表明干旱胁迫下通过硫代葡萄糖苷浸种可显著提高青花菜的抗逆性,这与范小玉等[40]发现在干旱胁迫下不同浓度的CaCl2均能提高花生抗干旱能力的结果相似。其中15.00 μg/mL硫代葡萄糖苷浸种(T5处理)能显著提高POD活性。表明干旱胁迫下应用高质量浓度硫代葡萄糖苷浸种可在一定程度上提高抗氧化酶活性,进而提升青花菜抗逆性。
隶属函数分析结果显示,在蒸馏水、200 mmol/L NaCl 以及15% PEG-6000 3种培养条件下,适宜质量浓度的硫代葡萄糖苷浸种均能提高青花菜的综合抗逆能力,其中蒸馏水培养和干旱胁迫下3.75 μg/mL硫代葡萄糖苷浸种提高青花菜综合抗逆能力较好;盐胁迫下7.50 μg/mL硫代葡萄糖苷浸种提高青花菜综合抗逆能力的效果最好。该研究仅比较了青花菜种子应用0~15.00 μg/mL硫代葡萄糖苷浸种24 h后,在蒸馏水、200 mmol/L NaCl 和15% PEG-6000 3种培养条件下,对其萌发及生理特性的影响。本试验在处理浓度和胁迫条件方面有较大的局限性,使用其他质量浓度(如0.5 μg/mL、20 μg/mL、50 μg/mL等)硫代葡萄糖苷浸种在不同胁迫时间(如2 h、4 h、6 h、8 h等)和不同程度盐胁迫(如100 mmol/L NaCl、300 mmol/L NaCl、400 mmol/L NaCl等)条件下的应用效果有待进一步探究。
4 结论
青花菜种子萌发时易遭受盐胁迫和干旱胁迫,导致其发芽率和发芽势降低,抑制胚根生长,严重影响青花菜后期生长发育。本研究结果表明,蒸馏水培养下,3.75 μg/mL硫代葡萄糖苷浸种可以显著提高青花菜幼苗的抗氧化酶活性,降低丙二醛含量;盐胁迫下,7.50 μg/mL硫代葡萄糖苷浸种可显著提升青花菜幼苗SOD、POD活性;干旱胁迫下,3.75 μg/mL硫代葡萄糖苷浸种可显著提高青花菜种子的发芽率及根冠比,降低丙二醛含量。由此可见,通过硫代葡萄糖苷浸种可提高青花菜种子发芽品质及耐盐、耐旱性,该研究结果可为利用硫代葡萄糖苷浸种提升青花菜综合抗逆性提供理论依据。
参考文献:
[1] 刘炳仁. 特种蔬菜高产栽培新技术[M]. 天津:天津科学技术出版社,2006:93-94.
[2] 张振超,潘永飞,戴忠良,等. 青花菜越冬设施高产栽培技术[J]. 长江蔬菜,2021(11):24-26.
[3] 杨佳航. 西兰花中萝卜硫苷的提取和纯化研究[D]. 杭州:浙江工商大学,2018.
[4] 江 敏. 萝卜硫苷的分离纯化工艺研究[D]. 合肥:合肥工业大学,2012.
[5] 梁志乐,汪宽鸿,杨 静,等. 硫代葡萄糖苷在十字花科植物应对非生物胁迫中的作用[J]. 园艺学报,2022,49(1):200-220.
[6] SALEHIN M, LI B, TANG M, et al. Auxin-sensitive Aux/IAA proteins mediate drought tolerance in Arabidopsis by regulating glucosinolate levels[J]. Nature Communications,2019,10(1):4021.
[7] MARTNEZ-BALLESTA M, MORENO-FERNNDEZ D A, CASTEJN D, et al. The impact of the absence of aliphatic glucosinolates on water transport under salt stress in Arabidopsis thaliana[J]. Frontiers in Plant Science,2015,6:524.
[8] GUO R, WANG X, HAN X, et al. Comparative transcriptome analyses revealed different heat stress responses in high- and low-GS Brassica alboglabra sprouts[J]. BMC Genomics,2019,20(1):269.
[9] 李向果,汝应俊,年 芳,等. 西兰花叶中硫代葡萄糖苷酸水解产物的体外和体内抗菌试验[J]. 甘肃农业大学学报,2014,49(2):55-60.
[10]张 睿,于建丽,宋 璇,等. 西兰花萝卜硫苷提取物的抑菌及体外免疫活性探究[J]. 食品研究与开发,2021,42(4):1-7.
[11]GAN R Y, LUI W Y, WU K, et al. Bioactive compounds and bioactivities of germinated edible seeds and sprouts:an updated review[J]. Trends in Food Science & Technology,2017,59:1-14.
[12]LINIC I, AMEC D, GRZ J, et al. Involvement of phenolic acids in short-term adaptation to salinity stress is species-specific among brassicaceae[J]. Plants,2019,8(6):155.
[13]张 毅,韩玉娥,张银乐,等. PEG-6000模拟干旱胁迫下3个青稞品种的萌发特性及抗旱性评价[J]. 江苏农业科学,2019,47(15):139-142.
[14]聂萌恩,宁 娜,张一中,等. 褪黑素对盐胁迫下高粱种子萌发的缓解效应及生理机制[J]. 种子,2023,42(4):31-40,63.
[15]支巨振,毕辛华,杜克敏,等. 农作物种子检验规程 GB/T 3543.1-3543.7-1995[M]. 北京:中国标准出版社,1995.
[16]李子芳,吴锡冬. 植物丙二醛含量测定试验设计方案[J]. 天津农业科学,2016,22(9):49-51.
[17]GIANNOPOLITIS C N, RIES S K. Superoxide Dismutases[J]. Plant Physiology,1977,59(2):309-314.
[18]KOCHBA J, LAVEE S, SPIEGEL-ROY P. Differences in peroxidase activity and isoenzymes in embryogenic and non-embryogenic ‘Shamouti’ orange ovular callus lines1[J]. Plant and Cell Physiology,1977,18(2):463-467.
[19]YANG Y, LIU Q, WANG G X, et al. Germination, osmotic adjustment, and antioxidant enzyme activities of gibberellin-pretreated Picea asperata seeds under water stress[J]. New Forests,2009,39(2):231-243.
[20]ENDARA M J, COLEY P D. The resource availability hypothesis revisited: a meta-analysis[J]. Functional Ecology,2011,25(2):389-398.
[21]SNCHEZ-PUJANTE P J, BORJA-MARTNEZ M, PEDREO M , et al. Biosynthesis and bioactivity of glucosinolates and their production in plant in vitro cultures[J]. Planta,2017,246(1):19-32.
[22]舒思晨. 外源MeJA和BR对番茄种子萌发的作用及其干旱胁迫下对幼苗生长的影响[D]. 乌鲁木齐:新疆农业大学,2023.
[23]SANJAYA G, ISOBEL A P, STEPPUHN H, et al. Seedling, early vegetative, and adult plant growth of oilseed rapes (Brassica napus L.) under saline stress[J]. Canadian Journal of Plant Science,2019,99(6):927-941.
[24]魏茜雅,林欣琪,梁腊梅,等. 褪黑素引发处理提高朝天椒种子萌发及幼苗耐盐性的生理机制[J]. 江苏农业学报,2022,38(6):1637-1647.
[25]MOHAMED Z, KADDA H, INES T, et al. Effect of salinity and drought on the germination of Lygeum spartum L. in the region of saida (western algerian steppe)[J]. Ekológia(Bratislava),2023,42(2):159-164.
[26]龙卫华,浦惠明,张洁夫,等. 甘蓝型油菜发芽期的耐盐性筛选 [J]. 中国油料作物学报,2013,35(3):271-275.
[27]胡竞渝,冯国军,刘大军,等. 外源腐胺对盐胁迫下菜豆种子萌发及抗性的影响[J]. 中国农学通报,2023,39(15):52-58.
[28]苏金强,谢晓清,林秋金,等. 外源赤霉素对盐胁迫下百香果种子萌发及幼苗生长的影响[J]. 广东农业科学,2023,50(10):66-74.
[29]蔚胜利,王秋雁,张群珧,等. 5-ALA浸种对干旱胁迫下紫花苜蓿种子萌发及幼苗生长的影响[J]. 草学,2022(6):22-31.
[30]范小玉,陈 雷,刘卫星,等. 氯化钙浸种对干旱胁迫下花生种子萌发及幼苗生理特性的影响[J]. 江苏农业科学,2022,50(8):101-105.
[31]邬 燕. 模拟干旱胁迫下葡萄的抗旱生理生化机理研究[D]. 呼和浩特:内蒙古农业大学,2023.
[32]孙三杰,李建明,姚勇哲,等. 亚低温与干旱胁迫对番茄幼苗渗透调节物质与抗氧化酶活性的影响[J]. 干旱地区农业研究,2012,30(3):154-158,164.
[33]MENG X, CAI J, DENG L, et al. SlSTE1 promotes abscisic acid-dependent salt stress-responsive pathways via improving ion homeostasis and reactive oxygen species scavenging in tomato[J]. Journal of Integrative Plant Biology,2020,62(12):1942-1966.
[34]李新蕾,李叶芳,李凤荣,等. 干旱胁迫对扁核木种子萌发及幼苗生理特性的影响[J]. 云南农业大学学报(自然科学),2020,35(4):682-687.
[35]刘建新,王金成,王瑞娟,等. 外源过氧化氢提高燕麦耐盐性的生理机制[J]. 草业学报,2016,25(2):216-222.
[36]赵 野,刘 威,王 贺,等. 外源CaCl2对盐胁迫下西伯利亚白刺活性氧代谢的影响[J]. 植物生理学报,2021,57(5):1105-1112.
[37]卢 环,王 成,曾玲玲,等. 不同浓度烯效唑浸种对绿豆生理及生长的影响[J]. 黑龙江农业科学,2023(8):50-57.
[38]张成冉,徐广海,宋朝玉,等. 糖浸种对盐胁迫玉米种子萌发和幼苗生长的影响[J]. 种子,2021,40(8):51-56.
[39]张 亮,李玉婷,夏文静,等. 盐胁迫下异甜菊醇浸种对油菜种子萌发和幼苗生长的影响[J]. 福建农业学报,2020,35(8):883-890.
[40]范小玉,陈 雷,刘卫星,等. 氯化钙浸种对干旱胁迫下花生种子萌发及幼苗生理特性的影响[J]. 江苏农业科学,2022,50(8):101-105.
(责任编辑:黄克玲)
