甘肃省甘蓝黑腐病的病原分离及鉴定
2024-09-11何树文魏兴颖许永锋杨成德王泽浩华军



摘要:为明确甘肃省张掖市甘蓝黑腐病的病原菌种类,采用平板划线法对采集到的甘蓝典型发病叶片进行病原菌分离、致病性测定及基因序列分析鉴定。结果表明,从具有典型黑腐病的甘蓝叶片上分离纯化获得6个分离株,其中菌株GL3-2为引起该病害的病原菌,为革兰氏阴性菌,菌落近似圆形,初呈淡黄色,后渐变为蜜黄色,菌落边缘整齐光滑, 有隆起,且具光泽;菌体多呈短杆状, 大小为(0.5~1.0)μm×(1.0~3.0)μm,无芽孢,单生或链生。根据培养性状、形态特征以及16S rDNA和特异性基因序列分析,确定致病菌菌株GL3-2为野油菜黄单胞菌野油菜致病变种(Xanthomonas campestris pv. campestris)。
关键词:甘蓝黑腐病菌;病原菌;分离;鉴定
中图分类号:S635;Q938 文献标志码:A 文章编号:2097-2172(2024)08-0779-06
doi:10.3969/j.issn.2097-2172.2024.08.015
Isolation and Identification of the Pathogen Causing Black Rot of
Cabbage in Gansu Province
HE Shuwen 1, WEI Xingying 2, XU Yongfeng 1, YANG Chengde 2, WANG Zehao 1, HUA Jun 1
(1. Zhangye Plant Protection and Phytosanitary Station, Zhangye Gansu 734000, China; 2. College of Plant Protection,
Gansu Agricultural University, Lanzhou Gansu 730070, China)
Abstract: To clarify the pathogen causing cabbage black rot in Zhangye City, Gansu Province, the cabbage leaves with typical disease symptoms were collected for pathogen isolation, purification by using plate scribing method. The pathogenicity was determined, and pathogen also was identified by morphological characteristics and molecular biology methods. The results showed that 6 isolates were obtained, among which GL3-2, Gram-negative, was pathogenic bacteria. Its colony was round, light yellow at first, and then honey yellow gradually. The colony edges were neat, smooth, and glossy; Most of the bacteria were short rods with the size of(0.5 to 1.0) μm ×(1.0 to 3.0) μm. No spores, solitary or chained, extremely solitary flagella. GL3-2 was identified as Xanthomonas campestris pv. campestris based on culture traits, morphological characteristics, 16S rDNA and specific genes sequence analysis.
Key words: Black rot of cabbage; Pathogen; Isolation; Identification
甘蓝(Brassicao leracea var. capitata)属十字花科芸薹属,草本植物,最早发现于地中海至北海沿岸地区,16世纪左右由俄罗斯以及东南亚地区传入我国,因其口感美味且具有极高的食用价值和营养价值而深受人们喜爱[1 ]。甘蓝在全球各地均广泛种植,尤其在中国更具有悠久的种植栽培文化历史,播种面积逐年增加[2 ],目前我国甘蓝播种总面积在93.6万hm2以上,且栽培总面积连年递增,在我国蔬菜的供给以及进出口贸易中占据市场主导地位[3 ]。黑腐病是危害甘蓝生长的重要病害之一,感病后导致幼苗期和成株期甘蓝不能正常生长。成株期感染,出现叶斑和叶脉变黑,影响植株正常生长,严重时可导致大面积死亡,给甘蓝生产带来极大危害。20世纪50年代末,甘蓝黑腐病(Xanthomonas campestris)在我国华北地区被首次发现,至20世纪70年代中期,甘蓝黑腐病在我国山西、北京以及山东等地区大面积传播,造成适宜甘蓝栽培的种植区域不断减少[4 ]。至20世纪80年代,甘蓝黑腐病在我国各栽培地区全面暴发,使得甘蓝及其他十字花科蔬菜产业受到严重威胁,发生严重时造成甘蓝减产近70%,极大地降低了甘蓝的品质和出口量,这也成为影响甘蓝经济效益的主要因素之一[5 ]。近年来,由于部分甘蓝生产地区多年连作,加之夏季阴雨连绵,甘蓝黑腐病大面积发生和传播,且逐年加重[6 ]。有关甘蓝黑腐病的研究国内外均有较多报道,但关于引起甘肃省甘蓝黑腐病的病原种类是否与国内外报道一致,还需有待进一步确定。因此,我们以采自甘肃省张掖市甘蓝种植基地具备甘蓝黑腐病典型特征的标本为研究对象,对其进行症状描述、病原菌分离、致病性测定及基因序列分析鉴定,以期为甘肃省甘蓝黑腐病田间诊断提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试材料 供试甘蓝品种为甘中11号,购自甘肃省兰州市安宁区农资市场。 供试甘蓝黑腐病标本采自甘肃省张掖市党寨镇汪家铺村甘蓝大田。将甘蓝种子经过浸种、催芽处理后,播种于直径为20 cm的花盆内(栽培基质为蛭石和营养土按体积比为1∶1的比例混合而成),每盆8~12株,出苗后每盆保苗6株。
1.1.2 仪器及器材 打孔器、接种针、灭菌锅、培养箱、培养皿、摇床、锥形瓶、移液枪、Ezup柱式基因组DNA抽提试剂盒(B518259-0100)由生工生物工程(上海)股份有限公司提供,光学显微镜(Ni-U 显微镜)由日本 Nikon 公司提供。
1.1.3 供试培养基 牛肉膏蛋白胨培养基(NA培养基):琼脂18 g,葡萄糖8 g,蛋白胨6 g,牛肉膏3 g,蒸馏水1 000 mL;NB培养基:琼脂18 g,酵母提取物5 g,胰蛋白胨10 g,蒸馏水1 000 mL,NaCl 10 g;LB培养基:NaCl 10 g,胰蛋白胨10 g,酵母提取物5 g,蒸馏水1 000 mL。
1.2 甘蓝黑腐病菌的分离
采用平板划线分离法进行分离。在无菌条件下,用灭菌的手术刀切取甘蓝叶片病健交界处组织(1 cm×1 cm),利用1 g/kg升汞表面消毒1 min,无菌水连续反复冲洗3次,置于无菌研钵中研磨后静置2~3 min,用灭菌的接种针(或灭菌竹签)蘸取上清液,并在NA培养基上划线,28 ℃下培养3~5 d,纯化后进行编号,并于4 ℃保存备用[7 ]。
1.3 致病性测定
采用致伤接种法进行致病性测定。将分离物接种于NA培养基上进行活化培养,28 ℃培养3~5 d。经活化的分离物接种至NB培养液中(50 mL),180 r/min振荡培养2~3 d,获得细菌悬浮液。利用分光光度计将菌悬液浓度调整至1×105个/mL(利用培养液进行稀释),并针刺致伤后喷雾接种,以接种无菌水的植株作为对照(CK),3次重复,室内保湿48 h后,逐天观察发病情况,对出现症状的植株进行再分离,将再分离物的菌落形态以及菌体形态等与接种分离物进行比较,利用柯赫氏法则进行病原菌鉴定。
1.4 病原菌的形态学观察
参照董汉松等[8 ]的《植病研究方法》将分离和纯化的甘蓝黑腐病菌株接种至NA培养基上,进行四区划线,观察单菌落的形态、大小以及颜色等,记录并拍照。对病原菌(菌龄18~24 h)进行革兰氏染色,观察病原菌菌体的颜色和形状,测量菌体的大小。
1.5 病原菌的16S rDNA基因序列分析鉴定
1.5.1 基因DNA的提取 参照Alvarez等[9 ]的方法,选用Ezup柱式基因组DNA抽提试剂盒及其方法提取病原菌的基因组DNA[10 ],具体方法按试剂盒说明进行。
1.5.2 PCR扩增 利用通用引物27F(5'-AGA GTTTGATCCTGGCTCAG-3)和1492R(5'-GGTTACCTTGTTACGACTT-3')进行16S rDNA的PCR扩增,参考杨丽萍等[11 ]的方法并经优化后应用于本试验。扩增体系为:Master Mix 22 μL;DNA 1 μL;1492R 1 μL;27F 1 μL。
扩增产物检测方法:取6 μL扩增产物在含有1.2%琼脂糖凝胶上进行电泳检测,由西安擎科生物工程有限公司对具特异性条带的扩增产物进行测序,所得序列于BLAST比对,用Mega 7.0采用邻接法(Neighbor-Joining methods)构建系统发育 树[12 ],初步确定病原菌的分类地位。
进一步利用野油菜黄单胞菌的特异性引物(DLH120,DLH125;Zup2309,Zup2310)进行扩增[13 ]。扩增体系参照张娜娜等[14 - 15 ]的方法进行。扩增产物进行琼脂糖凝胶电泳、测序和比较分析,最终构建系统发育树,以进一步鉴定。
1.6 数据处理
利用SPSS 25.0和DPS进行数据处理,用Excel 2016软件进行统计分析和作图。
2 结果与分析
2.1 病原菌分离及致病性测定
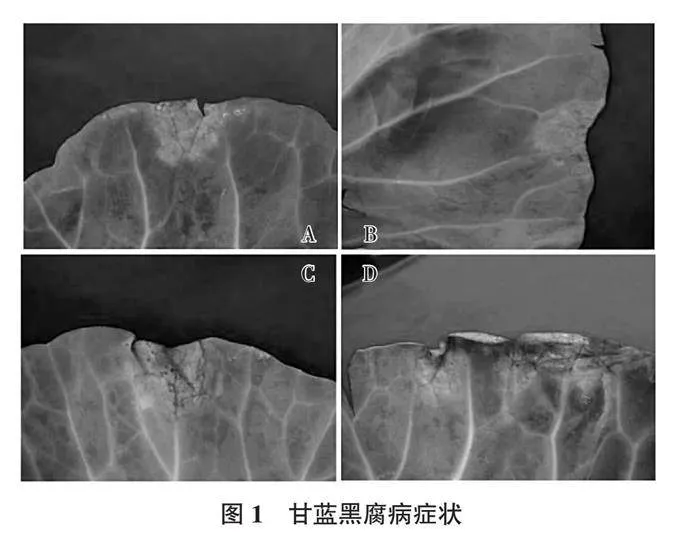
2.1.1 病害症状 甘蓝黑腐病苗期、成株期均可发病。幼苗染病,子叶水渍状,导致枯死或逐渐蔓延至真叶,最后整株枯死。成株期多从叶缘开始,逐步向内扩展,形成V型黄褐色病斑,健部界限不明显,且病斑周围组织变黄(图1A、图1B)。有时病菌沿叶脉向里扩展,形成网状黑脉或黄褐色大斑块;若病菌从植株伤口侵入,可在叶片的任何部位形成不规则形的黄褐色病斑;天气干燥时,叶片病斑干而脆;湿度较大时,发病部位腐烂,无臭味(图1C、图1D)。与已报道症状相似[16 - 17 ]。
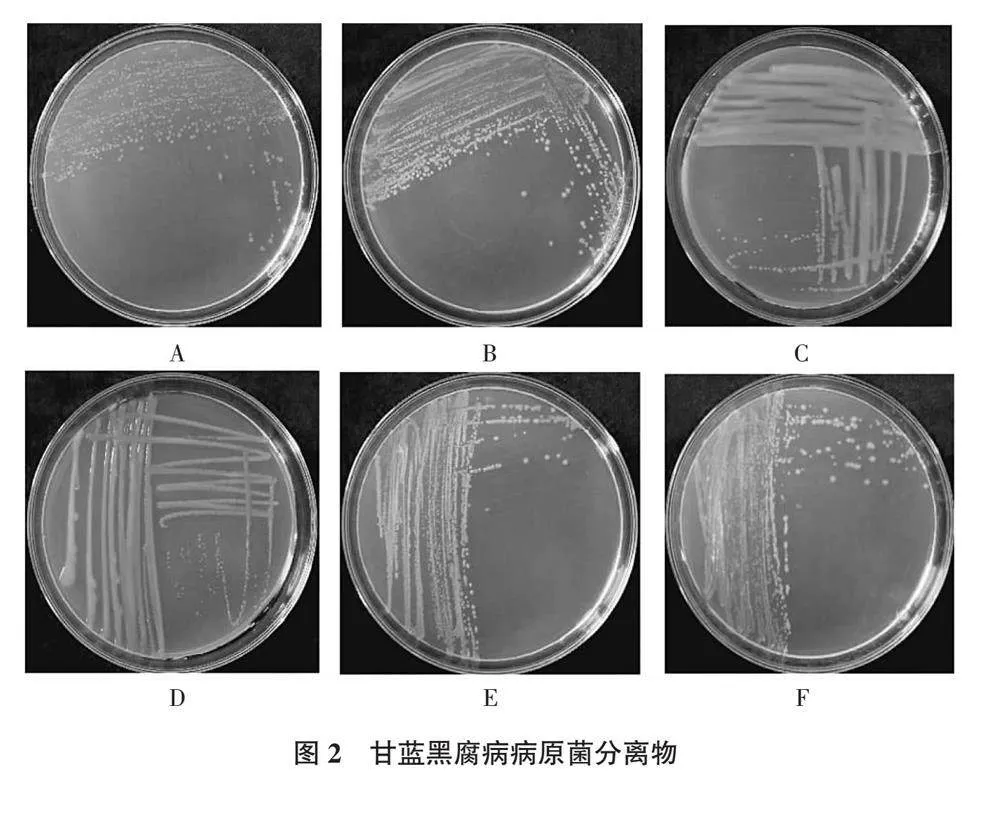
2.1.2 病原菌分离 从张掖市甘蓝种植地采集的具有典型黑腐病的甘蓝叶片上分离得到6个分离物,分别命名为GL1、GL2、GL3-1、GL3-2、GL4-1、GL4-2。其中GL1菌落圆形,边缘整齐,淡黄色(图2A);GL2菌落近圆形,浅黄色,表面干燥,粗糙(图2B);GL3-1菌落近圆形,扁平,浅白色,菌体湿润,半透明(图2C);GL3-2菌落圆形,偏小,凸起,黄色,有光泽(图2D);GL4-1菌落浅白色,光滑,扁平(图2E);GL4-2菌落圆形,边缘光滑,浅黄色,扁平(图2F)。
2.1.3 致病性测定 将6株分离物进行盆栽致病性测定结果(图3)可知,接种5~7 d后,接种分离物GL1、GL2、GL3-1的甘蓝叶片和CK均未发生明显症状,接种分离物GL4-1和GL4-2的甘蓝植株叶片在2 d后逐渐开始失水、萎蔫,皱缩(图3b、图3c);接种GL3-2的甘蓝植株叶片3 d后逐渐变黄,且出现病斑,病斑形状近似“V”字,多呈淡褐色,且边缘明显出现黄色晕圈(图3d、图3e、图3f),与田间甘蓝黑腐病的典型症状一致,并在发病植株上再次分离得到接种分离物GL3-2。依据柯赫氏法则[18 ],将GL3-2分离菌物确定为甘肃省甘蓝黑腐病病原菌。
2.2 病原菌鉴定
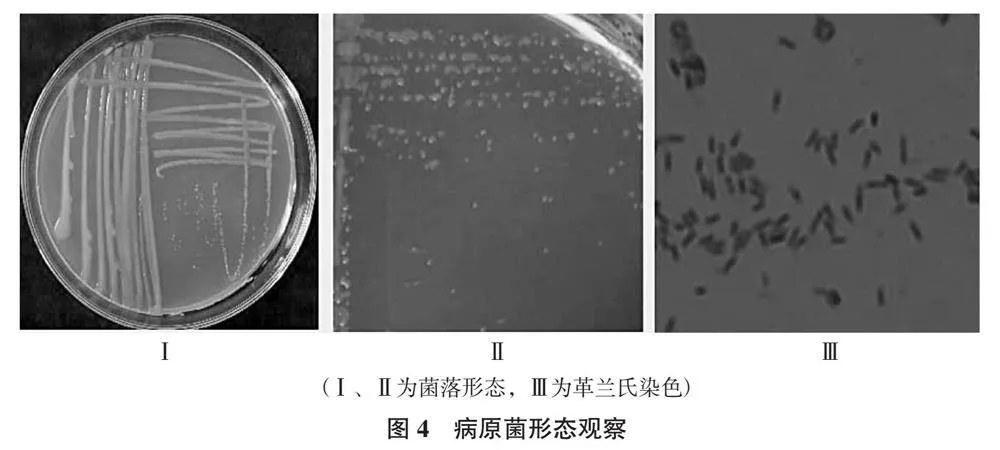
2.2.1 病原菌的菌落特征及形态 将病原菌GL3-2接种于NA平板上,28 ℃培养18~24 h后,菌落近圆形,前期淡黄色,后期逐渐变为蜜黄色,菌落边缘完整,有凸起,且具光泽。通过革兰氏染色呈阴性,菌体多数呈短杆状,大小为(0.5~1.0) μm×(1.0~3.0) μm,无芽孢,菌体多为单生或链生(图4Ⅰ、图4Ⅱ、图4Ⅲ)。
2.2.2 基因序列分析鉴定 以病原菌GL3-2的基因组DNA为模板,利用27F和1492R通用引物对16S rDNA进行扩增、测序,并在Blast中进行相似性分析、同源性比对,选择同源性较高的序列,使用Mega7.0软件采用邻接法(Neighbor-joining)构建系统发育树,病原菌与Xanthomonas campestris(登录号:KR708907.1)和X. arboricola pv. pruni(登录号:LC388643.1)等同源性均高(相似度达99%),且在系统发育树上聚在同一分支,初步鉴定为野油菜黄单胞杆菌属(Xanthomonas sp.)(图5)。为进一步分析鉴定,利用两对特异性引物扩增、测序和比较分析,构建系统发育树,结果(图6)表明GL3-2与X. campestris pv. campestris(登录号:CP142008.1、CP017319.1和AP019682.1等)的同源性均很高(相似度达99%),且在系统发育树上聚在一起。根据形态特征和分子生物学鉴定,确定GL3-2为野油菜黄单胞杆菌野油菜致病变种(X. campestris pv. campestris)。
3 讨论与结论
蔬菜是人类日常生活必需的副食品,其中,甘蓝是居民餐桌上的重要蔬菜之一。甘蓝所含营养成分相当丰富,其中包含有优质的蛋白质、纤维素、矿物质以及维生素等,且甘蓝所含的植化素还可预防癌症和冠状动脉等疾病[19 ]。据报道,20世纪80年代以前,甘肃省甘蓝年种植基数基本稳定于666.7 hm2左右。近年来,甘肃省甘蓝年种植面积约6 666.7 hm2,在全省各地均已有分布[20 - 21 ]。但是,随着高原夏菜大面积种植,甘蓝病害在很多种植区发生严重,严重影响甘蓝的质量和产量。
黑腐病的寄主范围相当广泛,主要危害甘蓝、结球白菜和不结球白菜等十字花科蔬菜[22 - 23 ]。本研究从张掖市甘蓝种植地采集的具有典型黑腐病的甘蓝叶片上分离得到细菌6个分离株,其中菌株GL3-2为引起该病害的病原菌,为革兰氏阴性菌,菌落近似圆形,初呈淡黄色,后渐变为蜜黄色,菌落边缘整齐光滑,有隆起,且具光泽;菌体多呈短杆状,大小为(0.5~1.0)μm×(1.0~3.0)μm,无芽孢,单生或链生。根据培养性状、形态特征以及生物学鉴定,明确了甘肃省甘蓝黑腐病病原菌GL3-2为野油菜黄单胞杆菌野油菜致病变种(Xanthomonas campestris pv. campestris),与芦燕[24 ]、解永梅等[25 ]、郑学立等[26 ]和Afrin等[27 ]对大白菜黑腐病和甘蓝黑腐病病原菌的鉴定结果一致。为了更精确地鉴别了病原菌种类,本试验参考Burlakoti等[13 ]的方法对甘蓝黑腐病的病原鉴定采用多基因序列分析方法,对黄单胞菌属中的不同种细菌进行快速检测,与金梦军等[28 ]通过利用多基因鉴定的方法对高寒草地青藏苔草拮抗内生细菌进行了鉴定类似,有效地避免了利用单一基因鉴定过程中出现的偶然现象。本研究结果为甘肃省甘蓝黑腐病的诊断提供了依据,也为后期进一步深入研究奠定基础。
参考文献:
[1] 黄德芬,李成琼,司 军,等. 甘蓝黑腐病生理小种划分及其抗病性鉴定研究进展[J]. 中国蔬菜,2011,(18):6-10.
[2] 张亚宏,张 岩,张桂荣,等. 优质甘蓝型冬油菜新品种天油18号选育报告[J]. 寒旱农业科学,2023,2(11):1013-1016.
[3] 王 新. 花椰菜黑腐病的发生症状及防治措施[J]. 上海蔬菜,2018(2):45;79.
[4] 韩风庆,李占省,刘玉梅,等. 青花菜黑腐病发病规律及综合防治措施[J]. 中国蔬菜,2019(11):98-101.
[5] 张大为,刘 烨,李继平,等. 兰州市高原夏菜病虫害种类调查及防治现状[J]. 甘肃科技纵横,2019,48(9):15-17.
[6] 胡 燕,周 娜,郑 阳,等. 甘蓝黑腐病研究进展[J]. 南方农业,2019,13(1):63-65.
[7] 胡 燕,周 娜,郑 阳,等. 甘蓝黑腐病的发生及综合防治[J]. 植物医生,2018,31(12):35-36.
[8] 董汉松,刘志恒,朱建兰. 植病研究法[M]. 北京:中国农业出版社,2012.
[9] ALVAREZ A M, BENEDICT A A, MIZUMOTO C Y, et al. Serological, pathological, and genetic diversity among strains of Xanthomonas campestris infecting crucifers[J]. Phytopathology, 1994, 84: 1449-1457.
[10] 魏立娟. 辣椒炭疽病菌的鉴定、综合防治及互作后辣椒基因差异表达[D]. 兰州:甘肃农业大学,2019.
[11] 杨丽萍,金梦军,崔凌霄,等. 甘肃省樱桃黑斑病病原菌的分离及鉴定[J]. 果树学报,2020,37(6):891-899.
[12] 丁嘉仪,邓宇慧,李国豪,等. 毛竹耐铅内生细菌分离及其16S rDNA鉴定[J]. 寒旱农业科学,2023,
2(8):740-744.
[13] BURLAKOTI R R, CHEN J, HSU C, et al. Molecular characterization,comparison of screening methods, and evaluation of cross-pathogenicity of black rot(Xanthomonas campestris pv. campestris) strains from cabbage, choy sum,leafy mustard and pakchoi from Taiwan[J]. Plant Pathology,2018, 67(7): 1589-1600.
[14] 张娜娜,温晓蕾,李双民,等. 三种镰刀菌引起的板栗内腐病病原菌鉴定[J]. 中国农业科技导报,2022,
24(7):117-122.
[15] 张娜娜,李双民,温晓蕾,等. 板栗红粉病病原菌鉴定及其生物学特性研究[J]. 中国农业科技导报,2021,23(7):145-52.
[16] 刘志恒. 十字花科蔬菜软腐病和黑腐病[J]. 新农业,2002(8):38-39.
[17] 王迪轩. 十字花科蔬菜黑腐病无公害防治[J]. 当代蔬菜,2004(4):35.
[18] 唐 伟,张成玲,王 芳,等. 甘薯基腐病病原鉴定及生长特性测定[J]. 南方农业学报,2022,53(7):1917-1924.
[19] 王 芳,韩浩章,张 颖. 不同药剂对多肉植物黑腐病和炭疽病的防效研究[J]. 安徽农学通报,2020,
26(7):86-87;98.
[20] 梁元凯,夏正丽,刘润安,等. 甘蓝黑腐病识别与综合防控技术[J]. 西北园艺(蔬菜),2016(1):43-44.
[21] 郭凤霞. 甘肃省甘蓝生产现状与发展对策[J]. 甘肃农业科技,1998(7):31-32.
[22] 李永镐,徐丽波. 甘蓝黑腐病苗期抗病性鉴定方法的研究[J]. 东北农学院学报,1990,21(2):125-129.
[23] 吴国顺. 日本对几种蔬菜病害抗病性鉴定方法的研究[J]. 中国蔬菜,1994(1):59-60.
[24] 芦 燕. 大白菜黑腐病病原菌鉴定和抗病性鉴定方法研究[D]. 杨凌:西北农林科技大学,2008.
[25] 解永梅,张成玲,赵永强,等. 山东省大白菜黑腐病病原的鉴定及其生物学特性的研究[J]. 山东农业科学,2007(6):68-70.
[26] 郑学立,谢鑫鑫,林 峰,等. 福建地区不结球白菜黑腐病病原菌的分离与初步鉴定[J]. 福建农业学报,2017,32(12):1335-1340.
[27] AFRIN K S, RAHIM M A, RUBEL M H, et al. Development of race-specific molecular marker for Xanthomonas campestris pv. campestris race 3, the causal agent of black rot of rucifers[J]. Canadian Journal of Plant Science, 2018, 98(5): 1119-1125.
[28] 金梦军,李珊珊,田文波,等. 高寒草地青藏苔草拮抗内生细菌筛选、鉴定及其促生作用测定[J]. 植物保护学报,2019,46(4):779-786.
