当归根际土壤中木霉菌的分离鉴定及拮抗作用
2024-09-11柳利龙张爱琴张环米永伟胡晓芬李玉芳

摘要:收集甘肃省道地中药材当归根际土壤,采用平板稀释法分离土壤中木霉菌株,利用平板对峙法测定其拮抗作用,结合形态学特征及ITS序列比对鉴定木霉菌株分类地位,以期筛选具有生防作用的菌株并明确其拮抗作用。结果表明,从甘肃省当归根际土壤中分离得到21株木霉菌株,筛选出1株对靶标菌拮抗效果最好的木霉菌株TD-5,鉴定为长枝木霉(Trichoderma longibrachiatum)。TD-5对茄病镰刀菌(Fusarium solani)拮抗作用最好,抑制率为83.31%;对首都叶点霉菌(Phyllosticta capitalensis)的拮抗作用最差,抑制率为24.55%;对三线镰刀菌(Fusarium tricinctum)和胶孢炭疽菌(Colletotrichum gloeosporioides)的拮抗作用介于二者之间。菌株TD-5的挥发性代谢产物对茄病镰刀菌的抑菌效果最好(抑制率79.44%),对胶孢炭疽菌的抑菌效果较差(抑制率64.99%);其难挥发性代谢产物对三线镰刀菌的抑菌效果最好(抑制率70.72%),对茄病镰刀菌的抑菌效果最差(抑制率31.12%)。
关键词:当归;木霉菌;生防菌;分离鉴定;拮抗作用
中图分类号:S567.239 文献标志码:A 文章编号:2097-2172(2024)08-0774-05
doi:10.3969/j.issn.2097-2172.2024.08.014
Isolation, Identification and Antagonism of Biocontrol Trichoderma spp.
from Rhizosphere Soil of Angelica sinensis
LIU Lilong 1, 2, ZHANG Aiqin 1, ZHANG Huan 1, MI Yongwei 3, HU Xiaofen 4, LI Yufang 1
(1. Institute of Animal Husbandry, Pasture and Green Agriculture, Gansu Academy of Agricultural Sciences, Lanzhou Gansu 730070, China; 2. Wheat Research Institute, Gansu Academy of Agricultural Sciences, Lanzhou Gansu 730070, China; 3. Institute of
Chinese Herbal Medicines, Gansu Academy of Agricultural Sciences, Lanzhou Gansu 730070, China; 4. Forest Farm
of Tange, Xiaolong Mountain Forestry Protection Center of Gansu Province, Tianshui Gansu 741300, China)
Abstract: Soil samples were collected from the rhizosphere of authentic medicinal herb Angelica sinensis in Gansu Province, and Trichoderma spp. strains were isolated using the dilution coating method. The antagonistic effects were determined using the plate confrontation method, and the classification of Trichoderma spp. strains were identified through morphological characteristics and ITS sequence alignment, aiming to screen strains with biocontrol potential and clarify their antagonistic effects. The results showed that 21 Trichoderma spp. strains were obtained by isolated from the rhizosphere soil of Angelica Sinensis in Gansu Province, 1 strain with the best inhibitory effect on the target pathogens was screened and identified as Trichoderma longibrachiatum strain TD-5. TD-5 had the strongest antagonistic effect on Fusarium solani with an inhibitory rate at 83.31%, antagonistic effect against Phyllosticta capitalensis was the worst(inhibitory rate was 24.55%), the antagonism effects against Fusarium tricinctum and Colletotrichum gloesosporioides were between them. The volatile metabolites of TD-5 were most sensitive to Fusarium solani (inhibitory rate was 79.44%), the sensitivity to Colletotrichum gloesosporioides was the lowest (inhibitory rate was 64.99%); Non-volatile metabolites from strain TD-5 were most sensitive to Fusarium tricinctum(inhibitory rate was 70.72%), the sensitivity to Fusarium solani was the lowest (inhibitory rate was 31.12%).
Key words: Angelicae sinensis; Trichoderma spp.; Biocontrol bacteria; Isolation and identification; Antagonism
当归(Angelica sinensis)是伞形科当归属多年生草本植物,以干燥根入药,有活血、调经、镇痛、抗肿瘤和抗抑郁等功效[1 ]。甘肃道地中药材“岷归”主产区集中在定西、陇南等地区,种植历史悠久,效佳质优[2 ]。近年来,随着中医药大健康产业的快速发展,当归需求量逐年增加,已成为促进当地经济和产业发展的重要支柱。然而,随着种植规模的逐步扩大,因连作等不规范栽培方式导致的当归土传病害发生日趋严重。化学农药是防治当归病害最有效的方式之一,但长期不科学、大量和单一使用会引起病原菌的抗药性、当归产品品质下降和质量安全等问题[3 ]。利用生物防治替代化学农药是目前防治植物病害最安全、可持续、对环境友好的方法,对防治中药材土传病害具有重要意义。
木霉菌(Trichoderma spp.)作为植物病害生物防治中应用和研究较多的一类真菌,大量存在于土壤、植物根部和各种环境中[4 ],其因具有拮抗、重寄生和生态竞争等作用,能够抑制植物病原菌的生长。近年来,利用木霉菌防治中药材病害已有较多报道。肖春萍等[5 ]从人参健株根际土壤中筛选出的长枝木霉(Trichoderma longibrachiatum)和多孢木霉(Trichoderma polysporum)对人参7种病原菌的抑菌率达46.67%以上;潘争艳等[6 ]从辽宁省20种药用植物土壤中分离筛选出4株对5种靶标菌抑制率大于70%的木霉菌;丁万隆等[7 ]开展木霉菌株对中药材病原菌的抑菌试验,通过温室盆栽和田间防治两种处理方式,发现木霉制剂对温室盆栽北沙参菌核病的防治效果高达83.6%,对黄芪根腐病的田间防治达效果高达80%,表明可以用生防木霉制剂替代多菌灵等常用农药。研究和实践表明,木霉菌对部分中药材土传病害的防治经济有效,且越来越受到人们的重视,但利用木霉菌及其制剂防治当归病害的相关报道较少。本研究拟从甘肃省道地中药材当归根际土壤中分离筛选对当归土传病害拮抗作用较好的木霉菌株,以期为当归土传病害的防治提供生物防菌资源。
1 材料与方法
1.1 供试材料
供试土样采集于甘肃省当归主要种植区域的定西市渭源县(会川镇、五竹镇、路园镇)、漳县(三岔镇、大草滩镇、金钟镇)、岷县(梅川镇、麻子川镇、秦许乡)和陇南市宕昌县(哈达铺镇、阿坞镇、南河镇),共4个县12个乡(镇)。每个采集地随机选取当归田3块,采用五点混合采样法,挖取5~20 cm土层内的当归根系,先抖落大块不含根系的土壤,然后取根系表面1~2 mm的细粒土样约100 g,混合均匀经自然风干后过筛(16目标准筛,孔径1 mm),装入无菌密封袋储存于4 ℃或零下20 ℃冰箱备用。
供试靶标菌株:茄病镰刀菌(Fusarium solani)和三线镰刀菌(Fusarium tricinctum)分离自采集的当归根际土壤,为当归土传病害病原菌[8 ];胶孢炭疽菌(Colletotrichum gloesosporioides)和首都叶点霉菌(Phyllosticta capitalensis)能侵染芒果、香蕉、火龙果及蜜柚等水果,均分离自采集的当归根际土壤[9 - 10 ],其对当归是否具有致病性需进一步测定。以上4种靶标菌均保存于甘肃省农业科学院畜草与绿色农业研究所(甘肃省农业科学院农业质量标准与检测技术研究所)微生物实验室。
供试培养基:马丁式-孟加拉红培养基(葡萄糖10 g、蛋白胨5 g、磷酸二氢钾5 g、七水硫酸镁0.5 g、琼脂15 g、蒸馏水1 L、1%孟加拉红水溶液3.3 mL)用于分离木霉菌菌株,并加入头孢霉素(200 mg/L)作为细菌抑制剂(培养基温度40 ℃左右);PDA培养基(马铃薯葡萄糖固体培养基,马铃薯200 g、葡萄糖20 g、琼脂15~20 g、蒸馏水1 L)用于木霉菌筛选和拮抗作用分析。
1.2 试验方法
1.2.1 木霉菌的分离纯化 采用稀释涂布法分离木霉菌株[11 ]。准确称取待测土样10 g,放入装有90 mL无菌水的三角瓶(150 mL)中,加入20 g石英砂,置于25 ℃摇床上130~160 rpm振荡2.5 h,使土壤中的微生物均匀分散,静置10 min,即为稀释度为1×10-1 g/mL的土壤悬浮液,再依次使用无菌水稀释至1×10-2、1×10-3、1×10-4 g/mL备用。分别吸取各梯度的稀释液100 ?滋L,采用“涂布法”均匀涂布于马丁式-孟加拉红培养基,置于25 ℃光照和黑暗(16/8 h)条件下培养3 d,挑取培养基上疑似木霉菌菌落边缘的少量菌丝接种于PDA培养基培养,并对培养菌株编号。长出菌落后,挑取菌落边缘的菌丝转移至新的PDA培养基进行纯化培养得到单一菌株。单一菌株接种于斜面培养基培养6 d后在4 ℃下保存备用。
1.2.2 木霉菌拮抗病原菌的室内平板测定 采用平板对峙培养法[12 ],将靶标菌株和分离纯化得到的木霉菌菌株接种于PDA培养基上,于28 ℃恒温条件下活化3 d后,用直径5 mm的打孔器在病原菌和木霉菌菌落边缘打取菌饼,将木霉菌菌饼分别与4种靶标菌菌饼接种于PDA培养基两端,两菌饼间隔6 cm,以只接种病原菌为对照,3次重复。28 ℃恒温下培养,每天定时测量病原菌菌落生长半径,培养7 d后计算病原菌生长抑制率。
抑制率(%)=[对照菌落半径(cm)-处理菌落半径(cm)]/对照菌落半径(cm)×100
1.2.3 木霉菌代谢产物对病原菌的抑菌作用测定
木霉菌挥发性代谢产物对病原菌的抑菌作用测定:采用对扣培养法[13 ],将木霉菌菌饼接种于PDA培养基中央,28 ℃恒温培养2 d后,上方盖双层无菌圆形玻璃纸(广州艾诺利高新材料有限公司,直径约10 mm),再将刚接种病原菌菌饼的PDA培养基扣于其上并密封,28 ℃恒温培养5 d。以空白PDA培养基与病原菌对扣培养为对照,3次重复,采用1.2.2描述的方法计算抑制率(下同)。
木霉菌难挥发性代谢产物对病原菌的抑菌作用:采用圆盘滤膜法[13 ],在PDA培养基上铺双层无菌玻璃纸,中央接种已活化3 d的木霉菌饼,28 ℃恒温培养。待木霉菌丝长满玻璃纸前,移去玻璃纸并接种已活化的病原菌,28 ℃恒温培养5 d。以未培养过木霉菌的PDA培养基接种病原菌作为对照,每个处理3次重复,计算抑制率。
1.2.4 木霉菌鉴定 形态学特征鉴定:将木霉菌株接种在PDA培养基活化后,打取菌饼接种于PDA培养基中央,28 ℃恒温培养3 d后,在菌落颜色出现明显变化期间逐日挑取培养物制片,在光学生物显微镜(OLYMPUS BX43,日本奥林巴斯株式会社)下观察子实体形态特征并拍照。参照杨合同著的《木霉分类与鉴定》[14 ],根据菌丝体颜色、孢子形态、产孢结构等特征初步确定木霉菌株的分类地位。
分子生物学鉴定:按上述方法,将培养5 d后的木霉菌,委托成都罗宁生物科技有限公司提取DNA,选用rDNA-ITS通用引物:ITS4(5'-TCCTCCGCTTATTGATATGC-3')和ITS5(5'-GGAAGTAAAAGTCGTAACAAGG-3')进行PCR扩增。PCR扩增反应体系25 μL:2×PCR MasterMix 12.5 μL、DNA模板1 μL、上下游引物(10 μmol/L)各1 μL、ddH2O 9.5 μL。PCR扩增反应程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸5 min。对扩增产物进行测序,将获得的序列通过MIST(Multilocus Identification System for Trichoderma)进行联合比对分析(http://mmit.china-cctc.org/,参数设置Identity值98,Expect Value值0.000 01,Coverage值0.8)[15 ]。同时,应用MEGA 5.1软件的Neighbor-Joining法构建系统发育树,以确定该菌与同属菌株间的亲缘关 系[16 ]。Nectria berolinensis CBS 127382作为外群。
1.2.5 数据统计与分析 采用Excel 2007进行数据处理,采用DPS v7.05软件进行统计分析,应用Duncan新复极差法进行差异显著性分析。
2 结果与分析
2.1 木霉菌的分离结果
从采集的36份土壤样品中经分离、纯化共得到21株木霉菌菌株。其中从采自定西市渭源县和岷县的土样中分离得到的木霉菌最多,均为6株;采自陇南市宕昌县的土样中分离到的最少,为4株;从来自定西市漳县的土样中分离到的菌株为5株。
2.2 木霉菌对病原菌的拮抗效果
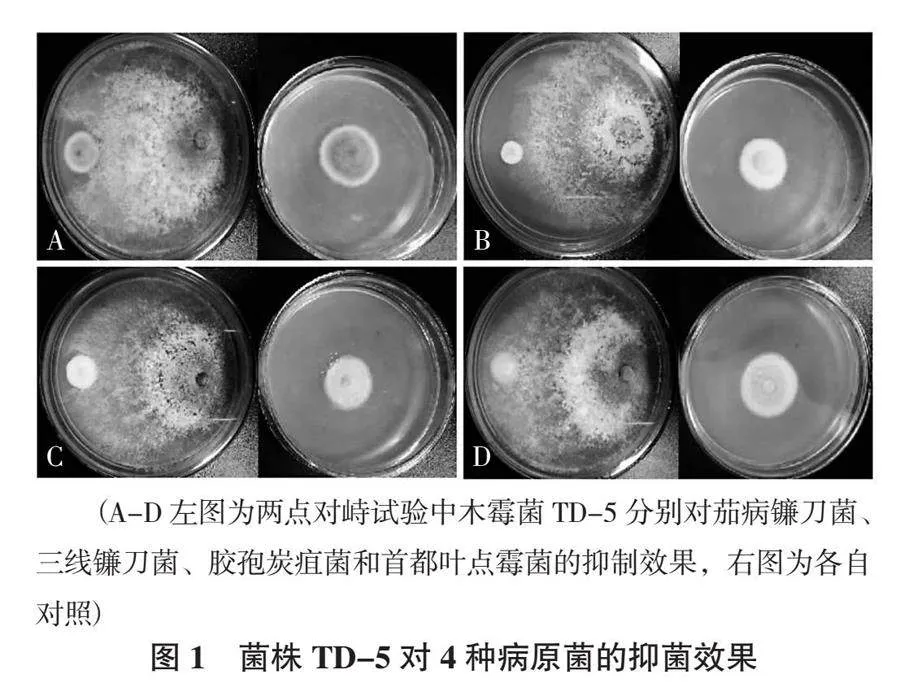
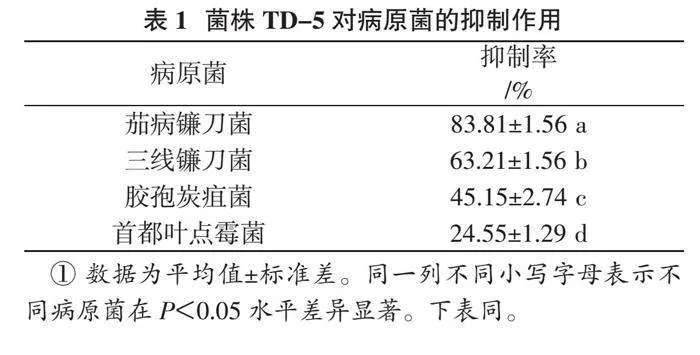
以茄病镰刀菌、三线镰刀菌、胶孢炭疽菌和首都叶点霉菌作为靶标菌株,利用对峙培养筛选得到1株对靶标菌抑制效果最好的木霉菌菌株TD-5。从表1可以看出,菌株TD-5对4种病原菌的抑制率差异显著(P < 0.05),对茄病镰刀菌拮抗作用最好,抑制率达83.31%;对首都叶点霉菌的拮抗作用最差,抑制率为24.55%;对三线镰刀菌和胶孢炭疽菌的抑制率分别为63.21%和45.15%。从木霉菌生长趋势可见,其菌丝生长迅速,能迅培养3 d即可观察到,病原菌的生长明显受到限制,4 d时木霉菌包围整个病原菌,5 d后被包围的病原菌边缘塌陷几乎不再生长(图1)。
2.3 菌株TD-5代谢产物对病原菌的抑菌作用
菌株TD-5挥发性与难挥发性代谢产物对4种病原菌均有抑制作用(表2)。菌株TD-5挥发性代谢产物对4种病原菌的抑制效果均在60.00%以上,对2种镰刀菌最为敏感(抑制率均高于75.00%)。对茄病镰刀菌的抑制率最高,为79.44%;对胶孢炭疽菌的抑制率最低,为64.99%,且二者差异显著(P < 0.05)。对三线镰刀菌和首都叶点霉菌的抑制率分别为75.69%和70.15%。菌株TD-5难挥发性代谢产物对三线镰刀菌最为敏感,抑制率为70.72%;对茄病镰刀菌的敏感度最低,抑制率为31.12%,且二者之间差异显著(P < 0.05);对首都叶点霉菌和胶孢炭疽菌的抑制率分别为44.15%和46.50%,两者差异不显著。
以上结果表明,菌株TD-5挥发性和难挥发性代谢产物对当归根腐病主要病原菌三线镰刀菌的抑制率均高于70.00%,生防潜力较大。
2.4 菌株TD-5的形态学鉴定
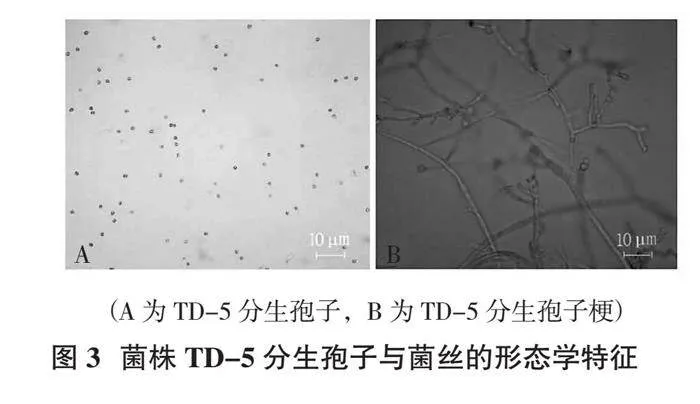
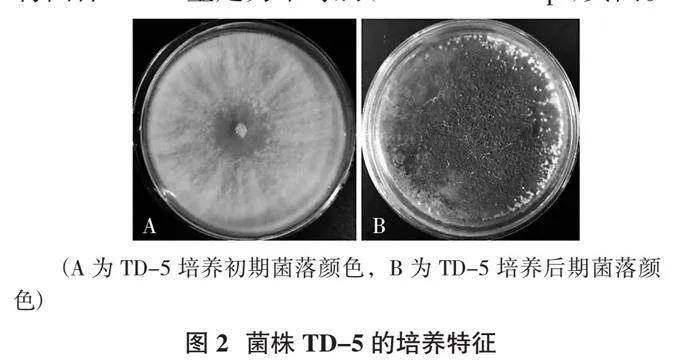
菌株TD-5在PDA培养基上培养3 d,菌丝即可长满整个培养皿。初期菌落呈白色,随着菌丝不断地生长,菌落上长出稠密的分生孢子堆,呈黑绿色,逐渐覆盖整个菌落;4 d后有白色杂斑点出现,同时伴有不太明显的同心轮纹。在培养皿边缘,可形成少量垫状聚合体结晶(图2)。分生孢子呈绿色,椭圆形,孢子壁光滑;分生孢子梗有发育强壮的中轴,在中轴上向顶端产生单生的分生孢子梗,随着离顶端距离的延伸,产生成对长度逐渐增加的二次分枝,瓶梗直接产生于二次分枝。分生孢子梗单生,圆柱形(图3)。据此,初步将菌株TD-5鉴定为木霉属(Trichoderma sp.)真菌。
2.5 菌株TD-5的分子生物学鉴定
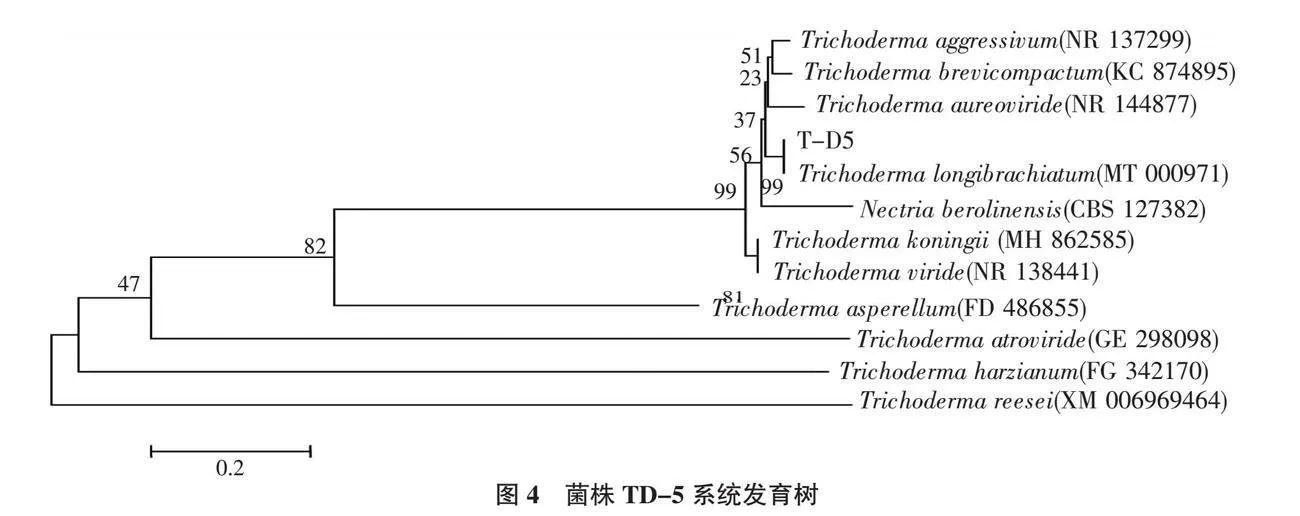
将测序获得的菌株TD-5的rDNA-ITS序列输入MIST,按照已设置的检索参数对序列同源性进行比对分析,选择Nectria berolinensis作为外群构建系统发育树(图4)。结果表明,菌株TD-5与Trichoderma longibrachiatum(MT 000971)位于同一进化分枝,且序列同源性为99%。结合形态学特征和分子生物学鉴定结果,确定菌株TD-5为长枝木霉(Trichoderma longibrachiatum)。
3 讨论与结论
利用分离自中药材根际土壤中的生防木霉菌来防治中药材土传病害,具有重要的科学研究和应用价值。研究发现,从药用植物根际土壤分离筛选出来的生防木霉菌如绿色木霉(Trichoderma viride)、长枝木霉(Trichoderma longibrachiatum)、多孢木霉(Trichoderma polysporum)和哈茨木霉(Trichoderma harzianum)等对中药材人参、麦冬丹参、川芎和黄芪等土传病害都有较好的防治效果[5 - 7 ]。本研究以甘肃道地中药材当归土传病害的生物防治研究为切入点,从甘肃省当归根际土壤中分离筛选出1株拮抗作用好的木霉菌株TD-5,并鉴定为长枝木霉,其对当归土传病害的病原菌茄病镰刀菌拮抗效果达83.31%,生防潜力大。
一般木霉产生的抗生物质以吡喃酮类、胶霉毒素等最多,且对植物病原真菌有广谱拮抗活性。深绿木霉、哈茨木霉和康宁木霉均能产生挥发性物质吡喃酮-6-戊基-2H-吡喃-2-酮(简称6PP),对立枯丝核菌、尖孢镰刀菌和灰葡萄孢均有抑菌活性,胶霉毒素对终极腐霉和立枯丝核菌等植物病原真菌具有强烈的抑制活性[17 ]。本研究发现,菌株TD-5的挥发性代谢产物对茄病镰刀菌和三线镰刀菌的抑制率最高,难挥发性代谢产物对三线镰刀菌的抑制率最高,且抑制率均高于70%。
综上,分离自甘肃省道地中药材当归根际土壤的长枝木霉TD-5拮抗效果好,生防潜力大,可作为当归土传病害防治的生防菌资源。
参考文献:
[1] 徐小琼,张小波,陈 娟,等. 定西市栽培当归生态适宜性研究[J]. 中华中医药杂志,2021,36(3):1586-1589.
[2] 杨 涛,姚阳阳,张永涛,等. 不同植物激素和微生物对重茬地当归产量和品质的影响[J]. 中药材,2021,
44(5):1065-1070.
[3] 陈静梅,严 辉,周桂生,等. 当归农药残留研究进展[J]. 中国中药杂志,2022,47(6):1445-1452.
[4] 尤佳琪,吴明德,李国庆. 木霉在植物病害生物防治中的应用及作用机制[J]. 中国生物防治学报,2019,
35(6):966-976.
[5] 肖春萍,杨利民,韩 梅,等. 人参主要病原菌生防真菌的筛选及鉴定[J]. 西北农林科技大学学报(自然科学版),2016,44(7):181-192;201.
[6] 潘争艳,傅俊范,马 亮,等. 辽宁省药用植物根际土壤木霉属真菌的多样性[J]. 浙江大学学报(农业与生命科学版),2010,36(4):405-410.
[7] 丁万隆,程惠珍,陈 君. 应用木霉制剂防治几种药用植物病害的研究[J]. 中国中药杂志,2003(1):28-31.
[8] LIU Y, TIAN Y, ZHAO X, et al. Identification of Pathogenic Fusarium spp. Responsible for Root Rot of Angelica sinensis and Characterization of Their Biological Enemies in Dingxi, China[J]. Plant Disease, 2022, 106(7): 1898-1910.
[9] 刘丽萍,高 洁,李 玉. 植物炭疽菌属Colletotrichum真菌研究进展[J]. 菌物研究,2020,18(4):266-281.
[10] 罗金水,郑域茹,卢松茂,等. 琯溪蜜柚亚洲柑橘叶点霉与首都叶点霉ITS-RFLP快速鉴定[J]. 福建农业学报,2018,33(2):195-198.
[11] 张树武,徐秉良,刘 佳,等. 一种植物根际盐碱土中木霉菌的快速分离方法:201611048011[P]. 2016-11-21.
[12] 李 琳,张雅梅,张祥辉,等. 生防棘孢木霉T31菌株的分离筛选及其生物学特性[J]. 植物保护学报,2014,41(1):54-60.
[13] 李小杰,李成军,姚晨虓,等. 拮抗烟草疫霉菌的木霉菌株筛选鉴定及防病促生作用研究[J]. 中国烟草科学,2020,41(3):65-70.
[14] 杨合同. 木霉分类与鉴定[M]. 北京:中国大地出版社,2009.
[15] DOU K, LU Z, WU Q, et al. MIST: a Multilocus Identification System for Trichoderma[J]. Appl Environ Microbiol, 2020, 86(18): e01532-20.
[16] 李 翟,姜大成,肖春萍,等. 木霉菌的分离、鉴定及对人参根系分泌物的趋化性响应[J]. 中药材, 2022,45(1):32-36.
[17] 李纪顺,陈 凯,杨合同,等. 木霉抗生性代谢产物研究进展[J]. 农药,2010,49(10):713-716;719.
