矾根胚性愈伤组织诱导与植株再生
2024-09-11任俞新






摘要:为了建立矾根组培快繁体系,以矾根去顶尖幼嫩顶芽为外植体,研究不同培养基对胚性愈伤组织诱导、胚性愈伤组织增殖以及植株再生的影响。结果表明,愈伤组织最佳培养基为MS+2.4-D 3.0 mg/L+6-BA 0.3 mg/L,愈伤诱导率达到93.0%,团块较大,结构较松散,有颗粒状态,个别团块呈水浸状;以最优胚性愈伤组织增殖培养基为MS+2.4-D 2.0 mg/L+6-BA 0.2 mg/L进行扩增,愈伤组织发育较好,结构较松散,颗粒状疣突分明,水分较少,呈淡黄绿色。胚状体分化最佳培养基为MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+IBA 0.2 mg/L,胚状体诱导率达91.8%。对幼根发育不良的植株,在1/2MS+IBA 0.1 mg/L+IAA 0.1 mg/L培养基上进行生根培养效果好,生根率100%,平均根数5.5条,根长2~3 cm,苗高4.1 cm。
关键词:矾根;去顶尖幼嫩顶芽;胚性愈伤组织;诱导;植株再生
中图分类号:S682 文献标志码:A 文章编号:2097-2172(2024)08-0747-05
doi:10.3969/j.issn.2097-2172.2024.08.009
Study on Embryonic Callus Induction and Plant Regeneration of
Heuchera micrantha
REN Yuxin
(Gansu Forestry Professional Technology College, Tianshui Gansu 741020, China)
Abstract: In order to establish tissue culture and rapid propagation system of Heuchera micrantha, using the young terminal buds of Heuchera micrantha as explants, this study investigated the effects of different media on the induction, proliferation, and regeneration of embryogenic callus tissues. The results showed that the medium MS+2.4-D 3.0 mg/L+6-BA 0.3 mg/L had a high callus induction rate of 93.0%. The callus formed was large, loosely structured, and grainy but immature, with some clusters appearing water-soaked. For the proliferation of embryogenic callus tissues, the medium MS+2.4-D 2.0 mg/L+6-BA 0.2 mg/L resulted in well-developed callus tissues that were loosely structured with distinct granular nodules and less water content, presenting a light yellow-green color. The differentiation medium MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+IBA 0.2 mg/L achieved a differentiation rate of 91.8%. For plants with poorly developed young roots, rooting culture on 1/2 MS+IBA 0.1 mg/L+IAA 0.1 mg/L resulted in a rooting rate of 100%, with an average of 5.5 roots per plant, root lengths of 2 to 3 cm, and plant height of 4.1 cm.
Key words: Heuchera micrantha; Terminal bud; Embryogenic callus; Induction; Plant regeneration
矾根(Heuchera micrantha)又名珊瑚铃,为虎耳草科矾根属多年生草本花卉[1 ],原产美洲中部,近年来在北方园林绿化中大量应用。矾根叶色艳丽繁多,极具观赏价值,可盆栽种植后置于室内。园林中多在乔灌木下种植,可用于做花境、花坛、地被及庭院绿化等,也可用于土壤修复[2 ]。矾根耐寒,在肥沃湿润排水良好的土壤中生长良好,喜中性偏酸、疏松透气的土壤,适宜半遮阴的生长环境,忌强光直射。矾根小苗长势较慢,成苗后生长旺盛,是少有的彩叶阴生地被植物,能耐-34 ℃低温[3 ]。矾根品种繁多,种苗生产以组织培养与分株繁殖为主,部分品种可用种子繁殖,但种子发芽慢而且不整齐[4 ],关于矾根组织培养与快速繁殖的研究已有报道[5 - 7 ],但对其胚性愈伤组织诱导与植株再生的研究还尚未见报道。为了建立矾根组培快繁体系,笔者于2022 — 2023年以矾根优良品种甜茶去顶尖幼嫩顶芽为外植体,优化和改良培养基,诱导产生了胚性愈伤组织,并通过分化培养,建立了胚状体再生体系,由胚状体快速发育成完整植株,为规模化生产种苗奠定基础,也为进一步研究矾根体细胞胚人工种子生产提供技术参考。
1 材料与方法
1.1 材料
材料来源于甘肃林业职业技术学院校区实训基地,选择矾根优良种苗,剪取顶芽,剥去小叶,用清水冲洗干净后待用。
1.2 试验方法
1.2.1 无菌体系建立 4月中旬剪取幼嫩顶芽,剥除全部叶片,用毛刷蘸1%的洗衣粉水刷掉上面的灰尘微粒,然后用清水将洗衣粉溶液清洗干净。切去根茎部,保留锥形芽体,在超净工作台上用75%酒精浸泡30 s,用无菌水冲洗5遍,再转入1 g/kg升汞溶液+吐温-80(2滴)中浸泡5 min,再用无菌水冲洗5遍,然后置于高压灭菌过铺有滤纸的接种盘中,切去顶尖和底部致褐部分,接种于无激素的MS培养基中进行无菌材料的筛选,培养基中附加蔗糖3%、高强琼脂0.6%、pH为5.8~6.0,培养温度22 ℃,光照强度1 000 Lx,光照时间12 h/d,7 d后选择无污染的外植体材料,进行愈伤诱导培养。
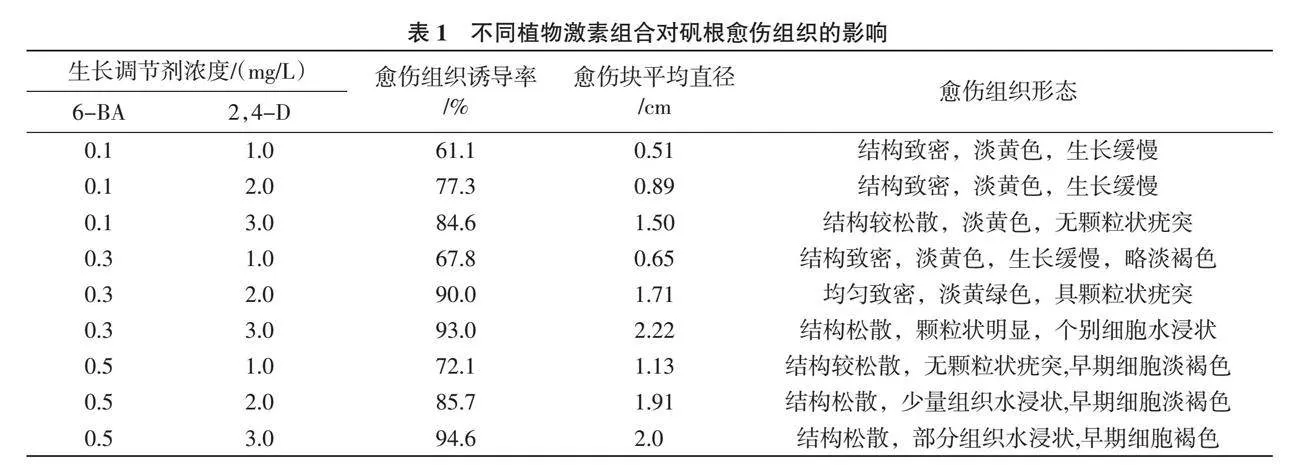
1.2.2 胚性愈伤组织诱导 将1.2.1培养所得的无菌材料接种到愈伤诱导培养基中,愈伤诱导以MS为基本培养基,分别添加植物生长调节剂6-BA和2,4-D,设计两因素三水平共9个随机处理(表1), 每处理10瓶培养基, 每瓶接种1个外植体, 3次重复。暗培养15 d再转入500 Lx弱光培养[8 ],光照时间10 h/d,培养基中附加蔗糖3%,高强琼脂0.6%,pH为5.8~6.0,培养温度22~25 ℃,40 d后观察并统计愈伤组织。
愈伤组织诱导率=(形成胚性愈伤组织的外植体数/接种外植体数)×100%。
1.2.3 胚性愈伤组织增殖培养 为促进胚性愈伤组织的成熟,提高胚状体在愈伤组织中的比例,可采用降低激素浓度或没有生长素的培养基进行愈伤组织的增殖和成熟培养[9 ],增殖培养基以愈伤诱导结果为依据,选择愈伤诱导培养的最佳组合,适当降低培养基中6-BA和2,4-D的浓度组成增殖培养基。挑选发育较好,团块较大的愈伤组织,切分成直径为3~5 mm的小块接种于增殖培养基上,培养基中附加蔗糖3%,高强琼脂0.6%,pH为5.8~6.0。光照强度为1 500 Lx,光照时间12 h/d,培养温度22~25 ℃,以20 d为培养周期,增殖培养两代后转入再分化培养基中,诱导植株再生。
1.2.4 植株再生培养 将增殖培养形成的大块愈伤组织转入分化培养基,分化培养基以MS为基本培养基, 添加不同浓度的6-BA、NAA和IBA,设计三因素两水平共8个随机处理(表2), 每处理10瓶, 每瓶接种3块愈伤组织, 重复3次, 培养基中附加蔗糖3%,高强琼脂0.6%,pH为5.8~6.0,培养温度20~22 ℃,光照强度为1 500 Lx,光照时间12 h/d,40 d后观察统计胚状体诱导率。
胚状体诱导率=(形成胚状体的愈伤块数/接种愈伤组织数)×100%
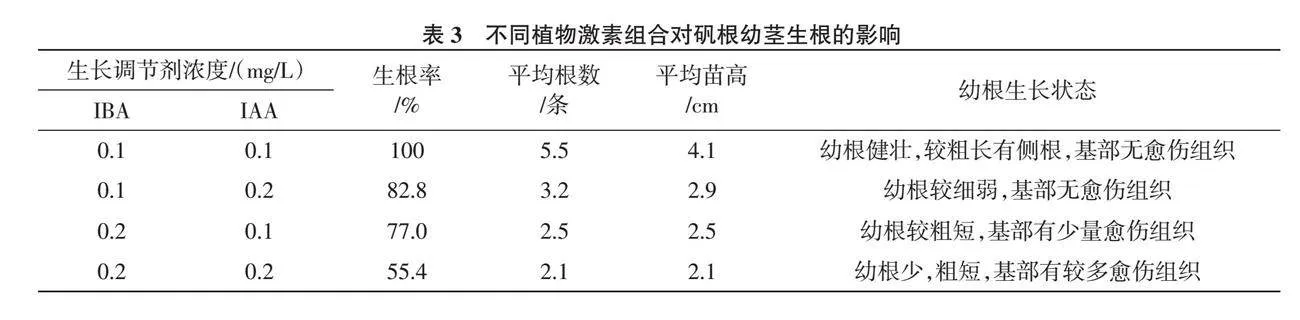
1.2.5 壮苗与生根 再分化产生的幼苗,有部分太弱小或无根,还需通过壮苗培养形成健壮幼茎后,以便生根和移栽,壮苗培养基采用无激素添加的MS培养基[10 ],并增加蔗糖和琼脂的添加量[11 ],即MS+蔗糖5%+高强琼脂0.7%,pH为5.8~6.0,培养温度20~22 ℃,光照强度为2 000 Lx[12 ],光照时间12 h/d,壮苗培养25~30 d将健壮幼茎切下转入生根培养基中。生根培养可选用1/2MS为基本培养基添加不同浓度的IBA和IAA,设计两因素两水平共4个随机处理(表3),培养基中均附加蔗糖2%,其他条件与前述同,30 d后观察生根情况,并统计生根率。
生根率=(生根苗数/接种苗数)×100%
1.3 数据处理及分析
采用Excel 2021进行数据分析与统计。
2 结果与分析
2.1 胚性愈伤组织诱导与增殖
根据观察,外植体接种7 d后开始膨大(图1),14 d后膨大部位快速生长并逐渐形成淡黄色的愈伤组织,随着细胞团的不断形成,整个芽体变成了愈伤组织块。从表1可以看出,不同生长调节剂2,4-D与6-BA对愈伤组织的形成都有一定影响,在相同6-BA浓度下,随着2,4-D浓度增大愈伤诱导率也增加,培养基MS+6-BA 0.3 mg/L+2,4-D 3.0 mg/L下外植体发育良好,愈伤诱导率较高,为93.0%,团块较大,40 d后平均直径为2.22 cm。结构较松散,有颗粒状态,个别块呈水浸状(图2),综合分析,MS+6-BA 0.3 mg/L+2,4-D 3.0 mg/L为较适合的愈伤诱导培养基。根据胚性愈伤组织诱导结果,适当降低培养基浓度,即6-BA浓度为0.2 mg/L、2,4-D浓度为2.0 mg/L下进行增殖培养,从图3可以看出,在降低激素浓度的MS+6-BA 0.2 mg/L+2,4-D 2.0 mg/L上增殖培养的愈伤组织发育较好,结构较松散,颗粒状疣突分明,水分较少,呈淡黄绿色。
2.2 植株再生
将增殖后的大块愈伤组织转入分化培养基上。培养20 d后颗粒状的愈伤组织表面疣突逐渐增大并转绿,继而形成小植株,40 d后可以看出,8种培养基上愈伤组织都能分化出小植物株,但随着激素配比不同分化效果存在差异。以MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+IBA 0.2 mg/L组合的胚状体诱导效果较好,占比较高,胚状体诱导率达91.8%;且生长均匀,无根苗很少,大部分幼苗可直接进行炼苗与移栽(表2、图4)。MS+6-BA 0.5 mg/L+NAA 0.2 mg/L+IBA 0.2 mg/L、MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+IBA 0.2 mg/L处理虽然分化率也较高,但再生植株幼根发育不良,或有少量玻璃化苗,需进行壮苗与生根培养后才能进行炼苗与移栽。
2.3 壮苗与生根培养
从表3可以看出,将胚状体发育过程中形成的弱小株、无根幼芽转接于无激素的MS培养基上,培养30 d后苗壮叶茂,大多根系发育良好。健壮无根幼苗在添加IBA和IAA的1/2MS培养基上都能生根,其中培养基1/2 MS+IBA 0.1 mg/L+ IAA 0.1 mg/L上生根率100%,幼苗生长较好,苗茎均匀直立,苗高可达4.1 cm,且有新根4~6条带侧根,长约2~3 cm(表3、图5)。
3 讨论与结论
研究表明,组织培养是矾根高效快繁的最佳途径,而在外植体的选择上有茎尖、茎段、叶片、叶柄等材料,但以茎尖为外植体诱导效果较好,因茎尖内含芽原基细胞,有潜在的不定芽分化能力,具诱导速度较快,诱导成功率较高等优点[13 ],且茎尖培养有脱病毒、复壮优良种性的特点[14 ],此外,分生组织细胞还具胚状体发生能力。本次试验选用了茎尖为外植体材料,对愈伤诱导和胚状体分化都产生了显著影响。愈伤诱导培养中2,4-D是较理想的生长调节剂,但其不能较好的促进胚性细胞的形成,通常采用生长素2,4-D 与低浓度细胞分裂素 6-BA配合使用,才能有效促进胚性细胞的发育[15 ],本试验在培养基MS+6-BA 0.3 mg/L+2,4-D 3.0 mg/L条件下愈伤组织诱导效果最好。增殖培养周期对体胚发生具有显著影响[16 ],因此为了获得优质胚性细胞以促进胚状体的形成,可适当缩短愈伤组织的培养周期,增加其培养代数,本试验以20 d为周期,增殖两代后进行再分化培养,有助于提高芽苗的再生能力。再分化过程中,以MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+IBA 0.2 mg/L的组合胚状体分化效果较好,分化率较高,但MS+6-BA 0.5 mg/L+NAA 0.2 mg/L+IBA 0.2 mg/L的幼苗不同程度上存在愈伤和玻璃化情况。降低培养基中6-BA的浓度,提高琼脂和蔗糖的添加量对芽苗的玻璃化有一定的控制作用,但琼脂浓度过高,硬化的培养基会影响试管苗对养分的吸收,蔗糖浓度过高时水解缓慢,同时也影响其他物质的吸收。无根不定芽在试验生根培养基上都可诱导生根,但从生根率、平均根数及平均苗高数据分析,IBA与IAA对幼根发生率都有显著影响,但IAA影响大于IBA,且低浓度组合更有助于幼根发生,1/2 MS+IBA 0.1 mg/L+IAA 0.1 mg/L诱导根的数量较多且质量较好。
本试验在胚性愈伤诱导过程中,MS+2,4-D 3.0 mg/L+6-BA 0.3 mg/L是较理想的培养基组合,诱导率可达93.0%,愈伤组织在MS+2,4-D 2.0 mg/L+ 6-BA 0.2 mg/L上进行扩增后,组织块结构松散,颗粒分明,水分较少,有利于胚状体分化;胚状体诱导过程中,培养基MS+6-BA 0.5 mg/L+ NAA 0.1 mg/L+IBA 0.2 mg/L上分化效果较好,胚状体诱导率达91.8%;且芽苗生长均匀健壮,大多无需生根培养;对于弱小株和无根幼芽需转接于无激素的MS培养基上,培养30 d后苗壮叶茂,大多根系发育良好;在生根培养基1/2MS+IBA 0.1 mg/L+IAA 0.1 mg/L上,矾根幼苗生根率100%,生长健壮,苗体均匀,高达4.1 cm,且有新根4~6条带侧根,长约2~3 cm。
参考文献:
[1] 李春辉,黄少玲,郭 翔,等. 我国矾根研究进展[J]. 安徽农学通报,2017,23(15):109-111.
[2] 孙 翊,殷丽青,张永春,等. 矾根叶柄和叶片不定芽高效再生体系优化[J]. 上海农业学报,2020,36(6):39-43.
[3] 刘 佳. ‘焦糖’矾根的组织培养与快速繁殖[C]. 2010北京园林绿化新起点,北京,2010-1045e7ef105198fb3db0111991bdebe96a045fd1396a7f0ecdc9f0d6f6585b4548-26,254-256.
[4] 张 露,李世峰,蒋雪彬,等. 矾根花粉离休萌发培养基组分及培养条件的优化[J]. 中国农学通报,2019,
35(30):64-70.
[5] 刘 丹,王 容,吴海峰,等. 不同激素浓度和培养条件对矾根组培快繁体系的影响[J]. 安徽农业科学,2022,50(14):46-49,56.
[6] 侯非凡,程宵婧,荊晓楠,等. 矾根‘莱姆里基’愈伤组织诱导及快速繁殖技术[J]. 山西农业大学学报(自然科学版),2020,40(6):21-28.
[7] 陈 琳,卢秋霜. 矾根叶片组培技术研究[J]. 绿色科技,2021,23(30):95-97.
[8] 沙月娥,欧阳乐军,彭 舒. 桉树胚状体再生与遗传转化的研究进展[J]. 植物生理学报,2012,48(4):325-332.
[9] 刘 敏. 花卉组织培养与工厂化生产[M]. 北京:地质出版社,2002.
[10] 谭文澄,戴策刚. 观赏植物组织培养技术[M]. 北京:中国林业出版社,1991.
[11] 曹孜义,刘国民. 实用植物组织培养技术教程(修定版)[M]. 兰州:甘肃科学技术出版社,1999.
[12] 王 晶,刘立功,左丽娟,等. 柔毛矾根组培快繁技术研究[J]. 北方园艺,2012(23):116-118.
[13] 卜顺法,方连明,陆锦明,等. 优良地被植物“矾根”组织培养技术及其在景观绿化中的应用[J]. 上海农业科技,2020(3):73-74.
[14] 中国科学院上海植物生理研究所,上海市植物生理学会. 现代植物生理学实验指南[M]. 北京:科学出版,1999:26-28.
[15] 王晓春,高 婷, 杨炜迪,等. 紫花苜蓿胚性愈伤组织诱导及胚状体分化研究[J]. 作物杂志,2023(4):98-103.
[16] 任毓辉,聂 帅,彭春雪,等. 红松胚性愈伤组织增殖的激素配比、糖源类型和增殖周期效应研究[J]. 植物研究,2022,42(4):704-712.
