贝伐珠单抗联合化疗在结直肠癌晚期患者中的应用效果及对免疫水平的影响
2024-08-19许云朋
【摘要】 目的:分析贝伐珠单抗联合化疗在结直肠癌晚期患者中的应用效果及对免疫水平的影响。方法:回顾性分析2022年1月—2023年1月阳江市人民医院肿瘤一科收治的60例结直肠癌晚期患者的临床资料,按治疗方案不同分为两组,各30例。对照组采用奥沙利铂联合卡培他滨(Oxaliplatin combined with Capecitabine,XELOX)化疗方案治疗,观察组在对照组基础上联合贝伐珠单抗治疗。对比两组临床疗效、肿瘤标志物、免疫指标、不良反应发生率。结果:观察组客观缓解率(objective response rate,ORR)为60.00%,高于对照组的33.33%,差异有统计学意义(P<0.05)。治疗后,两组癌胚抗原(carcinoembryonic antigen,CEA)、血清淀粉样蛋白A(serum amyloid A,SAA)及糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)均低于治疗前,且观察组均低于对照组,差异均有统计学意义(P<0.05)。治疗后,两组CD3+、CD4+及CD4+/CD8+均低于治疗前,CD8+均高于治疗前,但观察组CD3+、CD4+及CD4+/CD8+均高于对照组,CD8+低于对照组,差异均有统计学意义(P<0.05)。两组不良反应发生率比较,差异无统计学意义(P>0.05)。结论:与单纯XELOX化疗相比,XELOX化疗联合贝伐珠单抗治疗能提高结直肠癌晚期患者的临床有效率,能降低肿瘤标志物水平,改善患者T淋巴细胞免疫水平,且未增加不良反应发生率。
【关键词】 贝伐珠单抗 XELOX化疗 结直肠癌晚期 免疫水平 肿瘤标志物 不良反应
Application Effect of Bevacizumab Combined with Chemotherapy in Advanced Colorectal Cancer Patients and Its Impact on Immune Levels/XU Yunpeng. //Medical Innovation of China, 2024, 21(22): -128
[Abstract] Objective: To analyze the effect of Bevacizumab combined with chemotherapy on patients with advanced colorectal cancer and the impact on immune level. Method: The clinical data of 60 patients with advanced colorectal cancer admitted to the Oncology Ⅰ Department of Yangjiang People's Hospital from January 2022 to January 2023 were retrospectively analyzed, and they were divided into two groups according to different treatment plans, with 30 cases in each group. The control group was treated with Oxaliplatin combined with Capecitabine (XELOX) chemotherapy regimen, and the observation group was treated with Bevacizumab based on the control group. The clinical efficacy, tumor markers, immune indexes and incidence of adverse reactions between the two groups were compared. Result: The objective response rate (ORR) of the observation group was 60.00%, which was higher than 33.33% of the control group, the difference was statistically significant (P<0.05). After intervention, carcinoembryonic antigen (CEA), serum amyloid A (SAA) and carbohydrate antigen 19-9 (CA19-9) in two groups were lower than those before intervention, and those in the observation group were lower than those in the control group, the differences were statistically significant (P<0.05). After intervention, CD3+, CD4+ and CD4+/CD8+ in both groups were lower than those before intervention, and CD8+ was higher than that before intervention, but CD3+, CD4+ and CD4+/CD8+ in observation group were higher than those in control group, and CD8+ was lower than that in control group, the differences were statistically significant (P<0.05). There was no significant difference in the incidence of adverse reactions between the two groups (P>0.05). Conclusion: Compared with XELOX chemotherapy alone, XELOX chemotherapy combined with Bevacizumab can improve the clinical effective rate, reduce the level of tumor markers, improve the level of T lymphocyte immunity in patients with advanced colorectal cancer, and do not increase the incidence of adverse reactions.
[Key words] Bevacizumab XELOX chemotherapy Advanced colorectal cancer Immune level Tumor markers Adverse reaction
First-author's address: Department of Oncology Ⅰ, Yangjiang People's Hospital, Yangjiang 529500, China
doi:10.3969/j.issn.1674-4985.2024.22.029
结直肠癌作为临床发病率较高的消化道恶性肿瘤,好发于40~50岁人群中,多数患者早期临床症状不典型,随着病程延长可引起排便习惯改变,部分患者伴有腹泻、局部腹痛及便血等,晚期病例将出现体重下降及贫血等,成为居民死亡的重要原因[1]。奥沙利铂联合卡培他滨(Oxaliplatin combined with Capecitabine,XELOX)化疗方案是结直肠癌晚期患者常用的治疗方法,能最大限度减少操作程序,快速杀死肿瘤细胞,可延长患者寿命[2]。同时,患者治疗时保留了传统的给药方式,能提高患者治疗耐受性。但是,该化疗方案增用奥沙利铂,导致不良反应发生率增加,影响患者治疗耐受性[3]。Dijk等[4]研究证实,肿瘤靶向药物的应用,有助于减少结直肠癌晚期患者不良反应、提高生活质量。晚期结直肠癌患者在化疗基础上,联合靶向治疗药物有助于改善效果及生存期[5]。贝伐珠单抗是一种单克隆抗体,能抑制血管内皮生长因子,拮抗血管内皮细胞的生理活性[6]。与其他一线化疗药物联合使用,能改善血管通透性,增强肿瘤细胞对于药物的敏感性,具有广泛的临床应用前景[7]。基于此,本研究以结直肠癌晚期患者为对象,探讨贝伐珠单抗联合化疗在结直肠癌晚期患者中的应用效果,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2022年1月—2023年1月阳江市人民医院肿瘤一科收治的60例结直肠癌晚期患者的临床资料。纳入标准:(1)均为本院收治的结直肠癌晚期病例,具有完整的病理检查结果[8];(2)分化程度高,如高、中分化腺癌,未合并其他恶性肿瘤;(3)预计生存期>12个月,具有良好的依从性;(4)均无XELOX化疗方案及贝伐珠单抗药物禁忌证。排除标准:(1)严重肝肾功能异常、伴有自身免疫系统疾病;(2)近期接受或同期接受放疗、分子靶向等其他抗肿瘤药物治疗;(3)凝血功能异常、远处转移及伴有其他恶性肿瘤。按治疗方案不同分为两组,各30例。本研究经过本院医学伦理委员会批准。
1.2 方法
两组治疗过程中给予患者对症支持治疗,加强患者营养支持干预,常规抗感染、止吐及止痛干预。
对照组采用XELOX化疗方案治疗。餐后30 min内口服卡培他滨片(生产厂家:江苏恒瑞医药有限公司,批准文号:国药准字H20133365,规格:0.5 g)
1 000 mg/m2,2次/d,疗程开始后连续服药14 d;另给予奥沙利铂注射液(生产厂家:江苏恒瑞医药有限公司,批准文号:国药准字H20213312,规格:10 mL︰50 mg)130 mg/m2,混合500 mL浓度5%葡萄糖溶液静脉滴注,在疗程开始的第1天给药;同时,在给予奥沙利铂前后,给予注射用盐酸托烷司琼[生产厂家:哈尔滨三联药业股份有限公司,批准文号:国药准字H20050971,规格:5 mg(按托烷司琼计算)]防治化疗引起的恶心呕吐,每次取5 mg盐酸托烷司琼混合250 mL生理盐水,静脉滴注;21 d为1个疗程,连续治疗3个疗程。
观察组在对照组基础上联合贝伐珠单抗治疗。在疗程开始第1天加用贝伐珠单抗注射液(生产厂家:齐鲁制药有限公司,批准文号:国药准字S20190040,规格:100 mg︰4 mL)7.5 mg/kg,静脉滴注;21 d为1个疗程,连续治疗3个疗程。
1.3 观察指标及评价标准
(1)临床疗效:两组治疗3个疗程后根据实体瘤疗效评价标准(RECIST)从完全缓解(complete remission,CR,所有病灶消失)、部分缓解(partial response,PR,所有病灶直径总和缩小≥30%)、稳定(stable disease,SD,缩小未达到PR或增加未达到PD)和进展(progressive disease,PD,所有病灶直径总和增加≥20%或出现新病灶)进行评估,比较两组客观缓解率(objective response rate,ORR)和疾病控制率(disease control rate,DCR)[9];其中ORR=CR率+PR率,DCR=CR率+PR率+SD率。(2)肿瘤标志物:两组治疗前后采用电化学法测定癌胚抗原(carcinoembryonic antigen,CEA)、血清淀粉样蛋白A(serum amyloid A,SAA)及糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)水平[10]。(3)免疫水平:治疗前后采用流式细胞仪测定两组CD3+、CD4+、CD8+及CD4+/CD8+水平[11]。(4)不良反应:统计两组乏力、脱发、肝功能受损、胃肠道反应及晕眩发生率。
1.4 统计学处理
本研究数据采用SPSS 26.0统计学软件进行分析和处理,计量资料以(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,采用字2检验,以P<0.05为差异有统计学意义。
2 结果
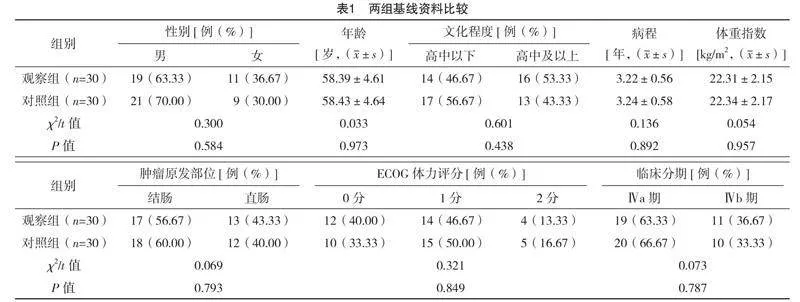
2.1 两组基线资料比较
两组基线资料比较,差异均无统计学意义(P>0.05),有可比性,见表1。
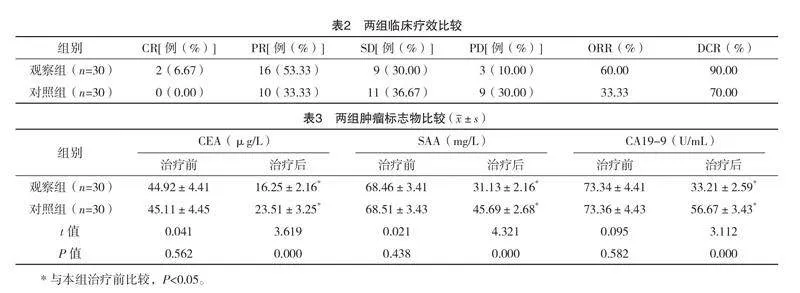
2.2 两组临床疗效比较
两组DCR比较,差异无统计学意义(字2=3.750,P=0.053);观察组ORR为60.00%,高于对照组的33.33%,差异有统计学意义(字2=4.286,P=0.038)。见表2。
2.3 两组肿瘤标志物比较
治疗后,两组肿瘤标志物水平比较,差异均无统计学意义(P>0.05);治疗后,两组CEA、SAA及CA19-9均低于治疗前,且观察组均低于对照组,差异均有统计学意义(P<0.05)。见表3。
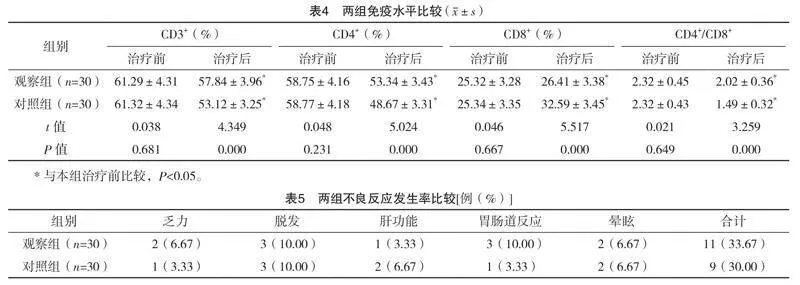
2.4 两组免疫水平比较
治疗前,两组免疫指标比较,差异均无统计学意义(P>0.05);治疗后,两组CD3+、CD4+及CD4+/CD8+均低于治疗前,CD8+均高于治疗前,但观察组CD3+、CD4+及CD4+/CD8+均高于对照组,CD8+低于对照组,差异均有统计学意义(P<0.05)。见表4。
2.5 两组不良反应发生率比较
两组不良反应发生率比较,差异无统计学意义(字2=0.300,P=0.584),见表5。
3 讨论
结直肠癌发病初期症状不明显,多数患者确诊时已经是中晚期,成为居民死亡的重要原因[12]。XELOX化疗方案主要由卡培他滨和奥沙利铂组成,能获得良好的近期疗效,有助于延长Ⅳ期结直肠癌患者存活期,可抑制肿瘤的生长,降低患者死亡率[13]。卡培他滨作为常用的抗肿瘤药物,在人体内可通过肿瘤组织中高浓度胸苷磷酸化酶转化为5-氟尿嘧啶,抑制肿瘤细胞DNA和RNA的合成,发挥较强的抗肿瘤作用[14];奥沙利铂能杀死增生活跃的细胞,对于大肠癌、卵巢癌等实体瘤具有良好的效果[15]。XELOX化疗能降低患者病死率,但是几乎所有的患者均会发生免疫功能下降,影响其生存质量。陈华敏等[16]研究表明,XELOX化疗期间会引起T淋巴细胞为主的细胞免疫功能降低,而细胞免疫与患者预后存在紧密的联系,可能会限制化疗剂量与疗程,影响患者预后。本研究中,观察组ORR为60.00%,高于对照组的33.33%;治疗3个疗程后观察组CEA、SAA及CA19-9低于对照组,从该结果看出,贝伐珠单抗联合化疗能提高结直肠癌晚期患者有效率,有助于降低肿瘤标志物水平,利于患者恢复。分析原因:贝伐珠单抗作为常用的靶向治疗药物,能与血管内皮生长因子结合,抑制心血管的生成,切断肿瘤的血氧供给,发挥抗肿瘤作用;药物能促进肿瘤血管萎缩,血管结构恢复正常,降低肿瘤内压,药物更好地达到肿瘤内部,从而能降低肿瘤标志物水平[17]。
从上述分析结果看出,化疗在结直肠癌晚期治疗中发挥了重要的作用。但是,化疗会对人体器官和系统造成损害,导致血液中白细胞数量减少,影响免疫球蛋白的数量[18]。结直肠癌晚期患者免疫功能相对较差,再加上化疗具有较高的毒副作用,加剧对患者免疫功能的损害,降低了机体抵抗不良反应和肿瘤的能力。而食欲不振、胃胀及恶心等均为常见的胃肠道不良反应,Kurtz等[19]研究证实,贝伐珠单抗具有较高的安全性。本研究中,治疗后观察组CD3+、CD4+及CD4+/CD8+高于对照组;CD8+低于对照组,差异有统计学意义(P<0.05);两组不良反应发生率比较,差异无统计学意义(P>0.05),从该结果看出,贝伐珠单抗联合化疗能改善结直肠癌晚期患者免疫水平,且药物治疗安全性较高,能提高患者治疗耐受性与依从性。分析原因:贝伐珠单抗的运用能延缓疾病的进展,能提升机体耐受性和免疫功能,增强临床治疗效果。同时,贝伐珠单抗的加入不会进一步加重对患者体液免疫造成的影响,能为患者后期的恢复奠定良好的基础[20]。
综上所述,与单纯XELOX化疗相比,XELOX化疗联合贝伐珠单抗治疗能提高结直肠癌晚期患者临床疗效,能降低肿瘤标志物水平,改善患者T淋巴细胞免疫水平,且未增加不良反应发生率。
参考文献
[1]刘梅,李仲然,武翔.贝伐珠单抗联合化疗对晚期结直肠癌患者的近远期疗效及肿瘤标志物和免疫功能的影响[J].中国临床医生杂志,2023,51(9):1063-1067.
[2]郑波,赵红梅,郭鹏伟,等.化疗联合贝伐珠单抗靶向治疗晚期结直肠癌患者的临床效果[J].中国医药导报,2023,20(11):111-114.
[3]邹文娟,宋娜,田甜,等.左心室压力-应变环技术评估结直肠癌患者贝伐珠单抗联合化疗早期心功能损害[J].临床超声医学杂志,2023,25(8):673-676.
[4] DIJK E V,WERKHOVEN E V,ASHER R,et al.Predictive value of chromosome 18q112-q121 loss for benefit from Bevacizumab in metastatic colorectal cancer: a post hoc analysis of the randomized phase Ⅲ-trial AGITG-MAX[J].Int J Cancer,2022,151(7):1166-1174.
[5]米迷,翁姗姗,陆德珉,等.2021年晚期结直肠癌治疗研究进展[J].实用肿瘤杂志,2022,37(1):23-28.
[6]胡浪,林小玲,唐文军.呋喹替尼单药及联合PD-1抑制剂用于晚期转移性结肠癌后线治疗的疗效及安全性[J].实用医学杂志,2023,39(15):1966-1973.
[7] FOLPRECHT G,MARTINELLI E,MAZARD T,et al.Triplet chemotherapy in combination with anti-EGFR agents for the treatment of metastatic colorectal cancer: current evidence, advances, and future perspectives[J].Cancer Treat Rev,2022,102:102301.
[8]刘佳,王坚,顾小伟,等.大分割放疗联合免疫检查点抑制剂治疗晚期转移性实体瘤的临床疗效研究[J].实用临床医药杂志,2024,28(6):19-23.
[9]丁婕,戴旭,孟宪运,等.实体瘤疗效评价标准的研究进展[J].中国肿瘤临床与康复,2015,22(9):1150-1152.
[10] WIRSIK N M,APPEL P C,BRAUN A,et al.Inhibition of the renin-angiotensin system improves response to neoadjuvant therapy in patients with liver metastasis of colorectal cancers[J].
J Surg Res,2024,298:176-184.
[11]陆悦,卢仁泉,张杰,等.联合凝血功能指标在结直肠癌患者化疗后高凝状态监测中的应用价值[J].中国癌症杂志,2024,34(3):278-285.
[12]曾强,唐源,周海涛,等.新辅助直肠评分在局部晚期直肠癌新辅助短程放疗后巩固化疗模式中的预后及辅助化疗决策作用[J].中华肿瘤杂志,2024,46(4):335-343.
[13]王冬芽,周青,刘昱昕,等.部分盲肠壁埋于皮下改良盲肠造口与回肠末端造口在低位直肠癌保肛术中的临床效果比较[J].中国医学创新,2023,20(11):39-43.
[14] O'REILLY E M.Flashback foreword: Bevacizumab and FOLFOX4 for colorectal cancer and Bevacizumab versus placebo plus Oxaliplatin-based chemotherapy in metastatic colorectal cancer[J].J Clin Oncol,2023,41(21):3661-3662.
[15]古爱虎,杨雪,许亚丽,等.康艾注射液联合化疗及贝伐珠单抗对晚期结直肠癌患者疗效及生存的影响[J].皖南医学院学报,2024,43(1):33-36.
[16]陈华敏,何志军,涂伟,等.XELOX化疗联合肠益方治疗对老年晚期结直肠癌患者生存质量、免疫功能及血浆硫酸类肝素蛋白多糖2、胞裂蛋白9水平的影响[J].临床和实验医学杂志,2023,22(17):1850-1854.
[17]孙梦喆.腹腔镜手术联合新辅助化疗对直肠癌患者CA199、CA125水平的影响[J].中国医学创新,2022,19(23):81-85.
[18]黄永年,谢英瑛.扶正抑瘤方联合化疗对晚期结直肠癌患者免疫功能的影响及近期疗效[J].医学临床研究,2022,39(3):471-474.
[19] KURTZ J E,PUJADE-LAURAINE E,OAKNIN A,et al.
Atezolizumab combined with Bevacizumab and platinum-based therapy for platinum-sensitive ovarian cancer: placebo-controlled randomized phase Ⅲ ATALANTE/ENGOT-ov29 trial[J].J Clin Oncol,2023,41(30):4768-4778.
[20]辛鑫,梁志伟,余会敏,等.支气管动脉化疗栓塞术联合贝伐珠单抗治疗中晚期非小细胞肺癌患者的疗效及其对血浆miR-200a和miR-375表达水平的影响研究[J].实用心脑肺血管病杂志,2022,30(4):37-41.
(收稿日期:2024-06-05) (本文编辑:马娇)
①阳江市人民医院肿瘤一科 广东 阳江 529500
通信作者:许云朋
