外周血干细胞联合外泌体治疗糖尿病足溃疡创面疗效观察
2024-08-18王国燕李勤雨贾玉萍桑宇超傅松涛彭艳聂君毅谢汶芹曹硕侯秀英
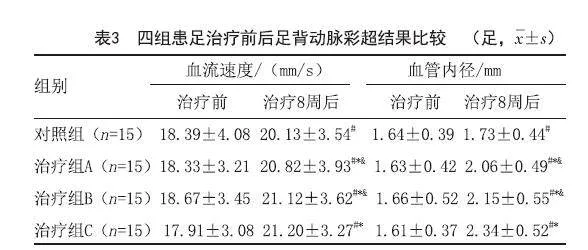
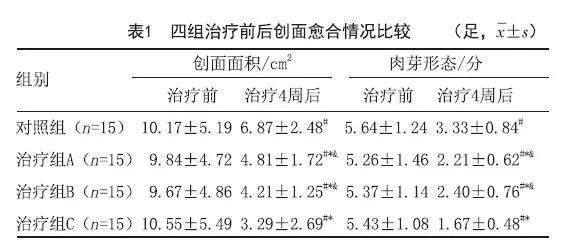


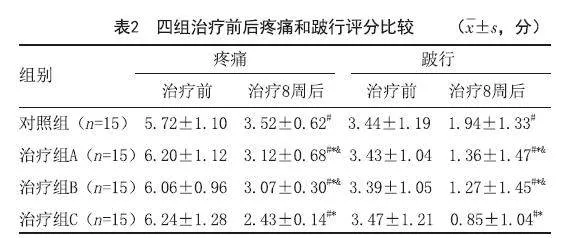
[摘要]目的:探究自体PBSCs联合SC-Exos对糖尿病足溃疡(Diabetic foot ulcer,DFU)创面的治疗效果。方法:将60例溃疡患足随机分为对照组、SC-Exos外敷组(治疗组A)、PBSCs注射组(治疗组B)、PBSCs联合SC-Exos组(治疗组C)各15足,在常规治疗(对照组)基础上,分别予以SC-Exos外敷或/和PBSCs创面周边注射,2周后第2次给药,并于第1次给药后第4、8和12周观察患者溃疡创面面积变化,肉芽形态评分,患足疼痛、冷感和跛行症状评分,足背动脉收缩期峰值流速(Peak systolic velocity,PSV)和血管内径及总有效率。结果:治疗后,四组患足溃疡创面面积变化,肉芽形态评分,患足疼痛、冷感和跛行症状评分,足背动脉PSV和血管内径较治疗前均有显著改善,各指标组间两两比较,治疗组A与治疗组B比较差异无统计学意义(P>0.05),其余各组间比较差异均有统计学意义(P<0.05),其中,治疗组C各指标结果明显优于其他各组(P<0.05)。治疗12周后,对照组、治疗组A、治疗组B三组行两两比较,差异无统计学意义(P>0.05),治疗组C总有效率明显高于其他各组(P<0.05)。结论:PBSCs、SC-Exos和两者联合治疗均能促进DFU创面愈合,改善患足症状和血液循环,PBSCs和SC-Exos联合应用的疗效比单一应用更好。
[关键词]自体外周血干细胞;外泌体;糖尿病足溃疡;治疗;创面愈合
[中图分类号]R622 [文献标志码]A [文章编号]1008-6455(2024)08-0033-04
Therapeutic Effect of Peripheral Blood Stem Cells Combined with Exosomes on Diabetic Foot Ulcer Wounds
WANG Guoyan1, LI Qinyu2, JIA Yuping2, SANG Yuchao3, FU Songtao4, PENG Yan1, NIE Junyi1,
XIE Wenqin1, CAO Shuo1, HOU Xiuying2
( 1.Department 1, the First Clinical College of Medicine, Shanxi Medical University, Taiyuan 030000, Shanxi, China; 2.Department of Plastic Surgery, the First Hospital of Shanxi Medical University, Taiyuan 030000, Shanxi, China; 3.Department of Chemistry and Molecular Biology, Shanxi Medical University, Taiyuan 030000, Shanxi, China; 4.Shanxi Penn Stem Cell Biotechnology Co., Ltd, Taiyuan 030000, Shanxi, China )
Abstract: Objective To investigate the therapeutic effect of autologous PBSCs combined with SC-Exos on diabetic foot ulcer (DFU) wound. Methods Sixty patients with ulcerated feet were randomly divided into control group, SC-Exos external application group (treatment group A), PBSCs injection group (treatment group B), and PBSCs combined with SC-Exos group (treatment group C) with 15 feet in each group. On the basis of conventional treatment (control group), SC-Exos external application or/and PBSCs peripheral injection were given respectively, and the second dose was given 2 weeks later. The ulcer wound area, granulation morphology score, foot pain, cold sensation and lameness score, peak systolic velocity (PSV), vessel diameter and total effective rate of the patients were observed at 4, 8 and 12 weeks after the first dose. Results After treatment, the wound area changes, granulation shape scores, pain, cold feeling and lameness scores of the affected foot, PSV and vessel diameter of the dorsal foot artery in the four groups were significantly improved compared with before treatment. Pairwise comparison of all indicators among groups showed no statistical significance between treatment group A and treatment group B (P>0.05). There were statistically significant differences among the other groups (P<0.05), and the results of C indexes in the treatment group were significantly better than those in the other groups (P<0.05). After 12 weeks of treatment, the control group, treatment group A and treatment group B were compared pair-to-pair, and the difference was not statistically significant (P>0.05). The total effective rate of treatment group C was significantly higher than that of other groups (P<0.05). Conclusion PBSCs, SC-Exos and their combined intervention can promote wound healing in patients with severe diabetic foot ulcer (DFU), improve symptoms and blood flow of the affected foot, and the combined application of PBSCs and SC-Exos is better than the single application.
Key words: autologous peripheral blood stem cells; exosome; diabetic foot ulcer; treatment; wound healing
糖尿病足是指糖尿病患者因糖尿病所致的下肢远端神经病变和/或不同程度的血管病变导致的足部溃疡和/或深层组织破坏,伴或不伴感染[1],是导致我国糖尿病患者致残、致死的严重慢性并发症之一[2],其发病率高,治疗困难,花费巨大。近年来,糖尿病足溃疡(DFU)外科辅助用药成为重要研究方向,尤其在干细胞(Stem cell,SC)及其相关衍生生物制品治疗DFU临床应用方面成果显著。SC具有可增殖、多重分化及分泌大量细胞因子、外泌体等生物学特征。研究表明,外周血干细胞移植与血管内皮细胞联合可促进新生血管形成,细胞移植显著改善了缺血肢体的毛细血管密度[3-4]。骨髓动员外周血干细胞(Peripheral blood stem cells,PBSCs)移植能促进缺血肢体新生血管形成,有效改善缺血肢体的疼痛和步行距离,并促进溃疡愈合,且SC易于体外分离和扩增,分离后在低温环境下冷冻保存,不影响其生物学活性,便于制备利用[5]。同时,干细胞治疗可以替代部分手术治疗,在一定程度上减轻老年患者由于手术所承受的身体负担及并发症等[6],尤其是下肢远端动脉流出道差无法进行搭桥的患者,可使一部分患者免除截肢或降低截肢平面,改善生活质量。张璟林等[7]汇总66篇干细胞源外泌体(Exosomes,Exos)促进糖尿病创面愈合的机制及应用文献,显示Exos可通过调节炎症、促进血管新生、再上皮化和细胞外基质重塑等促进糖尿病伤口愈合。糖尿病足创面的本质就是缺血,改善血供即可从根本上治疗溃疡,促进创面愈合[8]。因此,本研究对局部应用PBSCs、干细胞源Exos及两者联合治疗DFU的疗效和安全性进行观察,旨在为临床防治DFU提供新的方法和理论依据。
1 资料和方法
1.1 一般资料:选取2020年2月-2021年11月笔者医院收治的糖尿病足溃疡患者共43例,其中男28例,女15例,年龄42~75岁,平均61岁,双下肢病变17例,单肢病变26例,患足共计60足。采用随机数字表法将60足分为四组:对照组(常规治疗组)15足,治疗组A(Exos外敷组)15足,治疗组B(PBSCs注射组)15足,治疗组C(PBSCs注射+Exos外敷组)15足。所有患者均对检测项目和本研究知情同意,本研究中的实验程序由笔者医院临床伦理委员会批准(批号:SK006),并按照国家有关干细胞及外泌体采集、分离及移植的规定进行。
1.2 纳入和排除标准
1.2.1 纳入标准:有明确的2型糖尿病病史;符合糖尿病足诊断且溃疡经过4周以上的治疗未愈合。
1.2.2 排除标准:合并糖尿病酮症酸中毒;合并下肢大动脉闭塞;合并严重心功能衰竭、肝肾功能不全;合并精神心理疾病;合并恶性肿瘤;妊娠患者。
1.3 自体PBSCs混悬液分离:治疗组B和治疗组C患者皮下注射重组人粒细胞集落刺激因子150~300 µg/d,连用5 d,5 d后待白细胞达20.0×109/L以上,采集肝素抗凝外周血80~120 ml,在超净实验室应用Ficoll梯度离心法进一步分离PBSCs混悬液20~30 ml供移植用。流式细胞仪检测PBSCs混悬液中CD34+细胞数,无菌分装,一部分用于首次治疗,另一部分冻存于-80℃冰箱保存。治疗前,用生理盐水洗涤细胞后,配制成CD34+细胞数量约为2×106/ml的PBSCs混悬液备用。PBSCs混悬液配制及PBSCs镜下见图1~2。
注:离心后可看到管内分为三层,上层为血浆和缓冲液,下层为红细胞和粒细胞,中间层为淋巴细胞分离液。上中层分界处有以单个核细胞为主的白色云雾层狭窄带,即是PBSCs混悬液
图1 Ficoll梯度离心法分离PBSCs混悬液
图2 镜下可见PBSCs细胞呈圆形或椭圆形,细胞体积小
1.4 SC-Exos:由山西医科大学生化与分子生物学教研室制备,用生理盐水定量为5 ug/ml,无菌分装后冷藏备用。
1.5 治疗方法:对所有患者进行基础治疗,包括饮食控制、健康教育、采用胰岛素或口服降糖药物控制血糖(控制空腹血糖≤7.0 mmol/L,餐后血糖≤10.0 mmol/L,HbAlc<6.5%)、改善微循环治疗、营养神经治疗、抗生素抗感染治疗等。
1.5.1 对照组:给予常规治疗。对创面进行清创消毒,敷料覆盖包扎。
1.5.2 治疗组A:给予SC-Exos外敷治疗。创面清创消毒后,贴敷与创面面积相近的双层无菌纱布,后在纱布上均匀滴加SC-Exos,用量为0.05 ml/cm[9],敷料覆盖包扎。
1.5.3 治疗组B:给予自体PBSCs局部注射治疗。创面清创消毒后,无菌条件下在溃疡边缘外1 cm处的正常组织内点状注射PBSCs(PBSCs直接到达目标组织,在迁移过程中损失很小)[10],注射点间距1.5~2.0 cm,每点注射干细胞悬液0.5 ml[11],创面用敷料覆盖包扎。
1.5.4 治疗组C:创面清创消毒后,先后给予自体PBSCs局部注射和SC-Exos外敷,敷料覆盖包扎。
以上每组均行常规换药,治疗组A、B、C于首次给药2周后第2次给药,共给药两次。第一次给药后第4、8、12周分别对临床疗效进行动态评估。
1.6 观察指标
1.6.1 创面愈合情况:测量两组治疗前和治疗4周后的患足溃疡创面面积(长×宽),并评估创面肉芽形态。创面肉芽形态评分标准[12]:愈合评为0分;肉芽为淡红色,柔软湿润,呈小颗粒状评为2分;肉芽为鲜红色,呈肿大的颗粒状评为4分;肉芽色泽不鲜,颗粒大小不一评为6分。
1.6.2 临床相关症状评分:治疗前及治疗8周后,统计比较两组疼痛评分和间歇性跛行评分。疼痛评分采用视觉模拟评分法(Visual analogue scoring,VAS)进行评估,0分表示无痛,10分表示剧烈疼痛。间歇性跛行评分标准:行走≥500 m无疼痛,记为0分;400 m≤行走<500 m有疼痛感,记为1分;300 m≤行走<400 m,有疼痛感,记为2分;100 m≤行走<300 m,有疼痛感,记为3分;行走<100 m或静息痛记为4分。
1.6.3 足背动脉血流动力学相关指标:治疗前和第1次治疗8周后,彩超(飞利浦 EnVisorC HD型,频率5~18 MHz)探头置于患侧足背,取样线与血流方向夹角<60°,连续测3个心动周期的PSV和血管内径。
1.6.4 临床疗效:根据治疗前和治疗12周后临床症状和创面愈合情况,评估两组患者临床疗效。痊愈为症状、体征彻底消失,且创面愈合良好;显效为临床症状、体征显著改善,创面愈合面积超过70%;有效为临床症状、体征稍有缓解,创面愈合面积占比为30%~69%;无效为未达到上述标准或病情加重。治疗总有效率=(痊愈+显效+有效)例数/总例数×100%。
1.7 统计学分析:采用SPSS 26.0统计学软件进行数据分析,计量资料数据均符合正态分布,以(x¯±s)表示,各组间两两比较行LSD-t检验;计数资料以[例(%)]表示,各组间两两比较采用卡方检验,P<0.05表示差异有统计学意义。
2 结果
yoBE5sVyXQyFE6d2GO6lJQ==2.1 四组患足创面愈合情况比较:治疗4周后,四组患足创面面积及肉芽形态评分较治疗前均有不同程度的减小和降低(P<0.05),创面面积及肉芽形态评分各组间进行两两比较,治疗组A与治疗组B比较差异无统计学意义(P>0.05),其余各组间比较差异均有统计学意义(P<0.05),其中,治疗组C创面面积及肉芽形态评分明显低于其他各组(P<0.05)。见表1。
2.2 四组患足疼痛和跛行评分比较:治疗8周后,四组患足疼痛和跛行评分均有不同程度降低(P<0.05),疼痛和跛行评分各组间进行两两比较,治疗组A与治疗组B比较差异无统计学意义(P>0.05),其余各组间比较差异均有统计学意义(P<0.05),其中,治疗组C疼痛和跛行评分明显低于其他各组(P<0.05)。见表2。
2.3 四组患足足背动脉彩超结果比较:治疗8周后,四组患足足背动脉彩超结果均优于治疗前(P<0.05),各组间进行两两比较,治疗组A与治疗组B比较差异无统计学意义(P>0.05),其余各组间比较差异均有统计学意义(P<0.05),其中,治疗组C患足足背动脉彩超结果优于其他各组(P<0.05)。见表3。
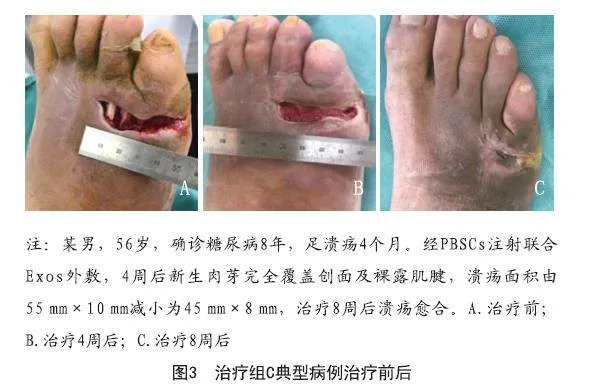
2.4 四组患足疗效比较:治疗12周后,对照组、治疗组A、治疗组B三组总有效率两两比较,差异无统计学意义(P>0.05),治疗组C总有效率明显高于其他各组(P<0.05)。见表4。治疗组C典型病例见图3。
3 讨论
DFU是一种累及神经、血管、皮肤、肌腱甚至骨骼的慢性进行性复杂病变,是糖尿病患者致残、致死主要原因之一。DFU主要是由长期高糖高渗环境所引起的周围神经病变,过度的氧化应激引发大血管及微血管病变,从而导致保护性知觉丧失,溃疡形成,由于神经感觉的缺失,疼痛感减弱或丧失,创伤愈合困难,甚至会导致足部变形及截肢[13-14]。DFU的治疗一直是临床慢性伤口治疗中的难题,近年来针对常规DFU治疗方法的局限性,间充质干细胞(Mesenchymal stem cells,MSCs)移植在DFU临床治疗中逐渐成为研究热点。MSCs是一类起源于中胚层的成体干细胞,具有自我更新和多向分化的潜能,并可通过促进细胞增殖分化、ECM的合成、释放生长因子、促进血管形成及细胞募集,进而促进糖尿病溃疡伤口的愈合[15]。对于糖尿病下肢缺血,MSCs可以在一定条件下促进血管再生,形成新的侧支循环,调节免疫反应,从而达到治疗下肢缺血的目的。此外,MSCs还可调整炎症与组织重建的平衡,使受损组织处于相对稳态的环境中,促进组织修复与重建[16]。何雄文等[17]在足溃疡边缘处注射PBSCs细胞悬液,同时用活血生肌汤0.8 g/kg灌胃治疗糖尿病足溃疡模型大鼠,治疗30 d后与模型组和对照组对比,治疗组大鼠的血清VEGF水平、溃疡局部组织中VEGF mRNA表达均显著增加(P<0.01),局部溃疡组织CD34、CD44、CD38表达升高(P<0.01);同时溃疡面的长径、短径均缩小(P<0.05、P<0.01),表明活血生肌汤联合外周血干细胞移植可促进新生血管的形成与溃疡创面的愈合。
笔者研究发现,PBSCs局部注射对重度DFU患足创面的愈合具有明显的改善作用,表现为PBSCs注射和SC-Exos创面外敷均能促进DF患者的溃疡创面愈合,降低肉芽形态评分,两者联合应用的效果优于单一干预。研究表明动物和人的外周血中可分离到内皮细胞祖细胞(EPC),因此笔者采用患者经动员后的自体外周血干细胞移植治疗糖尿病足,使干细胞在缺血的下肢组织内分化成内皮细胞,促进局部血管新生。另外外周血中的内皮祖细胞可从先前存在的血管发芽生成新的毛细血管,外泌体可以通过直接作用于内皮细胞,或使与血管生成有关的生长因子等表达水平升高,从而间接作用于内皮细胞,促进内皮细胞增殖,并迁移到伤口区域,促进血管生成[18]。外泌体可直接作用于内皮细胞,或通过调节血管生成相关的生长因子、细胞因子、趋化因子等的表达水平间接作用于内皮细胞,促进血管形成,为新生组织提供营养和氧气,PBSCs及SC-Exos均可间接促进血管形成,从而改善创面血供;PBSCs注射和PBSCs注射联合Exos外敷均能明显改善DF患者患足的疼痛、冷感和跛行症状,明显改善DF患者患足的血流供应。笔者发现,四组患足的临床疗效总体有差别,但行PBSCs注射和SC-Exos创面外敷单一干预手段的组别与对照组之间两两比较差异无统计学意义,考虑是因纳入研究的患足例数过少所致,两者联合应用的组别其疗效均优于其余三组,也体现了联合用药的优越性。
近年来,外泌体(Exosomes,Exos)在治疗糖尿病足溃疡方面受到广泛关注,是创面修复和再生医学的研究热点。Exos是多种类型细胞分泌的一类纳米级细胞外囊泡,可通过“配体-受体”模式,与靶细胞受体结合后激活信号通路,并将信息物质传递到靶细胞内,调节靶细胞内的微环境和相关的蛋白功能。作为干细胞旁分泌的亚细胞成分,Exos在组织修复和再生方面显示出优越的特性,在调节炎症反应、细胞免疫、促进血管再生、控制细胞的增殖和凋亡、延缓神经退行性变等生物过程中均发挥着重要的作用[19]。体外实验证明,人胎盘间充质干细胞源外泌体(PMSCs-Exos)具有生成血管的能力[20]。苏欢等[21]对外泌体促进糖尿病溃疡创面愈合的效果进行meta分析显示,外泌体组在糖尿病溃疡创面愈合的第7天、第14天创面愈合率高于对照组,在创面愈合过程中创伤部位新生血管密度、胶原纤维沉积百分比、再上皮化程度高于对照组,瘢痕形成低于对照组,说明外泌体应用于糖尿病溃疡,可以促进创面新生血管产生、改善上皮化及胶原纤维沉积,明显促进创面愈合,并减少瘢痕形成。人脐带间充质干细胞外泌体还可通过逆转外周胰岛素抵抗和减轻胰岛细胞的破坏来改善2型糖尿病[22],这表明外泌体不仅在创面局部发挥作用,可能还涉及调节体内多种机制,共同作用治疗创面。尽管PBSCs、MSCs及其外泌体在促进伤口愈合的治疗中展示出了良好的治疗效果,迄今,仍处于临床前研究和临床应用的初级阶段,其潜在的修复机制和长期随访结果仍有待进一步研究。
[参考文献]
[1]赵晨旭,周慧敏.《中国糖尿病足诊治指南》解读[J].中国临床医生杂志,2021,49(12):1405-1408.
[2]Eleftheriadou I, Tentolouris A, Tentolouris N, et al. Advancing pharmacotherapy for diabetic foot ulcers[J]. Expert Opin Pharmacother, 2019,20(9):1153-1160.
[3]Fujita Y, Kawamoto A. Therapeutic angiogenesis using autologous cd34-positive cells for vascular diseases[J]. Ann Vasc Dis,
2022,15(4):241-252.
[4]倪四阳,戴玉洋,卢来春,等.干细胞治疗糖尿病足溃疡研究状况[J].中国临床药理学杂志,2022,38(4):356-359.
[5]郑舒丹,吴金燕,张利平,等.间充质干细胞源性外泌体在皮肤创伤修复和再生中的研究进展[J].中国美容医学,2023,32(4):189-193.
[6]何强,张培华.间充质干细胞来源外泌体在创面修复中的作用及其机制研究进展[J].中国美容医学,2018,27(9):143-148.
[7]张璟琳,冷敏,朱博恒,等.干细胞源外泌体促进糖尿病创面愈合的机制及应用[J].中国组织工程研究,2022,26(7):1113-1118.
[8]戴兵,戴伟,黄梅.糖尿病足下肢动脉病变血管外科治疗进展[J].医学研究生学报,2021,34(10):1102-1105.
[9]杜婧,魏翠英.间充质干细胞治疗2型糖尿病及其相关并发症的可能机制研究进展[J].山东医药,2021,61(22):84-87.
[10]Huselstein C, Rahouadj R, de Isla N, et al. Mechanobiology of mesenchymal stem cells: Which interest for cell-based treatment?[J]. Biomed Mater Eng, 2017,28(s1):S47-S56.
[11]邹译娴,邹晓玲,吴源陶.自体脂肪干细胞局部注射对糖尿病足创面愈合及细胞因子、Wnt/β-catenin通路的影响[J].临床和实验医学杂志,2019,18(9):985-988.
[12]李响,梁学威,曹莹莹,等.臭氧水联合银黄洗剂治疗糖尿病足溃疡的临床观察[J].中国中西医结合外科杂志,2021,27(3):411-415.
[13]Davis F M, Kimball A, Boniakowski A, et al. Dysfunctional wound healing in diabetic foot ulcers: new crossroads[J]. Curr Diab Rep, 2018,18(1):2.
[14]Lim J Z, Ng N S, Thomas C. Prevention and treatment of diabetic foot ulcers[J]. J R Soc Med, 2017,110(3):104-109.
[15]胡青林,黄平平.间充质干细胞治疗糖尿病下肢缺血研究进展[J].中华细胞与干细胞杂志(电子版),2021,11(4):246-250.
[16]Shi Y, Wang Y, Li Q, et al. Immunoregulatory mechanisms of mesenchymal stem and stromal cells in inflammatory diseases[J]. Nat Rev Nephrol, 2018,14(8):493-507.
[17]何雄文,牛美兰.活血生肌汤联合外周血干细胞移植干预大鼠糖尿病足溃疡模型的研究[J].中医研究,2018,31(5):63-66.
[18]邱尧,岳毅刚,邵家松,等.干细胞治疗慢性难愈性创面的研究进展[J].中国美容医学,2018,27(4):148-151.
[19]丁科,韦积华,仇雯丽.不同源性外泌体促进糖尿病足溃疡修复的研究进展[J].现代医学,2021,49(2):243-247.
[20]Bakhtyar N, Jeschke M G, Herer E, et al. Exosomes from acellular Wharton's jelly of the human umbilical cord promotes skin wound healing[J]. Stem Cell Res Ther, 2018,9(1):193.
[21]苏欢,简华刚.外泌体促进糖尿病溃疡创面愈合的meta分析[J].重庆医学,2022,51(2):307-312,19.
[22]Sun Y, Shi H, Yin S, et al. Human mesenchymal stem cell derived exosomes alleviate type 2 diabetes mellitus by reversing peripheral insulin resistance and relieving β-cell destruction[J]. ACS Nano, 2018,12(8):7613-7628.
[收稿日期]2023-05-11
本文引用格式:王国燕,李勤雨,贾玉萍,等.外周血干细胞联合外泌体治疗糖尿病足溃疡创面疗效观察[J].中国美容医学,2024,33(8):33-37.
