鸢尾素调节JAK2/STAT3信号通路对牙周炎大鼠牙周组织损伤的影响
2024-08-18田梦婷赵景瑶刘晶

[摘要]目的:探讨鸢尾素调节Janus蛋白酪氨酸激酶2(Janus protein tyrosine kinase 2,JAK2)/信号转导和转录激活子3(Signal transduction and activator of transcription 3,STAT3)信号通路对牙周炎大鼠牙周组织损伤的影响。方法:通过结扎和接种牙龈卟啉单胞菌液建立牙周炎大鼠模型,将大鼠随机分为模型组、鸢尾素低(鸢尾素-L,50 mg/kg)、中(鸢尾素-M,100 mg/kg)、高剂量(鸢尾素-H,200 mg/kg)组、鸢尾素-H+激活剂(200 mg/kg鸢尾素+2 mg/kg香豆霉素)组,每组10只,并以注射等体积生理盐水的正常大鼠对照组。干预结束后,对大鼠牙龈出血指数、牙齿松动度评分;牙槽骨吸收、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素(Interleukin,IL)-6、IL-1β以及丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)水平分别以Micro-CT试剂盒检测;HE检测牙周组织病理学变化;Western blot检测JAK2、STAT3、p-JAK2、p-STAT3蛋白表达。结果:与对照组相比,模型组大鼠牙周组织被破坏,炎性浸润严重,牙龈出血指数、牙齿松动度评分、牙槽骨吸收、TNF-α、IL-6、IL-1β、MDA水平、p-JAK2/JAK2、p-STAT3/STAT3表达显著增加,SOD水平显著降低(P<0.05);与模型组相比,不同剂量的鸢尾素组大鼠病理损伤得到改善,牙龈出血指数、牙齿松动度评分、牙槽骨吸收、TNF-α、IL-6、IL-1β、MDA水平、p-JAK2/JAK2、p-STAT3/STAT3表达显著降低,SOD水平显著增加,具有剂量依赖性(P<0.05);与鸢尾素-H组相比,鸢尾素-H组+激活剂组大鼠病理损伤加重,大鼠牙龈出血指数、牙齿松动度评分、牙槽骨吸收、TNF-α、IL-6、IL-1β、MDA水平、p-JAK2/JAK2、p-STAT3/STAT3表达显著增加,SOD水平显著降低(P<0.05)。结论:鸢尾素抑制牙周炎大鼠氧化应激、炎性反应,减轻大鼠牙周组织损伤,减少牙槽骨吸收,可能与抑制JAK2/STAT3信号通路有关。
[关键词]鸢尾素;Janus蛋白酪氨酸激酶2/信号转导和转录激活子3;牙周炎;牙周组织损伤;炎症反应;氧化应激
[中图分类号]R743.3 [文献标志码]A [文章编号]1008-6455(2024)08-0022-05
Effect of Irisin on Periodontal Tissue Damage in Rats with Periodontitis by Regulating the JAK2/STAT3 Signaling Pathway
TIAN Mengting, ZHAO Jingyao, LIU Jing
[ Department of Dental Prosthetics and Implantation, the First Affiliated Hospital of Xinjiang Medical University ( Affiliated Stomatological Hospital ) /Xinjiang Uygur Autonomous Region Institute of Stomatology, Urumqi 830000, Xinjiang, China]
Abstract: Objective To investigate the effect of Irisin on periodontal tissue damage in rats with periodontitis by regulating the Janus protein tyrosine kinase 2 (JAK2)/signal transduction and activator of transcription 3 (STAT3) signaling pathway. Methods A rat model of periodontitis was established by ligation and inoculation of Porphyromonas gingivalis solution. The rats were randomly sepan61fiOsL2iFVbGtkuX+xzQ==rated into a model group, a low (50 mg/kg irisin L), a medium (100 mg/kg irisin M), a high-dose (200 mg/kg irisin H) groups, and a irisin H+activator group (200 mg/kg irisin+2 mg/kg coumermycin), with 10 rats in each group. Normal rats were injected with an equal volume of physiological saline as the control group. After the intervention, the gingival bleeding index and tooth mobility score of the rats were evaluated; the alveolar bone resorption, tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), IL-1β, malondialdehyde (MDA), and superoxide dismutase (SOD) levels were detected using the Micro-CT kit. HE was applied to detect pathological changes in periodontal tissue. Western blot was applied to detect the expression of JAK2, STAT3, p-JAK2, and p-STAT3 proteins. Results Compared with the control group, the periodontal tissue of rats in the model group was damaged and inflammatory infiltration was severe, the gingival bleeding index, tooth mobility score, alveolar bone resorption, TNF-α, IL-6, IL-1β, MDA levels, p-JAK2/JAK2, p-STAT3/STAT3 expression were obviously increased, the SOD level was obviously decreased (P<0.05). Compared with the model group, the pathological damage in rats treated with different doses of Irisin was improved, the gingival bleeding index, tooth mobility score, alveolar bone resorption, TNF-α, IL-6, IL-1β, MDA levels, p-JAK2/JAK2, p-STAT3/STAT3 expression were obviously decreased, the SOD level was obviously increased, in a dose dependent manner (P<0.05). Compared with the Irisin H group, the pathological damage in the Irisin H+activator group worsened, the gingival bleeding index, tooth mobility score, alveolar bone resorption, TNF-α, IL-6, IL-1β, MDA levels, p-JAK2/JAK2, p-STAT3/STAT3 expression were obviously increased, the SOD level was obviously decreased (P<0.05). Conclusion Irisin inhibits oxidative stress and inflammatory response in periodontitis rats, alleviates periodontal tissue damage and reduces alveolar bone resorption, which may be related to inhibiting JAK2/STAT3 signaling pathway.
Key words: Irisin; Janus protein tyrosine kinase 2/signal transduction and transcriptional activator 3; periodontitis; periodontal tissue damage; inflammatory response; oxidative stress
牙周炎是一种进行性炎症性牙周疾病,其特征在于牙周组织破坏、牙槽骨吸收和牙齿缺失[1]。牙周炎是一种非常普遍的疾病,但会导致全身性炎症,增加多种疾病的患病风险,是一个需要尽快解决的公共卫生问题[2]。鸢尾素是一种由骨骼肌分泌的肌因子,参与成骨细胞增殖、脂质体内平衡、骨生成和肌肉生长,还作为全身许多炎症途径的介质,参与疾病发展[3]。Huang X等[4]研究提出鸢尾素可以促进牙周牙髓干细胞的成骨/成牙骨质分化,为牙龈卟啉单胞菌破坏的牙周硬组织的再生提供了方向,但其机制尚未明确。Janus蛋白酪氨酸激酶2(JAK2)/信号转导和转录激活子3(STAT3)信号在促进成骨细胞增殖和分化中起着至关重要的作用[5]。在牙周炎研究中[6],抑制JAK2/STAT3轴的激活可阻止成骨分化促进牙槽骨吸收,缓解牙周炎并重建骨稳态。IL-6是通过激活JAK2/STAT3信号通路介导脂多糖对鸢尾素的分泌减少,提示鸢尾素与JAK2/STAT3信号通路存在一定关系[7]。但鸢尾素对牙周炎的影响是否与JAK2/STAT3信号通路有关尚不清楚,因此本验证旨在探讨鸢尾素对牙周炎大鼠牙周组织损伤及其作用机制。
1 材料和方法
1.1 材料
1.1.1 实验试剂与仪器:TNF-α、IL-6、IL-1β试剂盒购自安迪生物科技(上海)有限公司;鸢尾素购自美国Biovisiona公司;JAK2/STAT3信号通路激活剂-香豆霉素购自BIOMOL公司;丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒购自南京建成生物工程有限公司;JAK2、STAT3、p-JAK2、p-STAT3一抗购自Abcam公司。Nikon Eclipse 80i光学显微镜购自尼康公司;EM-UC6超薄型切片机购自德国徕卡公司;Micro-CT系统购自ScancoMedicalAG公司。
1.1.2 实验动物:中山大学孙逸仙纪念医院提供体重为200~230 g的Sprague-Dawley雄性大鼠,许可证号:SYXK(粤)2022-0289。大鼠被饲养在(23±3)℃、(55±15)%的湿度以及8:00-22:00的光照环境中,随意进食和饮水,动物实验遵循国家实验动物护理和使用指南。
1.2 方法
1.2.1 牙周炎大鼠模型的制备及干预:将适应性喂养的大鼠随机选取10只进行注射生理盐水,标记为对照组;其余50只大鼠进行用棉线结扎上颌第一磨牙牙龈下部,并于牙龈沟部位接种牙龈卟啉单胞菌液,连续接种1周,每天接种1次,之后取出棉线,当大鼠第一磨牙牙周袋形成,牙龈红肿,牙槽骨吸收等现象,表明牙周炎大鼠造模成功[8]。造模成功的大鼠随机分为模型组、鸢尾素低剂量(鸢尾素-L)、中剂量(鸢尾素-M)、高剂量(鸢尾素-H)组、鸢尾素-H+激活剂组,每组10只。其中不同剂量的鸢尾素干预组分别以50、100和200 mg/kg的剂量灌胃[9];鸢尾素-H+激活剂组以200 mg/kg的剂量灌胃的同时,以2 mg/kg香豆霉素腹腔注射干预[10];其余各组以等体积的生理盐水干预,每天1次,连续干预4周。
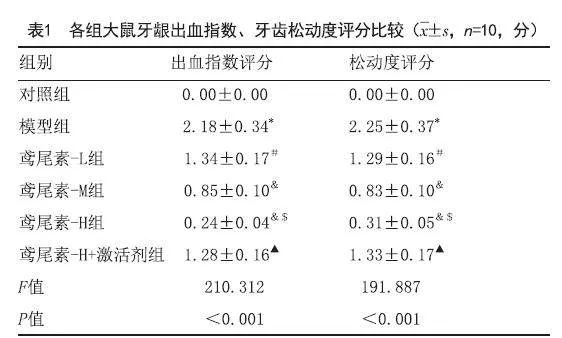
1.2.2 牙龈出血指数与牙齿松动度评分:干预结束后,麻醉各组大鼠,肉眼观察大鼠牙齿颜色,并对第一磨牙及牙周周围进行拍照[11];其中0分为牙龈正常;1分为轻度炎症,探测时无出血;2分为中度炎症、发红、水肿和探诊出血;3分为严重炎症、存在溃疡、水肿和严重出血。牙齿松动度评分:0分为无移动;1分为轻度活动(前庭-腭);2分为中度活动度(前庭-腭,近中-远中);3分为重度松动(垂直,牙齿进出牙槽)。
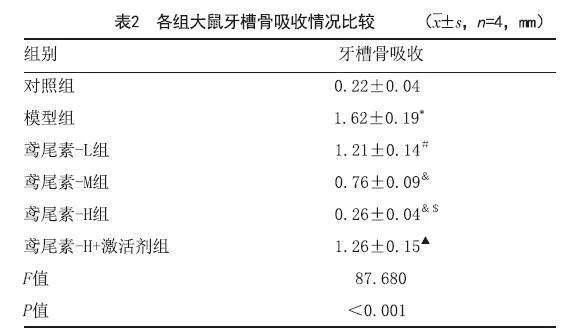
1.2.3 Micro-CT测定牙槽骨吸收:评分结束后,各组随机选取4只大鼠,经戊巴比妥钠麻醉后处死,将颌骨组织浸泡在亚甲蓝溶液中,随后洗去多余染液,Micro-CT拍摄,软件分别测定第一磨牙至第三磨牙牙槽嵴顶与釉牙骨质界的距离,标记为牙槽骨吸收值。多次测量取平均值。
1.2.4 ELISA检测牙龈组织中TNF-α、IL-6、IL-1β水平:麻醉各组剩余6只大鼠,将部分牙龈组织在冰上解冻,并在300μl裂解缓冲液中匀浆,然后补充蛋白酶抑制剂混合物。随后将样品在4℃下以14 000 r/min离心保持10 min,收集上清液试剂盒检测TNF-α、IL-6、IL-1β水平。
1.2.5 试剂盒检测牙龈组织中MDA、SOD水平:取部分牙龈组织,按照试剂盒说明检测MDA、SOD水平。
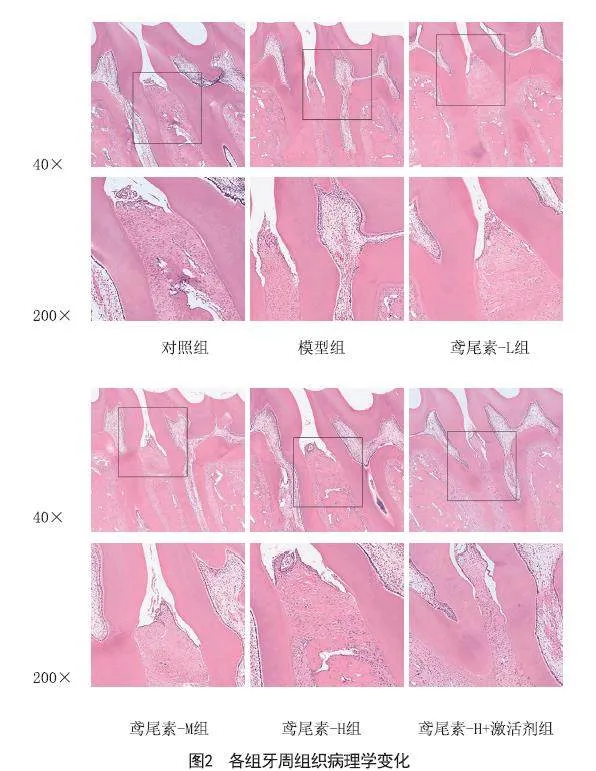
1.2.6 HE检测牙周组织病理学变化:颌骨组织用10%中性福尔马林缓冲液固定,然后用乙二胺四乙酸在4℃脱钙2周。在乙醇中脱水后,将样品包埋在石蜡中,并以5μm的厚度进行切片。切片用二甲苯脱蜡,用梯度乙醇进行再水合,并用苏木精和曙红染色。使用光学显微镜观察组织变化。
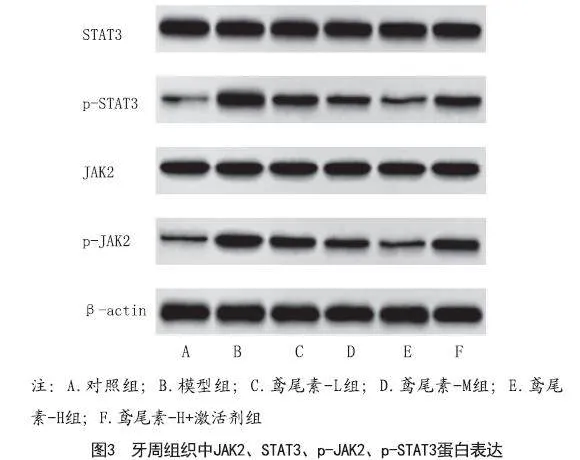
1.2.7 Western blot检测JAK2、STAT3、p-JAK2、p-STAT3蛋白表达:在含有苯甲基磺酰氟和磷酸酶抑制剂的RIPA缓冲液中裂解牙周组织。定量后上样,并进行电泳、转模,将转移的聚偏二氟乙烯膜在5%Tris缓冲盐水的脱脂牛奶中封闭。然后将膜与JAK2、STAT3、p-JAK2、p-STAT3在4℃下孵育,次日将膜与二抗共孵育。使用增强化学发光试剂进行蛋白印迹,蛋白条带灰度值进行定量蛋白表达。
1.3 统计学分析:采用SPSS 27.0软件分析实验数据,P<0.05时,差异有统计学意义。计量资料以均数±标准差(x¯±s)表示,单因素方差分析用于多组间比较,以snk-q检验进一步两两比较。
2 结果
2.1 鸢尾素对各组大鼠牙龈出血指数、牙齿松动度评分的影响:与对照组相比,模型组大鼠牙龈出血指数、牙齿松动度评分显著增加(P<0.05);与模型组相比,不同剂量的鸢尾素组大鼠牙龈出血指数、牙齿松动度评分显著降低,具有剂量依赖性(P<0.05);与鸢尾素-H组相比,鸢尾素-H组+激活剂组大鼠牙龈出血指数、牙齿松动度评分显著增加(P<0.05),见表1。
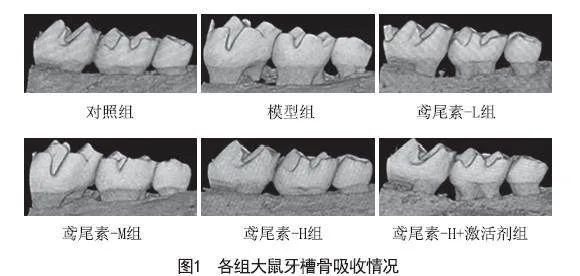
2.2 鸢尾素对各组大鼠牙槽骨吸收影响:与对照组相比,模型组大鼠牙槽骨吸收显著增加(P<0.05);与模型组相比,不同剂量的鸢尾素组牙槽骨吸收显著降低,具有剂量依赖性(P<0.05);与鸢尾素-H组相比,鸢尾素-H组+激活剂组牙槽骨吸收显著增加(P<0.05),见图1、表2。
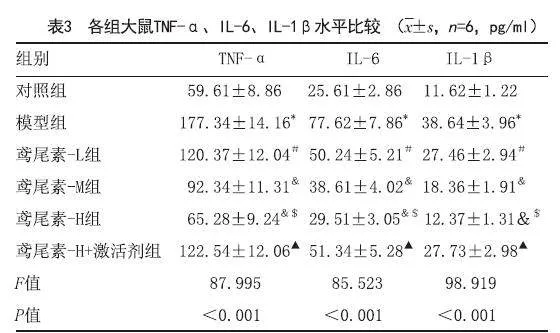
2.3 鸢尾素对各组大鼠牙周组织中TNF-α、IL-6、IL-1β水平:与对照组相比,模型组大鼠TNF-α、IL-6、IL-1β水平显著增加(P<0.05);与模型组相比,不同剂量的鸢尾素组TNF-α、IL-6、IL-1β水平显著降低,具有剂量依赖性(P<0.05);与鸢尾素-H组相比,鸢尾素-H组+激活剂组TNF-α、IL-6、IL-1β水平显著增加(P<0.05),见表3。
2.4 鸢尾素对各组大鼠牙周组织中MDA、SOD水平:与对照组相比,模型组MDA水平显著增加,SOD水平显著降低(P<0.05);与模型组相比,不同剂量的鸢尾素组MDA水平显著降低,SOD水平显著增加,具有剂量依赖性(P<0.05);与鸢尾素-H组相比,鸢尾素-H组+激活剂组MDA水平显著增加,SOD水平显著降低(P<0.05),见表4。
2.5 鸢尾素对各组大鼠牙周组织病理学的影响:对照组大鼠结缔组织无显著变化,牙槽骨无吸收;模型组牙周组织被破坏,结缔组织中炎性浸润严重,并伴随牙槽骨吸收;鸢尾素-L组、鸢尾素-M组、鸢尾素-H组病理损伤得到改善,牙槽骨吸收减少,炎性浸润降低;但鸢尾素-H+激活剂组病理损伤较鸢尾素-H组加重,见图2。
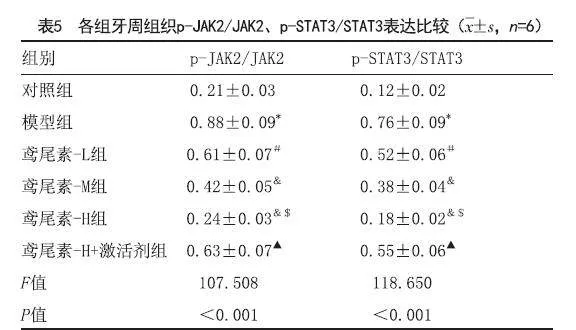
2.6 鸢尾素对各组大鼠JAK2、STAT3、p-JAK2、p-STAT3蛋白表达影响:与对照组相比,模型组p-JAK2/JAK2、p-STAT3/STAT3表达显著增加(P<0.05);与模型组相比,不同剂量的鸢尾素组p-JAK2/JAK2、p-STAT3/STAT3表达显著降,具有剂量依赖性(P<0.05);与鸢尾素-H组相比,鸢尾素-H组+激活剂组p-JAK2/JAK2、p-STAT3/STAT3表达显著增加(P<0.05),见图3、表5。
3 讨论
牙周炎是世界范围内最常见的口腔疾病之一,由牙周病原微生物感染和宿主免疫系统失调引起,我国牙周炎患病率高达80%[12]。此外牙周炎的发生与糖尿病、心血管疾病等疾病的发作、发展有关[13],因此治疗牙周炎的目前亟需解决的问题。
鸢尾素是一种新的激素样肌动蛋白,具有调节凋亡、炎症和氧化应激的独特功能[6]。如在骨关节炎发展中[14],鸢尾素抑制炎症介导的氧化应激和细胞外基质的减少,保护软骨组织。在牙周炎大鼠模型中[15],鸢尾素可以减轻牙槽骨丢失和氧化应激,恢复炎症刺激影响的牙周膜细胞的成骨和破骨能力。牙周炎作为常见的慢性炎症性疾病,炎症反应和氧化应激是其中主要的致病因素[16]。本研究结果发现牙周炎大鼠牙龈出血指数、牙齿松动度评分、牙槽骨吸收、TNF-α、IL-6、IL-1β、MDA水平增加,SOD水平降低,病理组织显示牙周组织被破坏,炎性浸润严重,与先前研究[17]相吻合。但经鸢尾素干预后,牙周炎大鼠病理损伤得到改善,牙槽骨吸收好转,牙龈出血指数、牙齿松动度评分降低,氧化应激及炎性水平被抑制,表明鸢尾素可以抑制牙周炎大鼠氧化应激及炎性反应,改善大鼠牙周病变。
JAK2/STAT3参与炎症反应、细胞生物学过程、氧化应激等途径[18]。大量研究发现在牙周组织中存在JAK2和STAT3高表达[19]。在人慢性根尖周炎研究中[20],JAK2、STAT3表达在根尖周肉芽肿组织及根尖周囊肿组织中均上调。在粪肠球菌诱导的根尖周炎大鼠中[21],JAK2、STAT3表达随着炎症反应的增加而增加。牙周炎与根尖周炎均炎症性骨破坏疾病,其机制相似,故推测JAK2/STAT3信号通路可能参与牙周炎的进展。结果发现,牙周炎大鼠牙周组织中p-JAK2/JAK2、p-STAT3/STAT3表达增加,提示牙周炎的发生可能与激活JAK2/STAT3信号通路有关。经鸢尾素干预后,JAK2/STAT3信号通路被抑制,牙周炎大鼠牙周病变得到改善,推测鸢尾素可能通过抑制JAK2/STAT3信号通路对牙周炎大鼠发挥抗炎、抗氧化作用。最后,实验以JAK2/STAT3通路激活剂-香豆霉素进行反向验证,结果发现香豆霉素逆转了鸢尾素对牙周炎大鼠的保护作用,表明鸢尾素对牙周炎大鼠牙周组织损伤的改善作用是通过抑制JAK2/STAT3信号通路实现。
综上所述,鸢尾素抑制牙周炎大鼠氧化应激、炎性反应,减轻大鼠牙周组织损伤,减少牙槽骨吸收,可能与抑制JAK2/STAT3信号通路有关,具体机制仍在进一步研究中。
[参考文献]
[1]Feng C, Liu Y, Zhang B Y, et al. Rapamycin inhibits osteoclastogenesis and prevents lps-induced alveolar bone loss by oxidative stress suppression[J]. ACS Omega, 2023,8(23):20739-20754.
[2]Branco-de-Almeida L S, Franco G C N, Castro M L, et al. Protective effects of desipramine on alveolar bone in experimental periodontitis[J]. J Periodontol, 2020,91(12):1694-1703.
[3]Slate-Romano J J, Yano N, Zhao T C. Irisin reduces inflammatory signaling pathways in inflammation-mediated metabolic syndrome[J]. Mol Cell Endocrinol, 2022,552(1):111676-111694.
[4]Huang X, Xiao J, Wang X, et al. Irisin attenuates P. gingivalis-suppressed osteogenic/cementogenic differentiation of periodontal ligament cells via p38 signaling pathway[J]. Biochem Biophys Res Commun, 2022, 618(1):100-106.
[5]Jo S, Wang S E, Lee Y L, et al. IL-17A induces osteoblast differentiation by activating JAK2/STAT3 in ankylosing spondylitis[J]. Arthritis Res Ther, 2018,20(1):115-124.
[6]Pan L, Zhang C, Zhang H, et al. Osteoclast-Derived Exosomal miR-5134-5p Interferes with Alveolar Bone Homeostasis by Targeting the JAK2/STAT3 Axis[J]. Int J Nanomedicine, 2023,18(1):3727-3744.
[7]Yan Y, Dong R, Zhang C, et al. Interleukin-6 mediates lipopolysaccharide-inhibited irisin secretion in Nile tilapia (Oreochromis niloticus)[J]. Fish Shellfish Immunol, 2022,121(1):99-107.
[8]苏娟娟,朱永翠,张文玲.连翘苷对牙周炎大鼠p38MAPK/c-Fos信号通路及破骨细胞活化的影响[J].口腔医学研究,2021,37(1):33-38.
[9]闫海波,魏代淑,韩红星.鸢尾素对局灶性脑缺血再灌注大鼠磷脂酰肌醇3激酶/蛋白激酶B通路及Th1/Th2失衡的影响[J].中国临床药理学杂志,2021,37(10):1153-1157.
[10]胡春艳,刘建林,李方晓.舒血宁对慢性肾衰竭透析大鼠的心肌保护作用及对JAK2/STAT3信号通路的影响[J].中西医结合心脑血管病杂志,2021,19(17):2929-2934.
[11]Lee H J, Lee D R, Choi B K, et al. Antiperiodontitis effects of magnolia biondii extract on ligature-induced periodontitis in rats[J]. Nutrients, 2019,11(4):934-943.
[12]郭建茹,冯妍,娄会杰,等.PRF联合龈下刮治,根面平整术治疗慢性牙周炎临床效果分析[J].中国美容医学,2022,31(8):160-163.
[13]Vitkov L, Muñoz L E, Knopf J, et al. Connection between Periodontitis-induced Low-grade endotoxemia and systemic diseases: neutrophils as protagonists and targets[J]. Int J Mol Sci, 2021,22(9):4647-4663.
[14]Wang F S, Kuo C W, Ko J Y, et al. Irisin mitigates oxidative stress, chondrocyte dysfunction and osteoarthritis development through regulating mitochondrial integrity and autophagy[J]. Antioxidants (Basel), 2020,9(9):810-826.
[15]Li G, Qin H, Zhou M, et al. Knockdown of SIRT3 perturbs protective effects of irisin against bone loss in diabetes and periodontitis[J]. Free Radic Biol Med, 2023, 200(1):11-25.
[16]张馨月,郑艳薇.益生菌联合消退素D1对牙周炎大鼠牙龈组织中炎症因子,正五聚体蛋白3和氧化应激的影响[J].中国美容医学,2022,31(8):104-107.
[17]俞梅,刘思佳,喻锦娴.扶脾益肾汤调节Wnt/-catenin信号通路对牙周炎大鼠牙周组织损伤的影响[J].湖北中医药大学医报,2023,25(2):15-19.
[18]余扬.JAK2信号通路介导人恶性黑素瘤A375细胞的自噬和凋亡机制研究[J].中国美容医学,2020,29(4):98-101.
[19]敖翔,王丽娜,王娇娇,等.JAK2-STAT3信号通路在大鼠根尖周炎中表达的相关性研究[J].口腔医学研究,2017,33(1):1-5.
[20]张晨,刘珺,赵涵,等.Janus蛋白酪氨酸激酶2/信号转导和转录激活因子3信号转导通路在人慢性根尖周炎中的表达[J].口腔医学研究,2019,35(1):84-88.
[21]Wang L, Jin H, Ao X, et al. JAK2-STAT3 signaling pathway is involved in rat periapical lesions induced by Enterococcus faecalis[J]. Oral Dis, 2019,25(7):1769-1779.
[收稿日期]2023-11-16
本文引用格式:田梦婷,赵景瑶,刘晶.鸢尾素调节JAK2/STAT3信号通路对牙周炎大鼠牙周组织损伤的影响[J].中国美容医学,2024,33(8):22-26.
