外周血绝对嗜酸性粒细胞计数水平对肺癌预后的评估价值研究
2024-08-06易芬王勇徐爱晖

【摘要】 背景 世界范围内肺癌的发生率和死亡率均较高且呈升高趋势,目前针对肺癌的发生、发展及预后已有许多研究,但仍缺乏早期评估肺癌预后的简便、有效手段。目的 探讨绝对嗜酸性粒细胞计数水平对肺癌患者的预后评估的意义。方法 回顾性分析2019年6月—2022年12月于安徽医科大学第一附属医院住院的152例肺癌患者的临床资料,通过门诊及电话随访的方式对患者进行随访调查,评估患者是否出现疾病进展,随访至2023年5月。将出现肿瘤复发、转移或死亡的患者纳入预后欠佳组,余纳入预后良好组,并记录患者无进展生存期(PFS)。通过组间差异性比较筛选影响肺癌患者预后的影响因素并进行多因素Cox回归分析;采用Kaplan-Meier生存分析探讨绝对嗜酸性粒细胞计数对肺癌患者预后的影响,绘制绝对嗜酸性粒细胞计数评估肺癌预后的受试者工作特征(ROC)曲线,计算ROC曲线下面积(AUC)并比较其预测价值;从全基因组关联分析汇总数据和国际肺癌研究联盟分别收集绝对嗜酸性粒细胞计数和肺癌的相关数据集进行孟德尔随机化分析,评估绝对嗜酸性粒细胞计数与肺癌之间的因果关系。结果 按照肺癌患者预后情况分为预后良好组(n=72)和预后欠佳组(n=80),两组患者绝对嗜酸性粒细胞计数水平比较,差异有统计学意义(P=0.004)。多因素Cox回归分析结果显示,绝对嗜酸性粒细胞计数是肺癌生存结局的独立影响因素(HR=1.58,95%CI=1.03~2.44,P=0.037)。Kaplan-Meier生存分析结果显示,绝对嗜酸性粒细胞计数升高组(n=76)的平均PFS[(618.44±72.57)d]短于正常组(n=76)的平均PFS[(842.32±76.04)d](P=0.048)。绝对嗜酸性粒细胞计数预测肺癌预后的AUC为0.634。孟德尔随机化分析结果得出绝对嗜酸性粒细胞计数可能是东亚人群中肺癌的总体风险因素,且为不利因素(OR=1.07,95%CI=1.01~1.13,P=0.030)。结论 绝对嗜酸性粒细胞计数水平的升高可能是影响肺癌患者预后的不利因素。
【关键词】 肺癌;绝对嗜酸性粒细胞计数;预后;Cox回归分析;孟德尔随机化分析
【中图分类号】 R 734.2 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0899
Evaluation Value of Peripheral Absolute Eosinophil Count for the Prognosis of Lung Cancer
YI Fen,WANG Yong,XU Aihui*
Department of Respiratory and Critical Care Medicine,the First Affiliated Hospital of Anhui Medical University,Hefei 230022,China
*Corresponding author:XU Aihui,Chief physician;E-mail:xuaihui0909@163.com
【Abstract】 Background Lung cancer remains a significant global health challenge,with both its incidence and mortality rates on the rise worldwide. Despite numerous investigations into its etiology,progression,and prognostic indicators,a pressing need persists for straightforward and efficient methods to assess the early prognosis of lung cancer. Objective This study aims to investigate the prognostic significance of absolute eosinophil count level in patients with lung cancer. Methods We conducted a retrospective analysis of clinical data from 152 lung cancer patients admitted to the First Affiliated Hospital of Anhui Medical University between June 2019 and December 2022,with follow-up conducted until May 2023. Patients experiencing tumor recurrence,metastasis,or mortality were categorized into the poor prognosis group,while the remaining patients comprised the good prognosis group. Progression-free survival time(PFS) was meticulously recorded. Group comparisons were made to identify factors influencing lung cancer prognosis,followed by multivariate Cox regression analysis. Additionally,Kaplan-Meier survival analysis was employed to assess the impact of absolute eosinophil count on survival. Receiver operating characteristic(ROC) curve analysis was utilized to evaluate the prognostic efficacy of lung cancer,with the area under the ROC curve(AUC) calculated to gauge its predictive value. To further explore the relationship between eosinophil counts and lung cancer,datasets were procured from genome-wide association analysis pooled data and the International Consortium for Lung Cancer Research for Mendelian randomization analysis,elucidating potential causal links. Results Patients were stratified into good and poor prognosis groups based on their lung cancer prognosis. A statistically significant contrast in absolute eosinophil count was observed between these groups(P=0.004). Multivariate Cox regression analysis highlighted absolute eosinophil count as an independent risk factor for lung cancer survival outcomes(HR=1.58,95%CI=1.03-2.44,P=0.037). Kaplan-Meier analysis revealed that the PFS time for patients with elevated absolute eosinophilic counts(n=76)(618.44±72.57 )days was shorter compared to those with normal counts(n=76)(842.32±76.04)days (P=0.048). Furthermore,the AUC was 0.634. Mendelian randomization findings indicated that eosinophil count might serve as an adverse overall risk factor for lung cancer in the East Asian population(OR=1.07,95%CI=1.01-1.13,P=0.030). Conclusion The elevation of absolute eosinophil count levels may adversely impact the prognosis of lung cancer patients.
【Key words】 Lung neoplasms;Absolute eosinophil count;Prognosis;Cox regression analysis;Mendelian randomization analysis
肺癌是起源于肺部支气管黏膜或腺体的恶性肿瘤。在全球范围内,肺癌是对人群健康和生命威胁较大的恶性肿瘤之一,近50年来,许多国家和地区报道肺癌的发病率和死亡率明显升高[1]。根据2022年国家癌症中心发布的全国癌症报告,我国癌症的新发病例和死亡人数位居全球第一,其中肺癌的发病率及死亡率均较高[2]。虽然肺癌诊断明确后即可进行手术、化学药物治疗或其他方式的治疗,目前仍缺乏早期判断肺癌预后的有效手段。研究发现肿瘤相关嗜酸性粒细胞可作为肿瘤预后的评估因子,但存在争议,其中一部分认为嗜酸性粒细胞增多可以降低患者癌症的复发率,而另一部分则持相反的观点[3-5]。
嗜酸性粒细胞作为人体白细胞的正常组成成分,来源于骨髓的造血干细胞,从骨髓中分化、成熟,并迁移到血液中,对细菌、寄生虫具有杀伤作用,同时对于免疫反应具有重要意义。此外,有文献报道成熟的嗜酸性粒细胞表达大量的表面分子,包括各种受体(如细胞因子受体等)、黏附分子和整合素,其中白介素(IL)-3、IL-5和巨噬细胞集落刺激因子(GM-CSF)对于调节嗜酸性粒细胞的发育至关重要[6-8]。在肿瘤免疫方面,成熟的嗜酸性粒细胞进入血液循环后与细胞内黏附分子和血管细胞黏附分子相互作用后,在不同类型趋化信号的作用下迁移到肿瘤微环境(tumor microenvironment,TME)中发挥作用[9-11]。
孟德尔随机化(Mendelian randomization,MR)研究以基因为工具变量(IV)研究疾病关联性,可以有效解决传统观察性研究的局限性[12]。根据孟德尔遗传定律,等位基因从父母随机分配到后代,不太可能受到混杂因素的影响。研究最多的IV类型是单核苷酸多态性(SNP)。IV是指与暴露因素相关但与其他混杂因素无关且与结局无直接关系的一类变量。如果基因型决定表型,则基因型通过表型与疾病发展相关。因此,基因型可以用作IV来推断表型和疾病结局之间的关联。
本研究的主要目的是探讨外周血绝对嗜酸性粒细胞计数(absolute eosinophil count,AEC)水平对肺癌患者预后评价的意义,并通过MR分析方法评估AEC增多与肺癌的因果关系。
1 资料与方法
1.1 一般资料
选择2019年6月—2022年12月于安徽医科大学第一附属医院住院的152例肺癌患者。
1.2 纳入及排除标准
1.2.1 纳入标准:(1)AEC升高:正常人外周血中嗜酸性粒细胞占白细胞的0.5%~5%,绝对值为0.05×109/L~0.5×109/L。将AEC≥0.5×109/L定义为AEC升高[13]。(2)病理诊断为原发性肺癌;无寄生虫感染及相关高危因素;无支气管哮喘或过敏性鼻炎病史及家族史;无血液系统相关疾病;无全身糖皮质激素类药物使用史。
1.2.2 排除标准:(1)无明确病理结果;(2)既往有寄生虫感染史或接触史;(3)合并有其他疾病:支气管哮喘、血液系统疾病、其他部位恶性肿瘤、结缔组织疾病等;(4)有药物滥用、吸毒、酗酒等既往史。
1.3 收集资料
1.3.1 收集患者的一般情况:包括年龄、性别、BMI、吸烟史、病理分型及治疗方式等基本信息并记录,通过采集身份证号信息避免数据重复。
1.3.2 收集患者入院接受治疗前的相关实验室及影像学指标:(1)血常规:AEC、绝对嗜中性粒细胞计数(absolute neutrophil count,ANC)、绝对淋巴细胞计数(absolute lymphocyte count,ALC),并计算AEC与ALC比率(eosinophil-to-lymphocyte ratio,ELR)、ANC与ALC比率(neutrophil-to-lymphocyte ratio,NLR);(2)生化:球蛋白(globulin,GLB)、前白蛋白(prealbumin,PA);(3)止凝血:D-二聚体(D-dimer)、纤维蛋白原(fibrinogen,FIB),并计算FIB与PA比率(fibrinogen to prealbumin ratio,FPR);(4)肿瘤标志物:癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)、细胞角蛋白19片段(CYFRA21-1);(5)预后情况:通过门诊及电话随访的方式对患者进行随访调查,每3个月随访1次,评估患者是否出现疾病进展,将出现肿瘤复发、转移或死亡的患者纳入预后欠佳组,余纳入预后良好组,并记录患者无进展生存期(progression-free-survival,PFS),PFS定义为从治疗开始至肿瘤转移、复发或全因死亡的时间。随访截止时间为2023年5月。
1.4 统计学方法
应用SPSS 25.0软件及R(4.3.2)版本进行数据的统计学分析处理及绘图。符合正态分布的计量资料采用(x-±s)表示,两组间比较采用成组t检验;不符合正态分布的计量资料采用M(P25,P75)表示,两组间比较采用Mann-Whitney U检验;计数资料以相对数表示,组间比较采用χ2检验。总生存率采用Kaplan-Meier法估计,组间比较采用Log-rank检验;使用R(4.3.2)版本survive包及ggplot2包绘制生存曲线;使用X-tile 3.6.1软件[14]确定最佳AEC截止值,X-tile 3.6.1软件是由耶鲁大学开发的一款单一功能的软件,通过选择显著的未校正的P值和最高χ2值提供数据的最佳划分。绘制受试者工作特征(ROC)曲线并计算曲线下面积(AUC)评估AEC对肺癌患者预后的预测价值。以P<0.05被认为差异具有统计学意义。
1.5 MR分析
1.5.1 MR分析基于3个假设:(1)IV与AEC密切相关;(2)IV与许多混杂因素无关;(3)IV仅通过其对AEC的影响而非其他途径影响肺癌。使用双样本MR方法中的3种分析方法评估因果关系,包括逆方差加权平均法(IVW)、MR-Egger回归和加权中位数法。
1.5.2 与AEC相关的遗传变异:从全基因组关联分析(genome-wide association study,GWAS)汇总数据中收集数据集(ID:ebi-a-GCST90002299,86 890名东亚血统的个体),包含48个与AEC相关的SNP,将不符合GWAS的统计学显著性阈值(P<5×10-8),且连锁不平衡(r2>0.001)的SNP剔除。
1.5.3 与肺癌相关的遗传变异:从国际肺癌研究联盟(ILCCO/TRICL)收集已发表的肺癌GWAS总结数据(ID:ieu-a-987,包含29 863例肺癌病例和55 586例对照病例),对于与AEC相关的每个选定的SNP,检索关于ILCCO的信息。
2 结果
2.1 两组一般资料比较
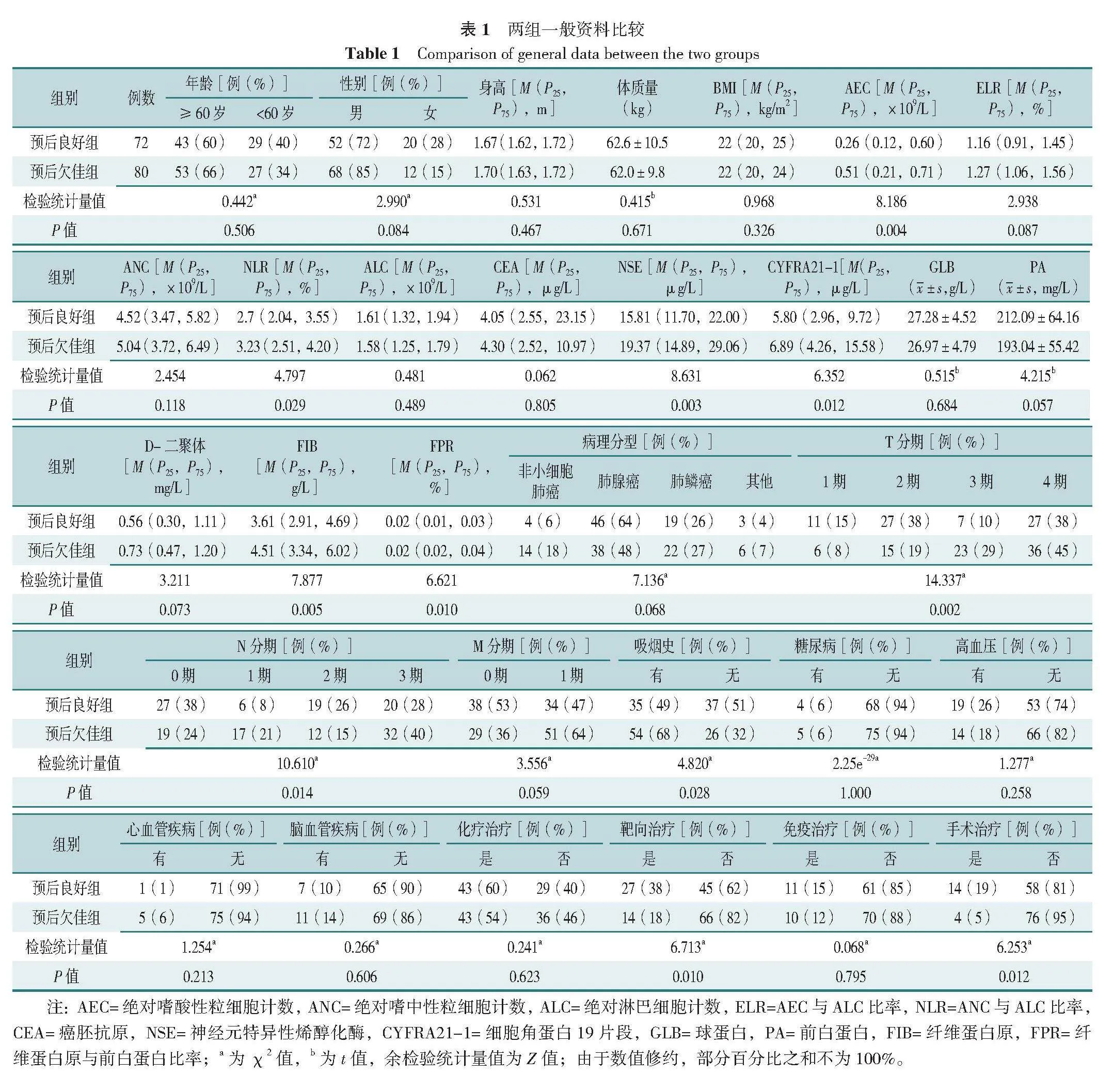
根据患者的生存结局,预后良好组72例,预后欠佳组80例。两组年龄、性别、身高、体质量、ELR、ANC、ALC、CEA、GLB、PA、D-二聚体、BMI、病理分型、M分期、糖尿病、高血压、心血管疾病、脑血管疾病、化疗治疗、免疫治疗比较,差异均无统计学意义(P>0.05);两组AEC、NLR、NSE、CYFRA21-1、FIB、FPR、T分期、N分期、吸烟史、靶向治疗、手术治疗比较,差异均有统计学意义(P<0.05),见表1。
2.2 肺癌患者预后的多因素Cox回归分析
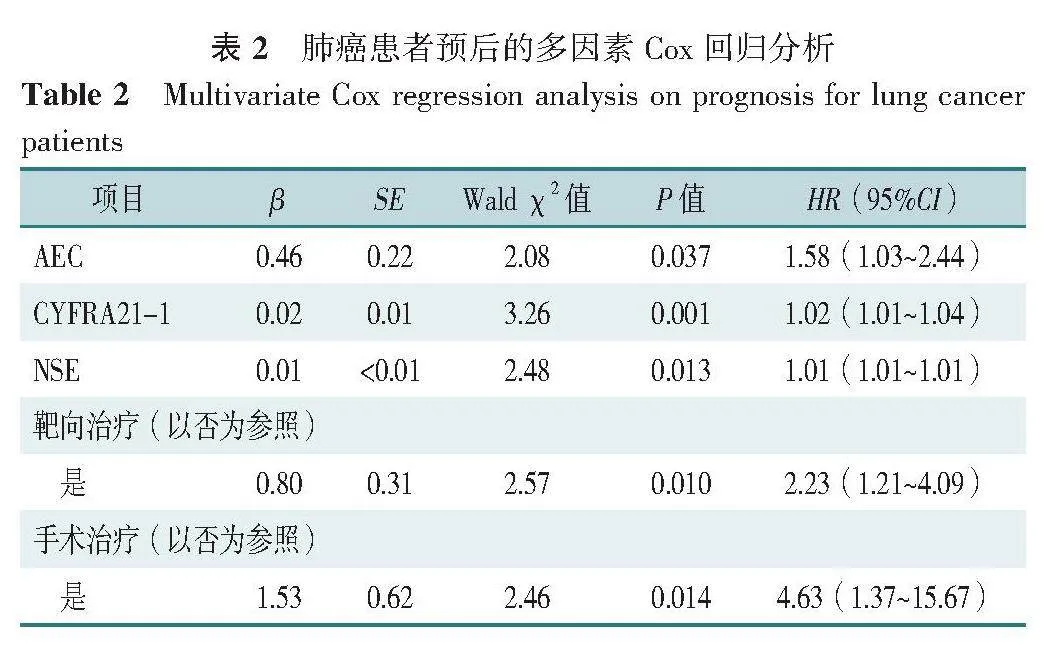
以预后情况为因变量(赋值:预后良好=0,预后欠佳=1),从单因素分析结果中获取P<0.05的变量作为自变量纳入模型进行多因素Cox回归分析,结果显示,AEC、CYFRA21-1和NSE水平升高、靶向治疗和手术治疗方式与肺癌患者预后相关(P<0.05,表2)。
2.3 肺癌患者PFS比较
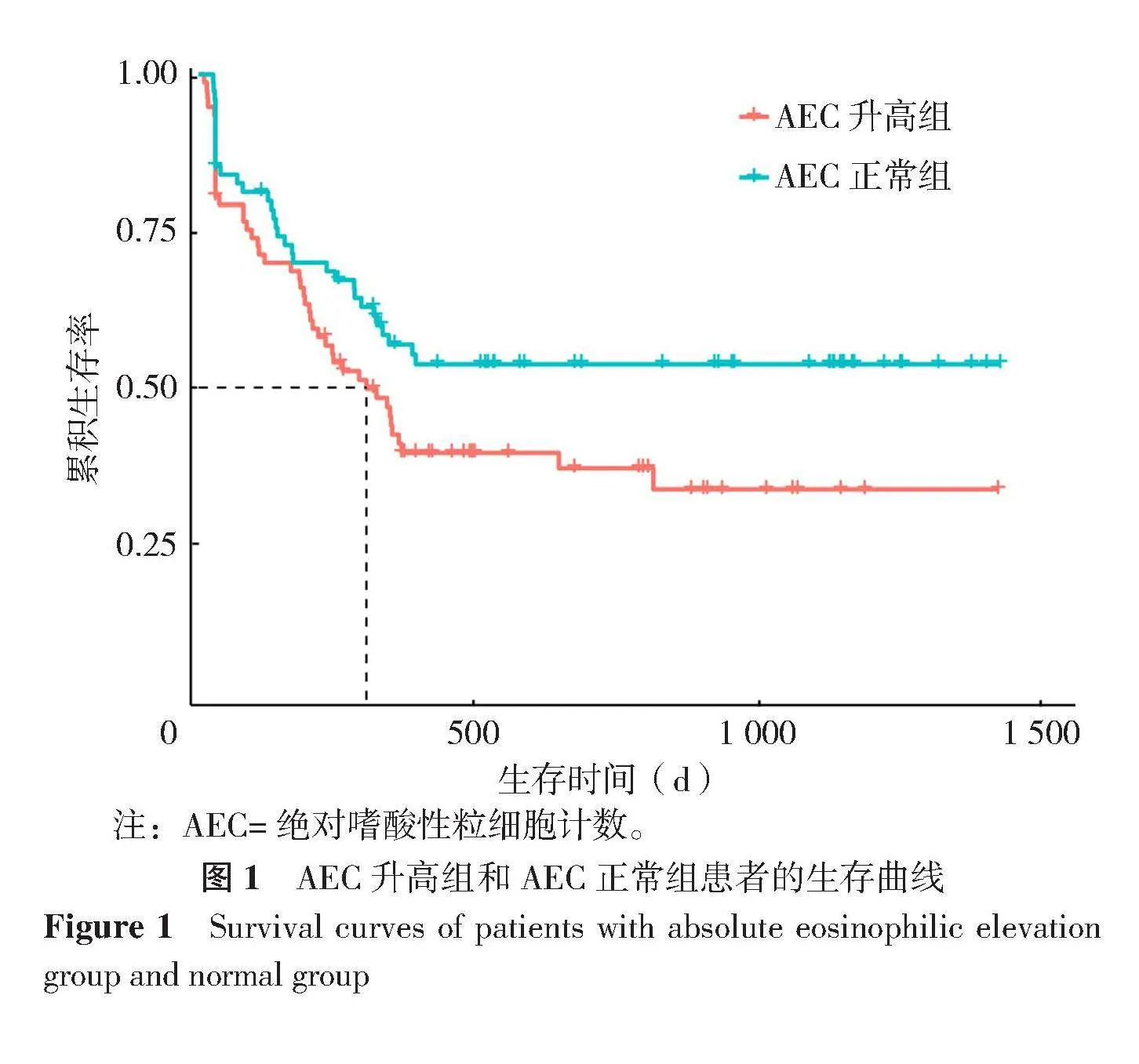
152例患者中,AEC升高组及正常组患者均为76例。截至随访时间,肺癌患者PFS为(731.26±53.24)d,AEC升高组PFS为(618.44±72.57)d,AEC正常组PFS为(842.32±76.04)d。AEC升高组PFS短于AEC正常组,差异有统计学意义(χ2=3.926,P=0.048,图1)。
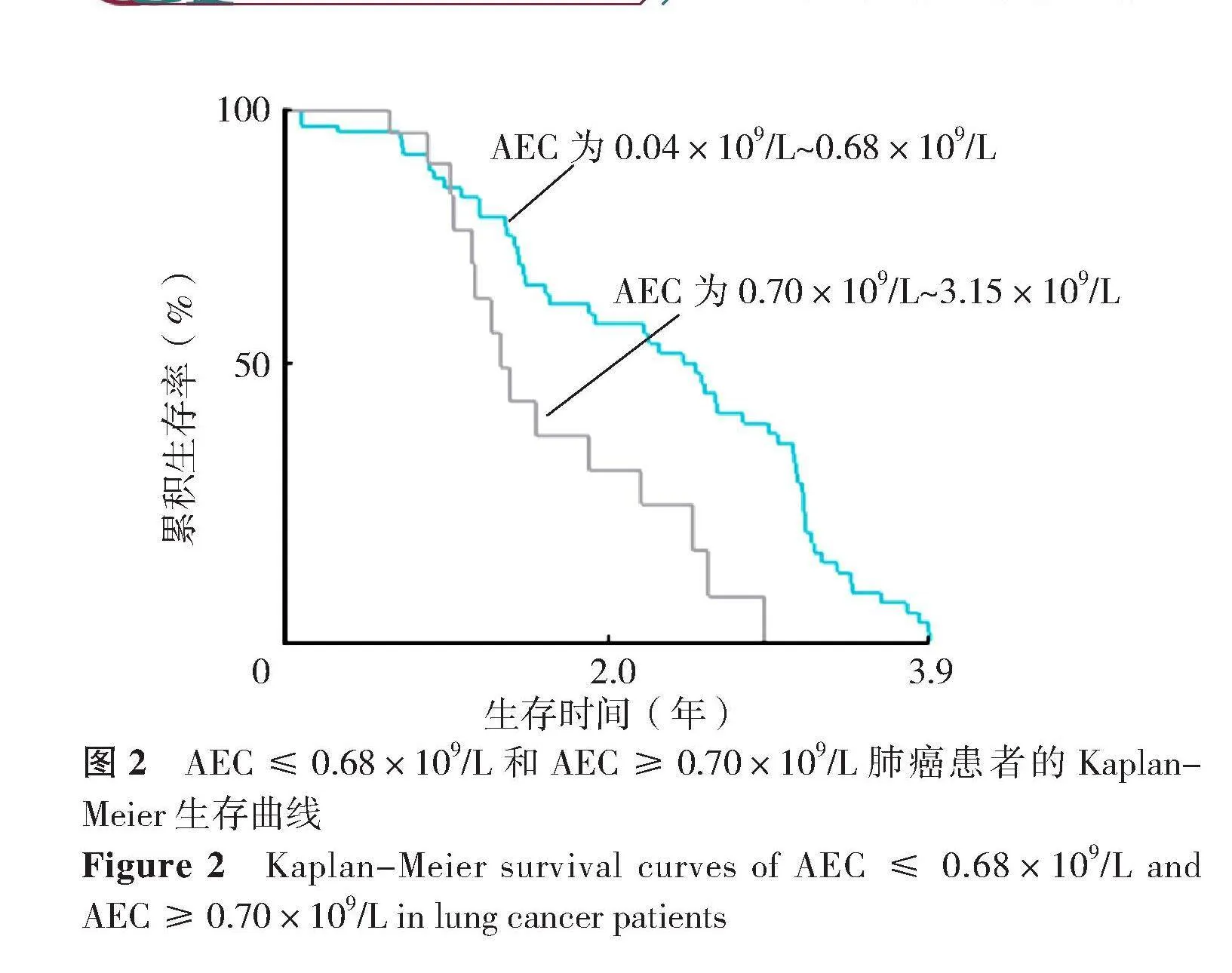
使用X-tile 3.6.1软件确定的最佳AEC截止值为0.70×109/L(χ2=6.950 7,未校正P=0.008 15)。依据该阈值将AEC分为两组,分别为115例(75.66%)(AEC为0.04×109/L~0.68×109/L)和37例(24.34%)(AEC为0.70×109/L~3.15×109/L)。两组Kaplan-Meier生存曲线比较,差异有统计学意义(χ2=6.951,P=0.008,图2)。
2.4 不同治疗方式肺癌患者的PFS比较
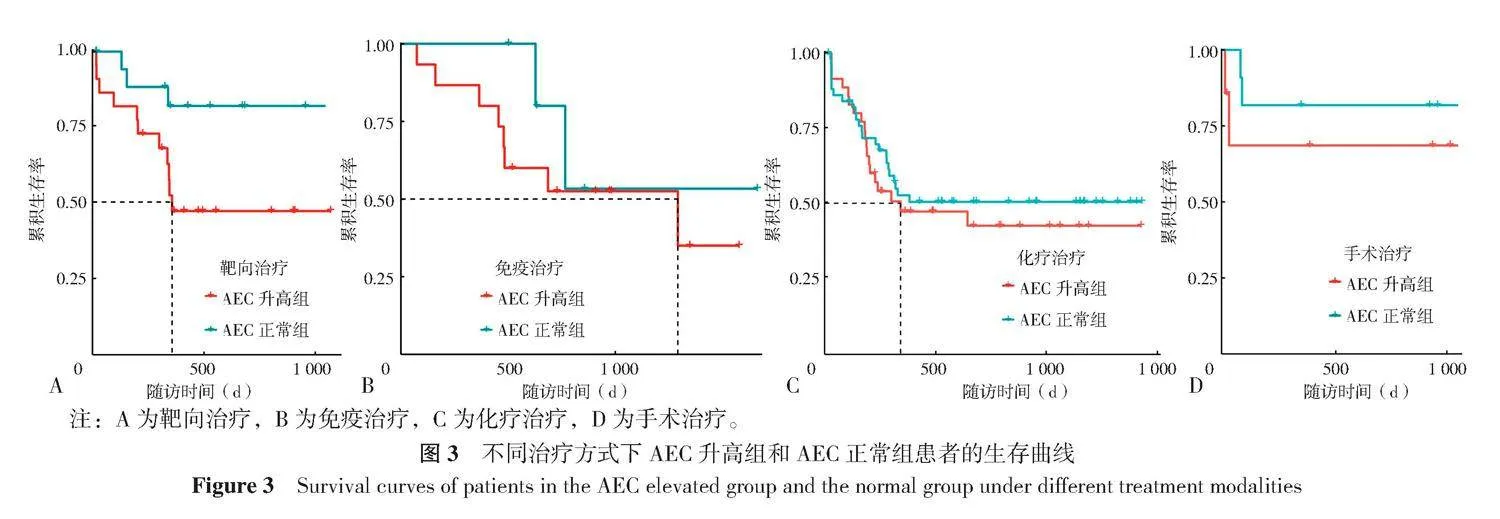
绘制采用不同治疗方式的肺癌患者的无进展生存曲线,结果显示靶向治疗患者在AEC升高组的PFS短于AEC正常组,差异有统计学意义(χ2=4.337,P=0.037)(图3A),在免疫治疗、化疗治疗和手术治疗中,AEC升高组和AEC正常组PFS比较,差异均无统计学意义(χ2=0.671,P=0.410;χ2=0.358,P=0.550;χ2=0.653,P=0.420)(图3B~D)。
2.5 ROC曲线
绘制AEC预测肺癌患者预后的ROC曲线,结果显示,AUC为0.634(95%CI=0.546~0.732),灵敏度为91.2%,特异度为33.3%(图4)。
2.6 MR分析
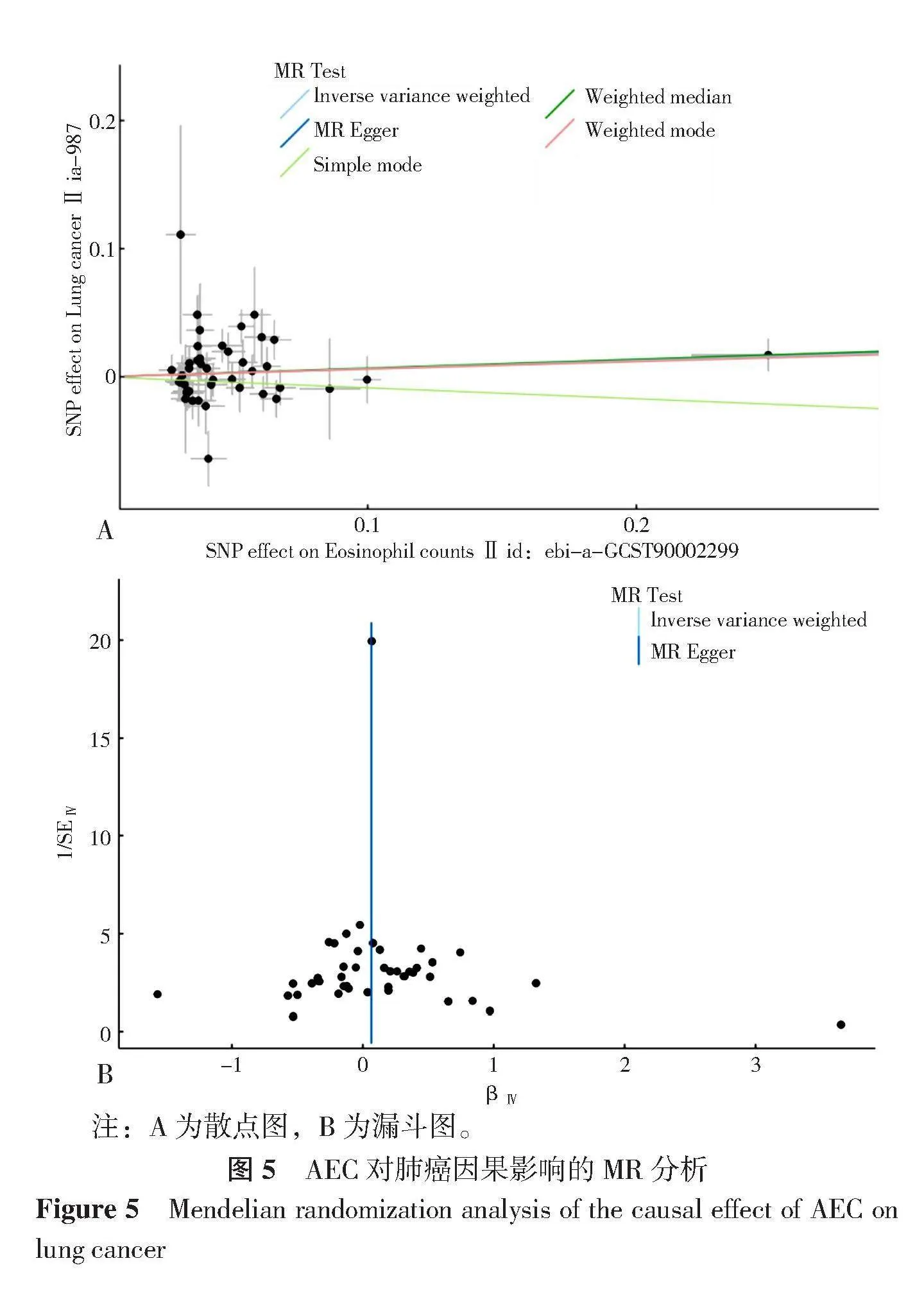
在符合GWAS的统计学显著性阈值下,总共有75个SNP与AEC和肺癌相关,结果提示AEC可能是东亚人群中肺癌的总体风险因素,且为不利因素(OR=1.07,95%CI=1.01~1.13,P=0.03)。
2.7 敏感性分析
由于AEC升高可能受到其他因素,如过敏等影响,这些因素可能导致AEC与肺癌之间关系评估的准确性下降,因此在MR分析中分别进行了水平多效性检验(图5A)和异质性检验(图5B)。异质性检验得到P=0.95,因此纳入的SNP不存在异质性,不需要考虑异质性造成的影响;水平多效性检验得到P=0.096,故AEC升高和肺癌之间不存在水平多效性。
3 讨论
嗜酸性粒细胞是一种常见的白细胞亚型,占所有循环白细胞的1%~5%,其细胞质中具有粗大的嗜酸性颗粒,颗粒中含有过氧化物酶和酸性磷酸酶。正常情况下,人类血液中的嗜酸性粒细胞数量在0~0.5×109/L范围内,在某些特定的疾病条件下,嗜酸性粒细胞可能出现明显的升高,例如支气管哮喘、过敏、寄生虫感染和某些血液病等[15-16]。研究证实嗜酸性粒细胞普遍存在于各种组织类型的癌症中,包括但不限于子宫癌、宫颈癌、胃肠道癌、膀胱癌、乳腺癌、胶质母细胞瘤、胰腺癌和口腔癌[9,17-23],而外周血AEC升高与肿瘤预后的关系均有相关报道,由此可知,外周血AEC与癌症预后之间的关系主要取决于癌症类型。已有研究证实,嗜酸性粒细胞存在于TME中,且外周血AEC升高与肿瘤内嗜酸性粒细胞浓度和活化相关。嗜酸性粒细胞同时具有促肿瘤和抗肿瘤的活性,但最终呈现的预后情况取决于多种参数的共同作用,包括细胞因子平衡,嗜酸性粒细胞与其他免疫细胞之间的相互作用,以及抗肿瘤细胞毒性[5]。
目前已经有大量研究阐明了嗜酸性粒细胞在TME中的作用机制及其与肿瘤生物学特性之间的关系,本研究通过对预后良好组与预后欠佳组间的一般临床资料进行收集与分析,结果显示AEC、NLR、NSE、CYFRA21-1、FIB、FPR、吸烟史、肿瘤病理类型、T分期、N分期、靶向治疗及手术治疗等多个因素在两组间的差异具有统计学意义,提示这些因素均可能有助于肺癌患者预后的评估,AEC、NLR、NSE、CYFRA21-1、FIB、FPR的值越高,肺癌患者的PFS可能越短,其中,高NLR值已经被证实可以促进肿瘤细胞增殖并最终免疫逃避,高NLR值与早期和晚期肺癌的较差预后相关[24-27],本研究结果与之一致。本研究对可能影响肺癌患者预后的危险因素进行多因素Cox回归分析,结果显示AEC水平的升高是影响肺癌患者PFS的独立危险因素,为了更进一步明确AEC水平在肺癌患者生存结局评估中的价值,利用X-tile软件对AEC进行了最佳划分,发现当AEC=0.70×109/L时,可以获得最小P值(P=0.008)和最高χ2值(χ2=6.950),AEC≥0.70×109/L的肺癌患者预后可能较AEC≤0.68×109/L者差。根据多因素Logistic回归分析结果显示,AEC升高是影响肺癌预后的独立危险因素,因此进一步绘制ROC曲线,评估AEC对肺癌患者PFS的预测价值,计算AUC为0.634,灵敏度为91.2%,特异度为33.3%,具有预测价值,但准确性较低。根据ROC曲线的绘制及AUC的计算,AEC在预测肺癌PFS时具有较高的灵敏度,可以认为其对于肺癌患者PFS的预测具有很高的识别能力,但由于其特异度较低,可能会在临床应用中出现假阳性导致结果误判,因此,AEC在预测肺癌预后方面有一定的临床应用前景及价值。
嗜酸性粒细胞是免疫系统中的一种白细胞,其参与调节免疫反应,特别是在过敏性疾病和寄生虫感染中发挥重要作用。嗜酸性粒细胞存在于TME中,根据癌症的类型和TME中的不同刺激,嗜酸性粒细胞在肿瘤生长中可能具有免疫刺激和免疫抑制功能。为了研究不同治疗方式的肺癌患者的PFS之间是否存在差异性,本研究收集了患者的治疗方案,包括免疫治疗、靶向治疗、化学药物治疗以及手术治疗,通过分析得出选择靶向治疗和手术治疗的患者,其PFS更长,而在免疫治疗和化疗治疗的患者中两组患者间未见明显差异性;为了进一步评估当AEC升高是否会对选择不同的治疗方式的肺癌患者的PFS产生影响,本研究对此进行了统计分析,并得出在选择靶向治疗的肺癌患者中,AEC升高组的患者可能PFS更短,而在免疫治疗、化疗治疗和手术治疗中未观察到这种现象。前述结果表明当肺癌患者出现外周血AEC升高时可能会导致靶向治疗疗效较差,而对于其他治疗方式,两组间数据无统计学意义,这可能是外周血AEC的升高不会对是否使用该种治疗方式患者的PFS产生影响,也可能是本研究的总样本量较小且选择免疫或其他治疗方式的样本量较小,预后分析时样本量不够导致结果的准确性下降。
近20余年,关于肺癌与AEC升高的相关文献报道多是病例系列[28-30]。为了进一步证实本研究结果,本研究应用MR分析验证AEC增多与肺癌之间潜在的因果关系,MR是以基因为IV来研究疾病与暴露因素之间的关联,其结果可能更具有准确性。本研究中MR结果显示,较高的AEC水平可能会增加东亚人群的肺癌风险,OR值达1.07。由于嗜酸性粒细胞在炎症反应、过敏反应及免疫调节中起不可忽视的作用,因此,AEC与肺癌之间可能存在其他影响因果关系的风险效应。为了除外其他因素的影响,本研究对收集的汇总数据进行了敏感性分析,包括水平多效性检验及异质性检验,结果提示P值均>0.05,故本研究纳入的SNP不需要考虑其他风险效应。以往的研究报道提示在各种组织类型的恶性肿瘤中,嗜酸性粒细胞增多的病例只是其中极少数的一部分,然而早在1983年人们已经发现肺癌细胞可以产生嗜酸性粒细胞生成因子,且已被证实为IL-5[26],而IL-5作为嗜酸性粒细胞最突出的影响因子,已经被证明是有人肿瘤细胞产生的[31],并且可以将嗜酸性粒细胞募集到外周血流中[26]。结合本研究中临床数据分析及MR分析的结果,AEC升高可能是影响肺癌预后的独立危险因素,即AEC升高可能会导致较差的肺癌预后。
本研究存在一定的局限性。第一,本研究采用回顾性研究的方式,仅从能查询到的病例系统中收集临床资料,存在部分资料不全的情况,且在资料收集过程中易受选择偏倚和回忆偏倚的影响;第二,本研究收集到的AEC升高患者的临床资料样本量较少,随访时间长短不一,且随访过程中存在失访病例,致使预后分析时样本量少,可能导致研究结果的准确性下降;第三,本研究数据收集来源于一家医院,地域局限,缺乏多中心及跨地区的研究;第四,在MR分析中,选用的GWAS数据集较少,仅针对东亚人群进行分析,结果可能受到种族差异的影响,并且缺少对不同病理分型肺癌的数据
分析。
4 小结
本研究通过临床真实数据分析及MR分析发现,外周血AEC升高与肺癌PFS存在负相关关系,且AEC在预测肺癌预后时具有一定价值,但其在临床的实际应用中可能会出现结果的误判。因此,在临床实践过程中,嗜酸性粒细胞尽管只是血常规检验中很容易被忽视的一部分,当AEC升高时也应当得到临床医师的关注与警惕,尤其是AEC≥0.70×109/L时,进行早期干预,可能会在一定程度上改善肺癌患者的预后。
作者贡献:易芬负责数据收集及统计学分析、绘制图表、论文起草;王勇提出研究思路、负责论文修订;徐爱晖负责最终版本修订及文章质量控制。
本文无利益冲突。
参考文献
袁蕙芸,蒋宇飞,谭玉婷,等. 全球癌症发病与死亡流行现状和变化趋势[J]. 肿瘤防治研究,2021,48(6):642-646.
国家癌症中心发布最新一期全国癌症统计数据[J]. 上海护理,2022,22(4):72.
SIMON S C S,HU X Y,PANTEN J,et al. Eosinophil accumulation predicts response to melanoma treatment with immune checkpoint inhibitors[J]. OncoImmunology,2020,9(1). DOI:10.1080/2162402x.2020.1727116.
SIMON S C S,UTIKAL J,UMANSKY V. Opposing roles of eosinophils in cancer[J]. Cancer Immunol Immunother,2019,68(5):823-833. DOI:10.1007/s00262-018-2255-4.
WILLEMS M,SCHERPEREEL A,WASIELEWSKI E,et al. Excess of blood eosinophils prior to therapy correlates with worse prognosis in mesothelioma[J]. Front Immunol,2023,14:1148798. DOI:10.3389/fimmu.2023.1148798.
ROTHENBERG M E,HOGAN S P. The eosinophil[J]. Annu Rev Immunol,2006,24:147-174. DOI:10.1146/annurev.immunol.24.021605.090720.
ROSENBERG H F,DYER K D,FOSTER P S. Eosinophils:changing perspectives in health and disease[J]. Nat Rev Immunol,2013,13(1):9-22. DOI:10.1038/nri3341.
AKUTHOTA P,WELLER P F. Eosinophils and disease pathogenesis[J]. Semin Hematol,2012,49(2):113-119. DOI:10.1053/j.seminhematol.2012.01.005.
GRISARU-TAL S,ITAN M,KLION A D,et al. A new dawn for eosinophils in the tumour microenvironment[J]. Nat Rev Cancer,2020,20(10):594-607. DOI:10.1038/s41568-020-0283-9.
MATSUMOTO S,TAMAI T,YANAGISAWA K,et al. Lung cancer with eosinophilia in the peripheral blood and the pleural fluid[J]. Intern Med,1992,31(4):525-529. DOI:10.2169/internalmedicine.31.525.
ROSMAN Y,HORNIK-LURIE T,MEIR-SHAFRIR K,et al. Changes in peripheral blood eosinophils may predict colorectal cancer-a retrospective study[J]. World Allergy Organ J,2022,15(10):100696. DOI:10.1016/j.waojou.2022.100696.
EMDIN C A,KHERA A V,KATHIRESAN S. Mendelian randomization[J]. JAMA,2017,318(19):1925. DOI:10.1001/jama.2017.17219.
BERNARD-TESSIER A,JEANVILLE P,CHAMPIAT S,et al. Immune-related eosinophilia induced by anti-programmed death 1 or death-ligand 1 antibodies[J]. Eur J Cancer,2017,81:135-137. DOI:10.1016/j.ejca.2017.05.017.
CAMP R L,DOLLED-FILHART M,RIMM D L. X-tile:a new bio-informatics tool for biomarker assessment and outcome-based cut-point optimization[J]. Clin Cancer Res,2004,10(21):7252-7259. DOI:10.1158/1078-0432.CCR-04-0713.
姬鹏宇,李娜,杨帆,等. 嗜酸性粒细胞功能与疾病研究进展[J]. 热带医学杂志,2014,14(3):397-401.
VARRICCHI G,GALDIERO M R,LOFFREDO S,et al. Eosinophils:the unsung heroes in cancer?[J]. Oncoimmunology,2017,7(2):e1393134. DOI:10.1080/2162402X.2017.1393134.
KLION A D,ACKERMAN S J,BOCHNER B S. Contributions of eosinophils to human health and disease[J]. Annu Rev Pathol,2020,15:179-209. DOI:10.1146/annurev-pathmechdis-012419-032756.
XU C J,SONG L S,PENG H,et al. Clinical eosinophil-associated genes can serve as a reliable predictor of bladder urothelial cancer[J]. Front Mol Biosci,2022,9:963455. DOI:10.3389/fmolb.2022.963455.
REICHMAN H,ITAN M,ROZENBERG P,et al. Activated eosinophils exert antitumorigenic activities in colorectal cancer[J]. Cancer Immunol Res,2019,7(3):388-400. DOI:10.1158/2326-6066.CIR-18-0494.
LEE J J,JACOBSEN E A,MCGARRY M P,et al. Eosinophils in health and disease:the LIAR hypothesis[J]. Clin Experimental Allergy,2010,40(4):563-575. DOI:10.1111/j.1365-2222.2010.03484.x.
SIBILLE A,CORHAY J L,LOUIS R,et al. Eosinophils and lung cancer:from bench to bedside[J]. Int J Mol Sci,2022,23(9):5066. DOI:10.3390/ijms23095066.
CORMIER S A,TARANOVA A G,BEDIENT C,et al. Pivotal advance:eosinophil infiltration of solid tumors is an early and persistent inflammatory host response[J]. J Leukoc Biol,2006,79(6):1131-1139. DOI:10.1189/jlb.0106027.
DAVIS B P,ROTHENBERG M E. Eosinophils and cancer[J]. Cancer Immunol Res,2014,2(1):1-8. DOI:10.1158/2326-6066.cir-13-0196.
COFFELT S B,WELLENSTEIN M D,DE VISSER K E. Neutrophils in cancer:neutral no more[J]. Nat Rev Cancer,2016,16(7):431-446. DOI:10.1038/nrc.2016.52.
CEDRÉS S,TORREJON D,MARTÍNEZ A,et al. Neutrophil to lymphocyte ratio(NLR)as an indicator of poor prognosis in stage IV non-small cell lung cancer[J]. Clin Transl Oncol,2012,
14(11):864-869. DOI:10.1007/s12094-012-0872-5.
SCILLA K A,BENTZEN S M,LAM V K,et al. Neutrophil-lymphocyte ratio is a prognostic marker in patients with locally advanced(stage ⅢA and ⅢB)non-small cell lung cancer treated with combined modality therapy[J]. Oncol,2017,22(6):737-742. DOI:10.1634/theoncologist.2016-0443.
SLUNGAARD A,ASCENSAO J,ZANJANI E,et al. Pulmonary carcinoma with eosinophilia. Demonstration of a tumor-derived eosinophilopoietic factor[J]. N Engl J Med,1983,309(13):778-781. DOI:10.1056/NEJM198309293091307.
WALTER R,JOLLER-JEMELKA H I,SALOMON F. Metastatic squamous cell carcinoma with marked blood eosinophilia and elevated serum interleukin-5 levels[J]. Exp Hematol,2002,30(1):1-2. DOI:10.1016/s0301-472x(01)00764-0.
PANDIT R,SCHOLNIK A,WULFEKUHLER L,et al. Non-small-cell lung cancer associated with excessive eosinophilia and secretion of interleukin-5 as a paraneoplastic syndrome[J]. American J Hematol,2007,82(3):234-237. DOI:10.1002/ajh.20789.
SAKKAL S,MILLER S,APOSTOLOPOULOS V,et al. Eosinophils in cancer:favourable or unfavourable?[J]. Curr Med Chem,2016,23(7):650-666. DOI:10.2174/0929867323666160119094313.
HUANG M,WANG J,LEE P,et al. Human non-small cell lung cancer cells express a type 2 cytokine pattern[J]. Cancer Res,1995,55(17):3847-3853.
(收稿日期:2024-03-10;修回日期:2024-05-16)
(本文编辑:贾萌萌)
基金项目:紧急医学救援状态下灾区医疗服务保障和重点传染病防治的规范与关键技术应用性研究(201302003)
引用本文:易芬,王勇,徐爱晖. 外周血绝对嗜酸性粒细胞计数水平对肺癌预后的评估价值研究[J]. 中国全科医学,2024,27(32):4001-4008. DOI:10.12114/j.issn.1007-9572.2023.0899. [www.chinagp.net]
YI F,WANG Y,XU A H. Evaluation value of peripheral absolute eosinophil count for the prognosis of lung cancer[J]. Chinese General Practice,2024,27(32):4001-4008.
© Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.
