淫羊藿苷调节SDF-1/CXCR4信号通路对多囊卵巢综合征大鼠卵巢颗粒细胞凋亡的影响
2024-07-13徐琼芳钟斐李子帅
徐琼芳 钟斐 李子帅
基金项目:湖南省教育厅科学研究项目(21C1525)
作者单位:1永州职业技术学院医学院(邮编425100);2泉州市中医院中医妇产科
作者简介:徐琼芳(1983),女,副教授,主要从事生殖内分泌系统疾病的中医药防治方面研究。E-mail:yymkzj@163.com
摘要:目的 探讨淫羊藿苷调节基质细胞衍生因子-1(SDF-1)/CXC型趋化因子受体4(CXCR4)信号轴对多囊卵巢综合征(PCOS)大鼠卵巢颗粒细胞凋亡的影响。方法 将从PCOS模型组大鼠卵巢组织中成功分离的颗粒细胞分为PCOS组、淫羊藿苷低剂量组、淫羊藿苷中剂量组、淫羊藿苷高剂量组、重组大鼠SDF-1蛋白(Rr-SDF-1)组、淫羊藿苷高剂量+Rr-SDF-1组,另取从正常对照组大鼠卵巢组织中成功分离的颗粒细胞作为对照组。酶联免疫吸附试验(ELISA)检测卵巢颗粒细胞上清液中卵泡刺激素(FSH)、睾酮(T)、黄体生成素(LH)水平;CCK-8法、EdU染色检测颗粒细胞增殖;流式细胞术检测颗粒细胞凋亡;Western blot检测颗粒细胞中Bcl-2相关X蛋白(Bax)、裂解的胱天蛋白酶-3(Cleaved Caspase-3)、SDF-1、CXCR4蛋白表达。结果 与对照组比较,PCOS组FSH水平、光密度(OD)450值、EdU阳性细胞率降低,T、LH水平、细胞凋亡率、Bax、Cleaved Caspase-3、SDF-1、CXCR4蛋白表达水平升高(P<0.05)。与PCOS组比较,淫羊藿苷低、中、高剂量组FSH水平、OD450值、EdU阳性细胞率均依次升高,T、LH水平、细胞凋亡率、Bax、Cleaved Caspase-3、SDF-1、CXCR4蛋白表达水平均依次降低;Rr-SDF-1组对应指标变化趋势与上述相反(P<0.05)。与淫羊藿苷高剂量组比较,淫羊藿苷高剂量+Rr-SDF-1组FSH水平、OD450值、EdU阳性细胞率降低,T、LH水平、细胞凋亡率、Bax、Cleaved Caspase-3、SDF-1、CXCR4蛋白表达水平升高(P<0.05)。结论 淫羊藿苷可能通过抑制SDF-1/CXCR4信号通路抑制PCOS大鼠卵巢颗粒细胞凋亡。
关键词:淫羊藿苷;基质细胞衍生因子-1/CXC型趋化因子受体4信号通路;多囊卵巢综合征;颗粒细胞;增殖;凋亡
中图分类号:R285.5文献标志码:ADOI:10.11958/20231504
The effect of icariin on apoptosis of ovarian granulosa cells in polycystic ovary syndrome rats by regulating the SDF-1/CXCR4 signaling pathway
XU Qiongfang1, ZHONG Fei2, LI Zishuai1
1 Medical College of Yongzhou Vocational Technical College, Yongzhou 425100, China; 2 Department of Obstetrics and Gynecology, Quanzhou Hospital of Traditional Chinese Medicine
Abstract: Objective To investigate the effect of icariin on apoptosis of ovarian granulosa cells in rats with polycystic ovarian syndrome (PCOS) by regulating stromal cell-derived factor-1 (SDF-1)/CXC chemokine receptor-4 (CXCR4) signal axis. Methods Granular cells successfully isolated from ovarian tissue of rats in the PCOS model group were grouped into the PCOS group, the low-dose icariin group, the medium-dose icariin group, the high-dose icariin group, the Rr-SDF-1 group and the high-dose icariin+Rr-SDF-1 group. Granular cells successfully isolated from ovarian tissue of rats in the normal control group were taken as the control group. Enzyme-linked immunosorbent assay (ELISA) was applied to detect levels of follicle-stimulating hormone (FSH), testosterone (T) and luteinizing hormone (LH) in supernatant of ovarian granulosa cells. CCK-8 method and EdU staining were applied to detect granulosa cell proliferation. Flow cytometry was applied to detect granulosa cell apoptosis. Western blot assay was applied to detect the expression of Bcl-2 associated X (Bax), Cleaved aspartate-specific cysteine protease-3 (Cleaved Caspase-3), SDF-1, and CXCR4 proteins in granulosa cells. Results Compared with the control group, the FSH level, OD450 value and EdU positive cell rate were decreased in the PCOS group, and T and LH levels, apoptosis rate, Bax, Cleaved Caspase-3, SDF-1 and CXCR4 protein expression increased (P<0.05). Compared with PCOS group, the FSH level, OD450 value and EdU positive cell rate were increased sequentially in the icariin low, medium and high dose groups, T and LH levels, apoptosis rate, Bax, Cleaved Caspase-3, SDF-1 and CXCR4 protein expression levels were decreased sequentially, and change trends of corresponding indicators were opposite to the above in the Rr-SDF-1 group (P<0.05). Compared with the high-dose icariin group, FSH level, OD450 value and EdU positive cell rate were decreased in the high-dose icariin+Rr-SDF-1 group, and T and LH levels, apoptosis rate, Bax, Cleaved Caspase-3, SDF-1 and CXCR4 protein expression levels were increased (P<0.05). Conclusion Icariin may inhibit the apoptosis of ovarian granulosa cells in PCOS rats by inhibiting the SDF-1/CXCR4 signaling pathway.
Key words: icariin; stromal cell-derived factor-1/CXC chemokine receptor-4 signaling pathway; polycystic ovarian syndrome; granular cells; proliferation; apoptosis
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是育龄女性中最常见的复杂内分泌疾病,其特征是生殖障碍、内分泌异常和代谢紊乱[1]。此外,PCOS可能会增加子宫内膜癌、代谢性心血管病的风险[2-3]。在临床实践中,PCOS患者通常采用克罗米芬和二甲双胍药物治疗;但尚无法治愈,主要是缓解相应症状和预防潜在问题的发生[4]。因此,迫切需要开发治疗PCOS的新方法。淫羊藿苷是淫羊藿的主要活性成分,具有抗炎和抗氧化等多种生物活性[5]。有研究报道,淫羊藿苷可抑制PCOS卵巢颗粒细胞凋亡[6],但具体机制尚不完全明确。另有研究显示,激活基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1)/CXC型趋化因子受体4(CXC chemokine receptor-4,CXCR4)通路可诱导卵巢早衰小鼠卵巢损伤[7]。据此,笔者推测淫羊藿苷是否通过调节SDF-1/CXCR4信号通路抑制PCOS大鼠卵巢颗粒细胞凋亡。鉴于此,本研究拟探究淫羊藿苷对PCOS大鼠卵巢颗粒细胞凋亡的影响及其作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级雌性SD大鼠24只,3周龄,体质量50~60 g,购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2022-0002,动物实验使用许可证号:SYXK(湘)2022-0016。所有实验程序均经本院实验动物管理委员会批准(批准号:202110-X38)。
1.1.2 主要试剂与仪器 淫羊藿苷购自上海脉铂医药科技有限公司;脱氢表雄酮购自信阳市沐凡生物科技有限公司;重组大鼠SDF-1蛋白(Rr-SDF-1)购自北京百奥莱博科技有限公司;大鼠卵泡刺激素(follicle-stimulating hormone,FSH)、睾酮(testosterone,T)、黄体生成素(luteinizing hormone,LH)酶联免疫吸附试验(ELISA)试剂盒购自上海杏宜生物科技有限公司;EdU细胞增殖检测试剂盒购自广州复能基因有限公司;Annexin V FITC/PI细胞凋亡检测试剂盒购自北京索来宝生物科技有限公司;兔源一抗卵泡刺激素受体(follicle stimulating hormone receptor,FSHR)、Bcl-2相关X蛋白(Bcl-2 associated X,Bax)、裂解的胱天蛋白酶-3(Cleaved aspartate-specific cysteine protease-3,Cleaved Caspase-3)、SDF-1、CXCR4、GAPDH及辣根过氧化物酶(HRP)标记的山羊抗兔二抗均购自英国Abcam公司。DM2500M型荧光显微镜购自德国徕卡公司;MK3型酶标仪购自美国Thermo Scientific公司;BD FACSCalibur型流式细胞仪购自美国BD公司;Gel Doc XR型凝胶成像系统购自美国伯乐公司。
1.2 实验方法
1.2.1 PCOS模型的构建及分组 通过连续21 d皮下注射脱氢表雄酮(溶于0.2 mL豆油,60 mg/kg,每日1次)的方式构建PCOS模型。从造模的第16天开始,若连续4 d观察到大鼠的阴道涂片出现角质细胞,则为造模成功[8]。按照随机数字表法将SD大鼠分为正常对照组和PCOS模型组,每组12只。PCOS模型组大鼠按照上述方法构建PCOS模型,正常对照组大鼠皮下注射等体积的豆油代替脱氢表雄酮,其余操作同造模过程。末次处理24 h后,将大鼠禁食12 h,2%戊巴比妥钠麻醉并处死大鼠,无菌条件下解剖并取出卵巢,然后剪取0.2 g卵巢组织用于分离卵巢颗粒细胞。
1.2.2 卵巢颗粒细胞的分离与鉴定 生理盐水冲洗大鼠卵巢组织,除去输卵管和脂肪,将卵巢组织置于DMEM/F12培养基中,用医用针头穿刺窦卵泡释放颗粒细胞,并使颗粒细胞悬浮在培养基中,将颗粒细胞经过滤、纯化、重悬、洗涤后,置于37 ℃、5%CO2细胞培养箱中培养。待细胞完全贴壁后,除去未贴壁细胞。利用显微镜(×100)观察培养3 d的细胞形态。颗粒细胞的鉴定:将细胞(1×105个/孔)置于24孔培养板(含载玻片)中,待细胞爬片至密度约为70%时,用4%多聚甲醛固定细胞,加入兔源一抗FSHR(1∶5 000)孵育过夜,再滴加DyLight 488标记的山羊抗兔二抗(1∶4 000)在室温下孵育1 h,DAPI染核后,利用荧光显微镜观察细胞中FSHR表达情况,以呈绿色荧光的细胞荧光强度作为判断FSHR阳性表达的依据。
1.2.3 细胞分组 将从正常对照组、PCOS模型组大鼠卵巢组织中成功分离的颗粒细胞分别命名为对照组和PCOS组,再取PCOS组颗粒细胞,分别用15 μmol/L、30 μmol/L、60 μmol/L淫羊藿苷[6]处理24 h,并命名为淫羊藿苷低、中、高剂量组;用20 μg/L Rr-SDF-1[9]处理24 h,命名为Rr-SDF-1组;用60 μmol/L淫羊藿苷和20 μg/L Rr-SDF-1共同处理24 h,命名为淫羊藿苷高剂量+Rr-SDF-1组。处理结束后收集各组颗粒细胞或颗粒细胞上清液用于后续实验。
1.2.4 ELISA检测卵巢颗粒细胞上清液中FSH、T、LH的水平 取1.2.3中处理24 h后的颗粒细胞悬液200 μL,3 000 r/min离心15 min收集上清液,严格按照试剂盒说明书检测卵巢颗粒细胞上清液中FSH、T、LH水平。
1.2.5 CCK-8法检测细胞增殖 将颗粒细胞(1×105个/孔)接种于96孔板中,按照1.2.3所述进行对应处理后,向各孔中加入10 μL CCK-8溶液,在37 ℃下避光孵育1 h后,酶标仪测量450 nm处的光密度(OD)值。
1.2.6 EdU染色检测颗粒细胞增殖 取1.2.3中处理24 h后的各组颗粒细胞(1×105个/孔),用100 μL 50 μmol/L EdU溶液孵育颗粒细胞2 h后,利用50 μL细胞固定液固定细胞30 min,100 μL 1×Apollo染色液孵育30 min,再用100 μL 1×Hoechst 33342反应液对细胞进行核染色,通过荧光显微镜观察EdU阳性细胞形成情况,EdU阳性细胞率(%)=EdU阳性细胞数/Hoechst 33342阳性细胞数×100%。
1.2.7 流式细胞术检测颗粒细胞凋亡 取1.2.3中处理24 h后的各组颗粒细胞,将颗粒细胞重悬于预冷的结合缓冲液中,并调整细胞密度为1×105个/mL。取200 μL细胞悬液,经Annexin V-FITC和PI溶液避光染色15 min。1 h内上机完成检测,并评估颗粒细胞凋亡。
1.2.8 Western blot检测颗粒细胞中Bax、Cleaved Caspase-3、SDF-1、CXCR4蛋白表达 RIPA裂解缓冲液用于提取1.2.3中处理24 h后的各组颗粒细胞总蛋白,每组细胞设置6个复孔,提取的蛋白经BCA法定量后,取30 μg蛋白样品进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(100 V恒压)分离,再将凝胶上的蛋白样本以0.65 mA/cm2的恒流电转移2 h转至PVDF膜上,PVDF膜经5%脱脂奶粉封闭1.5 h后,在4 ℃下将膜与兔源一抗Bax(1∶5 000)、Cleaved Caspase-3(1∶5 000)、SDF-1(1∶4 000)、CXCR4(1∶3 000)、GAPDH(1∶4 000)孵育过夜,TBST漂洗后,再将膜与山羊抗兔二抗(1∶5 000)在室温条件下孵育1 h。加入ECL试剂可视化蛋白,使用Image-Pro Plus 6.0软件评估目的蛋白灰度值。以GAPDH为蛋白内参。
1.3 统计学方法 采用GraphPad Prism 9.0软件进行数据分析。符合正态分布的计量资料以均数±标准差([x] ±s)表示,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验。P<0.05为差异有统计学意义。
2 结果
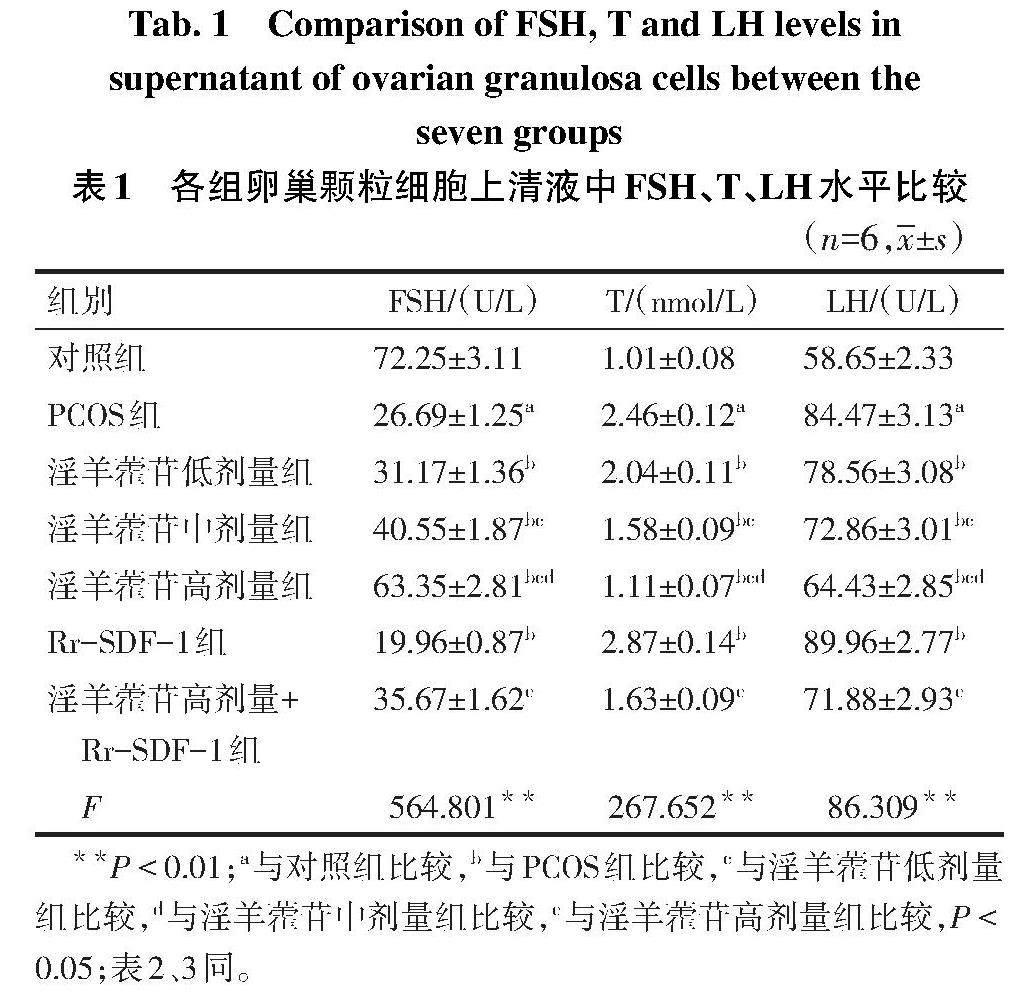
2.1 卵巢颗粒细胞的形态观察及鉴定 培养3 d的卵巢颗粒细胞呈纺锤体形态,见图1。免疫荧光染色显示,与对照组(0.98±0.08)比较,PCOS组(8.63±0.37)细胞中FSHR阳性表达水平升高(t=49.501,P<0.01),见图2。
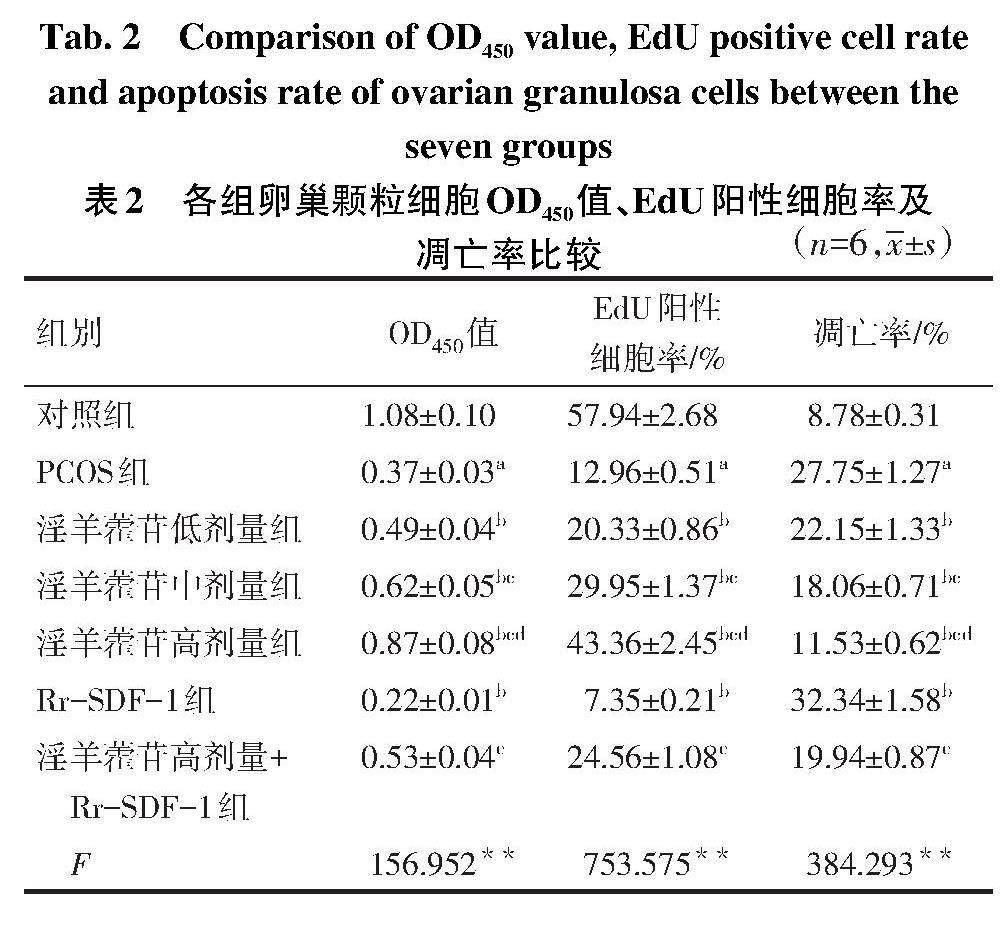
2.2 淫羊藿苷对各组卵巢颗粒细胞上清液中FSH、T、LH水平的影响 与对照组比较,PCOS组卵巢颗粒细胞上清液中FSH水平降低,T、LH水平升高(P<0.05)。与PCOS组比较,淫羊藿苷低、中、高剂量组卵巢颗粒细胞上清液中FSH水平依次升高,T、LH水平依次降低;Rr-SDF-1组卵巢颗粒细胞上清液中FSH水平降低,T、LH水平升高(P<0.05)。与淫羊藿苷高剂量组比较,淫羊藿苷高剂量+Rr-SDF-1组卵巢颗粒细胞上清液中FSH水平降低,T、LH水平升高(P<0.05)。见表1。
2.3 淫羊藿苷对各组卵巢颗粒细胞增殖的影响 与对照组比较,PCOS组卵巢颗粒细胞OD450值、EdU阳性细胞率降低(P<0.05)。与PCOS组比较,淫羊藿苷低、中、高剂量组卵巢颗粒细胞OD450值、EdU阳性细胞率均依次升高;Rr-SDF-1组卵巢颗粒细胞OD450值、EdU阳性细胞率降低(P<0.05)。与淫羊藿苷高剂量组比较,淫羊藿苷高剂量+Rr-SDF-1组卵巢颗粒细胞OD450值、EdU阳性细胞率降低(P<0.05),见表2,图3。[Tab.2 Comparison of OD450 value, EdU positive cell rate and apoptosis rate of ovarian granulosa cells between the seven groups
2.4 淫羊藿苷对卵巢颗粒细胞凋亡的影响 与对照组比较,PCOS组卵巢颗粒细胞凋亡率升高(P<0.05)。与PCOS组比较,淫羊藿苷低、中、高剂量组卵巢颗粒细胞凋亡率依次降低;Rr-SDF-1组卵巢颗粒细胞凋亡率升高(P<0.05)。与淫羊藿苷高剂量组比较,淫羊藿苷高剂量+Rr-SDF-1组卵巢颗粒细胞凋亡率升高(P<0.05)。见图4、表2。
2.5 淫羊藿苷对各组卵巢颗粒细胞中Bax、Cleaved Caspase-3蛋白及SDF-1/CXCR4通路相关蛋白表达的影响 与对照组比较,PCOS组卵巢颗粒细胞中Bax、Cleaved Caspase-3、SDF-1、CXCR4蛋白表达水平升高(P<0.05)。与PCOS组比较,淫羊藿苷低、中、高剂量组卵巢颗粒细胞中Bax、Cleaved Caspase-3、SDF-1、CXCR4蛋白表达水平均依次降低;Rr-SDF-1组卵巢颗粒细胞中Bax、Cleaved Caspase-3、SDF-1、CXCR4蛋白表达水平升高(P<0.05)。与淫羊藿苷高剂量组比较,淫羊藿苷高剂量+Rr-SDF-1组卵巢颗粒细胞中Bax、Cleaved Caspase-3、SDF-1、CXCR4蛋白表达水平升高(P<0.05)。见表3、图5。
3 讨论
PCOS通常表现为LH水平升高、FSH水平降低,高水平的LH会促进卵泡膜细胞合成大量T,而处于较低水平的FSH则会抑制卵巢颗粒细胞中芳香化酶活性,进而抑制T向雌激素转化,此时形成的高雄激素环境会使卵泡排出受阻,最后形成卵巢多囊性改变[10]。本研究成功分离并鉴定出PCOS卵巢颗粒细胞,结果显示,与对照组比较,PCOS组卵巢颗粒细胞上清液中FSH水平降低,T、LH水平升高,表明PCOS卵巢颗粒细胞激素代谢紊乱,符合PCOS卵巢颗粒细胞的特征。有研究显示,PCOS症状可以通过增加颗粒细胞增殖和减少颗粒细胞凋亡来缓解[11-13]。因此,PCOS的发病与颗粒细胞增殖和凋亡的失调密切相关。因此,促进卵巢颗粒细胞增殖,抑制细胞凋亡可能是改善PCOS的有效策略之一。
淫羊藿苷是淫羊藿中的主要活性化合物,具有强大的抗炎特性,还可以改善卵巢功能[14-15]。有研究显示淫羊藿苷可改善PCOS大鼠卵巢细胞凋亡[16];能改善自身免疫原发性卵巢功能不全小鼠受损卵巢的结构及其功能[17];还可促进卵巢储备功能减退患者卵巢颗粒细胞增殖[18]。以上研究表明淫羊藿苷对卵巢具有保护作用。本研究结果亦显示,淫羊藿苷可上调PCOS大鼠卵巢颗粒细胞OD450值和EdU阳性细胞率,抑制细胞凋亡率及卵巢颗粒细胞中促凋亡相关蛋白Bax、Cleaved Caspase-3表达,且呈剂量依赖性,表明淫羊藿苷可促进卵巢颗粒细胞增殖,抑制细胞凋亡,且呈剂量依赖性。提示淫羊藿苷可能成为治疗PCOS的潜在有效药物。
SDF-1是一种CXC趋化因子,也是CXCR4的唯一配体,SDF-1和CXCR4结合形成信号通路可以调节多种生理活性,包括细胞增殖、凋亡等[19]。抑制SDF-1/CXCR4信号通路可促进骨关节炎软骨细胞增殖及抑制细胞凋亡[20]。本研究结果显示,与PCOS组比较,Rr-SDF-1组卵巢颗粒细胞中SDF-1、CXCR4蛋白表达水平升高,卵巢颗粒细胞增殖能力减弱,凋亡能力增强,且Rr-SDF-1为SDF-1激活剂,证实SDF-1/CXCR4信号通路参与PCOS大鼠卵巢颗粒细胞增殖及凋亡过程。此外,本研究发现,淫羊藿苷可呈剂量依赖性地抑制PCOS大鼠卵巢颗粒细胞中SDF-1、CXCR4蛋白表达,故笔者推测淫羊藿苷可能通过抑制SDF-1/CXCR4信号通路抑制PCOS大鼠卵巢颗粒细胞凋亡。为了验证该猜想,本研究在高剂量淫羊藿苷作用的基础上再加SDF-1激活剂Rr-SDF-1来干预PCOS大鼠卵巢颗粒细胞,结果显示,Rr-SDF-1减弱了高剂量淫羊藿苷对颗粒细胞凋亡的抑制作用。进一步提示淫羊藿苷可能通过抑制SDF-1/CXCR4信号通路抑制PCOS大鼠卵巢颗粒细胞凋亡。
综上所述,淫羊藿苷可能通过抑制SDF-1/CXCR4信号通路抑制PCOS大鼠卵巢颗粒细胞凋亡。但该作用机制较为复杂,具体通过SDF-1/CXCR4信号通路下游的哪些蛋白发挥作用有待进一步探讨。
参考文献
[1] 宋玉,朱争艳,黄桓,等. 虾青素通过调节Klotho表达和Wnt/β- Catenin信号通路对多囊卵巢综合征大鼠的改善作用[J]. 天津医药,2023,51(10):1098-1103. SONG Y,ZHU Z Y,HUANG H,et al. The improvement effect of astaxanthin on rats with polycystic ovary syndrome by regulating Klotho expression and Wnt/β-Catenin signaling pathway[J]. Tianjin Med J,2023,51(10):1098-1103. doi:10.11958/20221727.
[2] BAHRI KHOMAMI M,JOHAM E,BOYLE A,et al. Increased maternal pregnancy complications in polycystic ovary syndrome appear to be independent of obesity-A systematic review,meta-analysis,and meta-regression[J]. Obes Rev,2019,20(5):659-674. doi:10.1111/obr.12829.
[3] RASOOL S U A,ASHRAF S,NABI M,et al. Elevated fasting insulin is associated with cardiovascular and metabolic risk in women with polycystic ovary syndrome[J]. Diabetes Metab Syndr,2019,13(3):2098-2105. doi:10.1016/j.dsx.2019.05.003.
[4] LI X,ZHU L,LUO Y. Long non-coding RNA HLA-F antisense RNA 1 inhibits the maturation of microRNA-613 in polycystic ovary syndrome to promote ovarian granulosa cell proliferation and inhibit cell apoptosis[J]. Bioengineered,2022,13(5):12289-12297. doi:10.1080/21655979.2022.2070965.
[5] SHAO Y,SUN L,YANG G,et al. Icariin protects vertebral endplate chondrocytes against apoptosis and degeneration via activating Nrf-2/HO-1 pathway[J]. Front Pharmacol,2022,13:937502. doi:10.3389/fphar.2022.937502.
[6] 邵梅,王家传. 淫羊藿素对多囊卵巢综合征颗粒细胞凋亡和自噬的影响[J]. 中国临床药理学杂志,2021,37(20):2830-2833. SHAO M,WANG J C. Effect of icaritin on the apoptosis and autophagy of granulosa cells in polycystic ovary syndrome[J]. The Chinese Journal of Clinical Pharmacology,2021,37(20):2830-2833. doi:10.13699/j.cnki.1001-6821.2021.20.028.
[7] LUO Q,YIN N,ZHANG L,et al. Role of SDF-1/CXCR4 and cytokines in the development of ovary injury in chemotherapy drug induced premature ovarian failure mice[J]. Life Sci,2017,179:103-109. doi:10.1016/j.lfs.2017.05.001.
[8] 孙彩萍,张丹,张珂. 干扰CLDN6基因表达通过调控MAPK/ERK信号通路对多囊卵巢综合征大鼠卵巢颗粒细胞凋亡的影响[J]. 现代妇产科进展,2022,31(2):96-101,106. SUN C P,ZHANG D,ZHANG K. The effect of interference with CLDN6 gene expression on the apoptosis of ovarian gran-ular cells in rats with polycystic ovary syndrome by regulating the MAPK/ERK signa-ling pathway[J]. Progress in Obstetrics and Gynecology,2022,31(2):96-101,106. doi:10.13283/j.cnki.xdfckjz.2022.02.004.
[9] 葛新,曹章,吕鹏威,等. miR-206抑制SDF-1/CXCR4信号活化诱导的乳腺癌细胞迁移和增殖[J]. 肿瘤基础与临床,2016,29(4):294-298. GE X,CAO Z,LYU P W,et al. miR-206 suppresses breast cancer cell migration and proliferation induced by SDF-1/CXCR4 Signaling[J]. Journal of Basic and Clinical Oncology,2016,29(4):294-298. doi:10.3969/j.issn.1673-5412.2016.04.005.
[10] 刘亚敏,董文霞,薛鹏坤,等. 金匮肾气丸通过调控PI3K-AKT-mTOR及PI3K-AKT-GLUT4通路干预多囊卵巢综合征大鼠的作用机制研究[J]. 中药药理与临床,2023,39(1):1-7. LIU Y M,DONG W X,XUE P K,et al. Intervention effect of Jinkui Shenqi wan(金匮肾气丸)on polycystic ovary syndrome in rats by regulating PI3K-AKT-mTOR and PI3K-AKT-GLUT4 pathways[J]. Pharmacology and Clinics of Chinese Materia Medica,2023,39(1):1-7. doi:10.13412/j.cnki.zyyl.20221118.002.
[11] CHEN L,KONG C. LINC00173 regulates polycystic ovarian syndrome progression by promoting apoptosis and repressing proliferation in ovarian granulosa cells via the microRNA-124-3p(miR-124-3p)/jagged canonical Notch ligand 1(JAG1) pathway[J]. Bioengineered,2022,13(4):10373-10385. doi:10.1080/21655979.2022.2053797.
[12] 陈丽敏,汪佳佳,董智钰. 微小RNA 761对人卵巢颗粒细胞增殖和凋亡的影响[J]. 中国临床药理学杂志,2021,37(20):2783-2785,2805. CHEN L M,WANG J J,DONG Z Y. Effects of microrNA 761 on proliferation and apoptosis of human ovarian granulocyte cells[J]. The Chinese Journal of Clinical Pharmacology,2021,37(20):2783-2785,2805. doi:10.13699/j.cnki.1001-6821.2021.20.016.
[13] GUO H,LI T,SUN X. LncRNA HOTAIRM1,miR-433-5p and PIK3CD function as a ceRNA network to exacerbate the development of PCOS[J]. J Ovarian Res,2021,14(1):19-27. doi:10.1186/s13048-020-00742-4.
[14] HE C,WANG Z,SHI J. Pharmacological effects of icariin[J]. Adv Pharmacol,2020,87:179-203. doi:10.1016/bs.apha.2019.10.004.
[15] TANG Y,LI Y,XIN D,et al. Icariin alleviates osteoarthritis by regulating autophagy of chondrocytes by mediating PI3K/AKT/mTOR signaling[J]. Bioengineered,2021,12(1):2984-2999. doi:10.1080/21655979.2021.1943602.
[16] ZUO L,HAI Y,ZHANG R,et al. Therapeutic potential of icariin in rats with letrozole and high-fat diet-induced polycystic ovary syndrome[J]. Eur J Pharmacol,2023,953:175825. doi:10.1016/j.ejphar.2023.175825.
[17] CHEN H,SONG L,XU X,et al. The effect of icariin on autoimmune premature ovarian insufficiency via modulation of Nrf2/HO-1/Sirt1 pathway in mice[J]. Reprod Biol,2022,22(2):100638. doi:10.1016/j.repbio.2022.100638.
[18] 李美玲. 淫羊藿苷通过调节卵巢颗粒细胞增殖与分泌功能改善DOR患者IVF助孕结局的临床与机制研究[D]. 南京:南京中医药大学,2020. LI M L. Effects of icariin on the proliferation and secretion of ovarian granulosa cells to improve the outcome of IVF of DOR patients with Kidney Yang Deficiency[D]. Nanjing:Nanjing University of Chinese Medicine,2020. doi:10.27253/d.cnki.gnjzu.2020.000232.
[19] YU P,CHENG L,XIA W M,et al. KLF9 inhibits the proliferation,invasion,and migration of renal cell carcinoma through the SDF-1/CXCR4 axis[J]. Kaohsiung J Med Sci,2023,39(6):587-595. doi:10.1002/kjm2.12671.
[20] 王雷,余德涛,邢祯全. 依托考昔抑制SDF-1/CXCR4信号通路影响骨关节炎软骨细胞增殖、凋亡及炎性因子表达[J]. 现代免疫学,2021,41(6):468-472. WANG L,YU D T,XING Z Q. Etoricoxib affects osteoarthritis chondrocytes' proliferation,apoptosis and expression of inflammatory factors by inhibiting SDF-1/CXCR4 signaling pathway[J]. Current Immunology,2021,41(6):468-472. doi:1001-2478(2021)06-0468-05.
(2023-11-06收稿 2023-12-20修回)
(本文编辑 陈丽洁)
