2-苯基-5-氯甲基-7-对甲苯胺基吡唑并[1,5-a]嘧啶的合成研究
2024-07-11刘杨包安丽
刘杨 包安丽
摘 要: 吡唑并[1,5-a]嘧啶类化合物是一类具有良好生物活性的含氮杂环化合物,其分子中同时存在吡唑和嘧啶两类重要的活性单元,因而此类化合物常表现出良好的生物活性,被广泛应用于医药、农药和化工等相关领域,用以开发新型的抗肿瘤药物、酶抑制、杀菌剂及除草剂等。本文主要合成2-苯基-5-氯甲基-7-对甲苯胺基吡唑并[1,5-a]嘧啶。并就实验过程中遇到的问题及解决方案做出详细说明,探索筛选合成路线,优化合成方法。
关 键 词:吡唑并[1,5-a]嘧啶; 含氮杂环化合物;合成方法; 路线优化
中图分类号:TQ463.5 文献标识码: A 文章编号: 1004-0935(2024)06-0938-05
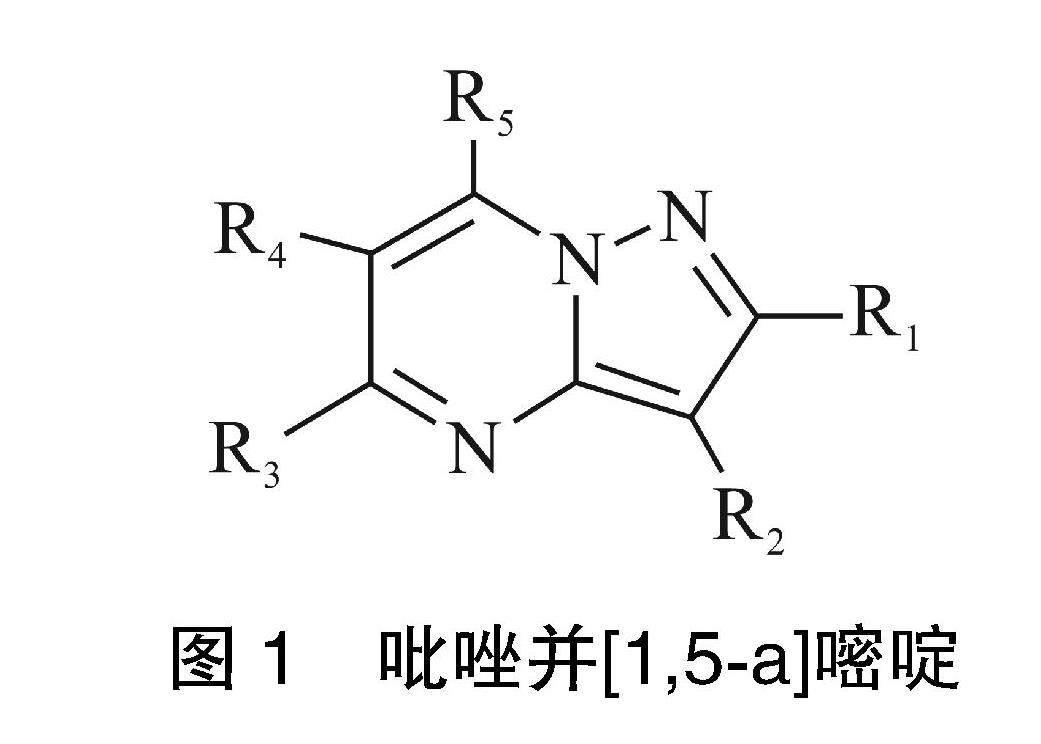
吡唑并[1,5-a]嘧啶类化合物是一类结构与嘌呤类似的含氮杂环类化合物,其分子由一个吡唑环与一个嘧啶环组成,吡唑并[1,5-a]嘧啶类化合物具有良好的生物活性,其结构式如图1:
由于吡唑与嘧啶两类重要的活性单元同时存在于吡唑并[1,5-a]嘧啶类结构化合物中,使得包含这类结构的化合物通常都具有良好的生物活性与药理活性,从而在医药等领域被广泛地应用。
在医药领域,吡唑并[1,5-a]嘧啶环是一个重要的活性中心。以这个活性中心为母核的衍生物对人体的多个重要的生物靶点能起作用,如GABA受体、钾离子通道、促肾上腺皮质激素、环氧合酶(COX-2)以及外周型苯二氮卓受体等。该类药物在临床使用中具有镇静催眠、抗病毒、抗肿瘤、抗菌、治疗心血管疾病等功效, 还可以作为多种受体配体与酶抑制剂等。长期以来受到有机化学和药物化学研究人员的广泛关注。
1 研究背景
1.1 镇静催眠药物
上市的镇静催眠药物扎来普隆,英文名称为Zaleplon,化学名称为3-[3-氰基吡唑并(1,5-a)嘧啶-7]-N-乙基乙酰苯胺。其化学结构与苯二氮卓类、巴比妥类及其它已知的催眠药不同,其发挥的药理作用可能是通过对γ氨基丁酸-苯二氮卓(GABA-BZ)受体复合物作用而实现。非临床研究显示出扎来普隆可与脑GABAA受体复合物α亚单位的ω-1受体可选择性结合。临床研究结果显示扎来普隆能缩短入睡时间,用于入睡困难导致的失眠症的短期治疗。
1.2 抗病毒药物
2011年,K·巴鲍格鲁 C·G·布加姆拉等合成吡唑并[1,5-a]嘧啶类专利化合物。所述此类化合物以及其组合物适用于治疗肺炎病毒亚科病毒引起的感染。具体地适用于治疗人类呼吸道的合胞体病毒感染导致的相关疾病。
1.3 抗菌药物
2011年,山本圭介等合成专利化合物吡唑并嘧啶衍生物,用于预防和治疗常见的如皮炎、荨麻疹、牛皮癣、湿疹、红斑狼疮、脓包病疥疮等感染性或其他皮肤疾病。
2022年,李思辉等合成了吡唑并[1,5-a]嘧啶-3-碳腈类衍生物,并发现其针对发根农杆菌具有良好的抑菌活性。
1.4 抗肿瘤药物
2012年,倪春燕等设计并合成了吡啶并[1,5-a]嘧啶酰胺类化合物,此类化合物能够对肿瘤细胞增殖活性产生影响。在构效关系研究中显示出,酰胺部分的碳链长度对其活性有较明显的影响,其中碳链长度越长活性相对越好;酰胺键中卤素相对位置的不同会部分影响该化合物对肿瘤细胞增殖活性的抑制作用,卤素在对位位置对肿瘤细胞增殖活性的抑制作用比卤素在间位时强,并且当对位为 F 时表现出的活性最强。
化合物4-[6-(4-异丙氧基)吡唑并[1,5-a]嘧啶-3-基]喹啉,其用于制备抑制自噬药物或肿瘤增敏药物的应用方法在2012年被董德利等在专利中公开。研究者发现4-[6-(4-异丙氧基)吡唑并[1,5-a]嘧啶-3-基]喹啉对于他莫昔芬(tamoxifen)的抗乳腺癌细胞的作用具有明显增强的效果,4-[6-(4-异丙氧基)吡唑并[1,5-a]嘧啶-3-基]喹啉在用于制备抑制自噬药物或肿瘤增敏药物中的应用前景极为广阔。
2013年,代荣阳等公开专利化合物6-[4-[2-(1-哌啶基)乙氧基]苯基]-3-(4-吡啶基)吡唑并[1,5-a]嘧啶及其药物组合物,研究发现可以有效抑制细胞转录,诱导肿瘤细胞凋亡,对肺癌、肝癌以及宫颈癌的疗效确切,临床应用表现出良好的前景。
2021年,赵明霞等设计并合成了吡唑并[1,5-a]嘧啶-氮芥衍生物,也在抗肿瘤细胞生长方面表现出了良好的活性。
1.5 酶抑制剂
2012年得到美国FDA批准上市的药物阿拉格列汀(Anagliptin),其化学名称为:N-[2-[[2-[(2S)-2-氰基-1-吡咯烷基]-2-乙氧基]氨基]-2-甲基丙基]-2-甲基-6-吡唑[1,5-a]嘧啶甲酰胺。是日本三和化学研究所研制的新一代治疗2-型糖尿病的DPP-4抑制剂。
2006年,P·因巴赫等在专利中公开了作为蛋白激酶抑制剂的吡唑并[1,5-a]嘧啶-7-基-胺衍生物5及其盐,用于治疗蛋白激酶依赖性疾病。
2 吡唑并[1,5-a]嘧啶及其衍生物的合成方法与进展
2.1 直接缩合
一种是利用氨基吡唑与1,3-二羰基化合物或α,β-不饱和化合物直接缩合反应。此类方法为一类传统的吡唑并[1,5-a]嘧啶类化合物的合成方法,此方法区域选择性低,反应条件剧烈,反应时间长,且产率较低。
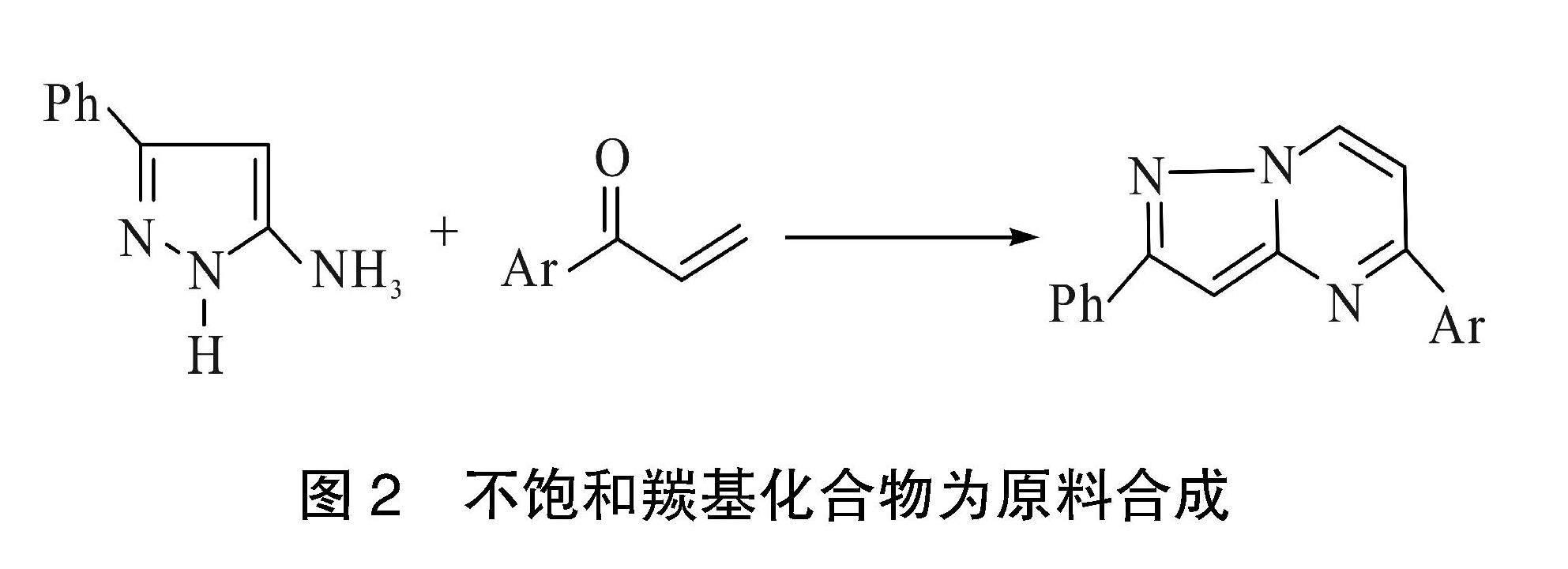
2.2 不饱和羰基化合物为原料合成
还有以1H-5-氨基吡唑与不饱和羰基化合物为原料反应合成吡唑并[1,5-a]嘧啶类化合物,反应过程如图2。
大量研究表明,吡唑并[1,5-a]嘧啶类化合物具有良好的生物活性,不仅在抗肿瘤、抗菌、抗病毒等方面效果显著还用于治疗心血管疾病、糖尿病以及精神类疾病等。因此,对吡唑并[1,5-a]嘧啶类化合物的研究已成为医药热点。
传统的吡唑并[1,5-a]嘧啶类化合物的合成方法存在反应条件剧烈、反应缓慢、产率低下等不足。本实验设计旨在探索吡唑并[1,5-a]嘧啶类化合物的新的合成途径和方法,改进提高以往方法的不足之处,寻求合成吡唑并[1,5-a]嘧啶类化合物的更加高效简洁的方法。
3 实验材料及仪器
4 实验过程
4.1 整体合成路线
实验设计以化合物2-苯基-5-氯甲基-7-对甲苯胺基吡唑并[1,5-a]嘧啶(化合物05)的合成为最终目标,设计合成线路如图3。
如图,首先以苯甲酰乙腈(化合物01)为原料,关环反应合成3-苯基-5-氨基吡唑(化合物02),以4-氯乙酰乙酸乙酯(化合物03)和对甲苯胺为原料合成1-对甲苯胺基-4-氯丁酰胺(化合物04),再将合成的原料3-苯基-5-氨基吡唑(化合物02)与1-对甲苯胺基-4-氯丁酰胺(化合物04)关环合成目标产物2-苯基-5-氯甲基-7-对甲苯胺基吡唑并[1,5-a]嘧啶(化合物05)。
该合成路线路径较短,可以在较少的反应步数内合成目标产物,而且在关环合成吡唑并[1,5-a]嘧啶环时可以避开三氯氧磷,降低反应危险性以及提高产率。
4.2 原料3-苯基-5-氨基吡唑的合成
取一只100 mL圆底烧瓶,放入一枚磁力搅拌子,先将7.26 g(50 mmol)苯甲酰乙腈加入至圆底烧瓶中,加入50 mL乙醇作为溶剂,开启搅拌器使原料逐渐溶解,再加入6.26 g(100 mmol)含量80%的水合肼(含5.01 g),继续搅拌片刻,然后将烧瓶移至油浴锅中加热回流反应,反应温度95 ℃。6小时后取反应液于离心管中加EA稀释,点TLC板,展开剂EA∶PE=1∶1(EA∶乙酸乙酯;PE3∶石油醚,下同),通过紫外分析仪观察判断反应情况,结果显示,苯甲酰乙腈反应完全且有新物质生成,如图4。
点1为苯甲酰乙腈(化合物01);点2为1、3交叉点;点3为产物点。
产物处理:取反应液用真空旋转蒸发仪旋干其乙醇溶剂,旋干产物加水搅拌,抽滤,并用PE洗涤3~5次,取固体,放入烘箱烘干即得产物(用PE重结晶产物纯度更高)3-苯基-5-氨基吡唑。烘干产物为灰白色粉末状固体。产率为73.6% 。
4.3 1-对甲苯胺基-4-氯丁酰胺的合成
取一只250 mL圆底烧瓶,放入一枚磁力搅拌子,加入80 mL甲苯作为反应溶剂,边搅拌边加入8.23 g(50 mmol)4-氯乙酰乙酸乙酯和5.36 g(50 mmol)对甲苯胺溶解,之后将催化剂氢氧化钠0.5 g溶于1 mL水中再加入反应容器,加热至115 ℃回流反应。8 h后取反应液点板(展开剂EA∶PE=1∶1),通过紫外分析仪观察无明显点,再用茚三酮染色,板上出现紫色点,显示原料反应完全,有新物质生成,产物为黄色海绵状固体。TLC板如图5。
产物处理:将其反应液抽滤,用PE冲洗3~5次,烘干即得较纯的产物。
4.4 2-苯基-5-氯甲基-7-对甲苯胺基吡唑并[1,5-a]嘧啶的合成
取1只25 mL圆底烧瓶,磁力搅拌下,加入10 mL冰乙酸作为溶剂。
点1为对甲苯胺点;点2为1、3交叉点;点3为反应液点。
先加入合成线路一中合成的原料3-苯基-5-氨基吡唑,搅拌溶解后再加入化合物30,置于油浴锅中加热至110 ℃搅拌回流反应。反应过夜后取反应液点板(展开剂EA∶PE=1∶1),通过紫外分析仪观察,有新物质生成,但反应进行不完全,原料未反应完。继续反应,24 h后点板与第一次点板结果一样,停止反应。TLC板如图6。
点1为1-对甲苯胺基-4-氯丁酰胺(化合物04)点;点2为3-苯基-5-氨基吡唑(化合物02)点;点3为反应液点。
产物处理:抽滤除去溶剂,固体用水冲洗多次,烘干即得产品。
产品用细硅胶层析柱分离提纯,洗脱液为(展开剂EA:PE=1:2)。柱层析时每隔20 mL收集一次溶液,点板确定目标产物后浓缩干燥,收率14.6%。
用氘代二甲基亚砜溶解后测一维氢谱,如图7。
1H NMR (600 MHz, DMSO) δ 11.04 (s, 1H), 8.19 (d, J = 7.4 Hz, 2H), 7.54 (t, J = 7.5 Hz, 2H), 7.49 (t, J = 7.3 Hz, 1H), 7.41 (d, J = 8.1 Hz, 2H), 7.37 (d, J = 8.1 Hz, 2H), 7.12 (s, 1H), 6.45 (s, 1H), 4.84 (s, 2H), 2.39 (s, 3H)。
5 结 论
在中间产物3-苯基-5-氨基吡唑的合成过程中,反应完全处理反应液时,最初是将溶剂乙醇用真空旋蒸仪旋干后加水搅拌再抽滤,然后用PE洗涤的产物。在后续的重复实验中,发现抽滤后将产物用PE重结晶效果明显更好,能得到纯度更高的产物。
经过反复的探索尝试,在大量实验之后,发现在目标产物2-苯基-5-取代甲基-7-芳胺基吡唑并[1,5-a]嘧啶的合成过程中,个别反应条件的改变对实验最终结果的正确与否以及产率高低有着较大的影响,因此在实验过程中,也反复对相关的这些条件进行了探讨和研究,最终筛选确定出最佳反应条件和最优合成路线。
此外,在实验过程中还发现目标化合物2-苯基-5-氯甲基-7-对甲苯胺基吡唑并[1,5-a]嘧啶的5位氯具有良好的取代活性和延展性,该化合物可以作为良好的活性中间体进一步以不同基团取代合成不同的活性目标化合物。
参考文献:
[1] 张琦, 曹贺冉, 齐婧婧, 等. 3-(2-{4-氨基-3-碘-1H-吡唑并[3, 4-d]嘧啶-1-乙氧基}丙酸)叔丁酯的合成[J]. 当代化工, 2022, 51(5): 1120-1123, 1130.
[2] 李思辉, 赵明霞, 陶佳丽, 等. 吡唑并[1, 5-a]嘧啶-3-碳腈类衍生物的合成及抑菌活性[J]. 山西农业大学学报(自然科学版), 2022, 42(4): 37-45.
[3] 赵明霞, 张东霞, 常进, 等. 新型吡唑并[1, 5-a]嘧啶-氮芥衍生物的设计、合成及抗肿瘤活性研究[J]. 化学通报(印刷版), 2021, 84(8): 803-813.
[4] 宋崇虎, 朱咏梅, 陈朴青, 等. 8-(3-氯苯基)-3-甲硫基-1-苯基-吡唑并[3, 4-d][1, 2, 4]三唑并[1, 5-a]嘧啶-4-酮衍生物的合成与表征[J]. 精细化工中间体, 2021, 51(3): 30-32, 41.
[5] 刘佳璐, 杨澳, 王楚, 等. 含噻吩并[2, 3-e][1, 2, 4]三氮唑并[4, 3-c]嘧啶结构的芳基脲类化合物的合成及抗肿瘤活性研究[J]. 中国药物化学杂志, 2022, 32(6): 421-429.
[6] 范宁娟, 李璐琦, 汤江江. 新型甾体类吡唑并[1, 5-a]嘧啶化合物的合成[J]. 合成化学, 2021, 29(2): 128-131.
[7] 王艳娇, 高晓琴, 刘斌, 等. 3-碘-1-异丙基-1H-吡唑并[3, 4-d]嘧啶-4-胺的合成研究[J]. 化学工程师, 2021, 35(9): 7-10.
[8] 孙晓阳, 冯思冉, 董金娇, 等. 含吲哚的吡唑并[3, 4-d]嘧啶衍生物的设计合成及其生物活性研究[J]. 有机化学, 2020, 40(2): 391-397.
[9] 黄欣. TRK抑制剂Selitrectinib中间体及吡唑并[1,5-a]嘧啶类化合物的合成研究[D]. 重庆: 重庆医科大学, 2022.
[10] 栗广龙, 江卓媛, 周聪, 等. 吡唑并嘧啶衍生物的设计、合成、杀虫活性及其与γ-氨基丁酸受体的结合模式[J]. 农药学学报, 2021, 23 (5): 845-855.
[11] 山本圭介, 荒武诚士, 边见和辉. 吡唑并嘧啶衍生物: CN102791712B[P]. 2015-07-01.
[12] 倪春燕, 张虞婷, 赵育, 等. 吡唑并[1, 5-a]嘧啶类c-Met激酶抑制剂的合成及生物活性研究[J]. 有机化学, 2012, 32(12): 2294-2299.
[13] 董得利, 生悦, 孙博, 等. 4-[6-(4-异丙氧基)吡唑并[1,5-a]嘧啶-3-基]喹啉在制备自噬抑制剂或肿瘤增敏药物中的用途:CN102949394 [P]. 2013-03-06.
[14] 代荣阳, 冯春红, 贺凯, 等. 吡唑并嘧啶类化合物在制备转录抑制剂药物中的用途: CN103655573A[P]. 2014-03-26.
[15] 汪雨潇. 吡唑并嘧啶及其衍生酮类的合成[J]. 医学信息, 2010, 23(7): 2251-2258.
[16] EL-BORAI M A, RIZK H F, BELTAGY D M, et al. Microwave- assisted synthesis of some new pyrazolopyridines and their antioxidant, antitumor and antimicrobial activities[J]. European Journal of Medicinal Chemistry, 2013, 66: 415-422.
[17] HASSAN A S, MADY M F, AWAD H M, et al. Synthesis and antitumor activity of some new pyrazolo[1, 5-a]pyrimidines[J]. Chinese Chemical Letters, 2017, 28(2): 388-393.
[18] MOY F J, LEE A, GAVRIN L K, et al. Novel synthesis and structural characterization of a high-affinity paramagnetic kinase probe for the identification of non-ATP site binders by nuclear magnetic resonance[J]. Journal of Medicinal Chemistry, 2010, 53(3): 1238- 1249.
[19] SALEM MOHAMED A, HELAL MOHAMED H, GOUDA MOUSTAFA A, et al. Recent synthetic methodologies for pyrazolo[1, 5-a]pyrimidine[J]. Synthetic Communications, 2019, 49(14): 1750- 1776.
Study on Synthesis of 2- Phenyl -5- Chloromethyl -7- p-Toluidine
Pyrazolo [1,5-a] Pyrimidine
LIU Yang1, BAO Anli2
(1. Sichuan Vocational College of Chemical Technology, Luzhou Sichuan 646300, China;
2. Pinghe Ankang Pharmaceutical Co., Ltd., Chengdu Sichuan 610096, China)
Abstract: Pyrazole [1,5-a] pyrimidine compounds are a class of nitrogen heterocyclic compounds with good biological activity, its molecules exist two kinds of important pyrazole and pyrimidine active unit, and thus these compounds show good biological activity, they are often widely used in medicine, pesticide, chemical and other related fields, to develop new type of antitumor drug, enzyme inhibition, fungicide, and herbicide, etc. In this paper, 2- phenyl -5- chloromethyl -7- p-toluidine pyrazolo [1,5-a] pyrimidine was synthesized. The problems and solutions in the experiments were discussed, the synthetic route was explored and screened, the synthesis method was optimized.
Key words: Pyrazole[1,5-a] pyrimidine; Nitrogenous heterocyclic compounds; Synthesis route, Route optimization
