长林小蠹对黑松挥发物电生理及行为反应
2024-07-10许建娇,张瀚文,陈焕文,周俊华,王美惠,石鹏,杨青山,项嘉建,宇佳
许建娇,张瀚文,陈焕文,周俊华,王美惠,石鹏,杨青山,项嘉建,宇佳

摘要:为探究长林小蠹对不同生理状态黑松(Pinus thunbergii)挥发物的选择偏好性,利用动态顶空吸附法,分别收集健康和不同受害程度的黑松树干和树根的挥发物,通过气相色谱-质谱联用仪(Gas chromatography-mass spectrometry,GC-MS)对收集的挥发物进行鉴定与分析,采用触角电位仪(Electroantennagraphy,EAG)和Y形嗅觉仪,分析鉴定到的黑松中主要挥发物及其他人鉴定到的黑松中主要挥发物对长林小蠹的电生理和行为影响。结果表明,健康和不同受害程度的黑松树干、树根的挥发物在组成和含量上部分差异显著(P<0.05)。树干中主要化合物(1R)-(+)-α-蒎烯的相对含量由健康木转向萎蔫木阶段呈下降趋势,在萎蔫木到枯死木阶段相对含量上升。而树根由健康木阶段转向濒死木阶段时(1R)-(+)-α-蒎烯的相对含量逐渐减少,在枯死木阶段其相对含量有所上升。EAG测试结果显示,在测定的10种挥发物中,有9种引发的雌成虫和雄成虫EAG反应值之间有显著差异。其中,雌虫对0.1 mg/mL的(1S)-(-)-α-蒎烯的反应值最高,雄虫对0.01 mg/mL的罗勒烯反应值最高。Y形嗅觉仪行为反应结果显示,不同质量浓度的挥发物对长林小蠹雌雄虫的作用不同。0.01 ~ 100 mg/mL的α-蒎烯、100 mg/mL的α-松油烯、10 mg/mL和100 mg/mL的(1S)-(-)-α-蒎烯、 (1R)-(+)-α-蒎烯对长林小蠹雌雄成虫都有较强的吸引作用,10 mg/mL的(-)-β-蒎烯对长林小蠹雌雄成虫都有较强的驱避作用。由此,0.01 ~ 100 mg/mL的α-蒎烯;100 mg/mL的α-松油烯、10 mg/mL和100 mg/mL的(1S)-(-)-α-蒎烯、 (1R)-(+)-α-蒎烯可以作为长林小蠹雌雄成虫引诱剂成分,10 mg/mL的(-)-β-蒎烯可作为长林小蠹成虫驱避剂成分。
关键词:长林小蠹;挥发性化合物;GC-MS;触角电位;行为反应
中图分类号:S763.38; S791.256文献标识码:A文章编号:1006-8023(2024)03-0101-14
Electrophysiological and Behavioral Responses of Hylurgus ligniperda to Pinus thunbergii Volatiles
XU Jianjiao, ZHANG Hanwen, CHEN Huanwen, ZHOU Junhua, WANG Meihui, SHI Peng, YANG Qingshan, XIANG Jiajian, YU Jia*
(College of Forestry, Northeast Forestry University, Harbin 150040, China)
Abstract:To explore the selectivity of the H.ligniperda to volatiles from Pinus thunbergii in different physiological states, the dynamic headspace adsorption was used to collect volatiles from healthy and harmed main trunks and roots of P. thunbergii in different damage degrees. The collected volatile samples were identified and analyzed by gas chromatography-mass spectrometry (GC-MS), and the electrophysiological and behavioral responses of H. ligniperda to the main volatiles identified in this paper (or published paper) from P.thunbergii were analyzed by electroantennography (EAG) recording system and Y-type olfactory apparatus. The results showed that there were significant differences (P<0.05) in the composition and content of volatiles in trunks and roots of P. thunbergii with different degrees of damage between healthy and different degree of damage. The relative content of the main compound (1R)-(+)-α-Pinene in the trunk decreased from healthy to wilted tree, and increased slightly in the wilted to dead standing tree stage. The relative content of (-)-β-Pinene increased significantly from the healthy stage to weakened tree, and gradually decreased in the weakened stage to dead standing tree. The relative content of (1R)-(+)-α-Pinene in the roots gradually decreased during the transition from healthy tree to dying tree stage, and its relative content increased in the dead standing tree. EAG test results showed that among those 10 tested volatiles, there were 9 substances triggered significant different EAG response values between female and male adults of H. ligniperda. Females had the highest response value to (1S)-(-)-α-Pinene at 0.1 mg/mL, and males had the highest response value to 0.01 mg/mL Ocimene. The behavioral response results of Y-type olfactory apparatus showed that different concentrations of volatiles had different effects on male and female H. ligniperda. 0.01 - 100 mg/mL α-Pinene, 100 mg/mL α-Terpinene, 10 mg/mL and 100 mg/mL (1S)-(-)-α-Pinene, (1R)-(+)-α-Pinene had a strong attractive effect on both male and female adults H. ligniperda, and 10 mg/mL(-)-β-Pinene had a strong repellent effect on both male and female adults H. ligniperda. Thus, 0.01-100 mg/mL α-Pinene, 100 mg/mL of α-Terpinene, 10 mg/mL and 100 mg/mL of (1S)-(-)-α-Pinene, (1R)-(+)-α-Pinene could be used as an attractant component for male and female adults H. ligniperda, and 10 mg/mL of (-)-β-Pinene could be used as an repellent component for adults H. ligniperda.
Keywords:Hylurgus ligniperda Fabricius; volatile compounds; GC-MS; antennal potential; behavioral responses
0引言
长林小蠹(Hylurgus ligniperda),又名红毛小蠹[1],属鞘翅目(Coleoptera)象虫科(Curculionidae)林小蠹属(Hylurgus),主要危害松属(Pinus)植物,寄主树种达20余种。现阶段,长林小蠹在我国的胶东半岛危害较为严重,主要对濒死或衰弱的黑松(Pinus thunbergii)、华山松(P. armandii)以及赤松(P. densiflora)等林木进行危害[2-3],其危害部位主要为树干、树干基部或裸露的根部。研究发现,长林小蠹也可穿过土壤对林木的根部进行危害[2]。目前,我国对于长林小蠹的研究主要停留在形态特征和分子鉴定技术方面,并未探明不同树势的寄主是否对长林小蠹具有一定的趋避或引诱作用。但已有研究表明,寄主植物挥发物对昆虫的行为具有一定的调控作用,特别是在寄主定位、取食、产卵、聚集和传播等方面 [4-5]。而小蠹主要通过其嗅觉的特异性来识别某些化合物,进而将其作为对寄主搜寻的信号[6]。研究发现,亚健康和衰弱树木易释放出特有的化学气味物质,使部分小蠹虫对其产生趋向行为[7]。如部分小蠹虫对衰弱树木中产生的乙醇有一定的趋性[8];纵坑切梢小蠹(Tomicus piniperda)对受伤的欧洲赤松(P. sylvestris)油脂中的单萜有强烈的反应[9]。而黑松中也一定存在某些化学物质来影响长林小蠹的寄主定位。
植物的不同部位所产生的化合物种类及含量有显著差异[10],而相同部位在不同生理时期所产生的挥发性物质也有很大区别[11]。在不同的生理状态下,寄主挥发物的组分差异对昆虫的行为会有一定影响[12]。如衰弱的云南松(P. yunnanensis)对纵坑切梢小蠹的引诱效果就显著高于健康树[13];榆小蠹(Hylurgopinus rufipes)会利用榆树在濒临死亡时释放出与健康株有差异的物质,来寻找合适的寄主进行繁殖[14]。研究发现,黑松健康木、机械损伤木中的挥发物随着时间的改变其种类发生变化[15]。郝德君等[16]在健康的黑松中鉴定出27种组分,在松材线虫危害木中鉴定出32种组分。而黑松在被长林小蠹危害后的衰败过程中化学成分物质以及含量发生的变化,目前尚未见报道。
小蠹对不同寄主挥发物的行为反应研究常通过触角电位进行探究,筛选出能影响小蠹趋性的寄主挥发物,从而对小蠹进行监测和防治。小蠹对不同种类、不同质量浓度的挥发物有不同的反应。例如,严广等[17]研究发现云南切梢小蠹(T. yunnanensis)对初侵害的云南松松针中的α-蒎烯、β-蒎烯和γ-萜品烯有触角电位反应;华山松大小蠹(Dendroctonus armandi)雌雄成虫对不同质量浓度、不同种类华山松针叶、韧皮部挥发性物具有不同的触角电位反应[18]。在1 mg/mL质量浓度下,橡胶树挥发物中的P-伞花烃、长叶烯等对橡胶材小蠹(Xyleborus affinis)具有引诱作用;而邻苯二甲酸二乙酯、棕榈酸甲酯等化合物对橡胶材小蠹虫均具有趋避作用[19]。目前,利用寄主植物挥发物进行有效监测及防治成为了一种避免虫害爆发的方法。梁传和等[20]使用α- 蒎烯配合信息素监测纵坑切梢小蠹的发生规律,监测准确率达到了100%。李丽莎等[21]利用寄主植物化合物制备的引诱剂对林间纵坑切梢小蠹实施了有效的监测,准确掌握了纵坑切梢小蠹的种群动态。寄主植物挥发物不仅能有效监测害虫对林木的侵害,而且能有效减少害虫对寄主的选择。例如,张维平[22]通过使用华山松中的α-蒎烯和 β-石竹烯做诱芯悬挂诱捕器,明显减轻了华山松大小蠹对华山松的危害。还有利用植物源引诱剂诱杀云杉八齿小蠹(Ips typographus)、毛束小蠹(Scolytus intricatus )、重齿小蠹(I. duplicatus)、红脂大小蠹(Dendroctonus valens)、南部松齿小蠹(I. grandicollis)以及云南纵坑切梢小蠹(T. piniperda) [23-26]的报道,都证明了研究昆虫对寄主植物挥发物的选择机制,可以有效监测和预防虫害的发生及蔓延,为防治虫害发生提供了有效的防治手段。
本研究利用气相色谱—质谱联用技术,研究了5种不同生理状态下黑松树干和树根挥发物化学成分及相对含量,鉴定并选择差异化合物对长林小蠹雌雄成虫的电生理和行为反应进行测定,可为不同生理状态、部位所释放挥发物成分的系统研究提供借鉴,也为进一步开发长林小蠹植物源引诱剂奠定基础。
1材料与方法
1.1供试虫源
2021年11月从山东省烟台市利用诱捕器收集扬飞期长林小蠹成虫,收集的长林小蠹放置在装有被害木树皮的纱网笼中。测试时要用手轻轻挤压其腹部末端,根据其是否发声辨别雌雄虫,发声的为雄虫,不发声的为雌虫[27],雌虫重复鉴定3次。
1.2仪器与设备
气相色谱-质谱联用仪(6890N,5975C安捷伦科技有限公司,美国);气相色谱-触角电位联用仪(7890A,安捷伦科技有限公司,美国);HP-5MS安捷伦毛细管柱(30 m×0.25 mm,0.25 μm filmthickness)数据采集控制器TDAC-4;气味刺激控制装置CS-55。大气采样仪QC-1S型(北京劳动保护科学研究所);吸附剂管(内填充吸附剂,长11 cm,内径0.4 cm);活性炭管(长20 cm,直径1.5 cm);聚四氟乙烯管。
1.3黑松受害等级划分
参照黑松受害木的分级标准[28-33],划分了健康木、衰弱木、萎蔫木、濒死木和枯死木5个害木等级见表1,对每个危害等级的树随机选取3株作为样本。
1.4挥发物收集与分析鉴定
收集树干挥发物时,在待测黑松距地面1.3 m处,选取树皮完好的部位,用毛刷将树皮表面附属物清理干净后,用装有阀门的聚四氟乙烯薄膜包裹。具体参考方法根据解丹等[34]的研究改进。收集树根挥发物时先选取平直无机械损伤的树根,将所选树根锯成1 m长的木段,断截面用湿棉花包裹避免失水,用毛刷清理表面浮土,再用装有阀门的聚四氟乙烯薄膜包裹树根段中部,包裹方式同上。
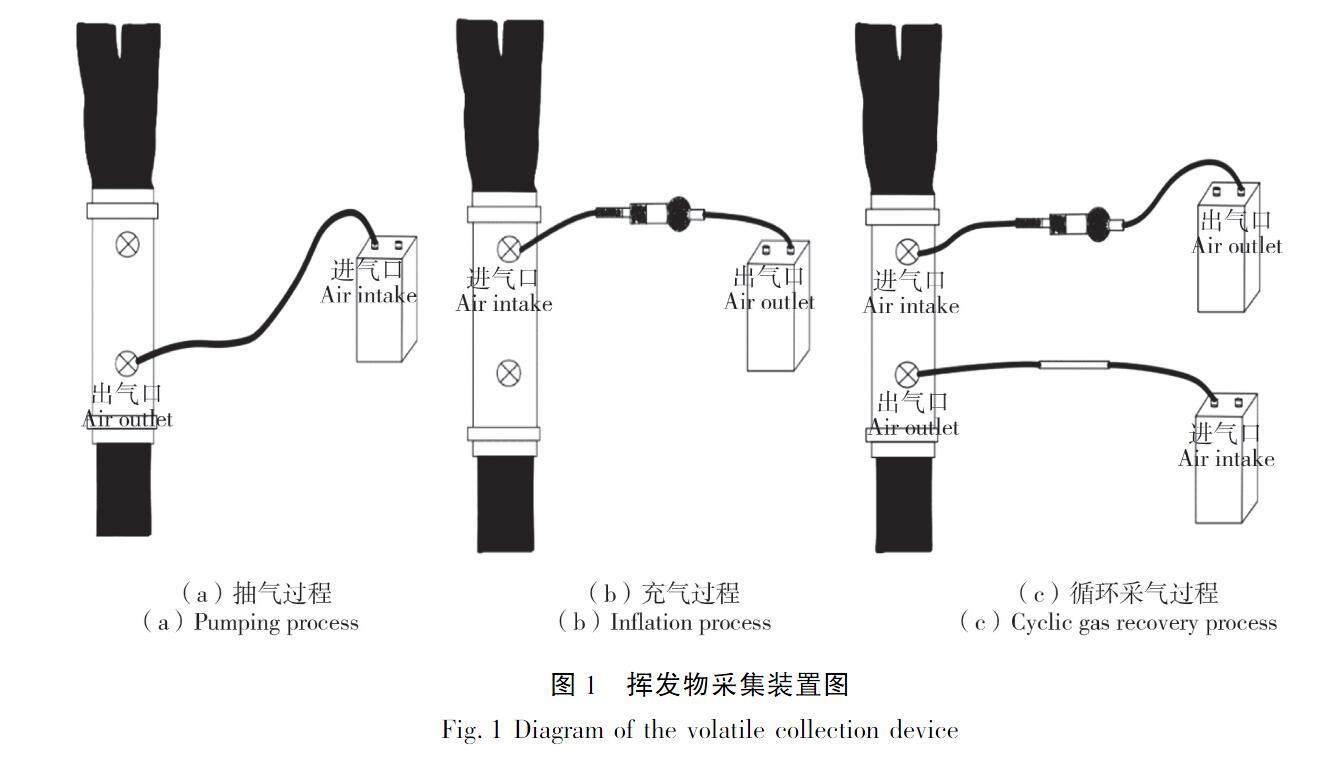
抽气时,先用聚四氟乙烯软管将大气采样仪进气口与采样桶的出气口连接,再依次打开出气口阀门与大气采样仪开关,如图1(a)所示。 对采样桶进行抽气,直到采样桶完全贴合到树皮上停止抽气,然后依次关闭出气口阀门和大气采样仪开关。充气时,用聚四氟乙烯软管依次连接大气采样仪出气口、活性炭管和采样桶的进气口,随后打开进气口阀门与大气采样仪,当采样桶中的空气达到其容量的70%时停止充气,如图1(b)所示。然后进行循环采气,循环采气时将采样桶的进气口与活性炭管和大气采样仪的出气口连接;采样桶的出气口与吸附剂采样管和另一台大气采样仪的进气口依次相连,如图1(c)所示。最后打开采样桶的进气口与出气口阀门,同时启动与两阀门相连的大气采样仪进行循环采气。在挥发物采集5 h后,将采样系统关闭,然后将吸附管迅速取下,并用铝箔纸和封口膜封住两端,低温带回试验室。在室内环境下,连续3次用0.5 mL的色谱级正己烷进行洗脱,洗脱液装入2 mL的棕色进样瓶中,做好标记后放在-4 ℃冰箱中备用。
利用气相色谱-质谱联用仪进行分析鉴定,通过谱库检索和标准品对照、复合,确定化合物的具体成分。气相色谱-质谱联用仪条件为进样口温度为250 ℃,以5 ℃/min升温至120 ℃,再以15 ℃/min升到280 ℃,并保持5 min,以高纯氮气作为载气,氢气流量为40 mL,空气流量为450 mL/min,气谱接口温度为250 ℃,气谱-质谱接口温度250 ℃,EI离子源,扫描范围30~500 m/z,离子源和四级杆温度分别为250 ℃和150 ℃,以高纯氦气作为载气,扫描频率为5次/s。
1.5电生理以及行为测定
1.5.1供试挥发物
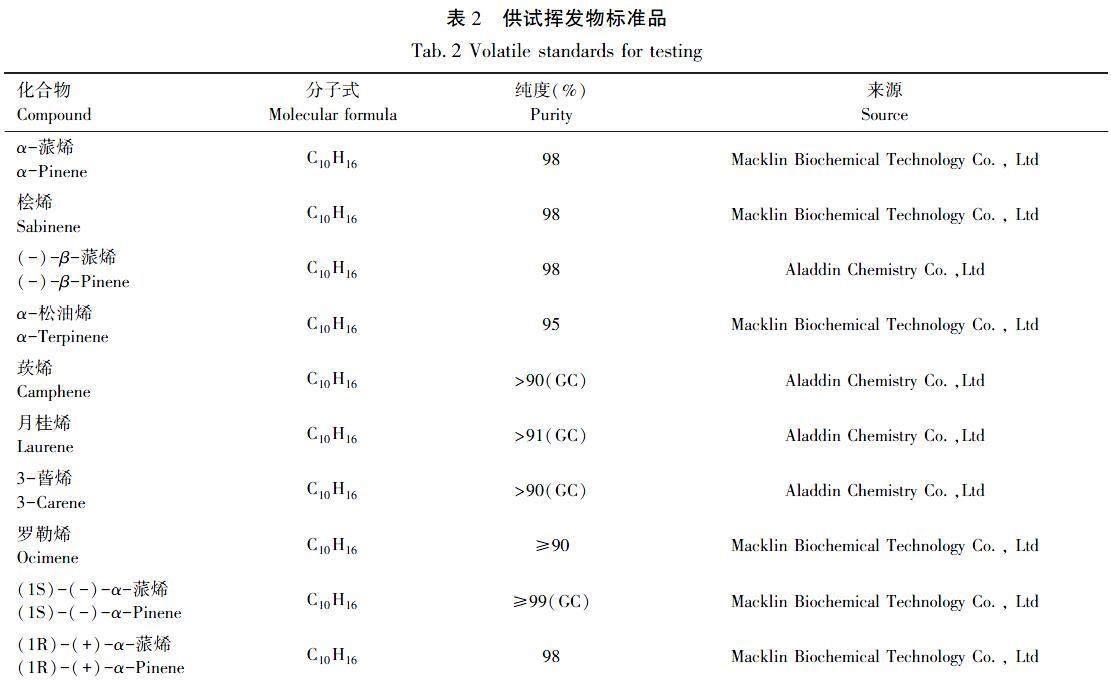
本试验选取10种黑松挥发的萜烯类化合物进行触角电位和行为学试验,见表2。其中α-蒎烯、(-)-β-蒎烯、α-松油烯、莰烯、月桂烯、3-蒈烯、(1S)-(-)-α-蒎烯、(1R)-(+)-α-蒎烯为本研究从黑松树干和树根中所鉴定到的,桧烯和罗勒烯分别由王海涛[15]、郝德君等[16]从黑松中鉴定得到。以液体石蜡为溶剂,将各样品均配制成0.01、0.1、1.0、10、100 mg/mL的5个质量浓度梯度的溶液。
1.5.2触角电位测定
将切下的触角通过毛细玻璃管连接在电极上,在巴斯德管中挥发物载体滴加样品10 μL,将其滴管末端连接气体刺激控制装置。待基线稳定后给予刺激,每个样品平均刺激6次;2次刺激的中间需用净化空气吹2 min,以减少气味分子在触角附近堆积。以液体石蜡作为对照,相同样品按质量浓度自低向高进行检测。
1.5.3Y形嗅觉仪中行为测定
利用Y形嗅觉仪测定长林小蠹对挥发性物质的生物活性。气味源为2 cm×0.5 cm的滤纸,滴加10 μL样品,以液体石蜡作对照。从Y形嗅觉仪主臂管口引入试虫,试虫在Y形管分叉处做出选择,趋向不同的侧臂。每头虫爬过侧臂1/3且停留1 min以上记为对该挥发性气味物质有选择,反之记为对该气味无选择。10头虫为一组,试验重复3次,每测15头调换Y形管两臂的位置,每次重复后更换滤纸条,以消除管臂位置和挥发物质残留对试虫行为可能产生的影响。
1.6数据分析
利用SPSS Statistics 25.0以单因素方差分析长林小蠹的EAG 反应相对值,利用邓肯检验(Duncan's test)检验其差异显著性。同时,使用独立样本t检验,来检验雌雄样本间的差异性。对Y形嗅觉仪测出的结果处理后进行卡方检验。
2结果与分析
2.1不同受害等级黑松挥发物成分及相对含量比较
通过GC-MS分析,黑松的树干和树根中共检测出25种挥发性化合物,均为萜烯类化合物,主要由单萜和倍半萜2类组成。树干挥发物中有12种单萜,8种倍半萜,见表3;树根挥发物中有11种单萜,8种倍半萜,见表4。单萜主要为(1R)-(+)-α-蒎烯、(-)-β-蒎烯、莰烯和β-月桂烯等组分,倍半萜主要为长叶烯、(+)-长叶环烯、(+)-α-长叶蒎烯和(+)-环苜蓿烯等组分。
由表3和表4可知,黑松由健康到枯死整个衰败过程中,其树干和树根挥发物的成分以及相对含量均发生了一定的变化,其中(1R)-(+)-α-蒎烯为黑松树干和树根的主要挥发物,在健康木中其相对含量均超过80%,随着受害程度的加重,(1R)-(+)-α-蒎烯仍为树干和树根挥发物的主要成分,且其相对含量在各危害等级间的树干和树根中无显著差异(P>0.05);(-)-β-蒎烯为所测黑松树干和树根挥发物的另一主要成分,其相对含量较(1R)-(+)-α-蒎烯少,(-)-β-蒎烯在树干挥发物中,从健康木到衰弱木阶段相对含量增加,并在衰弱木中的相对含量达到最高为29.55%±15.96%,而衰弱木直至枯死木阶段其相对含量逐渐减少,但无显著差异(P>0.05);(-)-β-蒎烯在树根挥发物中同样呈现出健康木到衰弱木阶段其相对含量增加,同样在衰弱木中相对含量达到最高为11.18%±4.30%,由衰弱木到濒死木阶段相对含量小幅减少,在枯死木阶段其相对含量少量上升;在树干和树根挥发物中均存在莰烯,其相对含量随危害等级的加重,相对含量也逐渐增加,并在枯死木中达到最大值,其相对含量在树干中可以从3.00%±0.20%升至11.98%±8.44%,树根中可以从2.25%±0.06%升至5.51%±1.22%;长叶烯在树干中的相对含量由健康木到萎蔫木阶段呈现小幅增加的趋势,由萎蔫木到枯死木阶段相对含量下降,树根挥发物中的长叶烯相对含量在健康木到衰弱木阶段小幅下降,由衰弱木到萎蔫木阶段其相对含量上升,由萎蔫木到濒死木阶段其相对含量下降,在枯死木阶段完全消失。长叶烯相对含量在树干和树根中均在萎蔫木中达到峰值,分别为7.52%±1.97%和7.00%±4.00%;其他挥发物的相对含量均较小,在树干挥发物中,(1S)-(-)-α-蒎烯、松油烯、异长叶烯、(-)-反式石竹烯和(-)-α-蒎烯均在濒死木和枯死木中消失,别罗勒烯、4-蒈烯、(-)-α-蒎烯均为受害后产生并最终消失,在树根挥发物中松油烯、(+)-α-长叶蒎烯、(+)-苜蓿烯和长叶烯均在枯死木中消失,(+)-3-蒈烯和香树烯为受害后产生并最终消失,(-)-α-古芸烯、葑烯和佛术烯只在枯死木中存在。
2.2长林小蠹对10种不同质量浓度植物挥发物的EAG反应
本研究选用10种不同质量浓度的挥发性化合物进行EAG反应测定。其中(1R)-(+)-α-蒎烯、(-)-β-蒎烯、莰烯是黑松的主要挥发物,另有研究表明松树在受害后出现了β-月桂烯和3-蒈烯,且黑松受害后α-松油烯、罗勒烯的含量上升[35],所以也将这些挥发物作为供试物质;除此之外还挑选了针叶树中对多种小蠹虫均有活性的桧烯、α-蒎烯以及(1S)-(-)-α-蒎烯进行试验[36]。长林小蠹雌雄成虫对所选的挥发物均产生一定程度的EAG反应值,见表5。长林小蠹雌虫对10 mg/mL的罗勒烯、1 mg/mL的(-)-β-蒎烯、0.01 mg/mL的β-月桂烯、0.01 mg/mL的α-蒎烯、0.01 mg/mL莰烯、0.01 mg/mL 3-蒈烯、0.1 mg/mL的(1S)-(-)-α-蒎烯反应值较高,其反应值分别为(1.156±0.488)、(0.937±0.217)、(0.935±0.675)、(1.041±0.645)、(1.450±0.423)、(1.040±0.324)、(2.778±0.709)mV。长林小蠹雄虫对0.01 mg/mL的罗勒烯、0.01 mg/mL的(-)-β-蒎烯、10 mg/mL的桧烯的反应值均较高,其反应值分别为(1.921±0.458)、(0.879±0.227)、(0.752±0.437)mV。而雄虫对各质量浓度的β-月桂烯、α-松油烯、α-蒎烯和莰烯的反应值均较低。
长林小蠹雌虫对10 mg/mL的罗勒烯与0.01 mg/mL和1 mg/mL的罗勒烯相比有显著差异(P<0.05),其反应值为(1.156±0.488)mV;雄虫对0.01 mg/mL的罗勒烯较其他4个质量浓度相比有显著差异(P<0.05),其反应值为(1.921±0.458) mV;长林小蠹雌虫对1 mg/mL的(-)-β-蒎烯与0.01、10、100 mg/mL的(-)-β-蒎烯相比有显著差异(P<0.05),其反应值为(0.937±0.217)mV;雄虫对0.01 mg/mL的(-)-β-蒎烯较其他4个质量浓度相比有显著差异(P<0.05),其反应值为(0.879±0.227)mV;长林小蠹雌虫对β-月桂烯的EAG反应值随质量浓度的降低而升高,并在0.01 mg/mL达到最大值,其反应值为(0.935±0.675)mV;雄虫对1 mg/mL和10 mg/mL的β-月桂烯与0.01、0.1、100 mg/mL的β-月桂烯相比有显著差异(P<0.05),其反应值为(0.329±0.070)mV和(0.317±0.067)mV;长林小蠹雌虫对1 mg/mL的α-松油烯与0.01 mg/mL和100 mg/mL的α-松油烯相比有显著差异(P<0.05),其反应值为(0.513±0.092)mV,雄虫对100 mg/mL的α-松油烯与0.1、1、 10 mg/mL的α-松油烯相比有显著差异(P<0.05),其反应值为(0.289±0.074)mV;长林小蠹雌虫对0.01 mg/mL的α-蒎烯较其他4个质量浓度相比有显著差异(P<0.05),其反应值为(1.041±0.645)mV,雄虫对10 mg/mL的α-蒎烯与0.01 mg/mL和100 mg/mL的α-蒎烯相比有显著差异(P<0.05),其反应值为(0.407±0.255)mV;长林小蠹雌虫对0.01 mg/mL的桧烯较其他4个质量浓度相比有显著差异(P<0.05),其反应值为(0.602±0.230)mV;雄虫对10 mg/mL的桧烯与0.01 mg/mL和100 mg/mL的桧烯相比有显著差异(P<0.05),其反应值为(0.752±0.437)mV;长林小蠹雌虫对0.01 mg/mL的莰烯较其他4个质量浓度相比有显著差异(P<0.05),其反应值为(1.450±0.423)mV;雄虫对10 mg/mL的莰烯与0.01 mg/mL和1 mg/mL的莰烯相比有显著差异(P<0.05),其反应值为(0.540±0.139)mV;长林小蠹雌虫对0.01 mg/mL的3-蒈烯较其他4个质量浓度相比有显著差异(P<0.05),其反应值为(1.040±0.324)mV;雄虫对0.1 mg/mL的3-蒈烯较其他4个质量浓度相比有显著差异(P<0.05),其反应值为(0.610±0.227)mV。长林小蠹雌虫对0.1 mg/mL的(1S)-(-)- α-蒎烯较其他4个质量浓度相比有显著差异(P<0.05),其反应值为(2.778±0.709)mV,雄虫对100 mg/mL的(1S)-(-)-α-蒎烯与1 mg/mL的(1S)-(-)-α-蒎烯相比有显著差异(P<0.05),其反应值为(0.218±0.044)mV。长林小蠹雌雄虫对(1R)-(+)-α-蒎烯所选的5个质量浓度的电生理反应值之间均无差异(P>0.05)。
独立t检验结果表明,长林小蠹雌雄虫对0.01 mg/mL的罗勒烯,1 mg/mL的(-)-β-蒎烯、α-松油烯、α-蒎烯、(1S)-(-)-α-蒎烯、桧烯以及0.1 mg/mL的桧烯和10 mg/mL的莰烯有极显著的EAG性别差异(P<0.01)。对0.01 mg/mL的(-)-β-蒎烯、桧烯、莰烯、3-蒈烯,0.1 mg/mL的α-松油烯、3-蒈烯、(1S)-(-)-α-蒎烯,1 mg/mL的β-月桂烯、3-蒈烯和10 mg/mL的罗勒烯、β-月桂烯、α-松油烯以及100 mg/mL的莰烯有显著的EAG性别差异(P<0.05)。除此之外,长林小蠹成虫对同一化合物在某一特定质量浓度下的EAG反应不存在性别差异性。
2.3长林小蠹对10种不同质量浓度植物挥发物的行为反应
本研究采用5种质量浓度的10种单体化合物进行Y形嗅觉仪的生物测定。由图2可知,100 mg/mL (1R)-(+)-α-蒎烯对长林小蠹雌虫表现极显著的引诱作用(P<0.01),引诱率为86.7%;0.1、10、100 mg/mL(1R)-(+)-α-蒎烯对雄虫表现出极显著引诱作用(P<0.01),引诱率分别为76.7%、73.3%、83.3%;10 mg/mL(P<0.05)(1S)-(-)-α-蒎烯对长林小蠹雌雄虫均表现出显著的引诱作用,引诱率均为80.0%;100 mg/mL(P<0.01)(1S)-(-)-α-蒎烯对长林小蠹雌雄虫表现出极显著的引诱作用,引诱率分别为83.3%和86.7%;1 mg/mL的罗勒烯对长林小蠹雌虫均表现出极显著的引诱作用(P<0.01),引诱率为76.7%;0.01 mg/mL罗勒烯对雄虫均表现出极显著引诱作用(P<0.01),引诱率为86.7%;0.01 mg/mL和10 mg/mL的3-蒈烯对雌虫均表现出显著引诱作用(P<0.05),引诱率分别为80.0%、70.0%;0.1 mg/mL的3-蒈烯对长林小蠹雄虫表现出显著的引诱作用(P<0.05),引诱率为70.0%;100 mg/mL β-月桂烯对长林小蠹雌虫表现出极显著的引诱作用(P<0.01),引诱率为90.0%;1 mg/mL和10 mg/mL的β-月桂烯对长林小蠹雄虫表现出极显著的引诱作用(P<0.01),引诱率分别为76.7%、80.0%;1 mg/mL(P<0.01)莰烯对雌虫表现出极显著引诱作用,引诱率为73.3%;100 mg/mL的莰烯对雄虫表现出极显著引诱作用(P<0.01),引诱率为83.3%;100 mg/mL的α-松油烯对长林小蠹雌虫表现出显著的引诱作用(P<0.05),引诱率为86.7%;0.1 mg/mL(P<0.05)和100 mg/mL(P<0.01)α-松油烯对雄虫表现出显著或极显著引诱作用,引诱率分别为60.0%、73.3%; 0.1 mg/mL的(-)-β-蒎烯对长林小蠹雌虫表现出极显著引诱作用(P<0.01),引诱率为76.7%;10 mg/mL的(-)-β-蒎烯对长林小蠹雌虫表现出显著驱避作用(P<0.05),驱避率为66.7%;0.1 mg/mL的(-)-β-蒎烯对长林小蠹雄虫表现出显著的引诱作用(P<0.05),引诱率为70.0%;0.1 mg/mL和10 mg/mL的桧烯对雌虫表现出极显著的引诱作用(P<0.01),引诱率分别为76.7%和83.3%;0.01、0.1、1、100 mg/mL的桧烯均对长林小蠹雄虫表现出极显著的引诱作用(P<0.01),引诱率分别为83.3%、76.7%、86.7%、80.0%;10 mg/mL的α-蒎烯对长林小蠹雌成虫具有显著的引诱作用(P<0.05),0.01、0.1、1、100 mg/mL的α-蒎烯对长林小蠹雌成虫均具有极显著的引诱作用(P<0.01),引诱率分别为77.30%、83.30%、96.70%、93.30%;0.01 mg/mL(P<0.01)、100 mg/mL(P<0.01)的α-蒎烯对长林小蠹雄虫表现出极显著的引诱作用,引诱率分别为73.3%、90.0%。
3讨论
试验结果表明,黑松挥发物主要由单萜和倍半萜构成。所测黑松树干的主要挥发物为(1R)-(+)-α-蒎烯、莰烯、(-)-β-蒎烯、β-月桂烯、3-蒈烯和长叶烯,部分学者对黑松树干、枝条、松针分别做过研究报道,(1R)-(+)-α-蒎烯、莰烯、(-)-β-蒎烯、β-月桂烯均为主要挥发性成分[15-16,37],但是主成分的相对含量以及相对含量低的物质成分上存在明显差异。本研究树干挥发物只测出20种萜烯类化合物,而王海涛[15]所测的黑松松针挥发物共检测出95种化合物,大部分是萜烯类化合物,同时还检测出5种醇类、5种酯类以及1种酸类和2种醚类;郝德君等[16]利用水蒸气蒸馏装置从黑松健康木中鉴定出了27种组分,单萜主要为α-蒎烯、β-蒎烯、莰烯、β-水芹烯和α-异松油烯等组分,倍半萜主要为异长叶烯、紫穗槐烯和反式-石竹烯等组分,研究结果不一致可能是取样部位、采样时间、提取方式、色谱条件以及种源和植物所处环境等多方面因素所造成的。伍苏然等[38]研究发现,云南松在衰弱状态下的α-蒎烯相对含量显著低于其健康状态下的含量;而本试验测出被长林小蠹危害后的黑松树干中的(1R)-(+)-α-蒎烯相对含量在萎蔫木阶段比健康木阶段含量低,这证明了(1R)-(+)- α-蒎烯的相对含量与随着受害程度加深而降低。而(1R)-(+)-α-蒎烯在萎蔫木到枯死木阶段其相对含量上升,这或许是由于黑松被长林小蠹危害后产生的抗性生理反应所造成的。在本研究中,黑松树干内的(-)-β-蒎烯在健康木转向衰弱木阶段其相对含量大幅增加,这是由于 β-蒎烯作为植物体防御机制有关的有机物成分[35,39],在黑松受到长林小蠹危害时,自身会释放出更多的(-)-β-蒎烯对其进行防御;而衰弱木转向枯死木阶段其 (-)-β-蒎烯的相对含量逐渐降低,这可能是由于小蠹危害导致树干韧皮部和木质部输导组织被切断,影响树体生长,进而导致释放的化合物相对含量也降低。伍苏然等[40]研究发现云南松由健康转向衰弱过程中其莰烯的含量相对增加;而本研究中树干内的莰烯在健康木转向枯死木的阶段中其相对含量也逐步增加,推测莰烯可能是影响长林小蠹取食和产卵的关键性物质。本研究发现, (-)-α-蒎烯只存在于萎蔫木阶段,而(1S)-(-)-α-蒎烯、松油烯、异长叶烯和(-)-反式石竹烯均未出现在濒死木和枯死木阶段,虽然这些物质的含量很低但也不能被忽略,或许正是微量成分的比例变化为长林小蠹的寄主选择、取食、产卵提供了化学信息。而黑松树根的主要挥发物略不同于树干,但其健康木转向枯死木的过程中物质的变化也是存在一定差异的。树根的主要成分为(1R)-(+)-α-蒎烯、莰烯、(-)-β-蒎烯、松油烯和长叶烯。黑松树根由健康木阶段转向濒死木时 (1R)-(+)-α-蒎烯的相对含量逐渐减少,在枯死木阶段其相对含量有所上升;而(-)-β-蒎烯的相对含量在健康木转向衰弱木的过程中上升,由衰弱木转向萎蔫木的过程中相对含量下降,而在萎蔫木转向枯死木的过程中相对含量逐步上升;松油烯、(+)-α-长叶蒎烯、(+)-苜蓿烯和长叶烯均在枯死木树根中消失。树干、树根挥发物的成分和相对含量的变化不同可能是由于二者所处的环境条件、采样条件造成的。小蠹类害虫常常有聚集危害的特点,在侵入成功以后,刺激寄主植物或者自身利用寄主植物化合物产生释放出大量聚集的化学信号,促使更多同类入侵[41]。而研究发现,黑松树干和树根均在萎蔫木中萜类化合物的种类最多,故推测由于长林小蠹的入侵造成健康木到萎蔫木阶段的黑松释放出聚集信息化合物,吸引了更多的长林小蠹危害,随着寄主受害程度的加重,濒死木和枯死木阶段黑松树势衰弱,所释放的挥发物种类和含量降低。
王茹琳等[41]研究发现,华山大小蠹雌虫触角对低剂量的寄主挥发物的EAG反应值显著高于雄虫,闫争亮等[42]对红脂大小蠹的研究也表明雌虫对α-蒎烯、3-蒈烯的EAG灵敏度要高于雄虫。而本研究通过EAG和Y形嗅觉仪的结果表明,长林小蠹成虫对不同质量浓度的(1R)-(+)-α-蒎烯、(1S)-(-)-α-蒎烯、桧烯、(-)-β-蒎烯、α-松油烯、莰烯、β-月桂烯、3-蒈烯、罗勒烯、α-蒎烯均表现出不同程度的电生理反应和行为反应。所选挥发物的质量浓度对长林小蠹雌雄虫触角的EAG反应具有直接的影响。在刺激剂量为0.01 mg/mL时,长林小蠹雌虫对β-月桂烯、α-蒎烯、桧烯、莰烯、3-蒈烯均有显著的触角电位反应,且引起的触角电位反应相对值要明显高于雄虫,证明了长林小蠹在较低剂量气味刺激下,雌虫触角比雄虫触角更为敏感,这可能是由于不同性别的昆虫个体在寻找寄主、繁殖后代等行为中所起的作用并不相同。
行为反应测定结果表明,α-蒎烯对长林小蠹雌雄虫均有较强的引诱作用,桧烯、罗勒烯、(1S)-(-)-α-蒎烯均对长林小蠹雌虫有较强的引诱作用;3-蒈烯、(1R)-(+)-α-蒎烯对雄虫有引诱作用;低质量浓度的β-月桂烯对长林小蠹雌虫有驱避作用,而高质量浓度β-月桂烯对雌虫有显著的吸引作用。这可能是由于寄主挥发性物质的质量浓度对昆虫的行为有一定影响,只有活性成分质量浓度恰当时才能表现出引诱效果,质量浓度过高、过低可能起到驱避或迷向的作用[41],由于林间释放效率尚未可知,所以这些物质对长林小蠹在林间的引诱效果可能不稳定,有待进一步研究验证。
长林小蠹在Y形型嗅觉仪中的行为反应与EAG反应的趋势并非全部一一相对应,如雄虫触角对0.01 mg/mL的α-蒎烯引起的EAG反应与其他所选的4个质量浓度没有显著性差异,而0.01 mg/mL的α-蒎烯对雄虫的引诱率差异显著;雌虫触角对10 mg/mL桧烯引起的EAG反应与其他所选的4个质量浓度没有显著性差异,而10 mg/mL桧烯对雄虫的引诱率其他所选的4个质量浓度相比有极显著差异。这可能与嗅觉感受器的生理结构和其对气味的敏感性和选择性有关,因此长林小蠹雌雄虫对寄主挥发物行为感受机制中存在一定的差异还需要进一步进行研究。总体而言,雌虫的正趋向率要明显高于雄虫,这说明长林小蠹雌虫在寻找寄主过程中起着极其重要的作用,雌虫先利用寄主挥发物搜寻及入侵寄主,而后诱集雄虫进入进行危害[2],这也可能是造成雌虫的正趋向率高于雄虫的主要原因。
4结论
本研究测定了不同健康水平下的黑松树干和树根挥发物的组成及差异。在此基础上研究了10种植物挥发性化合物对长林小蠹的电生理和行为反应,其中包括多种松属植物广泛存在的(1S)-(-)-α-蒎烯、(1R)-(+)-α-蒎烯以及3-蒈烯等物质和多种由寄主树势衰弱引发波动的挥发物组分,也包括前人研究的对多种小蠹亚科昆虫有吸引作用的物质。发现长林小蠹对特定质量浓度的一些挥发物会产生EAG反应和趋性。由此可见长林小蠹对各种松属树木均有较大的危害风险。
【参考文献】
[1]李承锦,赵文霞,淮稳霞,等.我国新入侵害虫长林小蠹研究进展[J].环境昆虫学报,2023,45(4):850-861.
LI C J, ZHAO W X, HUAI W X, et al. Research progress on Hylurgus ligniperda Fabricius (Coleoptera: Curculionidae), a new invasive species in China[J]. Journal of Environmental Entomology, 2023, 45(4): 850-861.
[2]任利利,陶静,武海卫,等.重大害虫长林小蠹入侵我国的首次发现与侵染特征[J].林业科学,2021,57(5):140-150.
REN L L, TAO J, WU H W, et al. The first discovery and infective characteristics of A major invasive pest Hylurgus ligniperda (Coleoptera: Scolytidae) in China[J]. Scientia Silvae Sinicae, 2021, 57(5): 140-150.
[3]Hoebeke E R.Hylurgus ligniperda: A new exotic pine bark beetle in the United States[J]. Newsletter of the Michigan Entomological Society, 2001, 46: 1-2.
[4]WANG H, ZHOU W L, LI Z, et al. Plant volatiles mediate evolutionary interactions between plants and tephritid flies and are evolutionarily more labile than non-volatile defenses[J]. The Journal of Animal Ecology, 2021, 90(4): 846-858.
[5]SHIMODA T, NISHIHARA M, OZAWA R, et al. The effect of genetically enriched (E)-β-ocimene and the role of floral scent in the attraction of the predatory mite Phytoseiulus persimilis to spider mite-induced volatile blends of torenia[J]. The New Phytologist, 2012, 193(4): 1009-1021.
[6]BYERS J A. Attraction of bark beetles,Tomicus piniperda, Hylurgops palliatus, and Trypodendron domesticum and other insects to short-chain alcohols and monoterpenes[J]. Journal of Chemical Ecology, 1992, 18(12): 2385-2402.
[7]GREGOIRE J C, BAISIER M, DRUMONT A, et al. Volatile compounds in the larval frass of Dendroctonus valens and Dendroctonus micans (Coleoptera: Scolytidae) in relation to oviposition by the predator, Rhizophagus grandis (Coleoptera: Rhizophagidae)[J]. Journal of Chemical Ecology, 1991, 17(10): 2003-2019.
[8]SCHROEDER L M, LINDELOW A. Attraction of scolytids and associated beetles by different absolute amounts and proportions of α-pinene and ethanol[J]. Journal of Chemical Ecology, 1989, 15(3): 807-817.
[9]SCHROEDER L M. Attraction of the bark beetle Tomicus piniperda to Scots pine trees in relation to tree vigor and attack density[J]. Entomologia Experimentalis et Applicata, 1987, 44(1): 53-58.
[10]肖春.枫杨枝把引诱棉铃虫Helicoverpa armigera的机理[D].上海:中国科学院上海昆虫研究所,1999.
XIAO C. The mechanism of attracting Helicoverpa armigera with maple and poplar branches[D]. Shanghai: Shanghai Institute of Entomology, Chinese Academy of Sciences, 1999.
[11]宁眺,樊建庭,方宇凌,等.不同危害状态下寄主萜烯挥发物含量的变化及松墨天牛对其组分的触角电位反应[J].昆虫学报,2006,49(2):179-188.
NING T, FAN J T, FANG Y L, et al. Changes in contents of host volatile terpenes under different damaged states and electroantennogram response of Monochamus alternatus Hope to these volatiles[J]. Acta Entomologica Sinica, 2006, 49(2): 179-188.
[12]樊慧,金幼菊,李继泉,等.引诱植食性昆虫的植物挥发性信息化合物的研究进展[J].北京林业大学学报,2004,26(3):76-81.
FAN H, JIN Y J, LI J Q, et al. Advances on plant volatile semiochemicals attracting herbivorous insects[J]. Journal of Beijing Forestry University, 2004, 26(3): 76-81.
[13]赵涛,李丽莎,周楠.云南松对松小蠹的引诱能力及其挥发物组成[J].东北林业大学学报,2002,30(4):47-49.
ZHAO T, LI L S, ZHOU N. The attraction of Yunnan pine to pine shoot beetle and tree volatile compositions[J]. Journal of Northeast Forestry University, 2002, 30(4): 47-49.
[14]MILLAR J G, ZHAO C H, LANIER G N, et al. Components of moribund American elm trees as attractants to elm bark beetles,Hylurgopinus rufipes and Scolytus multistriatus[J]. Journal of Chemical Ecology, 1986, 12(3): 583-608.
[15]王海涛.松褐天牛对黑松的危害及部分防御性物质的影响[D].泰安:山东农业大学,2016.
WANG H T. Effect of Monlchamus alternatus (Hope) harm on Pinus thunbergii and part of secondary metabolites[D]. Taian: Shandong Agricultural University, 2016.
[16]郝德君,马凤林,王焱,等.松墨天牛对不同生理状态黑松挥发物的触角电生理和行为反应[J].应用生态学报,2006,17(6):1070-1074.
HAO D J, MA F L, WANG Y, et al. Electroantennogram and behavioral responses of Monochamus alternatus to the volatiles from Pinus thunbergii with different physiological status[J]. Chinese Journal of Applied Ecology, 2006, 17(6): 1070-1074.
[17]严广,张梦蝶,钱路兵,等.云南切梢小蠹对初侵害云南松挥发物的电生理和行为反应[J].环境昆虫学报,2021,43(6):1389-1397.
YAN G, ZHANG M D, QIAN L B, et al. Electrophysiological and behavioral responses of Tomicus yunnanensis to plant volatiles from primarily infected Pinus yunnanensis in Yunnan, Southwest China[J]. Journal of Environmental Entomology, 2021, 43(6): 1389-1397.
[18]王茹琳,杨伟,杨佐忠,等.华山松大小蠹对9种植物挥发物的EAG和行为反应[J].中国森林病虫,2011,30(1):23-26.
WANG R L, YANG W, YANG Z Z, et al. Electroantennographic and behavioral responses of Dendroctonus armandi (Tsai et Li) to 9 plant volatiles[J]. Forest Pest and Disease, 2011, 30(1): 23-26.
[19]徐凡丁,周祥,宋灿灿.橡胶树挥发性成分对橡胶材小蠹的行为影响[J].基因组学与应用生物学,2020,39(9):4145-4153.
XU F D, ZHOU X, SONG C C. Effects of volatile components in rubber tree on behavior of Xyleborus affinis[J]. Genomics and Applied Biology, 2020, 39(9): 4145-4153.
[20]梁传和,孙继平,徐海峰,等.应用聚集信息素监测与防治纵坑切梢小蠹效果初报[J].吉林林业科技,2012,41(2):23-25.
LIANG C H, SUN J P, XU H F, et al. Application of semiochemicals on monitoring and control of Tomicus piniperda[J]. Journal of Jilin Forestry Science and Technology, 2012, 41(2): 23-25.
[21]李丽莎,刘宏屏,周楠,等.松小蠹综合控制技术研究[J].西部林业科学,2004,33(1):62-71.
LI L S, LIU H P, ZHOU N, et al. Studies on the integrated control techniques of Tomicus piniperda[J]. Yunnan Forestry Science and Technology, 2004, 33(1): 62-71.
[22]张维平.华山松大小蠹寄主选择机制的初步研究[D].杨凌:西北农林科技大学,2015.
ZHANG W P. Preliminarystudies on the host selection mechanism of Dendroctonus Armandi (Coleoptera: Scolytidae)[D]. Yangling: Northwest A & F University, 2015.
[23]陈敏,李永和,王晓佳.华山松树皮挥发性诱虫活性物质成分分析[J].林业科学研究,2007,20(3):428-432.
CHEN M, LI Y H, WANG X J. Analysis of volatile constituents in Pinus armandii bark with GC/MS[J]. Forest Research, 2007, 20(3): 428-432.
[24]李为争,胡晶晶,陈汉杰,等.挥发性植物源害虫引诱剂筛选与混配方法的新视角[J].应用昆虫学报,2015,52(5):1094-1106.
LI W Z, HU J J, CHEN H J, et al. A new perspective on the screening and blending of volatile pest attractants derived from plants[J]. Chinese Journal of Applied Entomology, 2015, 52(5): 1094-1106.
[25]苗振旺,赵明梅,王立忠,等.强大小蠹植物源引诱剂林间应用技术[J].昆虫知识,2003,40(4):346-350.
MIAO Z W, ZHAO M M, WANG L Z, et al. Application of semiochemicals in monitoring and controlling the red turpentine beetle,Dendroctormus Valens[J]. Entomological Knowledge, 2003, 40(4): 346-350.
[26]李菁,骆有庆,石娟,等.利用植物源引诱剂监测与控制舞毒蛾[J].北京林业大学学报,2011,33(4):85-90.
LI J, LUO Y Q, SHI J, et al. Use of phyto-attractant in monitoring and controlling Gypsy moth[J]. Journal of Beijing Forestry University, 2011, 33(4): 85-90.
[27]SOPKOTA S. Acoustic communication and behaviour of the golden haired pine bark beetle, Hylurgus ligniperda (Coleoptera: Curculionidae)[D]. New Zealand, Palmerston North: Massey University, 2017.
[28]张海林,肖广会,乔润喜.落叶松小蠹虫测报及防治对策[J].科技信息(科学教研),2008(24):324,190.
ZHANG H L, XIAO G H, QIAO R X. Forecast and control countermeasures of larch bark beetles[J]. Science & Technology Information, 2008(24): 324, 190.
[29]高宝嘉,信金娜,关慧元,等.红脂大小蠹的发生和危害规律[J].动物学杂志,2003,38(5):71-73.
GAO B J, XIN J N, GUAN H Y, et al. The generation and damage regulation of red turpentine beetle[J]. Chinese Journal of Zoology, 2003, 38(5): 71-73.
[30]李菊彩,宋升治,金智伟,等.昆明市西山林场云南松纵坑切梢小蠹危害调查及综合防治[J].现代农业科技,2019(13):103-104,106.
LI J C, SONG S Z, JIN Z W, et al. Harm investigation and comprehensive prevention of Tomicus piniperda in Pinus yunnanensis of Xishan forest farm in Kunming city[J]. Modern Agricultural Science and Technology, 2019(13): 103-104, 106.
[31]张威,李巧,赵祎,等.昆明翠湖公园三角枫材小蠹危害调查及防治对策[J].云南农业大学学报(自然科学),2012,27(2):294-298.
ZHANG W, LI Q, ZHAO Y, et al. Investigation of Xyleborus sp. attacking on Acer buergerianum and strategy of control on the beetle in Cuihu Park, Kunming[J]. Journal of Yunnan Agricultural University (Natural Science), 2012, 27(2): 294-298.
[32]张红玉,张吉乾,陶伦艳,等.纵坑切梢小蠹对健康马尾松人工林的侵害特点[J].贵州科学,2012,30(6):6-11.
ZHANG H Y, ZHANG J Q, TAO L Y, et al. Damage characteristics of Tomicus piniperda in healthy man-made forest of Pinus massoniana[J]. Guizhou Science, 2012, 30(6): 6-11.
[33]阿红昌,黄雅志,杨雄飞.西双版纳橡胶小蠹虫优势种类和为害规律调查[J].云南热作科技,2002,25(3):9-11.
A H C, HUANG Y Z, YANG X F. Dominant species of rubber borer and it's working rule in Xishuangbanna[J]. Journal of Yunnan Tropical Crops Science & Technology, 2002, 25(3): 9-11.
[34]解丹,宋效惠,王海峰,等.不同种源红松主干挥发物对赤松梢斑螟危害的影响[J].东北林业大学学报,2021,49(5):115-119.
XIE D, SONG X H, WANG H F, et al. Effects of volatiles from the tunk of Pinus koraiensis of different provenances on the damage of Dioryctria sylvestrella[J]. Journal of Northeast Forestry University, 2021, 49(5): 115-119.
[35]吕迪,王得祥,谢小洋,等.油松释放萜烯类挥发性成分研究[J].西北林学院学报,2016,31(1):231-237.
LYU D, WANG D X, XIE X Y, et al. Terpene volatile components released from Pinus tabulaeformis[J]. Journal of Northwest Forestry University, 2016, 31(1): 231-237.
[36]陈辉,李宗波.植物挥发性化合物在小蠹虫寄主选择中的作用[J].福建林学院学报,2006,26(1):87-91.
CHEN H, LI Z B. The regulation role of plant volatiles in host selection of bark beetles (Coleoptera: Scolytidae)[J]. Journal of Fujian College of Forestry, 2006, 26(1): 87-91.
[37]高慈元.松树蜂和新渡户树蜂相关信息化学物质及林间诱捕技术研究[D].北京:北京林业大学,2020.
GAO C Y. Study on theassociated semiochemicals and trapping techniquesin forest of Sirex noctilio Fabricius and S Nitobei[D]. Beijing: Beijing Forestry University, 2020.
[38]伍苏然,周平阳,李正跃,等.云南松健康松与衰弱松针叶挥发物化学成分比较[J].天然产物研究与开发,2010,22(6):1048-1052.
WU S R, ZHOU P Y, LI Z Y, et al. Analysis the volatile constituents of pine needles from health and debility Pinus yunnanensis[J]. Natural Product Research and Development, 2010, 22(6): 1048-1052.
[39]刘敏.影响红脂大小蠹寄主树种选择行为关键因子的研究[D].北京:北京林业大学,2020.
LIU M. Study on key factors affecting host tree species selection behavior of Dendroctonus valens[D]. Beijing: Beijing Forestry University, 2020.
[40]伍苏然,张淑颖,熊国如,等.不同生理状态云南松木段挥发物化学成分比较[J].东北林业大学学报,2012,40(10):115-119,147.
WU S R, ZHANG S Y, XIONG G R, et al. Analysis of volatile constituents in pine logs from Pinus yunnanensis under different physiological states[J]. Journal of Northeast Forestry University, 2012, 40(10): 115-119, 147.
[41]王茹琳,杨伟,杨佐忠,等.华山松大小蠹对几种寄主挥发物组分的EAG和行为反应[J].生态学杂志,2011,30(4):724-729.
WANG R L, YANG W, YANG Z Z, et al. Electroantennographic and behavioral responses of Dendroctonus armandi (Coleoptera: Ipidae)to host plant volatiles[J]. Chinese Journal of Ecology, 2011, 30(4): 724-729.
[42]闫争亮,方宇凌,孙江华,等.红脂大小蠹后肠挥发性物质的鉴定、触角电位和室内趋向实验[J].昆虫学报,2004,47(6):695-700.
YAN Z L, FANG Y L, SUN J H, et al. Identification and electroantennal olfactory and behavioral tests of hindgut-produced volatiles of the red turpentine beetle,Dendroctonus valens LeConte (Coleoptera: Scolytidae)[J]. Acta Entomologica Sinica, 2004, 47(6): 695-700.
