2株甘蔗内生菌功能特性研究
2024-07-03罗艳菊谢林艳刘涵刘鲁峰何丽莲李富生
罗艳菊 谢林艳 刘涵 刘鲁峰 何丽莲 李富生
doi:10.15889/j.issn.1002-1302.2024.10.037
摘要:K5菌株和ZM菌株是在30% PEG-6000胁迫下具有较强活性的2株甘蔗内生菌,对其溶无机磷、分泌嗜铁素、羧甲基纤维素酶、ACC脱氨酶、胞外多糖(EPS)的能力进行探究,并通过发芽试验评价2株菌株对玉米种子萌发和幼苗生长的促进作用。结果表明,2株甘蔗内生菌均具备上述测定的多种功能特性。其中K5菌株具有较强的分泌嗜铁素和ACC脱氨酶的能力,其嗜铁素相对含量为0.209(培养3 d),ACC脱氨酶活性为3.302 U/mg;ZM菌株具有较强的分泌胞外多糖和溶无机磷能力,其胞外多糖分泌量为0.157 mg/mL,溶无机磷量为407.454 mg/L。此外,与清水处理的对照相比,2株菌株均能提高玉米种子的发芽势,并且表现出一定的促生长效果,其中K5菌株的促生效果较好。表明2株甘蔗内生菌均是具有促生、抗旱和产羧甲基纤维素酶潜力的多功能菌株,有良好的开发潜力,可为植物抗旱性的研究及生物菌肥的研制提供一定的理论依据及菌株资源。
关键词:甘蔗;内生菌;功能特性;定性;定量;发芽试验
中图分类号:S566.101;S182 文献标志码:A
文章编号:1002-1302(2024)10-0268-06
收稿日期:2023-07-06
基金项目:云南省重大科技专项(编号:202202AE090021);云南省教育厅科学研究基金(编号:2022J0286);云南省作物生产与智慧农业重点实验室专项(编号:202105AG070007)。
作者简介:罗艳菊(1998—),女,云南砚山人,硕士研究生,研究方向为甘蔗种质资源评价与利用。E-mail:1833912990@qq.com。
通信作者:李富生,博士,教授,主要从事甘蔗资源研究与利用工作。E-mail:Lfs810@sina.com。
甘蔗(Saccharum officinarum L.)属于禾本科甘蔗属多年生的无性繁殖作物[1],是世界上重要的糖料和能源作物。我国是重要的甘蔗种植国,蔗糖产量占食糖总产量的90%以上[2]。目前,有130多个国家进行甘蔗的种植,占地约2 600万hm2[3]。近年来,我国甘蔗种植的大部分区域逐渐向土地贫瘠、灌溉条件差、养分水分保持能力弱的旱坡地发展,旱地甘蔗种植面积约占甘蔗种植总面积的80%[4-5]。在这样的条件下甘蔗种植受养分不足及干旱胁迫就更为严重,而甘蔗在其生育期内对水肥需求大,但过多的水肥投入会使产投比降低,不利于甘蔗产业的可持续发展。如何提高甘蔗对土壤养分的利用率和增强甘蔗作物自身抗逆性来增加产投比以实现甘蔗产业可持续发展,目前已成为甘蔗栽培研究领域急需解决的问题。
众多研究表明,植物内生菌能够促进植物的生长并提高植物的抗旱性[6-7],而且一些菌株还能产羧甲基纤维素酶,具有重要的工业应用价值[8]。植物内生菌能通过溶磷、分泌生长素、嗜铁素等促生长特性来促进植物的营养吸收和健康生长,提高植物适应外界不利的条件,从而提高植物的抗逆性[9-10]。Arshad等认为,含ACC脱氨酶的微生物有助于平衡非生物胁迫下植物中产生的乙烯水平,从而有利于植物的生长和发育[11]。有学者认为,接种分泌ACC脱氨酶的菌株有助于植物对N、P、K的吸收,有助于消除外界胁迫对植物生长的抑制作用[12]。谷书杰等接种分泌ACC脱氨酶的内生菌,提高了甘蔗的抗旱性[13]。此外,杨苗研究发现,胞外多糖(EPS)具有独特的保水性,具有保持土壤团聚体稳定性的功能,接种分泌EPS和ACC脱氨酶的促生菌能提高植物的抗旱性[14];魏宏宇等也认为,分泌EPS的微生物可以用来提高逆境胁迫下农作物的抗逆能力[15]。目前国内外对甘蔗多功能内生菌的报道较少,筛选具有促生和抗旱潜力等多功能的内生菌对甘蔗内生菌的研究及甘蔗产业的发展具有重要的意义。
本研究以前期在30% PEG-6000处理下具有较强活性的2株甘蔗内生菌为目标菌株,探究菌株溶无机磷,分泌嗜铁素、羧甲基纤维素酶、ACC脱氨酶、EPS,促发芽和促生长等能力,以期挖掘甘蔗内生菌潜在的功能特性,丰富甘蔗的内生菌资源,为后期大田试验的研究及生物菌肥的开发利用提供一定的理论基础。
1 材料与方法
1.1 试验材料
供试菌株:由云南农业大学甘蔗研究所前期分离保存的甘蔗内生菌,其中编号为K5的菌株是从甘蔗栽培种崖城89的根部分离所得,经前期鉴定为考克氏菌(Kocuria),菌株登录号为OP737815;编号为ZM的菌株是从甘蔗野生种蔗茅的根部分离所得,前期鉴定为芽孢杆菌(Bacillus),菌株登录号为OP740361。
植物材料:玉米种子(师单8号),由云南农业大学植物保护学院提供。
培养基:LB培养基,NBRIP培养基[16],CAS培养基,MKB培养基[17],TSB液体培养基,DF液体培养[18],基础培养基[19],羧甲基纤维素酶鉴别培养基[20]。
1.2 试验时间和地点
试验于2023年2—6月在云南农业大学农学与生物技术学院作物生产与智慧农业重点实验室进行。
1.3 试验方法
1.3.1 菌株溶无机磷能力的测定
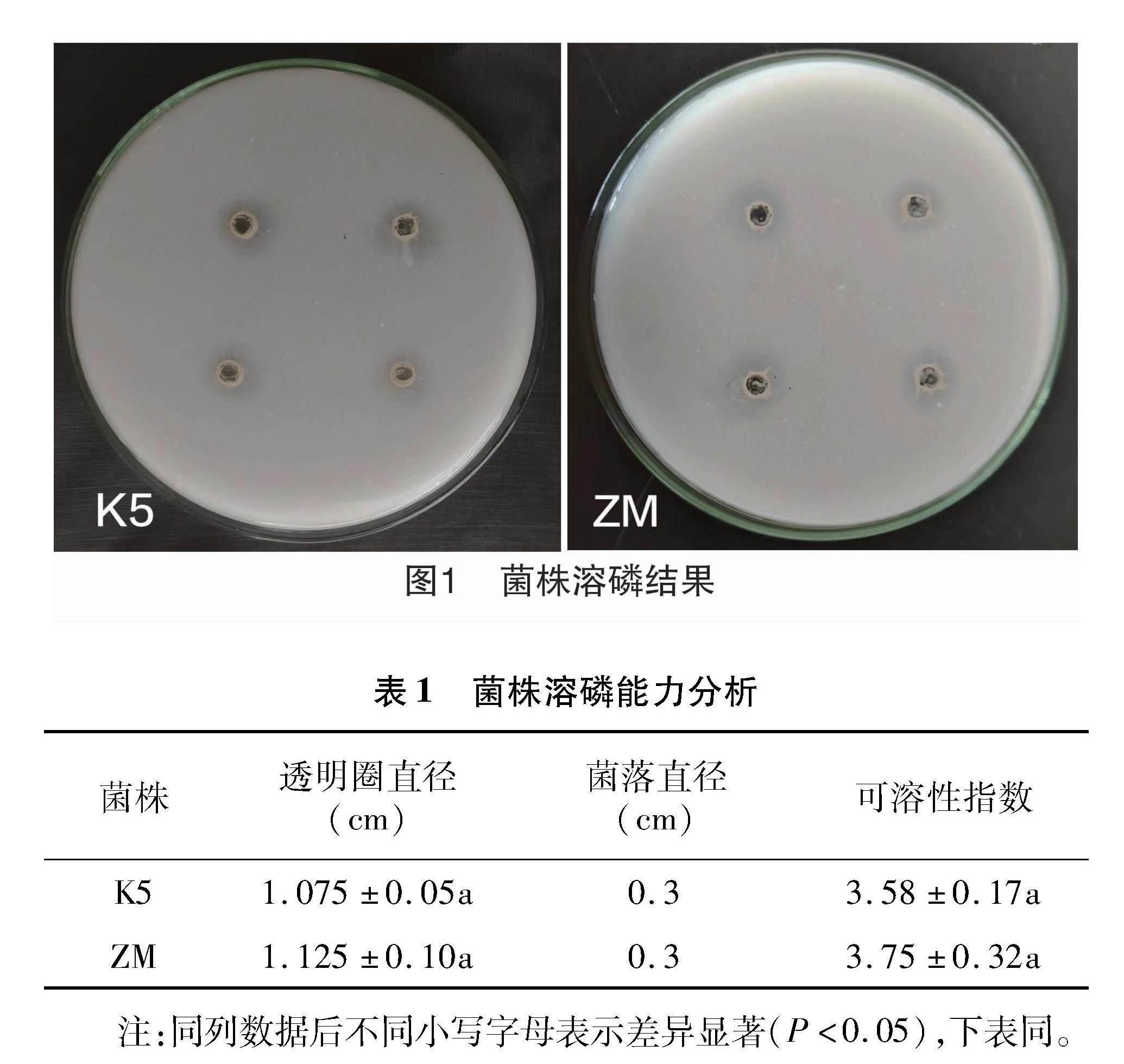
定性测定:采用平板透明圈法对菌株的溶磷能力进行测定。将 50 μL 菌株种子液接种于用打孔器打好孔(打孔器直径0.3 cm)的NBRIP固体培养基中,每株菌株3个重复,于28 ℃培养箱中培养10 d后根据培养基中透明圈的大小及可溶性指数D/d(D为透明圈大小,d为菌落直径)来初步确定菌株的溶磷能力[21]。
定量测定:首先建立磷标准曲线,然后将菌株接种于NBRIP无机磷液体培养基中,于摇床30 ℃、160 r/min培养12 d后采用钼锑抗比色法于波长700 nm处进行吸光度的测定,并计算菌株的溶磷量K(mg/L)=(c×V×T)/V0[22-23]。其中:c表示通过标准曲线计算得到的磷浓度,mg/L;V表示定容体积,此处为50 mL;T为分取倍数,为10倍;V0表示加入发酵液的体积,为5 mL。
1.3.2 菌株分泌嗜铁素能力的测定
定性测定:菌株分泌嗜铁素的定性测定参照陈佳亮等的方法[17,24],将50 μL菌株种子液接种于打好孔(打孔器直径0.6 cm)的CAS固体培养基上,于 28 ℃ 的恒温培养中培养10 d后观察培养基中菌落周围若有橘黄色透明圈产生,即该菌株能分泌嗜铁素。测定橘黄色透明圈直径(D)和菌落直径(d),计算可溶性指数(D/d),根据可溶性指数的大小判断菌株分泌嗜铁素的能力。
定量测定:采用CAS检测法进行菌株分泌嗜铁素的定量测定,将菌株以1%的接种量接种于MKB液体培养基中,于30 ℃、160 r/min的摇床中分别培养2、3 d,参照赵微等的方法[25-26]于630 nm的分光光度计下测定其吸光度。用去离子水调零;菌株的光密度值记为Ds,对照记为Dr,最后计算嗜铁素的相对含量(Ds/Dr)。
1.3.3 菌株产羧甲基纤维素酶能力的测定
将菌株接种于羧甲基纤维素酶鉴别培养基中,28 ℃恒温培养7 d后,1 mg/mL刚果红染色60 min,1 mol/L氯化钠溶液脱色2 min,根据透明圈的大小及可溶性指数判断菌株产羧甲基纤维素酶能力的强弱[8,20]。
1.3.4 菌株分泌ACC脱氨酶能力的测定
菌株接种于TSB液体培养基中,于28 ℃、160 r/min摇床培养12 h后,4 ℃,8 000 r/min离心10 min,收集菌体重悬于7.5 mL的DF液体培养基中,加入0.5 mol/L的ACC,28 ℃、160 r/min培养24 h后参照张国壮等的方法[18,27]进行ACC脱氨酶的测定和计算。
1.3.5 菌株产EPS能力的测定
利用苯酚-硫酸法和DNS法绘制葡萄糖标准曲线,将菌株种子液以4%的接种量接种于基础培养基中,于30 ℃、140 r/min 摇床培养48 h后参照王琪的方法[19]测定菌株分泌总糖和还原糖的量,然后根据EPS含量=总糖含量-还原糖含量,计算出菌株分泌EPS的量。
1.3.6 菌株对玉米发芽和幼苗生长的影响
选择粒大饱满的玉米种子,先用75%的乙醇浸泡1 min,再用2%的次氯酸钠溶液浸泡10 min对种子进行表面消毒[28],后用无菌水冲洗3次,最后用吸水纸将种子表面的水分吸干备用。将目标菌株于摇床 28 ℃、160 r/min,培养48 h后离心去除上清,将菌体用无菌水进行重悬后并稀释成浓度为1.0×107 CFU/mL 的菌液用于浸种处理,其中CK为清水浸种。对玉米种子采用不同菌液和清水分别浸种 4 h 后,放于铺有湿润滤纸的培养皿中,并于28 ℃恒温箱中培养,期间每天观察种子发芽情况,并适当补充水分。第3天计算种子发芽势,第7天计算其发芽率,第10天对玉米幼苗的株高、茎粗和主根长等农艺性状进行测定。
种子发芽势=(3 d内种子萌发数/供试种子数)×100%;种子发芽率=(7 d内种子萌发数/供试种子数)×100%。
1.4 数据分析
采用Excel 2019和SPSS 25.0对数据进行统计分析及图表绘制。
2 结果与分析
2.1 菌株的溶磷能力
2.1.1 定性测定
从图1可见,2株菌株在溶无机磷固体培养基上均能产生明显的透明圈,说明2株菌株均具备一定的溶无机磷能力。根据表1中可溶性指数的大小判断菌株溶无机磷的能力,其中ZM菌株的可溶性指数为3.75±0.32,大于K5的可溶性指数(3.58±0.17),可初步判断ZM菌株溶无机磷的能力强于K5菌株。
2.1.2 定量测定
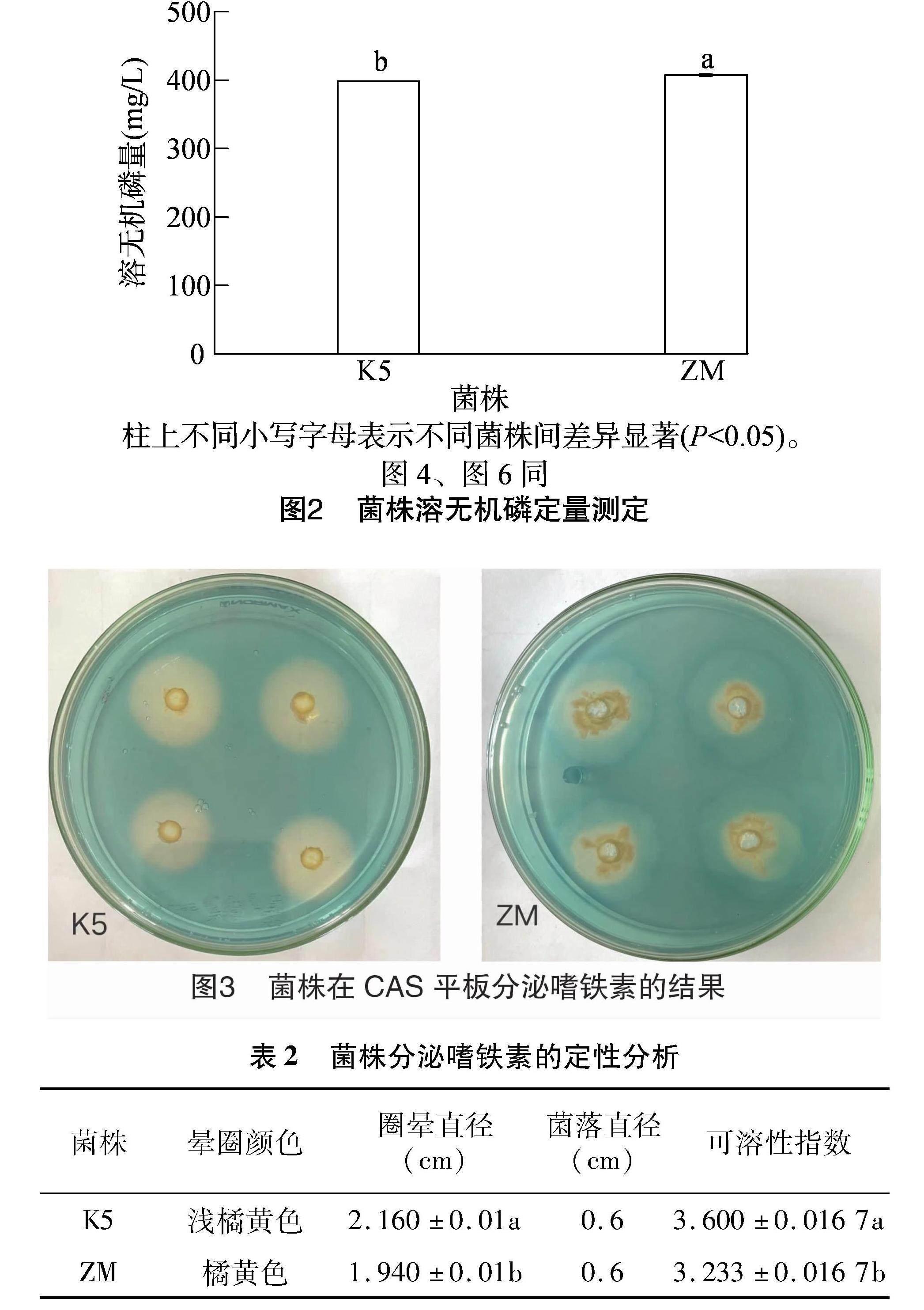
图2为菌株溶无机磷能力的定量分析(其中磷标准曲线的回归方程为 y=0.048 4x-0.000 4,r2=0.999 5),K5、ZM菌株有效溶无机磷的量分别为398.383、407.454 mg/L,其中ZM菌株溶无机磷能力强于K5菌株,与定性测定结果一致。
2.2 菌株分泌嗜铁素的能力
2.2.1 定性测定
CAS固体检测培养基上2株甘蔗内生菌周围均存在橘黄色晕圈,可初步认为其均具备嗜铁素合成的能力(图3)。在相同培养条件和时间下,可溶性指数的值越大则说明该试验菌株分泌嗜铁素的能力越强,可以用来初步分析菌株分泌嗜铁素能力的强弱。根据表2可知,K5菌株的可溶性指数显著大于ZM菌株,初步判断K5菌株分泌嗜铁素的能力强于ZM菌株。
2.2.2 定量测定
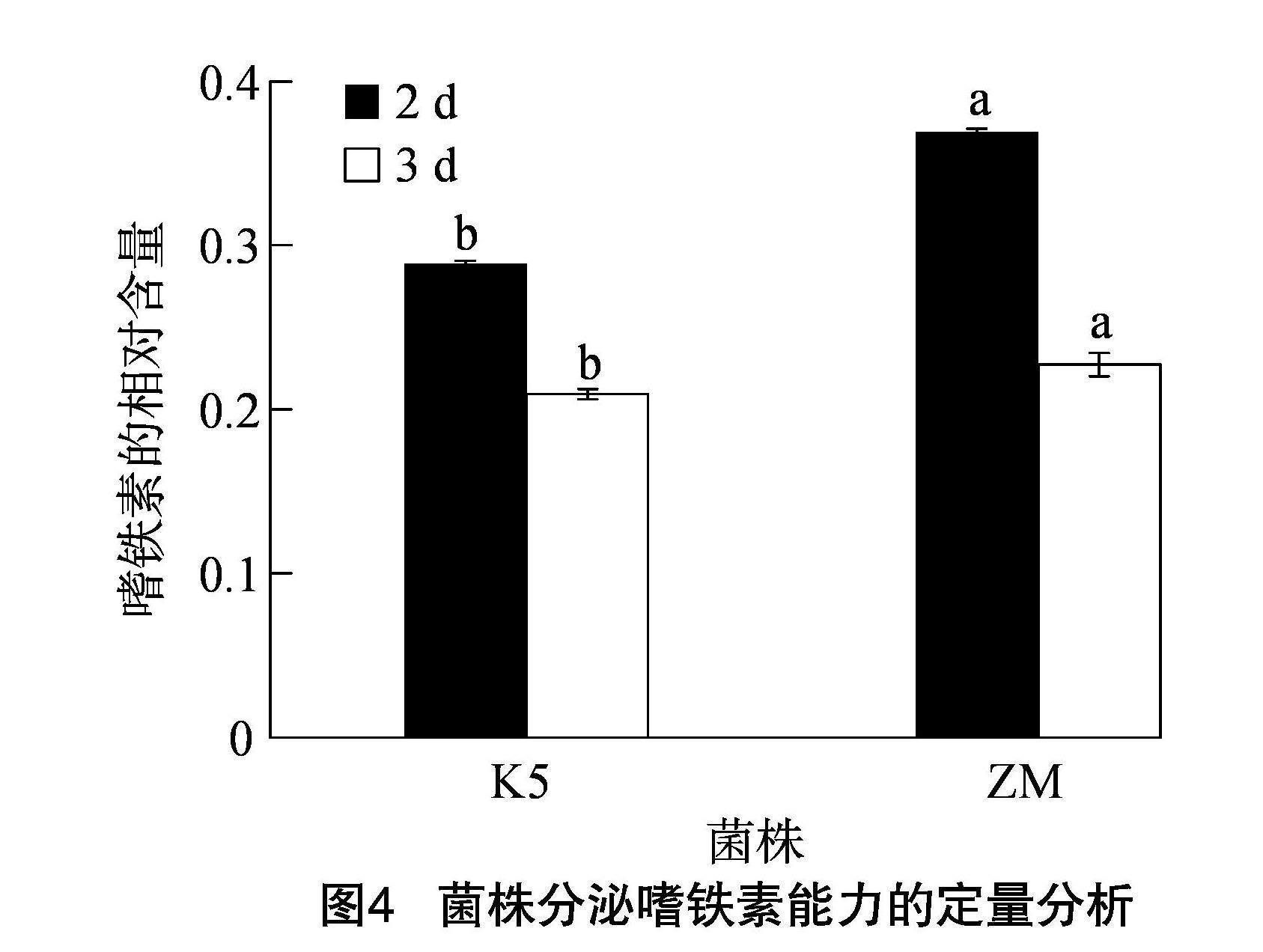
采用紫外分光光度法,以分光光度计波长630 nm下的颜色反应对2株菌株分泌嗜铁素的能力进行定量测定。根据As/Ar的大小来判断菌株分泌嗜铁素的能力,As/Ar越小,表明菌株产嗜铁素量越多。从图4可知,菌株培养2 d和 3 d 后嗜铁素的相对含量(As/Ar)均为K5<ZM且差异显著,表明K5菌株分泌嗜铁素的能力强于ZM,测定结果与定性测定结果一致。此外,在一定的时间范围内菌株随着培养时间的延长,其嗜铁素的分泌量增加。培养3 d后嗜铁素相对含量为0.209。
2.3 菌株产羧甲基纤维素酶的能力
图5为菌株产纤维素酶的定性测定结果。经过计算菌株可溶性指数可知,ZM菌株产羧甲基纤维素酶的能力微强于K5菌株,但差异不显著(表3)。
2.4 菌株分泌ACC脱氨酶的能力
2株菌株测得的ACC脱氨酶活性如图6所示,K5、ZM菌株的ACC脱氨酶活性分别为3.302、1.520 U/mg,K5菌株的ACC脱氨酶活性显著高于ZM菌株。
2.5 菌株分泌EPS的能力
根据总糖和还原糖标准曲线的回归方程(总糖 y=0.441 1x-0.002 3,r2=0.996;还原糖y= 0.009 8x +0.006 4,r2=0.992),计算得菌株产总糖、还原糖及EPS的含量。从表4可知,ZM菌株分泌EPS的能力较强,为0.157±0.002 mg/mL,而K5菌株EPS的分泌量仅为0.086±0.002 mg/mL,2株菌株分泌EPS的能力为ZM菌株显著强于K5菌株。
2.6 菌株对玉米种子萌发及幼苗生长的影响
由表5可知,相比于CK,K5菌株处理显著提高了玉米种子的发芽势、株高和主根长,ZM菌株处理也提高了玉米种子发芽势和株高,但效果不显著;CK、K5、ZM这3个处理对玉米的发芽率、茎粗、根冠比和鲜重无显著影响。综上可知,K5、ZM菌株相比于CK具有促进玉米种子发芽势的提高和玉米植株生长的作用,且K5菌株的促进作用强于ZM菌株。图7为玉米种子恒温培养10 d后的植株生长情况,从中可以看出,经过ZM、K5菌株处理的玉米株高明显高于CK处理,且根系也较CK更为发达。因此认为K5、ZM菌株具有促进玉米种子早发芽和促进玉米植株生长的作用。
3 讨论与结论
本研究对2株菌株溶无机磷能力进行了定性和定量分析,结果表明,2株菌株均具有溶无机磷的能力,菌株培养12 d后其溶无机磷量分别为398.383、473.905 mg/L;低于尚晓静等蓝莓溶磷菌摇瓶培养5 d的最大溶磷量(587.31 mg/L)[22];高于李云海等摇瓶培养12 d后溶磷菌的最大溶磷量(362.60 mg/L)[16];远高于普凤雅等的薏苡溶磷菌摇瓶培养5 d的最大溶磷量(62.93 mg/L)[29]。推测菌株溶磷能力的强弱与菌株培养时间的长短、 宿主植物及菌株类型等因素均有一定的关系。吕娇娇对菌株溶磷机制进行了相关的研究[30],但菌株的溶磷机理较为复杂,本试验未进行深入研究。此外,本研究中菌株溶磷能力的定量测定结果与定性测定结果具有一致性,但在定性测定中会因培养基厚度不同而影响菌株溶磷速度及效率,从而影响其透明圈的大小和溶磷能力的定性测定结果。
铁在植物生长发育中起着重要的作用,地壳中有丰富的铁,但可被植物利用的可溶性游离铁离子较少,植物需要从自身或微生物合成的嗜铁素中摄取铁离子[31]。通常认为Ds/Dr低于0.5的菌株分泌嗜铁素的能力较强[32],本研究的2株甘蔗内生菌培养3 d的Ds/Dr分别为0.21和0.23,因此认为本研究的2株甘蔗内生菌具有较强的分泌嗜铁素能力。此外,K5、ZM菌株培养2 d的Ds/Dr分别为0.29和0.37,高于培养3 d的Ds/Dr,表明在一定的时间范围内菌株分泌嗜铁素的能力随培养时间的延长而增强。狄义宁等从甘蔗内生菌中筛选得到12株功能菌可分泌异羟肟酸类、儿茶酚类、有羧酸类的嗜铁素[23],而本研究中2株甘蔗内生菌分泌嗜铁素的类型还有待进一步研究和验证。
ACC脱氨酶在微生物促进植物生长及提高植物抗旱性方面有重要的作用。张丹对细菌菌株中AcdS基因进行敲除发现,ACC与脱氨酶直接负责胁迫条件下的植物生长,细菌中存在高含量的ACC脱氨酶,能够保护作物免受多种胁迫的伤害[26]。研究表明,当ACC脱氨酶活性高于0.020 U/mg时,即可促进植物的生长[33]。本研究的2株菌株分泌ACC脱氨酶的活性分别为1.520、3.302 U/mg,低于辛树权等从燕麦根际菌株中发现ACC脱氨酶的活性(8.893 U/mg)[34],又高于黄天姿等从大豆根际土壤中分离的菌株分泌,ACC脱氨酶的最高活性 (0.097 8 U/mg)[35],推测酶活性的强弱可能与菌株的种类及其宿主植物的类型等因素有关。此外,Arshad等认为,产ACC脱氨酶的微生物可以有效地部分或完全消除干旱胁迫对豌豆生长、产量和成熟的影响[11]。而且有学者认为,ACC脱氨酶活性的大小可作为抗逆能力强弱的标准[36]。所以菌株分泌ACC脱氨酶的能力强弱可以作为该菌株是否能提高植物抗旱性的参考。
此外,分泌EPS的微生物在提高植物抗旱性方面也具有重要的作用。魏宏宇等认为,产EPS的微生物提高植物抗旱性的原因是EPS具有独特的保水性,一方面能够稳定土壤团聚体结构,另一方面能够调节植物根系的水分[15]。Sandhya等研究发现,产EPS的内生有益菌,可以通过改善土壤结构和促进植物生长来减轻向日葵植物的干旱胁迫[37]。据Ghosh等报道,细菌分泌EPS更有助于它们定殖于根部并形成生物膜,保护它们在渗透胁迫下免于干燥[38]。Naseem等用产EPS的细菌对玉米种子进行浸种处理,发现改善了土壤的水分含量及植物生物量,并提高了玉米的抗旱性[39]。不难发现,提高植物抗旱性的基础是改善土壤环境并促进植物的健康生长。此外,有学者认为菌株功能的多样性与其宿主植物生活的环境及其生态竞争力具有相关性[24]。所以,功能菌株的寻求可以选择生态竞争力强的宿主植物进行探究。
综上可知,本研究中K5菌株的促生作用略强于ZM菌株,可能是由于K5菌株分泌嗜铁素、ACC脱氨酶的能力显著高于ZM菌株。菌株的作用机制较为复杂,后期有待结合分子层面及多组学分析、温室试验等进行探究。
参考文献:
[1]张跃彬,邓 军,杨绍林,等. 国际上甘蔗栽培的研究进展[J]. 甘蔗糖业,2021,50(2):1-5,140.
[2]Li Y R,Yang L T. Sugarcane agriculture and sugar industry in China[J]. Sugar Tech,2015,17(1):1-8.
[3]de Abreu L G F,Grassi M C B,de Carvalho L M,et al. Energy cane vs sugarcane:watching the race in plant development[J]. Industrial Crops and Products,2020,156:112868.
[4]罗晟昇,廖韦卫,韦海球,等. 干旱胁迫对甘蔗生长研究进展[J]. 中国热带农业,2020(5):70-73.
[5]李晓君,罗正清,陆昌强,等. 20个甘蔗品种(系)的抗旱性比较[J]. 热带作物学报,2020,41(12):2482-2491.
[6]王 震. 甘蔗根际放线菌资源筛选及促生机制研究[D]. 南宁:广西大学,2020.
[7]Zhou X R,Dai L,Xu G F,et al. A strain of Phoma species improves drought tolerance of Pinus tabulaeformis[J]. Scientific Reports,2021,11:7637.
[8]徐海燕,辛国芹,陈梅楠,等. 一株产纤维素酶枸杞内生菌的分离鉴定[J]. 江西农业学报,2013,25(4):38-42.
[9]曹 凯,李远婷,安登第,等. 内生菌对植物抗干旱胁迫能力的影响研究进展[J]. 生物技术通报,2015(9):23-29.
[10]刘 璐. 豌豆成熟期内生菌多样性及固氮菌促生长的研究[D]. 青岛:青岛科技大学,2020.
[11]Arshad M,Shaharoona B,Mahmood T. Inoculation with Pseudomonas spp.containing ACC-deaminase partially eliminates the effects of drought stress on growth,yield,and ripening of pea (Pisum sativum L.)[J]. Pedosphere,2008,18(5):611-620.
[12]Nadeem S M,Zahir Z A,Naveed M,et al. Rhizobacteria containing ACC-deaminase confer salt tolerance in maize grown on salt-affected fields[J]. Canadian Journal of Microbiology,2009,55(11):1302-1309.
[13]谷书杰,钱禛锋,娄永明,等. 接种内生菌对干旱胁迫下甘蔗的生理影响[J]. 中国农学通报,2022,38(6):42-47.
[14]杨 苗. 具有ACC脱氨酶活性促生细菌的筛选、鉴定及其接种效应研究[D]. 杨凌:西北农林科技大学,2018.
[15]魏宏宇,李 怡,彭帅英,等. 胞外多糖促进胁迫条件下农作物生长的研究与展望[J]. 江苏农业学报,2022,38(4):1123-1134.
[16]李海云,蒋永梅,姚 拓,等. 蔬菜作物根际促生菌分离筛选、鉴定及促生特性测定[J]. 植物保护学报,2018,45(4):836-845.
[17]陈佳亮. 烟草根际促生菌Sm-1的分离及其外泌铁载体的纯化与鉴定[D]. 长沙:湖南农业大学,2017.
[18]张国壮. 产ACC脱氨酶根际促生菌的分离鉴定及其接种对小麦乙烯代谢和生长的效应[D]. 杨凌:西北农林科技大学,2014.
[19]王 琪. 罗汉果内生菌产胞外多糖菌株的筛选及其抗氧化与降糖活性研究[D]. 桂林:广西师范大学,2021.
[20]穆春雷,武晓森,李术娜,等. 低温产纤维素酶菌株的筛选、鉴定及纤维素酶学性质[J]. 微生物学通报,2013,40(7):1193-1201.
[21]狄义宁,谢林艳,谷书杰,等. 甘蔗及甘蔗近缘属内生菌的筛选、鉴定与功能研究[J]. 中国农业大学学报,2021,26(11):70-83.
[22]尚晓静,侯 瑞,徐芳玲,等. 2株蓝莓溶磷内生真菌的筛选、鉴定及溶磷效果评价[J]. 江苏农业科学,2022,50(20):246-252.
[23]狄义宁,刘鲁峰,谢林艳,等. 一株甘蔗内生菌鉴定及其溶磷能力的研究[J]. 作物杂志,2018(6):68-75.
[24]陈艳彬,韩燕燕,王 斐,等. 吡咯伯克霍尔德氏菌JK-SH007产嗜铁素的相关基因克隆及条件优化[J]. 中国生物防治学报,2019,35(4):630-641.
[25]赵 微,崔 璇,赵 蕾. 磷、铁胁迫对棘孢木霉根际定殖的影响[J]. 西北农业学报,2022,31(1):72-78.
[26]张 丹. 紫花苜蓿内生菌的分离鉴定及特性分析[D]. 哈尔滨:哈尔滨师范大学,2016.
[27]冀玉良,李 丹,罗嘉凡. ACC脱氨酶活性菌的分离及其对桔梗的促生作用[J]. 商洛学院学报,2021,35(2):33-40.
[28]普凤雅,谷书杰,何永宏,等. 2株薏苡内生菌促生特性及其对种子萌发的影响[J]. 江苏农业科学,2022,50(14):115-122.
[29]普凤雅,谷书杰,何永宏,等. 溶磷内生菌的筛选鉴定及其对薏苡生长发育的影响[J]. 福建农业学报,2022,37(7):946-953.
[30]吕娇娇. 甘肃省13种药用植物根际和内生菌的分离及5株功能菌株鉴定和抑菌促生功能测定[D]. 兰州:甘肃中医药大学,2022.
[31]殷奥杰,王 齐,葛淼淼,等. 微生物铁载体的应用研究进展[J]. 环境保护与循环经济,2021,41(7):20-24,69.
[32]林天兴,唐 梅,黄明远,等. 高产铁载体棉田土壤细菌SS05的筛选与鉴定[J]. 微生物学通报,2012,39(5):668-676.
[33]廉法钦. 具有ACC脱氨酶活性橡胶树根际促生菌(PGPR)的筛选及其促生作用研究[D]. 海口:海南大学,2016.
[34]辛树权,高 扬,赵骥民.含ACC脱氨酶PGPR菌株的分离及其对燕麦耐盐性的影响[J]. 长春师范学院学报,2011,30(8):58-62.
[35]黄天姿,李同祥,汤 薇,等. 大豆根际土壤产ACC脱氨酶细菌的分离与鉴定[J]. 南方农业,2022,16(6):1-3.
[36]刘冠一,刘艳玲,刘博文,等. 含ACC脱氨酶活性的复合菌株提高苜蓿抗盐碱能力研究[J]. 核农学报,2017,31(5):1022-1028.
[37]Sandhya V D,Shaik Z A,Grover M,et al. Alleviation of drought stress effects in sunflower seedlings by the exopolysaccharides producing Pseudomonas putida strain GAP-P45[J]. Biology and Fertility of Soils,2009,46(1):17-26.
[38]Ghosh D,Gupta A,Mohapatra S. A comparative analysis of exopolysaccharide and phytohormone secretions by four drought-tolerant rhizobacterial strains and their impact on osmotic-stress mitigation in Arabidopsis thaliana[J]. World Journal of Microbiology and Biotechnology,2019,35(6):90.
[39]Naseem H,Bano A. Role of plant growth-promoting rhizobacteria and their exopolysaccharide in drought tolerance of maize[J]. Journal of Plant Interactions,2014,9(1):689-701.
