3种梨树链格孢病菌的鉴定、遗传多样性及其对杀菌剂的敏感性
2024-07-03贾艺凡赵延存李朝辉孙伟波刘凤权
贾艺凡 赵延存 李朝辉 孙伟波 刘凤权

doi:10.15889/j.issn.1002-1302.2024.10.018
摘要:梨黑斑病是梨树的主要真菌病害之一,可引起叶片早落,降低梨果产量及品质,造成巨大经济损失。本研究从各地区梨园采集病叶病果后进行病原菌分离,基于形态学观察和多基因串联进化树构建对分离的病原菌进行鉴定,并进行室内药剂敏感性试验。结果表明,从昆明、砀山、成都、贵阳等地采集的样品中分离鉴定到梨黑斑病菌41株,将其分为4个种,分别为乔木链格孢(Alternaria arborescens,3株)、梨黑斑链格孢(A. gaisen,1株)、棉链格孢(A. gossypina,1株)、链格孢(A. alternata,36株)。选取3种链格孢进行致病力分析,在翠玉梨叶片、库尔勒香梨果实上均表现致病性,但致病力存在差异。4种杀菌剂室内药剂敏感性测定结果表明,3种梨黑斑病菌对咪鲜胺、苯醚甲环唑、吡唑醚菌酯均有较好的敏感性,抑制中浓度(EC50值)为0.051 8~10.114 7 mg/L;乔木链格孢9-15菌株对嘧菌酯敏感性较好,EC50值为1.533 0 mg/L;乔木链格孢8-34、9-53,黑斑链格孢9-1,棉链格孢8-46对嘧菌酯敏感性较差。明确了3种可引起梨黑斑病的链格孢属真菌特性及其对不同药剂的敏感性,为后续药剂防治提供技术支撑。
关键词:梨黑斑病;链格孢;病原菌鉴定;致病力分析;敏感性
中图分类号:S436.612;S182;S482.2 文献标志码:A
文章编号:1002-1302(2024)10-0137-08
收稿日期:2023-05-15
基金项目:国家现代农业产业技术体系资助项目(编号:CARS-28);江苏省现代农业梨产业技术体系项目(编号:JATS[2023]049)。
作者简介:贾艺凡(1990—),女,河北石家庄人,硕士,助理研究员,主要从事果树病害研究。E-mail:yifanjia123@163.com。
通信作者:刘凤权,博士,研究员,主要从事植物病害防控研究。E-mail:fqliu20011@sina.com。
我国是世界上最大的梨生产国,根据联合国粮食及国家统计局数据,2019年中国梨栽培面积达94.07万hm2,产量1 731.4万t(2020年已达1 781.5万t),占世界梨产量的71.45%。梨黑斑病对于梨树危害重大,主要侵染果实、叶片和新梢,严重时导致叶片皱缩变形焦枯,果实龟裂,叶和果实提前脱落、新梢枯死,在世界各梨产区均有发生,给梨产业造成重大经济损失[1-4]。梨黑斑病于1933年在日本首次由Tanaka报道;1935年,我国首次发现梨黑斑病[5-6]。梨黑斑病是由链格孢(Alternaria sp.)类真菌引起,目前,梨果实上链格孢已发现9个种,我国共发现其中6个种,即梨黑斑链格孢(A. gaisen K.Nagan)、链格孢[A. alternata (Fr.) Keissler]、极细链格孢(A. tenuissima)、侵染链格孢(A. infectoria)、鸭梨侵染链格孢(A. yaliinficiens R.G. Roberts)、紫萼链格孢(A. ventricosa R.G.Roberts)[7-10]。其中,A. alternata、A. tenuissima和A. infectoria主要生长在植物的枯死部分或衰弱部位上,A. yaliinficiens和 A. ventricosa是由美国生物学家Roberts在2003年和2007年从中国进口的鸭梨树中分离并鉴别出来的2个新种[11-12]。
引起梨黑斑病的链格孢在我国分布较为广泛,种类多样,危害严重,目前主要依赖化学药剂进行防治,且存在盲目过量施用现象。本研究比较分析来源不同的3种梨黑斑病菌的遗传特征、菌落菌体形态、致病性及对4种杀菌剂的敏感性,旨在为我国梨黑斑病菌的分类、病害监测及科学选药提供依据。
1 材料与方法
1.1 样品采集及分离纯化
2018—2020年,从陕西铜川、江苏南京、云南昆明、安徽砀山、四川成都、贵州贵阳等10个省份的33个梨园采集100余份病叶与病果,用组织分离法进行样品分离。用已灭菌手术刀在发病部位与健康部位交界处切取一小部分组织,每个样品取3块,放入75%乙醇中浸泡30 s进行消毒,再用无菌水清洗2次。将清洗后的组织用无菌滤纸按压至干爽状态,将该组织置于新鲜的马铃薯葡萄糖琼脂(PDA)培养基中,25 ℃恒温培养2~3 d,待长出真菌后,从边缘打孔,将菌丝块转接到新的PDA培养基中,在25 ℃恒温培养箱中黑暗倒置培养6~9 d。
1.2 病原菌鉴定
1.2.1 病原菌形态学观察
将菌株纯培养后,采用5 mm打孔器在菌落边缘打出菌块,放置于PDA培养基平板中,每个处理3个重复,将其倒置于25 ℃恒温培养箱中,黑暗培养7 d后,观察菌落形态、颜色等特征。利用光学显微镜对分生孢子梗和分生孢子形态特征进行观察,并对其进行摄影记录。
1.2.2 病原菌分子鉴定
1.2.2.1 病原菌基因组DNA提取
使用T5 Direct PCR Kit(南京擎科生物科技有限公司)提取菌株的DNA,具体操作如下:利用无菌牙签从菌落边缘挑取少量菌丝,放入装有50 μL Lysis Buffer A溶液的离心管内,95 ℃加热10 min(较难裂解的样品可适当增加裂解时间),12 000 r/min离心1 min,取上清液1~3 μL为模板进行PCR扩增(杂质含量较高时,可取适量上清液与等体积的Dilution Buffer B混匀后,取1~3 μL为模板进行PCR扩增)。
1.2.2.2 病原菌基因组扩增和测序
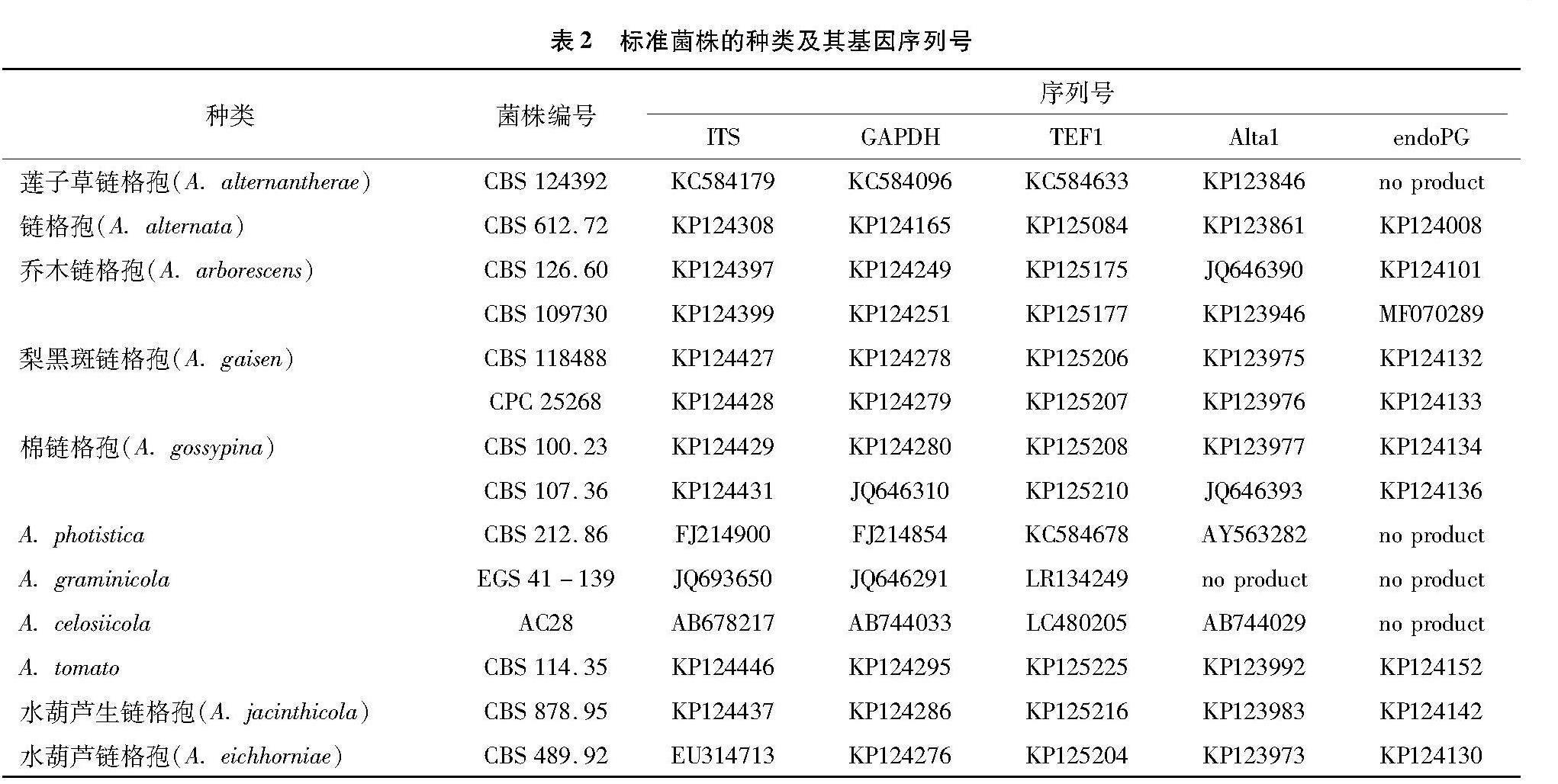
采用分子鉴定法对得到的菌落进行鉴定。利用特异性引物分别采用聚合酶链式反应(PCR)扩增病原菌内部转录间隔区核苷酸序列ITS以及翻译延伸因子TEF1、链格孢过敏原基因Alta1、内聚半乳糖醛酸酶基因endoPG、甘油醛-3-磷酸脱氢酶基因GAPDH序列。序列扩增引物见表1。PCR 扩增选用20 μL 体系,包括无菌水8.5 μL,2×Hieff PCR Master Mix 10 μL,上游引物 0.5 μL,下游引物 0.5 μL,模板 0.5 μL。PCR 扩增程序:94 ℃预变性 5 min;94 ℃变性30 s,72 ℃延伸30 s,72 ℃补充延伸5 min,ITS、TEF1、Alta1、endoPG、GAPDH扩增的退火温度分别为52、52、59、54、59 ℃,反应30 s,30个循环。利用1%的琼脂糖凝胶电泳,其中缓冲剂选择TBE,在140 V下上样5 μL电泳检测。将PCR扩增产物送至南京擎科生物科技有限公司进行序列测定,将获得的序列在NCBI数据库中进行Blastn比对(表2)。
1.2.2.3 多基因系统进化分析
将对比后的基因序列与参考文献中报道的引物对应的序列,在MAGA 7.0软件中进行多基因对比分析,使用最大似然法进行系统发育分析,构建系统发育进化树。
1.3 病原菌致病性测定
1.3.1 叶片刺伤接种
2021年,通过叶片针刺接种测定各菌株的致病性。挑选大小均匀的翠玉梨叶片,喷洒75%乙醇进行表面消毒后,用无菌水漂洗处理,之后用无菌牙签刺伤叶片,在伤口上接种供试菌株菌饼,设置PDA培养基为空白对照,将叶片放在白色无菌搪瓷盘中,并将无菌脱脂棉浸沾无菌水覆于叶柄上,每个黑斑病菌株设置3个重复,并用保鲜膜封闭保湿。将搪瓷盘放置在25 ℃恒温培养箱中,培养5 d后观察记录发病情况。
1.3.2 果实有伤接种
2021年,通过果实针刺接种测定各菌株的致病性。选取大小一致的库尔勒香梨果实,用水将香梨洗净,再使用75%乙醇喷洒到梨果表面达到消毒的效果,最后用无菌水清洗果面。用无菌牙签刺伤果面,将菌饼接种于伤口处,每个黑斑病菌株设置3个重复,将接种后的香梨放入无菌保鲜盒中密封,在25 ℃恒温培养箱中培养 6 d 后观察并记录发病情况。
病果分级标准:0级,无病斑;1级,病斑直径≤1.0 cm;2级,病斑直径1.1~2.0 cm;3级,病斑直径2.1~3.0 cm;4级,病斑直径3.1~4.0 cm;5级,病斑直径≥4.1 cm[18]。
1.4 梨黑斑病菌对4种常用杀菌剂的室内敏感性测定
生长速率法是测定病原真菌对杀菌剂敏感性的常规方法之一,2021年测定各菌株对梨生产上4种常用杀菌剂的敏感性[19]。4种杀菌剂原药分别用甲醇溶解,配制母液,然后按照以下各药剂的终浓度分别添加到液态的PDA培养基中,快速混匀倒入无菌平皿中,制备各药剂5个浓度梯度的PDA平皿,即嘧菌酯(10、20、40、80、160 μg/mL)、咪鲜胺(0.2、0.4、0.8、1.6、3.2 μg/mL)、苯醚甲环唑(0.2、0.4、0.8、1.6、3.2 μg/mL)、吡唑醚菌酯(0.4、0.8、1.6、3.2、6.4 μg/mL)。每种浓度重复3次,在PDA培养基中加入同等比例的甲醇作为空白对照。在梨黑斑病菌菌落边缘打孔(直径5 mm),将菌饼置于已制备好的PDA平板中心,而后放入25 ℃培养箱内倒置培养,6 d后以十字交叉法测量记录菌落直径,按照公式(1)计算抑制率。
抑制率=[(对照菌落直径-0.5)-(处理菌落直径-0.5)]/(对照菌落直径-0.5)×100%。(1)
以药剂浓度的对数值为自变量,抑制率对应的概率值为因变量,拟合每种杀菌剂对各菌株的毒力回归方程,计算EC50值及相关系数。
2 结果与分析
2.1 病原菌的鉴定与基因序列分析
基于菌株的形态学和5个基因序列(ITS、endoPG、GAPDH、Alta1和TEF1)的特征,将2018—2020年从江苏省、陕西省、云南省等梨产区采集的梨黑斑病病样中分离纯化获得的41个菌株初步鉴定为链格孢菌,进一步将每个菌株的5个基因序列串联起来,使用MAGA 7.0进行系统发育分析。结果发现,除鉴定到常规的链格孢(A. alternata)36株,还基于多基因串联进化树分析鉴定到乔木链格孢(A. arborescens)3株、梨黑斑链格孢(A. gaisen)1株、棉链格孢(A. gossypina)1株(图1)。链格孢(A. alternata)多生长于植物的干枯和衰弱部位,在我国各梨产区均有发生且已被系统研究,但关于梨黑斑链格孢、乔木链格孢和棉链格孢的研究相对较少,对其生物学特性、致病性及其对不同杀菌性的敏感性、发生流行的潜在风险缺乏认识[20]。
2.2 病原菌的分布
从10个省份13个市采集的病害样品中共分离
鉴定得到41株菌株,其中36株链格孢(A. alternata)菌株分别来源于江苏南京7株、江苏镇江1株、陕西铜川4株、陕西咸阳1株、云南昆明1株、四川金川2株、四川成都1株、贵州贵阳1株、安徽砀山5株、山西长治5株、浙江杭州2株、河南商丘3株、河北邢台3株;3个乔木链格孢菌株分别来源于云南昆明2株、安徽砀山1株;1个梨黑斑链格孢(A.gaisen)菌株来自四川成都;1个棉链格孢(A.gossypina)菌株来自贵州贵阳(表3)。
2.3 病原菌形态学特征
2.3.1 菌落形态
将3株乔木链格孢(8-34、9-15、9-53)、 1株梨黑斑链格孢(9-1)、 1株棉链格孢(8-46)在PDA固体培养基平皿上培养7 d后发现,各菌株菌落形态差异明显(图2),其中8-34、9-1 和8-46菌株的菌丝为绿色,9-15和9-53菌株的菌丝为深灰色,均可以产生黑色素;9-15和9-53菌落边缘呈白色且比较平整,8-34、9-1和8-46菌落边缘呈灰色波浪状;9-1和8-46菌落伴有大量白色绒毛状气生菌丝;9-15菌株生长最快,8-34菌株生长最慢。
2.3.2 病原菌在PDA培养基上的产孢表型
从图3可以看出,3种链格孢在PDA培养基上的产孢表型存在一定差异,其中乔木链格孢菌株8-34、9-15不产孢;乔木链格孢9-53、黑斑链格孢9-1、棉链格孢8-46均可产生分生孢子,分生孢子着生在气生菌丝上。乔木链格孢9-53产生分生孢子链,是在1根分生孢子梗上形成多个树状分枝,链长 1~11个孢子;梨黑斑链格孢9-1形成分生孢子短链,这些短链能多次分枝且形成在1根分生孢子梗上,链长1~4个孢子;棉链格孢8-46形成不分枝的分生孢子长链,链长3~11个孢子。
2.3.3 分生孢子形态观察
3种链格孢分生孢子形态观察结果(图4)显示,乔木链格孢分生孢子横隔数为1~4个,纵隔数为0~1个,主要呈卵形,梨黑斑链格孢分生孢子横隔数1~4,纵隔数0~2,主要呈阔倒棒状或倒梨形,棉链格孢分生孢子横隔数2~3,纵隔数1~2,主要呈梨形。
2.4 病原菌的致病力分析
2.4.1 病原菌对梨叶的致病力分析
将乔木链格孢菌株8-34、9-15、9-53,梨黑斑链格孢9-1,棉链格孢8-46离体接种于翠玉梨叶片上。从图5可以看出,病斑为褐色或黑褐色,形态为圆形斑点,周围具淡黄色晕圈,拓展后呈近圆形,有时也呈不规则状,中间灰褐色,边缘黑褐色,呈黑斑病的典型症状。接种5 d后,乔木链格孢8-34致病力最强,病斑直径为1.06 cm;梨黑斑链格孢9-1次之,病斑直径为0.99 cm。
2.4.2 病原菌对梨果的致病力分析
将鉴定出的菌株乔木链格孢8-34、9-15、9-53,梨黑斑链格孢9-1,棉链格孢8-46离体接种于库尔勒香梨果实上,培养6 d后发现,果面出现浅褐色或黑褐色圆形病斑,病斑略凹陷,果肉软腐,对照果实未发病。根据病情指数得到的病果分级标准,乔木链格孢 8-34病斑直径为2.1 cm,属于3级病斑,致病力最强;其他菌株病斑直径为1.4~1.6 cm,属于2级病斑,致病力较弱。由于果实病斑为曲面且不规则,因此为了表示更为准确,柱形图使用病斑面积(图6)。
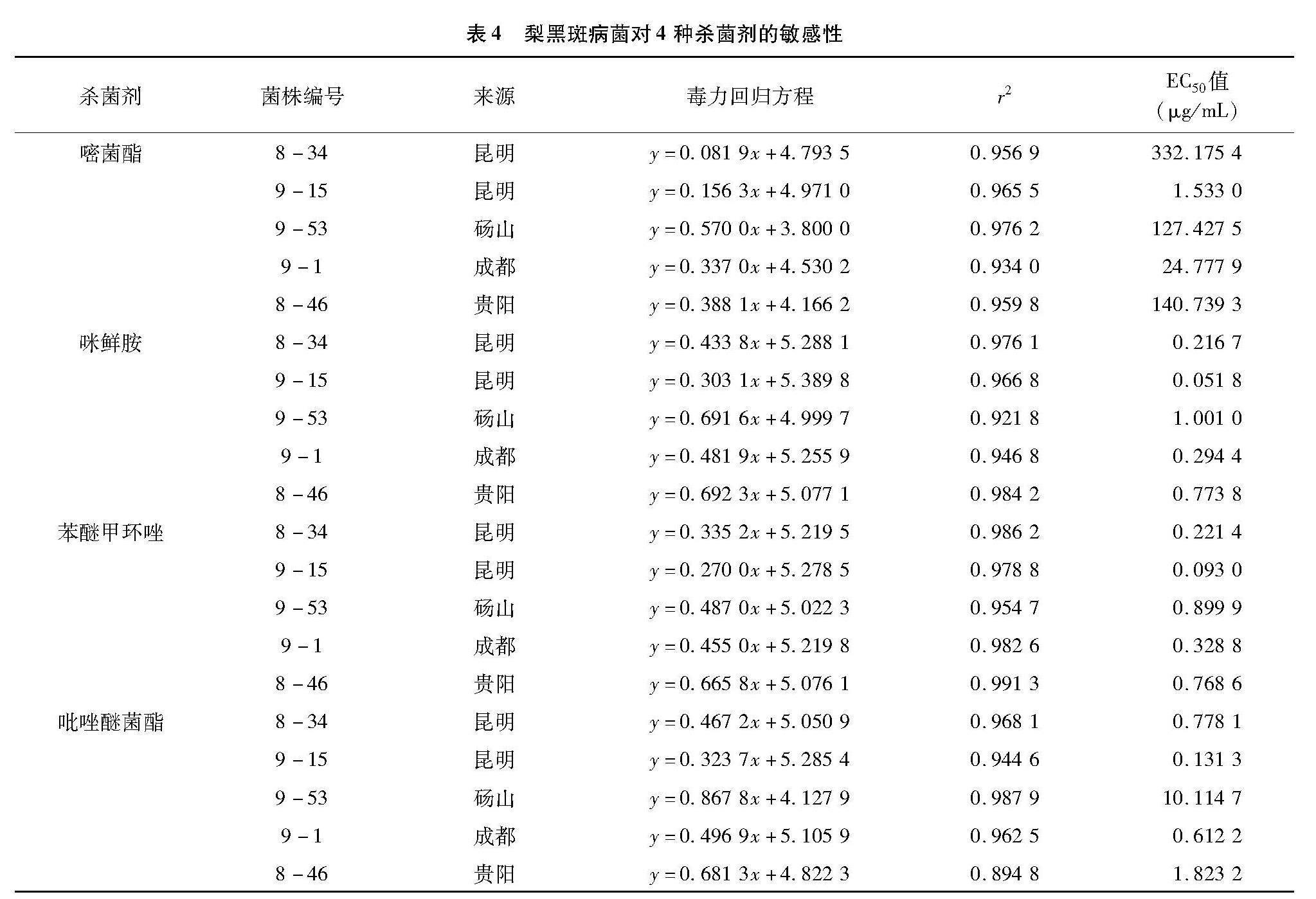
2.5 梨黑斑病菌对4种常用杀菌剂的敏感性测定结果
选取生产上4种常用杀菌剂嘧菌酯、咪鲜胺、苯醚甲环唑和吡唑醚菌酯,测定5株梨黑斑病菌对药剂的敏感性(表4)。嘧菌酯对5株黑斑病菌的EC50值分别为332.175 4、1.533 0、127.427 5、24.777 9、140.739 3 μg/mL,其中昆明乔木链格孢菌株9-15对嘧菌酯最敏感,昆明乔木链格孢菌株8-34对嘧菌酯最不敏感;咪鲜胺对5株黑斑病菌的EC50值分别为0.216 7、0.051 8、1.001 0、0.294 4、0.773 8 μg/mL,其中昆明乔木链格孢菌株9-15对咪鲜胺最敏感,砀山乔木链格孢菌株9-53对咪鲜胺最不敏感;苯醚甲环唑对5株黑斑病菌的EC50值分别为0.221 4、0.093 0、0.899 9、0.328 8、0.768 6 μg/mL,其中昆明乔木链格孢菌株9-15对苯醚甲环唑最敏感,砀山乔木链格孢菌株9-53对苯醚甲环唑最不敏感;吡唑醚菌酯对5株黑斑病菌的EC50值分别为0.778 1、0.131 3、10.114 7、0.612 2、1.823 2 μg/mL,其中昆明乔木链格孢菌株9-15对吡唑醚菌酯最敏感,砀山乔木链格孢菌株9-53对吡唑醚菌酯最不敏感。
结果表明,昆明乔木链格孢菌株9-15对4种杀菌剂都最敏感,昆明乔木链格孢菌株8-34、砀山乔木链格孢菌株9-53、成都梨黑斑链格孢9-1及贵阳棉链格孢8-46对嘧菌酯敏感性较差,对咪鲜胺、苯醚甲环唑、吡唑醚菌酯敏感性较好。
3 讨论与结论
梨黑斑病是我国梨树的主要真菌病害之一,由链格孢属真菌引起,可侵染危害梨树叶片、果实和新梢,发病严重时影响梨果的品质和产量,导致巨大经济损失。目前,梨黑斑病仍是生产上亟待解决的问题。
链格孢属在早期分类系统中属于半知菌类,在新的分类系统中属于真菌界子囊菌门座囊菌纲格孢腔菌目格孢腔菌科。初期链格孢属真菌的分类鉴定主要依据形态学特征、寄主专一性、分子标记,但这些分类标准存在一些不足。链格孢属的形态特征随着营养、温度、光照、pH值等条件的不同,会发生变化,因此,不能通过形态特征来准确鉴定链格孢菌的种类[21]。寄主专一性也不能作为分类标准,是因为链格孢通常是多种复合侵染,难以判断寄主范围和专一性。单个的分子标记在现代分子生物学中应用比较广泛,可以区分遗传距离较远的链格孢种,但无法区分亲缘关系较近的种。2013年,Lawrence等应用gpd、Alt a1、ACT、ATP、CAL等5个核酸蛋白质编码位点,将链格孢属划分为8个组群[14]。多基因联合构建系统发育进化树的精准度高于基于单基因构建的系统发育进化树,目前在分类研究中被普遍应用[22-23]。本研究通过对5株链格孢菌多基因联合构建系统发育进化树,明确1株属梨黑斑链格孢、3株属乔木链格孢、1株属棉链格孢。采用这分属3个种的5个菌株接种翠玉梨叶片和库尔勒香梨果实,结果均表现致病性。对翠玉叶片,8-34 菌株致病力强,9-1致病力中等,其他菌株致病力较弱;对香梨果实,8-34菌株致病力最强,与叶片致病性测定结果一致。
在明确致病类型和分类地位的基础上,测定5株代表性菌株对生产上常用的4种杀菌剂的敏感性,结果发现,来源于昆明的乔木链格孢菌株9-15对4种杀菌剂都最敏感,来源于昆明的乔木链格孢菌株8-34、砀山的乔木链格孢菌株9-53、成都的梨黑斑链格孢菌株9-1及贵阳的棉链格孢菌株 8-46 对嘧菌酯敏感性较差,对咪鲜胺、苯醚甲环唑、吡唑醚菌酯敏感性较好。来自不同地区分属于3个种的5株梨黑斑病菌对苯醚甲环唑均有较好敏感性,EC50值为0.093 0~0.899 9 mg/L,与付余波等的报道[24]一致。各菌株对不同药剂的敏感性差异可能与菌株的遗传背景和当地的历史用药有关。该研究结果可为梨黑板病菌的分离鉴定和药剂的科学选择提供试验依据,对4个梨产区黑斑病的防治具有一定的指导意义。
参考文献:
[1]刘亚慧,戴德江,沈 瑶,等. 梨黑斑病菌抗药性检测及其对啶酰菌胺的敏感性基线[J]. 农药学学报,2015,17(3):274-278.
[2]Baudry A. First report of Japanese pear black spot caused by Alternaria kikuchianain in France[J]. Plant Disease,1993(4),77:428B.
[3]Simmons E G. Alternaria:an identification manual[M]. The Netherlands:CBS Fungal Biodiversity Centre Utrecht,2007:1-780.
[4]Yu S H. Korean species of Alternaria and Stemphylium[M]. Suwon:National Institute of Agricultural Science and Technology,2001.
[5]Simmons E. Alternaria themes and variations(63-72)[J]. Mycotaxon,1993(48):91-107.
[6]张志铭,宋 福,孙淑贞,等. 河北鸭梨黑斑病病原菌的鉴定[J]. 植物检疫,2003,17(4):212-214,258.
[7]张天宇. 中国真菌志:第十六卷 链格孢属[M]. 北京:科学出版社,2003:1-281.
[8]宋 博,朱晓锋,徐兵强,等. 库尔勒香梨果萼黑斑病病原鉴定及其ITS、GPD和EF-1α序列分析[J]. 园艺学报,2016,43(2):329-336.
[9]常有宏,刘永锋,王 宏,等. 梨黑斑病病菌的致病条件[J]. 江苏农业学报,2008,24(3):316-320.
[10]刘新伟,陈 岩,宋 福,等. 我国梨和部分国外梨果实上链格孢菌的鉴定研究[J]. 植物检疫,2009,23(5):1-5.
[11]Roberts R G. Alternaria yaliinficiens sp.nov. on Ya Li pear fruit:from interception to identification[J]. Plant Disease,2005,89(2):134-145.
[12]Roberts R G. Two new species of Alternaria from pear fruit[J]. Mycotaxon,2007,100:159-167.
[13]White T J,Bruns T D,Lee S B,et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//PCR protocols.New York:Academic Press Inc.,1990:315-322.
[14]Lawrence D P,Gannibal P B,Peever T L,et al. The sections of Alternaria:formalizing species-group concepts[J]. Mycologia,2013,105(3):530-546.
[15]Hong S G,Cramer R A,Lawrence C B,et al. Alt a1 allergen homologs from Alternaria and related taxa:analysis of phylogenetic content and secondary structure[J]. Fungal Genetics and Biology,2005,42(2):119-129.
[16]Peever T L,Su G,Carpenter-Boggs L,et al. Molecular systematics of citrus-associated Alternaria species[J]. Mycologia,2004,96(1):119-134.
[17]Berbee M L,Pirseyedi M,Hubbard S. Cochliobolus phylogenetics and the origin of known,highly virulent pathogens,inferred from ITS and glyceraldehyde-3-phosphate dehydrogenase gene sequences[J]. Mycologia,1999,91(6):964-977.
[18]宋 聪,宋水山,关军锋. 梨采后黑斑病拮抗菌J18的鉴定及防治效果的初步研究[J]. 现代食品科技,2011,27(1):6-10,25.
[19]田雪莲,尹显慧,李荣玉,等. 几种杀菌剂对番茄枯萎病的毒力及田间防效[J]. 农药,2015,54(2):143-145,149.
[20]付余波. 我国四省区梨主要病害的病原鉴定、分子检测与药剂筛选研究[D]. 南京:南京农业大学,2010:1-81.
[21]Rotem J. The genus Alternaria:biology,epidemiology,and pathogenicity[M]. St Paul,Minnesota:American Phytopathological Society Press,1998.
[22]Andrew M,Peever T L,Pryor B M. An expanded multilocus phylogeny does not resolve morphological species within the small-spored Altemrnaria species complex[J]. Mycologia,2009,101(1):95-109.
[23]Woudenberg J H C,Truter M,Groenewald J Z,et al. Large-spored Alternaria pathogens in section Porri disentangled[J]. Studies in Mycology,2014,79:1-47.
[24]付余波,钱国良,胡白石,等. 21种杀菌剂对梨炭疽病菌、轮纹病菌、黑斑病菌的室内毒力测定[J]. 江苏农业科学,2011,39(2):178-180.
