贝莱斯芽孢杆菌TC-52的分离鉴定及其对水稻幼苗生长和立枯病的影响
2024-07-03李坤洪秀杰王欣悦齐鹏宇霍佳慧于欣卉商梓琳毕少杰王彦杰
李坤 洪秀杰 王欣悦 齐鹏宇 霍佳慧 于欣卉 商梓琳 毕少杰 王彦杰
doi:10.15889/j.issn.1002-1302.2024.10.017
摘要:为丰富可用于水稻育秧基质防治由尖孢镰刀菌(Fusarium oxysporum)所引起的水稻立枯病的生防菌资源,从大豆根际土壤中分离得到1株对尖孢镰刀菌有拮抗作用的细菌,对该菌株分泌的胞外酶与促生能力进行了测定,并进行菌种鉴定。同时,初步研究了该菌株的抑菌谱、对水稻幼苗的促生作用以及对水稻立枯病的防治效果。研究结果表明,菌株TC-52为贝莱斯芽孢杆菌(Bacillus velezensis),其对尖孢镰刀菌抑菌率达到72.7%,其分泌的上清液和挥发性气体都能抑制尖孢镰刀菌的生长,并具有广谱抑菌活性;该菌株能够分泌蛋白酶、纤维素酶与几丁质酶并具有固氮、产铁载体与吲哚-3-乙酸(IAA)能力,其IAA产量达到21.70 μg/mL,耐受最低pH值达到4.0。与无菌水浸种处理相比,1.0×106 CFU/mL的菌悬液浸种,水稻胚根的生长量可提高19%;相较于未添加生防菌的育秧基质,在菌浓度为1.0×109 CFU/mL的育秧基质中种植水稻,主根长度增长了25%,侧根数增加了29%,对水稻立枯病的防治效果>75%。可见,菌株TC-52在水稻育秧基质中具有促生与防病作用,有一定的开发和应用潜力。
关键词:水稻立枯病;尖孢镰刀菌;贝莱斯芽孢杆菌;生物防治
中图分类号:S182;S435.111 文献标志码:A
文章编号:1002-1302(2024)10-0129-08
收稿日期:2023-11-20
基金项目:黑龙江省大学生创新创业训练计划(编号:201910223008);黑龙江八一农垦大学“揭榜挂帅”项目(编号:JB20220001);资源化利用木糖渣等生产系列肥料的研发(编号:2021066)。
作者简介:李 坤(1997—),男,山东烟台人,硕士研究生,从事农用微生物的筛选与应用研究。E-mail:1137021417@qq.com。
通信作者:王彦杰,博士,教授,从事农业废弃物资源化研究。E-mail:wangyanjie1972@163.com。
自水稻旱育秧技术推广以来,立枯病已成为水稻育苗期间的常见病害,每年发病率为10%~23%,严重者死苗率高达70%[1]。此外,由于气温波动和管理不善等因素,黑龙江省的水稻立枯病发病情况十分严重[2]。在实际工作中,插秧机会导致许多空穴,严重影响水稻的质量和产量。
水稻立枯病常分为生理性立枯病和病理性立枯病。生理性立枯病又称水稻青枯病,是秧苗在不良环境下的吸水与蒸腾能力失调所致,会造成水稻叶片的严重失水,使得水稻叶片呈青灰色,根毛稀少[3];病理性立枯病常分为3种不同的类型,即芽腐、基腐和黄枯,一般由镰刀菌属(Fusarium)、丝核菌属(Rhizoctonia)、根霉菌属(Rhizopus)、蠕孢菌属(Helminthosporium)等病原菌侵染造成。尖孢镰刀菌是黑龙江省水稻秧苗枯病的主要致病菌,占致病菌总量的48%左右[4]。
当前,为了预防和控制水稻立枯病,在水稻生产中通常采用化学药剂进行拌种、浸种、包衣或者对苗床进行消毒处理。然而,长期以来过度依赖使用化学农药必然会导致病原菌产生抗药性,同时也对农田环境造成严重破坏,最终导致农产品质量和产量下降,甚至对食品安全形成威胁[5-6]。因此,这种做法不利于实现水稻立枯病的可持续防治。与之相反,生物防治具有环境友好、不易产生抗药性等特点,正渐渐地成为水稻立枯病防治的发展趋势。微生物菌剂也有望成为理想的可替代或部分替代化学农药的产品之一。
目前有报道指出采用浸种或拌种的方式施用微生物菌剂,在防病方面取得了显著的效果。例如,李敏等利用哈茨木霉分生孢子粉和多菌灵按照6 ∶4的比例拌种水稻,水稻立枯病防治效果达到了82%[7];Limtong等利用附生酵母菌浸泡水稻种子,对水稻苗期出现的烂苗现象的防治效果达到100%[8]。另一部分报道则采用喷施的方式施用微生物菌剂,也达到了较好的防病效果。例如,李鑫杰等利用寡雄腐霉可湿性粉剂的6 000倍液分别于水稻秧苗的立针期和2叶期喷施,使得防病效果达到90%[9];曹阳利用水稻内生菌枯草芽孢杆菌于2叶期喷施处理,使得防病效果达到74%[3]。当前报道较少采用拌土的方式施用微生物菌剂,可能是由于采用拌土的方式将微生物菌剂加入到水稻育秧基质会降低对水稻立枯病的防治效果,于文清等利用土地类芽孢杆菌来防治水稻立枯病,菌液浸种结合拌土处理,对立枯病防效达到了80%,浸种方式所产生的防治效果为74%,而拌土方式对水稻立枯病的防治效果仅有55%[10]。这可能是水稻育秧基质呈酸性,不利于生防菌株的定殖所造成,故而对病原菌的抑菌效果有所下降。
本研究欲筛选可以直接加入到水稻育秧基质中并对水稻立枯病有生防作用的菌株。以尖孢镰刀菌为指示菌,通过采制性培养,从大豆根际土壤中筛选出对尖孢镰刀菌具有较好拮抗效果的菌株,并对其促生效果进行研究。结合形态学观察、生理生化鉴定及16S rRNA序列分析对其进行菌株鉴定,通过水稻催芽、盆栽试验,对该菌株水稻立枯病的防治和促生效果进行评价,以期提供具有在育秧基质中发挥防治水稻立枯病潜力的菌株资源。
1 材料与方法
1.1 试验材料
1.1.1 土样及病原菌
供试土壤样品采集于黑龙江省安达市科技园区(地理位置46°24′N,125°21′E),属于北温带大陆性半干旱季风气候,海拔147~148 m,年平均日照时数为2 659 h,年平均气温为3.2 ℃,年际间气温差异不大。在常年种植大豆的田地中,用铁锹沿着大豆根部的生长方向尽量将植物根际完整取出,采用抖根法采集根际土壤,将附在根际上的土用毛刷全部刷下,装入密封袋中做好标记,于4 ℃冰盒保存。所有操作均用无菌工具进行,带回实验室进行微生物分离和筛选。
供试病原菌:尖刀镰孢菌(F. oxysporum)、立枯丝核菌(R. solani)、层出镰刀菌(F. proliferatum)、串珠镰刀菌(F. moniliforme)、禾谷镰刀菌(F. graminearum)、大豆疫霉菌(Phytophthora sojae)、小麦全蚀病菌(Gaeumannomyces graminis)、核盘菌(Sclerotinia sclerotiorum)。
1.1.2 供试培养基
LB培养基(pH值为5.0)、马铃薯葡萄糖琼脂培养基(PDA)(pH值为5.0)、几丁质酶检测培养基[11]、蛋白酶检测培养基[12]、纤维素酶检测培养基[12]、Ashby无氮培养基[13]、PKO无机磷培养基[14]、蒙金娜有机磷培养基[14]、钾细菌筛选培养基[15]、CAS产铁载体检测培养基[16]。
1.1.3 供试水稻种子
水稻品种为农丰1702,由黑龙江八一农垦大学农学院水稻课题组提供。
1.2 试验方法
1.2.1 拮抗菌株的分离与纯化
采用土壤稀释涂布法进行分离,将所取土样称取10 g,配成10-4、10-5、10-6、10-7倍稀释液,分别取100 μL涂布到LB固体培养基平板上,每个浓度梯度重复3次,于32 ℃避光培养24 h,挑取形态不同的细菌菌落于LB固体培养基上划线纯化,连续纯化3次后,将所得的细菌单菌落,划线至LB固体斜面培养基上,放入4 ℃冰箱保藏备用。
1.2.2 拮抗菌株的初筛
将在斜面保藏的拮抗菌株于LB固体培养基上进行划线活化后,挑取单菌落接种于LB液体培养基中,于32 ℃、150 r/min振荡培养20 h,制成发酵培养液,并放置于4 ℃条件下贮存,用于对峙培养。在无菌工作台中,用打孔器在已活化好的尖孢镰刀菌平板上取5 mm菌饼接于PDA平板中央,接种后在距离病原菌菌饼2.5 cm处呈“十”字形滴加3 μL分离菌株发酵液,以接种等量LB液体培养基的处理作对照,每个处理重复3次。30 ℃培养7 d后,通过测量比较抑菌圈大小,计算抑菌率。抑菌率(V)计算公式如下:
V=(DCK-Dd)/DCK×100%。
其中:Dd为处理平板上病原菌菌落直径,cm;DCK为对照平板上病原菌菌落直径,cm。
1.2.3 拮抗菌株的复筛
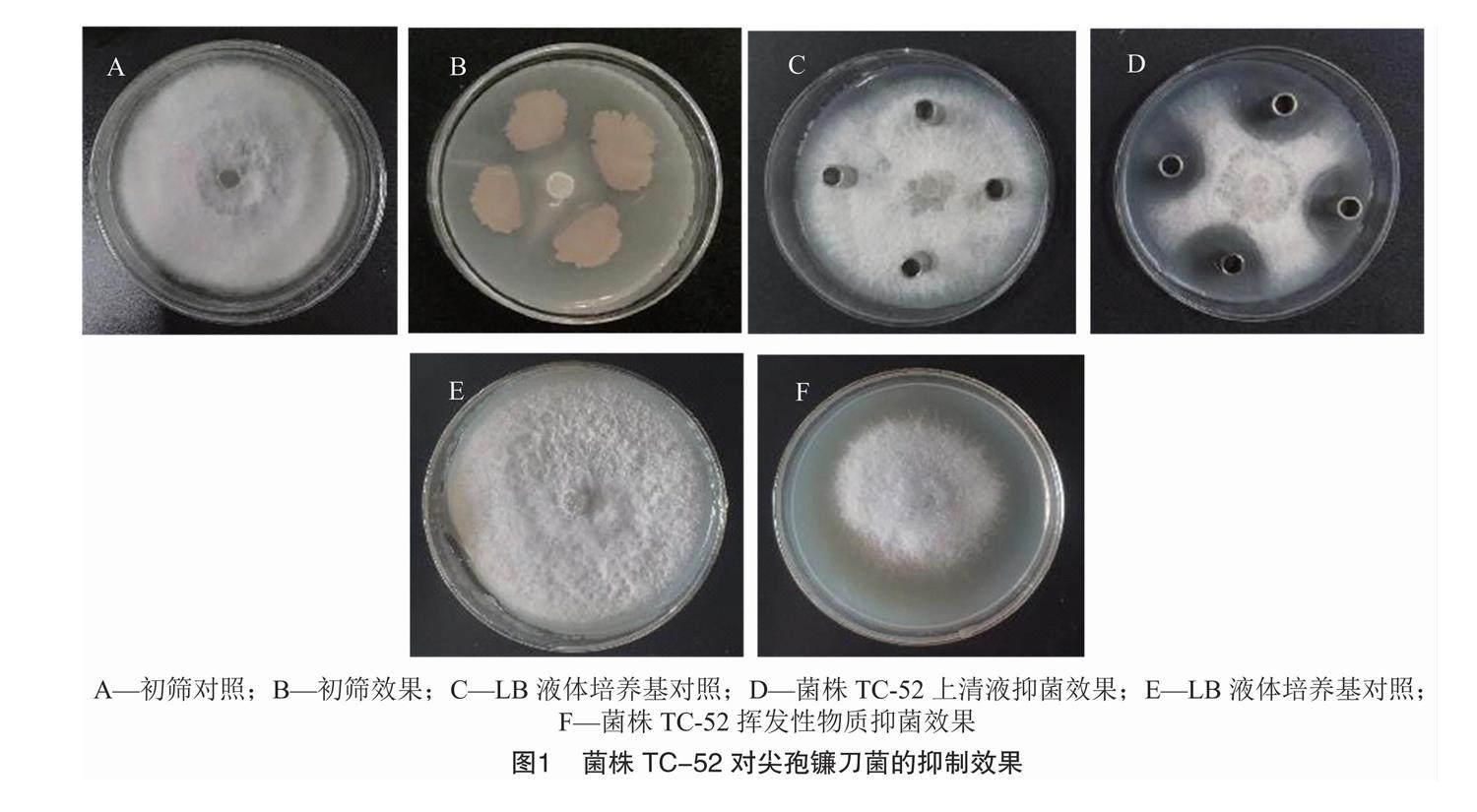
拮抗菌株上清液的抑菌效果测定:在无菌工作台中,用打孔器在已活化好的尖孢镰刀菌平板上取5 mm菌饼接于PDA平板中央,培养3 d后,在距离病原菌菌饼2.5 cm处呈“十”字形放置牛津杯,将拮抗菌株发酵培养液 10 000 r/min 离心10 min,取上清液经过0.22 μL滤膜过滤,得到无菌上清液,取无菌上清液50 μL加入牛津杯中,以向牛津杯中加入等量LB液体培养基的处理作对照,每个处理重复3次,于30 ℃恒温培养箱中培养7 d。
拮抗菌株挥发性物质的抑菌效果测定:采用平板倒扣法[17],在无菌工作台中,吸取拮抗菌株发酵培养液10 μL均匀涂布于LB平板上,用打孔器在已活化好的尖孢镰刀菌平板上取5 mm菌饼接于PDA平板中央,并将接种病原菌的PDA平板倒扣于含发酵培养液的LB平板上,密封。以在LB平板上涂布了等量的LB培养基为对照,于30 ℃恒温培养箱中培养7 d,计算抑菌率。
1.2.4 拮抗菌株几丁质酶、蛋白酶与纤维素酶活性测定
将保藏的拮抗菌株划线接种于LB固体培养基上并于32 ℃生长活化24 h后,用无菌接种环挑取单菌落分别点接于几丁质酶、蛋白酶与纤维素酶检测培养基上,每个处理重复3次,于32 ℃恒温培养箱中培养3 d,其中纤维素检测培养基需用1 mg/mL的刚果红溶液将整个培养皿浸没染色30 min,再用1 mol/L的氯化钠溶液洗涤,观察3个检测培养基的透明圈。根据HC值判断酶活性大小,酶活性与HC值呈正相关,HC值计算公式如下:
HC=D/d×100%。
其中:D为胞外酶检测培养基上透明圈直径,cm;d为胞外酶检测培养基上菌落直径,cm。
1.2.5 拮抗菌株的促生性研究
参照余涵霞等的方法[13],通过菌株能否在无氮培养基上生长判断菌株有无固氮能力。参照代志等的方法[14],通过菌株在PKO无机磷和蒙金娜有机磷培养基上有无透明圈判断菌株有无溶磷活性。参照吴红艳等的方法[15],通过菌株解钾培养基上有无透明圈判断菌株有无解钾活性。参照李冬莹的方法[16],通过菌株CAS产铁载体培养基上有无透明圈判断菌株有无产铁载体能力。参照张昊鑫等的方法[18]判断菌株是否能分泌吲哚乙酸(IAA)。参照Glickmann等的方法[19]对菌株产IAA能力进行定量检测。
1.2.6 拮抗菌株的生物学相关特性测定
1.2.6.1 生长pH值范围测定
将LB液体培养基的pH值分别调整为2、3、4、5、6、7、8、9、10、11、12、13,取1 mL发酵液接种于不同pH值的LB液体培养基中,32 ℃、150 r/min培养30 h后取样,测定样本的D600 nm,每组重复3次。
1.2.6.2 形态学及生理生化鉴定
将筛选出的拮抗菌株在LB培养基上划线接种,32 ℃培养24 h,观察筛选出的拮抗细菌单个菌落的形态、大小、颜色、干湿、光滑或粗糙等。根据《伯杰细菌鉴定手册》《常见细菌系统鉴定手册》的方法,对拮抗细菌进行硫化氢试验、明胶液化试验、苯丙氨酸脱氢酶试验、淀粉水解试验、Voges-Proskauer试验、硝酸盐还原试验、甲基红试验、吲哚试验、接触酶试验、酪素水解试验,并进行革兰氏染色[20-21]。
1.2.6.3 分子生物学鉴定
拮抗菌株DNA的提取:挑取单菌落菌株接种于LB液体培养基中,于32 ℃、150 r/min 培养18 h后得到发酵培养液,按照天根生化细菌基因组DNA提取试剂盒要求进行拮抗菌株DNA的提取。
16S rRNA序列分析:采用通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-CTACGGCTACCTTGTTACGA-3′,经过PCR扩增后,送至进行序列分析,结果在EzBioCloud数据库中比对后,选取相似性较高的菌株序列,利用MEGA 11.0软件中的Neighbor-Joining(重复抽样1 000次)进行系统发育树的构建。
1.2.7 拮抗菌株抑菌谱系测定
采用滤纸片法对拮抗细菌进行筛选[22]。在无菌工作台中,用打孔器在已活化好的尖孢镰刀菌平板上取5 mm菌饼接于PDA平板中央,在距离病原菌2.5 cm处呈“十”字形放置无菌滤纸片并滴加3 μL拮抗菌株发酵液,并且以接种LB液体培养基的处理为对照,每个处理重复3次。
1.2.8 拮抗菌株对水稻幼苗的促生性研究
1.2.8.1 水稻种子的消毒处理
在小烧杯中加入纯水,将种子浸没并保持30 min。剔除空秕粒后,用75%的乙醇表面消毒5 min,1% NaClO浸泡5 min,再用无菌水清洗3~5次,装入烧杯中加入无菌水浸没水稻种子。
1.2.8.2 菌悬液的制备方法
将拮抗菌株划线接种于LB固体培养基上,32 ℃活化16 h后,挑取单菌落接种于LB液体培养基中,于32 ℃、150 r/min振荡培养24 h,制成发酵培养液。将所制成的发酵培养液8 000 r/min离心5 min后,弃去上清液,向菌体中加入无菌蒸馏水,重复该操作3次,制成菌悬液。
1.2.8.3 不同菌浓度对水稻种子发芽的影响
在无菌工作台中,将培养皿底部铺上2层无菌滤纸,每个培养皿中装30粒水稻种子,分别设置4个处理:CK(5 mL无菌蒸馏水浸润);T1(5 mL 1.0×106 CFU/mL菌悬液浸润);T2(5 mL 1.0×107 CFU/mL菌悬液浸润);T3(5 mL 1.0×108 CFU/mL菌悬液浸润),每组进行重复6次,并放置在30 ℃恒温培养箱中暗处理。催芽期间逐日记载发芽粒数,以籽粒幼根达籽粒长,幼芽至少达籽粒长的1/2为发芽标准,于第5天计算发芽势,第7天计算测定胚芽长度与胚根长度,第10天计算发芽率,并计算发芽指数(GI)。试验进行过程中,及时向培养皿中补充蒸馏水使滤纸始终保持湿润状态,计算公式如下:
X=M1/M×100%;
Y=M2/M×100%;
GI=∑(DG/Dt)。
式中:X为发芽势;Y为发芽率;GI为发芽指数;M1为第5天正常发芽籽粒数;M2为第10天正常发芽籽粒数;M为组试籽粒数;Dt为对应DG的发芽天数;DG为发芽试验终期内每天的发芽数。
1.2.8.4 不同菌浓度对水稻幼苗期生长的影响
本试验共设置4个处理:CK(1 L育秧基质+10 mL无菌蒸馏水);T1(1 L育秧基质+10 mL 1.0×108 CFU/mL 菌悬液);T2(1 L育秧基质+10 mL 1.0×109 CFU/mL菌悬液);T3(1 L育秧基质+10 mL 1.0×1010 CFU/mL菌悬液),试验在105 mm×105 mm×58 mm方盘中进行,每盘播种100粒经消毒后的水稻种子,每个处理重复3次,方盘放置于 25 ℃、光—暗周期为14 h—10 h的温室中生长,21 d 后,对水稻幼苗的株出苗率、茎长、根长以及侧根数进行考察。
1.2.9 拮抗菌株盆栽防效测定
本试验共设置5个处理:CK1(1 L育秧基质+10 mL无菌蒸馏水);CK2(1 L育秧基质+10 mL无菌蒸馏水+10 mL浓度为1.0×105个/mL的尖孢镰刀菌分生孢子悬浮液);T1(1 L育秧基质+10 mL稀释600倍的霉灵+10 mL浓度为1.0×105个/mL的尖孢镰刀菌分生孢子悬浮液);T2(1 L育秧基质+10 mL 1.0×108 CFU/mL 菌悬液+10 mL浓度为1.0×105个/mL的尖孢镰刀菌分生孢子悬浮液);T3(1 L育秧基质+10 mL 1.0×109 CFU/mL菌悬液+10 mL浓度为1.0×105个/mL的尖孢镰刀菌分生孢子悬浮液)。试验在105 mm×105 mm×58 mm方盘中进行,每盘播种100粒经消毒后的水稻种子,并喷施10 mL浓度为1.0×105个/mL的尖孢镰刀菌分生孢子悬浮液,每个处理重复3次,方盘放置于25 ℃、光—暗周期为14 h—10 h温室中生长,6 d后调查出苗率,15 d后计算发病率与防治效果。
发病率=发病株数/总株数×100%;
防治效果=(对照发病率-处理发病率)/对照发病率×100%。
1.2.10 数据统计与分析
试验数据采用Excel 2010、SPSS 25、Origin 2018、MEGA 11.0统计软件进行处理分析和构建系统发育树。
2 结果与分析
2.1 拮抗菌株的分离与筛选
采用稀释涂布平板法在pH值为5.0的LB固体培养基上共筛选出102株菌,分离出5株对尖孢镰刀菌有较好拮抗效果的菌株(图1),其中TC-52菌株对尖孢镰刀菌抑菌率达(72.7±1.4)%。后又对上述5种菌进行复筛,TC-52菌株的抑菌效果最好,其上清液抑菌直径达到(27.29±1.57) mm,挥发性物质的抑菌率达(33.7±2.0)%。
2.2 拮抗菌株抑菌胞外酶活性测定
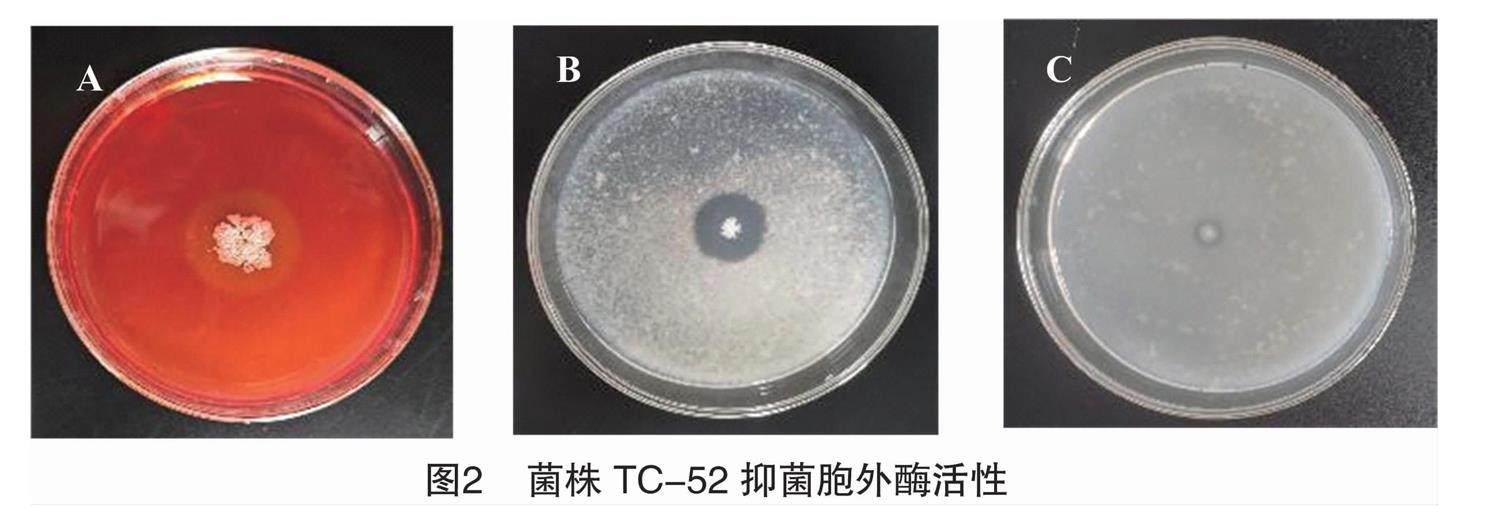
菌株TC-52在纤维素酶检测培养基(图2-
A)、蛋白酶检测培养基(图2-B)与几丁质酶检测培养基(图2-C)上均产生透明圈,其中蛋白酶的活性最强,HC值为3.13±0.04,纤维素酶与蛋白酶的活性较弱,HC值依次为1.61±0.06、1.14±0.03。
2.3 拮抗菌株的促生性研究
菌株无法在PKO无机磷培养基和蒙金娜有机磷培养基上生长,初步判断菌株不具备溶磷能力;菌株可以在解钾培养基上生长,却不产生透明圈,初步判断菌株不具备解钾能力;菌株在固氮培养基上生长(图3-A),初步判断菌株具有固氮能力;菌株在CAS产铁载体培养基上生长,并产生透明圈(图3-B),可以初步判断该菌株具有产铁载体的能力。将菌株发酵液与比色液混合后暗孵育30 min,混合液呈现红色(图3-C),初步表明菌株能够分泌IAA。对菌株产IAA能力进行测定,标准曲线为y=0.011 8x+0.011 9,决定系数r2为0.994 5,表明试验数据和拟合函数吻合度较高,方程可用,确定菌株TC-52分泌IAA的量为21.70 μg/mL。
2.4 拮抗菌株的生物学相关特性
2.4.1 生长pH值范围测定
将菌株接种在不同pH值的培养基中,其生长情况见图4,菌株在最适pH值为5.0~8.0时没有明显差异,当pH值<5.0或>8.0时,菌株的生长受到明显的抑制,当pH值<4.0或>9.0时,菌株几乎不能生长,因此,可以推断菌株可以适应pH值为5.0左右的育秧基质的环境。
2.4.2 形态学及生理生化鉴定
在LB平板上,TC-52 菌落呈不规则圆形,边缘透明,不整齐,中心不透明,整体呈现灰白色,呈革兰氏阳性,如图5所示,菌株的生理生化试验结果见表1。
2.4.3 分子生物学鉴定
测序获得菌株TC-52的16S rRNA序列大小为1 060 bp,通过16S rRNA序列鉴定并与同源序列比对分析,对拮抗菌株的分类地位进行确定,推断菌株TC-52属于贝莱斯芽孢杆菌(B. velezensis),且在已鉴定到种的该属细菌中,
菌株TC-52与B. velezensis CR-502亲缘关系最为接近,同源性最高(一致性99.14%),确定 TC-52 号菌株为贝莱斯芽孢杆菌(图6)。
2.5 拮抗菌株抑菌谱系的鉴定
菌株TC-52对病原菌的抑制效果见表2,其中,菌株TC-52对禾谷镰刀菌的抑菌效果最为明显,抑菌率高达66.77%,对大豆疫霉菌的抑菌效果较差,仅有43.95%,对核盘菌几乎没有拮抗效果,对立枯丝核菌、 串珠镰刀菌、层出镰刀菌、小麦全蚀病菌抑菌率均在50%~70%之间。菌株TC-52具有较广的抑菌谱系。
2.6 拮抗菌株对水稻种子发芽的影响
将农丰1702水稻种子经消毒处理后浸润在不同浓度的TC-52菌悬液中,种子萌发情况见表3。相较于CK,不同浓度菌悬液对水稻种子的发芽率、发芽势、发芽指数以及胚芽长无明显影响;但T1与T2处理却能显著促进胚根的生长,分别增加了19%与13%;而T3处理对水稻种子的胚根生长产生了一定的抑制效果。由此可见,拮抗菌株浸种浓度不超过1.0×108 CFU/mL时对水稻种子无毒害作用。
2.7 拮抗菌株对水稻幼苗生长的影响
在含有不同菌浓度的育秧基质中种植农丰1702水稻种子,幼苗生长状况见表4。相较于CK处理,T1、T2处理分别使得水稻幼苗根长显著增加了16%与25%,侧根数分别显著增加了20%与29%,其中,T2处理还会使得水稻幼苗的平均茎长增加1 cm,而当菌浓度增加至T3处理时,水稻出苗率显著降低,水稻幼苗的生长受到抑制。由此可见,适宜的菌悬液浓度可以显著促进水稻幼苗根与茎的生长。
2.8 盆栽防效测定
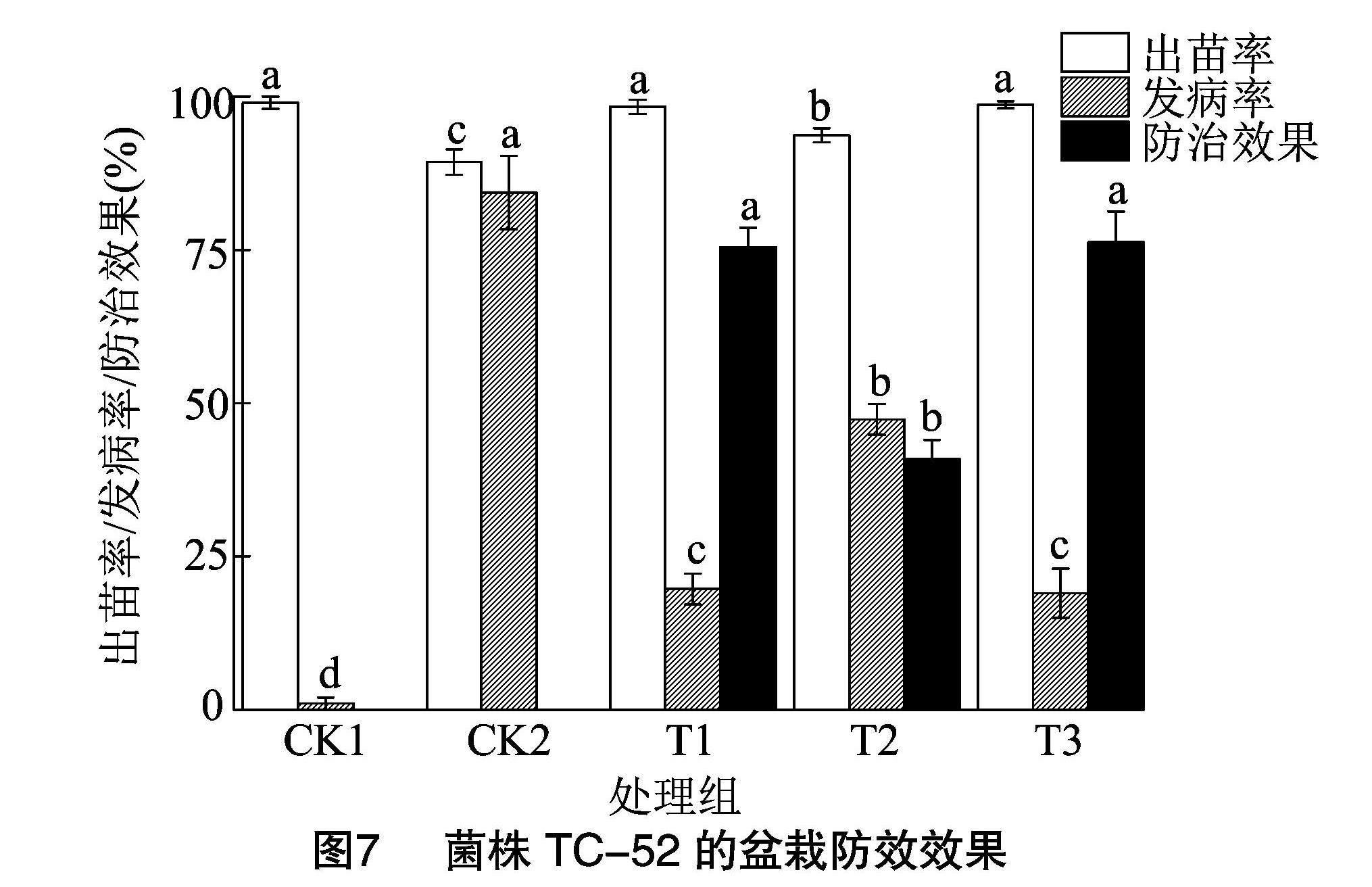
将尖孢镰刀菌的分生孢子悬浮液分别喷洒到添加等量无菌水、霉灵与不同浓度的TC-52菌株的育秧基质中,对其出苗率、发病率等指标进行测定,结果见图7,相较于处理组CK1,处理组CK2的出苗率降低了9.67%。相较于处理组CK2,T1、T2、T3处理组出苗率分别提升了9.00%、4.34%与9.34%,发病率分别降低了64.66%、37.00%、65.33%,由此可见,喷施化学杀菌剂与菌悬液均可以一定程度防治水稻立枯病,改善因病原菌的侵染所导致的出苗率低的问题。相较于菌浓度较低的T2组,菌浓度较高的T3组在防治效果上更加明显,且与施加化学杀菌剂的T1组防治效果均>75%,由此可见,一定浓度的TC-52菌株拌入水稻育秧基质中对水稻立枯病有较好的防病效果。
3 讨论与结论
酸碱度合适的育苗基质不仅有利于水稻生长,同时有利于预防一些水稻病虫害,水稻的最适生长pH为5.0左右,因此,筛选可以在该pH环境中长势较好的生防菌株就变得尤为重要。李晋等发现了一株暹罗芽孢杆菌,其可耐受pH值为4.0,在酸性土壤中对西瓜枯萎病的防治效果达到67%[23];Zhao等研究发现,假单胞菌CLP-6在pH值为5.5时释放的挥发性有机化合物对烟草白性枯萎病的防治效果为78.91%[24]。本研究所筛选的菌株,根据菌体特征、16S rRNA序列分析及生理生化试验,鉴定为贝莱斯芽孢杆菌,在水稻育秧基质中的防效达到75.41%,这是对于耐酸水稻立枯病拮抗菌株的首次报道。该菌株既具芽孢杆菌(Bacillus)繁殖速度快、因可以产生内生孢子而具有较强的抵御外界有害因子能力的特点[25],又可以在pH值为5.0左右的环境中正常繁殖生长,耐受pH值达到4.0。
尖孢镰刀菌是常见的植物致病菌,其细胞壁成分主要由糖蛋白、几丁质与纤维素等物质构成[26],真菌细胞壁在细胞分裂、生长、维持菌丝形态和适应环境中起着重要作用,因此破坏了病原菌细胞壁的完整性,将会极大程度地抑制病原菌生长,降低植物的发病率[27]。在本研究中,贝莱斯芽孢杆菌TC-52具有产纤维素酶、蛋白酶以及几丁质酶3种抑菌胞外酶的能力,3种酶互相协作,通过分解真菌的细胞壁,进而抑制病原菌的生长,降低植物的发病率,这与Wang等的报道结果[28]一致,芽孢杆菌的抑菌特性还可以通过分泌抗生素来直接抑制病原菌的生长[29-31]。本研究中,贝莱斯芽孢杆菌 TC-52 的上清液与挥发性抑菌活性物质可以进一步抑制尖孢镰刀菌的生长,使得对尖孢镰刀菌抑菌率达到72.7%,同时该菌株对立枯丝核菌(R. solani)、层出镰刀菌(F. proliferatum)等6种常见菌株均有明显的抑制效果。但是该菌株是否产生其他抗生素以及挥发性抑菌物质的具体成分尚不可知,需后续进一步研究分析。
菌株的促生特性也是生防菌的机制之一[32],菌株能利用植物根系分泌的色氨酸合成IAA,直接促进植物细胞伸长和细胞分裂,高雅新等发现,具有产IAA能力的哈茨木霉M95对黄瓜幼苗生长具有显著的促进作用[33];王东亚等还发现,具有产IAA能力的菌株在浸染条件下可以显著增加水稻种子的萌发率、根和芽长及生物量[34]。本研究中贝莱斯芽孢杆菌TC-52具有产IAA能力,其IAA产量达到21.70 μg/mL,相较于浸润在无菌水中,将水稻种子浸润在1.0×106 CFU/mL菌悬液中,胚根的生长增加了19%。菌株的促生性还表现在可以通过固氮、溶磷、解钾等能力提高土壤速效、缓效养分含量,提高微生物的生物活性,进一步促进植物的生长,以增加对病原菌的抗性[35-36],本研究中贝莱斯芽孢杆菌TC-52具有固氮能力,进一步促进了水稻的生长,减少了病害的侵染,将贝莱斯芽孢杆菌TC-52拌入水稻育秧基质中时,可以明显促进水稻幼苗根系的生长,对主根长度的增长达到25%,对侧根数的增长达到29%。此外,贝莱斯芽孢杆菌 TC-52 具有产铁载体能力,可以特异地螯合Fe3+,在低铁环境中与病原菌竞争铁元素,抑制病原菌生长,也可以将难溶的铁转化为易溶的铁供植物吸收,促进植物生长[11,37-38]。
综上所述,贝莱斯芽孢杆菌TC-52可以适应酸性环境,对尖孢镰刀菌有较好的抑制效果,拌入水稻育秧基质中可以明显改善水稻立枯病的发病情况,同时对水稻幼苗的生长有明显的促进作用,表现出了良好的应用前景,但关于该菌株代谢产物的分离纯化、大田应用效果等方面还需进一步的研究。
本研究从大豆根际土壤中筛选得到了1株对尖孢镰刀菌具有明显拮抗作用的菌株TC-52,根据菌体特征、16S rRNA序列分析及生理生化试验,初步鉴定该菌株为贝莱斯芽孢杆菌,该菌株可以通过分泌纤维素酶、蛋白酶以及几丁质酶3种抑菌胞外酶以及挥发性抑菌活性物质来抑制尖孢镰刀菌以及其他病原菌的生长,具有较广的抑菌谱,同时该菌株具有固氮、产铁载体与产IAA能力,有较好的防病效果和一定的促生能力。
参考文献:
[1]傅 强,黄世文. 图说水稻病虫害诊断与防治[M]. 北京:机械工业出版社,2019:26-29.
[2]张俊华,杨松润,彭莉莉,等. 水稻立枯病原菌尖孢镰孢菌致病力降低T-DNA突变体的筛选与插入位点鉴定[J]. 东北农业大学学报,2022,53(11):10-18.
[3]曹 阳. 水稻立枯病拮抗内生菌分离及其代谢组学的研究[D]. 哈尔滨:东北农业大学,2021.
[4]Liu J X,Cai Y N,Jiang W Y,et al. Population structure and genetic diversity of fungi causing rice seedling blight in northeast China based on microsatellite markers[J]. Plant Disease,2020,104(3):868-874.
[5]鲁晏宏,郝金辉,罗 明,等. 梨火疫病拮抗菌筛选及温室防效测定[J]. 微生物学通报,2021,48(10):3690-3699.
[6]李风顺,乔俊卿,张荣胜,等. 防治水稻恶苗病拮抗细菌的筛选、鉴定和评价[J]. 江苏农业学报,2022,38(4):907-914.
[7]李 敏,杨 谦,王 疏,等. 哈茨木霉与多菌灵复合使用对水稻苗期立枯病的防治[J]. 浙江大学学报(农业与生命科学版),2009,35(1):65-70.
[8]Limtong S,Into P,Attarat P.Biocontrol of rice seedling rot disease caused by Curvularia lunata and Helminthosporium oryzae by epiphytic yeasts from plant leaves[J]. Microorganisms,2020,8(5):647.
[9]李鑫杰,汪丽军,黄利春,等. 寡雄腐霉对水稻立枯病的防效初探[J]. 中国植保导刊,2015,35(8):56-58.
[10]于文清,李 鹏,王 鑫,等. 土地类芽孢杆菌(Paenibacillus terrae)NK3-4对水稻立枯病的生物防治[J]. 分子植物育种,2023,21(1):327-336.
[11]连文浩,林 娟,王国增,等. 产几丁质酶微生物的筛选、鉴定及酶学性质研究[J]. 中国食品学报,2017,17(3):82-89.
[12]谢海鹏,林樱桃,吴小燕,等. 豇豆枯萎病生防细菌的筛选鉴定及抗病机理初探[J]. 热带作物学报,2023,44(6):1224-1236.
[13]余涵霞,梁浩林,王子轩,等. 薇甘菊根际可培养固氮菌和氨化细菌的分离鉴定与促生作用[J]. 微生物学报,2022,62(5):1851-1863.
[14]代 志,高俊明. 兼具解磷解钾功能生防菌分离鉴定及效果评价[J]. 山西农业科学,2018,46(4):627-633.
[15]吴红艳,于 淼,冯 健,等. 土壤中解钾菌K02的筛选、鉴定及培养条件优化[J]. 微生物学杂志,2020,40(4):60-65.
[16]李冬莹. 松嫩平原耐盐碱促生菌的筛选鉴定及其植物促生作用研究[D]. 哈尔滨:黑龙江大学,2022.
[17]周 瑚,邹秋霞,胡 玲,等. 特基拉芽孢杆菌JN-369的分离鉴定及其抑菌物质分析[J]. 农药学学报,2019,21(1):52-58.
[18]张昊鑫,王中华,牛 兵,等. 产IAA兼具溶磷解钾高效促生菌的筛选、鉴定及其广谱性应用[J]. 生物技术通报,2022,38(5):100-111.
[19]Glickmann E,Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology,1995,61(2):793-796.
[20]布坎南. 伯杰细菌鉴定手册[M]. 8版.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译. 北京:科学出版社,1984:710-735.
[21]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:350-370.
[22]郭会婧. 几种微生物源提取物抑制致病疫霉及其机理的研究[D]. 保定:河北大学,2008.
[23]李 晋,普 倩,张帅帅,等. 西瓜枯萎病多功能生防细菌的筛选和抗病效果[J]. 浙江理工大学学报(自然科学版),2021,45(5):685-690.
[24]Zhao Q,Cao J M,Cai X J,et al. Antagonistic activity of volatile organic compounds produced by acid-tolerant Pseudomonas protegens CLP-6 as biological fumigants to control tobacco bacterial wilt caused by Ralstonia solanacearum[J]. Applied and Environmental Microbiology,2023,89(2):e0189222.
[25]Ngalimat M S,Mohd Hata E,Zulperi D,et al. Plant growth-promoting bacteria as an emerging tool to manage bacterial rice pathogens[J]. Microorganisms,2021,9(4):682.
[26]Schoffelmeer E A M,Klis F M,Sietsma J H,et al. The cell wall of Fusarium oxysporum[J]. Fungal Genetics and Biology,1999,27(2/3):275-282.
[27]Adams D J. Fungal cell wall chitinases and glucanases[J]. Microbiology,2004,150(7):2029-2035.
[28]Wang X Y,Zhou X N,Cai Z B,et al. A biocontrol strain of Pseudomonas aeruginosa CQ-40 promote growth and control Botrytis cinerea in tomato[J]. Pathogens,2020,10(1):22.
[29]任沛东,彭健玲,刘圣航,等. 沙福芽孢杆菌GX-H6的分离鉴定及对水稻细菌性条斑病的防病效果[J]. 生物技术通报,2023,39(5):243-253.
[30]Chen H,Wang L,Su C X,et al. Isolation and characterization of lipopeptide antibiotics produced by Bacillus subtilis[J]. Letters in Applied Microbiology,2008,47(3):180-186.
[31]Malanicheva I A,Kozlov D G,Efimenko T A,et al. New antibiotics produced by Bacillus subtilis strains[J]. Microbiology,2014,83(4):352-356.
[32]武亚芬,向 丹,梁 斌,等. 番茄枯萎病拮抗菌KCKB1的分离、鉴定及生防效果[J]. 江苏农业科学,2023,51(9):131-139.
[33]高雅新,王甲果,张翔凯,等. 高产IAA哈茨木霉突变株M95的筛选及其对黄瓜的促生作用[J]. 南京农业大学学报,2023,46(3):499-509.
[34]王东亚,陈冠虹,方利平,等. 水稻根际芽孢杆菌抗砷胁迫作用及其微生物机制[J]. 土壤学报,2024,61(3):783-793.
[35]韦江璐,覃 英,谢显秋,等. 促生菌对土壤养分、酶活性及细菌群落功能多样性的影响[J]. 南方农业学报,2020,51(10):2348-2357.
[36]许佳露,张 平,李美芳,等. 产铁载体菌株的分离、培养条件优化及初步应用[J]. 微生物学通报,2022,49(3):1004-1016.
[37]Lucena J J,Hernandez-Apaolaza L. Iron nutrition in plants:an overview[J]. Plant and Soil,2017,418(1):1-4.
