枳PtrPP2C51基因克隆与非生物胁迫表达分析
2024-07-03佟晓楠胡文娟杨杰陈凯董小筠钟奕恬张晓媛李兴涛
佟晓楠 胡文娟 杨杰 陈凯 董小筠 钟奕恬 张晓媛 李兴涛


doi:10.15889/j.issn.1002-1302.2024.10.006
摘要:克隆枳PP2C基因家族的PtrPP2C51基因,分析其在低温、高温和干旱等胁迫下的表达规律,探究其在非生物胁迫中的功能。以1年生枳苗为试材,从嫩叶克隆到PtrPP2C51基因cDNA序列,采用生物信息学方法对其进行分析,利用实时荧光定量PCR仪(qRT-PCR)检测枳苗在低温、高温和干旱(15%PEG-6000)处理下的PtrPP2C51基因表达模式。克隆获得PtrPP2C51基因编码区CDS序列长度为879 bp,编码292个氨基酸,其蛋白分子量为31.36 ku,理论等电点4.9,脂肪系数79.52,不稳定系数39.57,亲水性平均值-0.279。PtrPP2C51蛋白的二级结构中α-螺旋、β-转角、延伸链和无规则卷曲占比分别为40.07%、7.88%、18.15%和33.90%。PtrPP2C51蛋白与克里曼丁橘的PP2C蛋白在同一小分支上,亲缘关系最近。经低温(0 ℃)、高温(38 ℃)和干旱(15%PEG-6000)3种不同胁迫处理,PtrPP2C51基因的相对表达量均表现持续上调趋势,并且均在处理12 h时表达量达到最高值。PtrPP2C51基因可能参与枳的抗逆胁迫调控机制。
关键词:枳;PP2C基因;基因克隆;非生物胁迫
中图分类号:S666.01 文献标志码:A
文章编号:1002-1302(2024)10-0049-06
收稿日期:2023-07-19
基金项目:国家自然科学基金(编号:32160731);江西省教育厅科技项目(编号:GJJ2201233)。
作者简介:佟晓楠(1983—),女,辽宁辽阳人,硕士,讲师,主要从事柑橘低温胁迫分子机制研究。E-mail:tongxn_gnnu@qq.com。
通信作者:李兴涛,博士,副教授,研究方向为果树逆境植物生理。E-mail:lixt.gnnu@qq.com。
柑橘(Citrus reticulata Blanco)是我国乃至全球多个国家的主要水果栽培作物之一,是世界第一大水果,但柑橘在生长发育过程中十分容易受到多种非生物胁迫的不利影响。柑橘砧木的选用是柑橘生产过程中的关键,这不仅影响柑橘的质量和产量,其抗逆性也会受到影响。目前,在我国柑橘产业中枳是使用最为广泛的柑橘砧木[1],枳对气候具有较强的适应性,抗逆性也较强,这也为柑橘筛选抗性基因提供了良好的材料。
蛋白磷酸酶2C(PP2C)是磷蛋白金属磷酸酶的一个分支,其活性受Mn2+和Mg2+调控,在大多数生物体中广泛存在[2]。植物与动物相比,含有数量更为丰富的PP2C蛋白[3]。PP2C家族蛋白具有一致特征,即有11个特异的亚结构域。植物中PP2C兼具多种不同功能,这是由于植物PP2C蛋白的N端具有多功能延伸区,在C端还有保守的催化结构域。研究表明,植物中的PP2C家族蛋白能够参与多种激素信号的传导,也能对植物体内的激素水平和代谢途径产生影响[4],从而在干旱、盐碱和低温等环境胁迫调控中发挥作用[5-8]。迄今为止,已经在拟南芥、二穗短柄草、马铃薯、水稻和大豆等多种植物中开展了PP2C的相关研究[2,5-6,9-10]。Xue等对拟南芥进行鉴定得到80个PP2C基因家族成员,并将其分为13个亚族,其中对A、B、C亚族的研究较多,对其他亚族研究的相对较少[9]。A亚族的ABI1和ABI2等PP2C蛋白依靠结合脱落酸(ABA)受体蛋白进而负调控ABA表达[11],Gosti等的研究表明ABI1和ABI2均参与ABA信号的负调控机制[12-13],B亚族蛋白能够传导有丝分裂原激活蛋白激酶(MAPK)信号,C亚族蛋白能够调控花发育[14],以此说明了PP2C可以依靠信号通路的差异影响转录因子的表达,从而参与植物逆境响应和生长发育[13,15]。PP2C基因家族成员在非生物胁迫方面有重要的调控功能。低温胁迫下,转ZmPP2C2基因的烟草植株的抗氧化酶活性和发芽率比对照显著升高,电解质渗透率和丙二醛含量显著降低[16];对葡萄PP2C家族基因表达谱分析表明,低温胁迫下有7个葡萄PP2C基因表达显著上调[17];张婷婷等对铁皮石斛全基因组鉴定得到了67个DcPP2C基因家族成员,选取10个基因进行分析,4 ℃ 低温处理后,根系有3个基因表达量上调,叶片有9个基因表达量上调,对铁皮石斛42 ℃高温处理后,在根系和叶片中,选取的10个基因均出现表达量上调[18];Cao等通过研究发现,对二穗短柄草进行4 ℃低温和42 ℃高温胁迫处理,全部BdPP2C基因均出现表达量上调[2];对苗期的黄瓜进行干旱处理,根系、茎部和叶片的CsPP2C2都出现了上调[19]。杨杰等在枳全基因组中鉴定得到53个PtrPP2C基因,分为10个亚族,利用qRT-PCR分析所有PtrPP2C基因在非生物胁迫下的表达模式,在低温、高温和干旱胁迫下,分别有10、8、9个基因表达量显著上调,其中较为明显的是PtrPP2C51,研究还发现,其中的A和F 2个亚族在枳响应逆境胁迫中起突出作用[20]。因此,PP2C基因家族成员在非生物胁迫中起重要的调控功能。
目前,PP2C基因已在拟南芥、小麦、苜蓿、玉米、白桦和茶树等多种植物中被克隆并进行了表达分析[15-16,21-23],但涉及枳F亚族的PtrPP2C基因克隆及其非生物胁迫的表达研究尚未见报道。本研究以枳苗为试验材料,从嫩叶片中克隆F亚族的PtrPP2C51基因的cDNA全长序列,再进行生物信息学分析,使用qRT-PCR检测枳在低温、高温和干旱胁迫处理下0、3、6、12 h时间点PtrPP2C51基因的表达模式,为解析PtrPP2C51基因参与枳抗逆调控机制提供参考。
1 材料与方法
1.1 试验材料
以1年生枳组培盆栽苗作为供试材料,培养基质为蛭石、珍珠岩和草炭以1 ∶1 ∶3的体积比混合,苗钵规格为30 cm×28 cm,在对其进行处理前保证良好的生长状况。。
1.2 样品胁迫处理
挑选出生长良好的枳苗对其进行相应的处理,低温和高温胁迫处理为将枳苗放置于光照度 1 500~2 000 lx和相对湿度75%的培养箱中,分别进行0 ℃低温和38 ℃高温处理;干旱胁迫处理为利用浓度为15%的PEG-6000溶液,将枳苗放置于装满Hoagland营养液的塑料容器(36 cm×33 cm×26 cm)中,并对其进行供氧,供氧使用的打氧机为ACO-318型(广东海利集团有限公司)。每组处理均进行3次重复,并分别在0、3、6、12 h共4个时间点取枳苗嫩叶片,快速放置于-80 ℃的超低温冰箱中保存以便取用。
1.3 总RNA提取及反转录合成cDNA
利用Trizol法提取总RNA,用超微量分光光度计(上海元析仪器有限公司,B-500)检测RNA浓度和纯度。以cDNA第一链合成试剂盒(杭州新景生物试剂开发有限公司)将合格的RNA模板反转录合成cDNA。
1.4 PtrPP2C51基因的克隆
利用Primer Premier 5.0设计全长序列扩增引物(表1)。以枳苗嫩叶片cDNA为模板,克隆PtrPP2C51基因的cDNA全长序列。PCR反应体系为25 μL,反应体系含2×E-Taq PCR Master Mix 12.5 μL,上下游引物均为1 μL,cDNA模板1 μL,ddH2O 9.5 μL。扩增程序为95 ℃预变性3 min;95 ℃ 变性30 s,56 ℃退火30 s,72 ℃延伸1 min,设置35个循环;72 ℃延伸5 min。PCR经产物电泳检测后用AxyPrep PCR清洁试剂盒进行胶回收,送生工生物工程(上海)股份有限公司测序。
1.5 PtrPP2C51基因的实时荧光定量PCR检测
根据扩增获得的PtrPP2C51基因序列,使用Beacon Designer 7.0软件设计qRT-PCR引物qPtrPP2C51-F和qPtrPP2C51-R(表1)。以枳苗嫩叶片cDNA为模板,使用Light Cycler 96 Real-Time PCR System仪器进行qRT-PCR检测。反应体系10 μL:2×SYBR Green PCR Mix(杭州新景生物试剂开发有限公司)5 μL,ddH2O和模板cDNA各2 μL,15 μmol/L正反向引物各0.5 μL,每个样本3个重复。扩增程序为94 ℃预变性3 min;94 ℃变性20 s,58 ℃退火20 s,72 ℃延伸30 s,35个循环。以柑橘ACTB基因为内参基因[24]。
1.6 生物信息学分析
使用ProtParam tool(https//web.expasy.org/protparam/)分析PtrPP2C51蛋白理化性质;使用WoLF PSORT(https://psort.hgc.jp/)预测PtrPP2C51蛋白亚细胞定位;通过ProtScale分析PtrPP2C51蛋白的疏水性;利用SOPMA和SWISS-MODEL在线软件分别对PtrPP2C51蛋白二级、三级结构进行分析;通过Jalview对PtrPP2C51基因序列进行比对;从NCBI数据库下载与PtrPP2C51蛋白不同物种的同源氨基酸序列,使用MEGA 7.0中的邻接法(neighbor-joining method)生成系统发育进化树,Bootstrap位置为1 000,其他条件为默认。
1.7 统计分析
PtrPP2C51基因的相对表达量计算利用2-ΔΔCT法[25],基因表达量间的显著性分析使用SPSS 21.0软件,使用Excel 2016作图。
2 结果与分析
2.1 PtrPP2C51基因的克隆
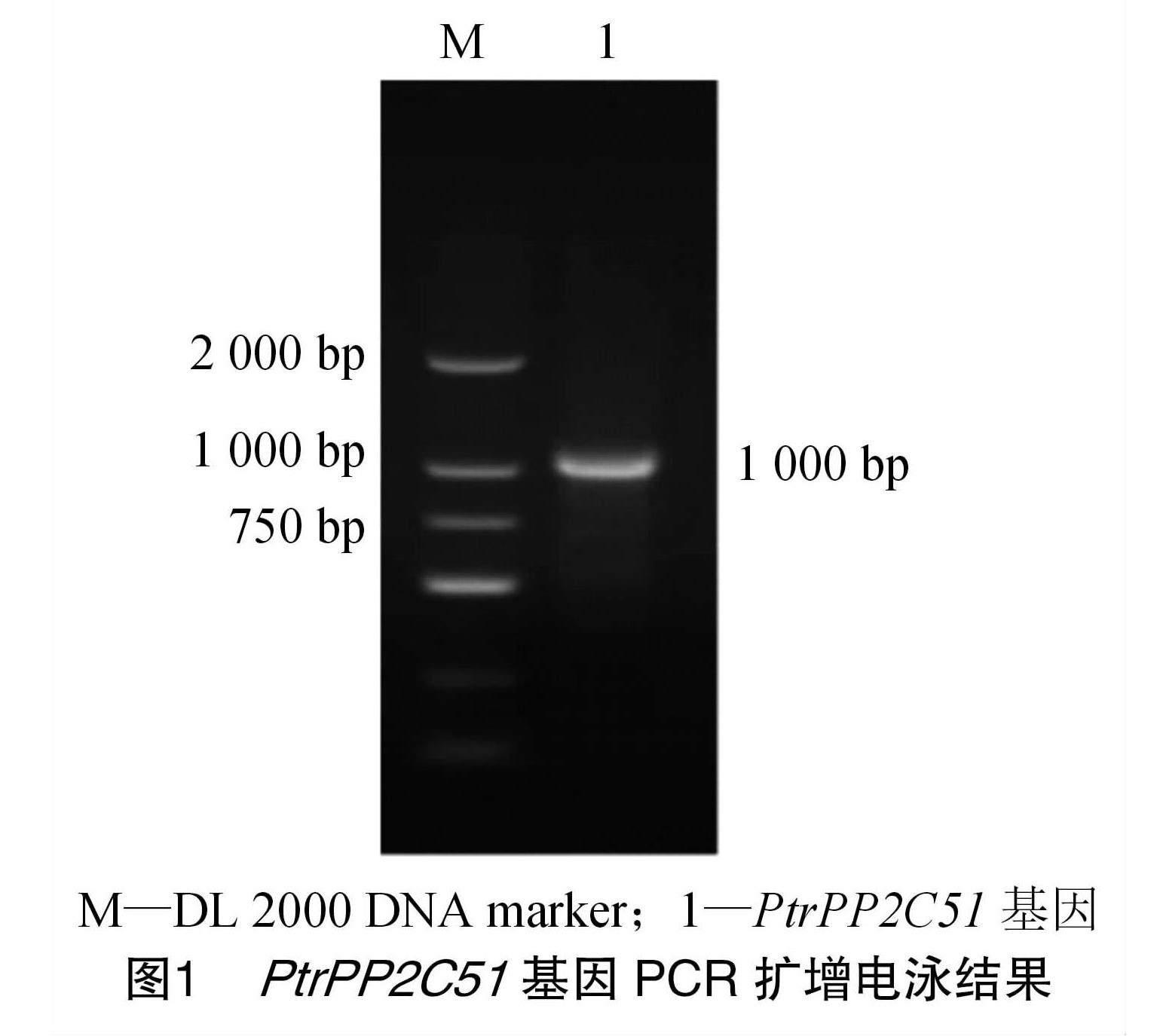
利用qPtrPP2C51基因上下游引物,以枳苗嫩叶片RNA反转录得到的cDNA为模板进行PCR扩增,扩增得到的结果如图1所示,大小约1 000 bp,与预期结果1 006 bp相符。测序结果表明,编码序列(CDS)全长为879 bp,编码292个氨基酸,对其命名为PtrPP2C51。
2.2 PtrPP2C51基因的序列比对
将测序获得的PtrPP2C51基因序列在NCBI上进行Blastx比对,获得与之编码蛋白序列相同的一条克里曼丁橘蛋白序列(GenBank登录号为XP_006450232.1,对应基因序列登录号为XM_006450169.2),通过Jaiview软件比对其CDS序列,发现两序列共有6处不同,分别处于第72、189、222、480、747、804位,其中只有第480位为颠换,由鸟嘌呤置换成胸腺嘧啶,其余5处都是转换,分别为第72位由鸟嘌呤置换成腺嘌呤,第222位由腺嘌呤置换成鸟嘌呤,其余3个均是由胞嘧啶置换成胸腺嘧啶(图2),由此可见,发生转换的频率比发生颠换的频率高。枳和克里曼丁橘蛋白序列完全相同(图3),表明该序列在核酸水平发生的突变都是无义突变。枳是芸香科(Rutaceae)枳属(Poncirus),克里曼丁橘是芸香科柑橘属(Citrus),不同属的2个核酸序列虽然有差异,但是蛋白序列完全相同,说明在芸香科内,该基因在蛋白水平具有较为严格的保守性。
2.3 PtrPP2C51蛋白的理化性质分析
利用ExPASy ProtParam对PtrPP2C51蛋白的理化性质进行分析,结果显示,PtrPP2C51蛋白的分子式为C1 366H2 133N391O444S7,由292个氨基酸残基组
成,包含20种氨基酸,其中丝氨酸(Ser)、丙氨酸(Ala)和甘氨酸(Gly)含量较高,且丝氨酸含量最高,占10.6%,丙氨酸和甘氨酸含量相同,均占10.3%;PtrPP2C51蛋白分子量为31.36 ku,理论等电点为4.9,不稳定系数为39.57,表明其为稳定蛋白;脂肪系数为79.52,为强脂溶性蛋白。亚细胞定位预测该蛋白可能位于细胞质。
PtrPP2C51蛋白的疏水性通过ProtScale进行分析,结果(图4)显示,分值最高出现于第276位的缬氨酸,为2.333,疏水性最强,分值最低出现于第119位的天冬酰胺,为-3.356,疏水性最弱。其整体疏水性小于0,亲水性平均值(GRAVY)为-0.279,由此判断PtrPP2C51蛋白为亲水性蛋白。
2.4 PtrPP2C51蛋白的二级、三级结构分析
对PtrPP2C51蛋白进行二级结构分析使用的是SOPMA软件,结果(图5)显示,PtrPP2C51蛋白含有4种二级结构类型,分别为α-螺旋、β-转角、延伸链和无规则卷曲,其中α-螺旋由117个氨基酸残基构成,占氨基酸序列的40.07%,是占比最多的一个类型;延伸链由53个氨基酸残基构成,占氨基酸序列的18.15%;β-转角由23个氨基酸残基构成,占氨基酸序列的7.88%,且占比最少;无规则卷曲由99个氨基酸残基构成,占氨基酸序列的33.90%。利用SWISS-MODEL对PtrPP2C51蛋白的三级结构进行分析, 结果(图6)与二级结构的分
析结果相符。
2.5 系统发育进化树分析
利用NCBI数据库进行搜索,从中下载了甜橙(Citrus sinensis)、月季花(Rosa chinensis)、桃(Prunus persica)、麻风树(Jatropha curcas)、苹果(Malus pumila)、石榴(Punica granatum)、胡杨(Populus euphratica)、大麻(Cannabis sativa)、胡桃(Juglans regia)、葡萄(Vitis vinifera)、雷公藤(Tripterygium wilfordii)、蒺藜苜蓿(Medicago truncatula)、茶(Camellia sinensis)、拟南芥(Arabidopsis thaliana)等不同植物物种的PP2C蛋白氨基酸序列,与PtrPP2C51蛋白共同构建系统发育进化树。结果(图7)表明,PtrPP2C51蛋白与克里曼丁橘的PP2C蛋白在同一小分支上,同源性最高,亲缘关系最近,与葡萄的亲缘关系也比较近;而与拟南芥的同源性最差,亲缘关系最远。
2.6 PtrPP2C51基因在非生物胁迫下的表达模式分析
对枳苗分别进行0 ℃低温、38 ℃高温以及干旱(15%PEG-6000)处理,再使用qRT-PCR检测枳在3种不同处理方式下PtrPP2C51基因的表达模式,结果(图8)显示,经低温、高温以及干旱处理后的0~12 h内,PtrPP2C51基因均出现了表达量持续升高的情况(P<0.05),其中在低温处理后12 h表达量上调尤为显著,并且3种不同处理下的PtrPP2C51基因表达量均在处理后12 h达到最高值。
3 讨论与结论
PP2C是植物体内十分重要的一类蛋白磷酸酶,能够调控植物的逆境信号传导,主要依靠催化底物蛋白的去磷酸化和磷酸化反应进行。柑橘生长发育过程会受到生物和非生物胁迫,以至于品质变差、产量下降,而枳是柑橘生产中常用的砧木,探究PP2C基因家族成员在枳逆境中发挥的功能及作用从而提高柑橘生产的质量就很有必要。目前,已经从枳中鉴定出了可分为10个亚族(A、B、C、D、E、F、H、I、J、L)的53个PtrPP2C基因家族成员,并将其命名为PtrPP2C1~PtrPP2C53[20]。本研究从枳中克隆得到的PtrPP2C51基因归类于F亚族,PtrPP2C51基因CDS长度为879 bp,蛋白质编码长度为292个氨基酸,蛋白分子量为31.36 ku。系统进化结果表明,PtrPP2C51蛋白与克里曼丁橘和葡萄的亲缘关系较近,与拟南芥NP_001185062.1的亲缘关系最远,相似性为43.25%,说明PP2C在进化中相对保守。
本研究对枳苗分别进行低温、高温以及干旱(15%PEG-6000)胁迫处理,结果表明PtrPP2C51基因表达量会随着处理时间逐步升高。Dong等的研究表明,PP2C基因能够参与低温胁迫的调控是通过MAPK或ABA信号通路[15],在谷子的PP2C基因受到低温胁迫后,除了SiPP2CA2,其他的基因表达量都呈现上升趋势[26],本研究中的PtrPP2C51基因低温胁迫下表现与之一致。张金旭等分析干旱处理的甘蔗转录组,发现有37个SsPP2Cs基因表达受到干旱强烈诱导(FPKM>2),相对表达量分析结果表明,SsPP2C38和SsPP2C81 2个基因的表达量随着干旱处理时间逐步升高,处理12 h达到最高值[27]。对葡萄赤霞珠进行干旱(PEG)处理,发现大部分基因表达量下降,但也有5个PP2C基因的表达量在干旱处理6 h后均表现出逐步上升的趋势[17],表明只有部分PP2C基因响应干旱胁迫,在本研究中PtrPP2C51基因对干旱胁迫也存在响应。同样,经高温处理后,PtrPP2C51基因也表现出表达量上升的情况,但上升趋势不如低温和干旱处理。综上所述,PtrPP2C51基因能积极响应多种非生物逆胁迫,可能参与调控低温、高温和干旱胁迫。
以上分析及结果对今后深入研究枳的抗逆胁迫机制,为提高枳抗逆境胁迫能力提供参考,同时也为柑橘筛选良好的抗性基因提供了材料。
参考文献:
[1]朱世平,王福生,陈 娇,等. 柑橘不同类型砧木的种子和苗期性状[J]. 中国农业科学,2020,53(3):585-599.
[2]Cao J M,Jiang M,Li P,et al. Genome-wide identification and evolutionary analyses of the PP2C gene family with their expression profiling in response to multiple stresses in Brachypodium distachyon[J]. BMC Genomics,2016,17(1):175.
[3]Singh A,Pandey A,Srivastava A K,et al. Plant protein phosphatases 2C:from genomic diversity to functional multiplicity and importance in stress management[J]. Critical Reviews in Biotechnology,2016,36(6):1023-1035.
[4]Nishimura N,Okamoto M,Narusaka M,et al. ABA hypersensitive germination2-1 causes the activation of both abscisic acid and salicylic acid responses in Arabidopsis[J]. Plant and Cell Physiology,2009,50(12):2112-2122.
[5]Wang Y F,Liao Y Q,Wang Y P,et al. Genome-wide identification and expression analysis of StPP2C gene family in response to multiple stresses in potato (Solanum tuberosum L.)[J]. Journal of Integrative Agriculture,2020,19(6):1609-1624.
[6]Chen C,Yu Y,Ding X D,et al. Genome-wide analysis and expression profiling of PP2C clade D under saline and alkali stresses in wild soybean and Arabidopsis[J]. Protoplasma,2018,255(2):643-654.
[7]Bhaskara G B,Nguyen T T,Verslues P E. Unique drought resistance functions of the highly ABA-induced clade A protein phosphatase 2Cs[J]. Plant Physiology,2012,160(1):379-395.
[8]Akimoto-Tomiyama C,Tanabe S,Kajiwara H,et al. Loss of chloroplast-localized protein phosphatase 2Cs in Arabidopsis thaliana leads to enhancement of plant immunity and resistance to Xanthomonas campestris pv.campestris infection[J]. Molecular Plant Pathology,2018,19(5):1184-1195.
[9]Xue T T,Wang D,Zhang S Z,et al. Genome-wide and expression analysis of protein phosphatase 2C in rice and Arabidopsis[J]. BMC Genomics,2008,9:550.
[10]曾 坚,谢雅倩,陈丽萍,等. 木薯2C型蛋白磷酸酶基因MePP2C55的克隆及表达分析[J]. 江苏农业科学,2022,50(8):73-78.
[11]Singh A,Jha S K,Bagri J,et al. ABA inducible rice protein phosphatase 2C confers ABA insensitivity and abiotic stress tolerance in Arabidopsis[J]. PLoS One,2015,10(4):e0125168.
[12]Gosti F,Beaudoin N,Serizet C,et al. ABI1 protein phosphatase 2C is a negative regulator of abscisic acid signaling[J]. The Plant Cell,1999,11(10):1897-1909.
[13]Merlot S,Gosti F,Guerrier D,et al. The ABI1 and ABI2 protein phosphatases 2C act in a negative feedback regulatory loop of the abscisic acid signalling pathway[J]. The Plant Journal,2001,25(3):295-303.
[14]张继红,陶能国. 植物PP2C蛋白磷酸酶ABA信号转导及逆境胁迫调控机制研究进展[J]. 广西植物,2015,35(6):935-941.
[15]Dong W,Liu X J,Lü J,et al. The expression of alfalfa MsPP2CA1 gene confers ABA sensitivity and abiotic stress tolerance on Arabidopsis thaliana[J]. Plant Physiology and Biochemistry,2019,143:176-182.
[15]Hu X L,Liu L X,Xiao B L,et al. Enhanced tolerance to low temperature in tobacco by overexpression of a new maize protein phosphatase 2C,ZmPP2C2[J]. Journal of Plant Physiology,2010,167(15):1307-1315.
[17]何红红,路志浩,马宗桓,等. 葡萄PP2C家族基因的鉴定与表达分析[J]. 园艺学报,2018,45(7):1237-1250.
[18]张婷婷,李雨欣,张德遥,等. 铁皮石斛蛋白磷酸酶PP2C家族基因鉴定及其表达分析[J]. 园艺学报,2021,48(12):2458-2470.
[19]Wang Y P,Wu Y,Duan C R,et al. The expression profiling of the CsPYL,CsPP2C and CsSnRK2 gene families during fruit development and drought stress in cucumber[J]. Journal of Plant Physiology,2012,169(18):1874-1882.
[20]杨 杰,陈 蓉,胡文娟,等. 枳PP2C基因家族的鉴定及表达分析[J]. 果树学报,2022,39(4):532-547.
[21]Hu W,Yan Y,Hou X W,et al. TaPP2C1,a group F2 protein phosphatase 2C gene,confers resistance to salt stress in transgenic tobacco[J]. PLoS One,2014,10(6):e0129589.
[22]Sugimoto H,Kondo S,Tanaka T,et al. Overexpression of a novel Arabidopsis PP2C isoform,AtPP2CF1, enhances plant biomass production by increasing inflorescence stem growth[J]. Journal of Experimental Botany,2014,65(18):5385-5400.
[23]Xing B Y,Gu C R,Zhang T X,et al. Functional study of BpPP2C1 revealed its role in salt stress in Betula platyphylla[J]. Frontiers in Plant Science,2021,11:617635.
[24]严佳文. 柑橘内参基因筛选及转pthA基因甜橙的表达分析[D]. 长沙:湖南农业大学,2010:41-56.
[25]Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4):402-408.
[26]闵东红,薛飞洋,马亚男,等. 谷子PP2C基因家族的特性[J]. 作物学报,2013,39(12):2135-2144.
[27]张金旭,周少丽,姜 烁,等. 甘蔗割手密PP2C基因家族的全基因组鉴定与表达分析[J]. 植物生理学报,2023,59(6):1101-1116.
