中国南方猩猩化石的研究进展
2024-06-30廖卫
廖卫
摘要: 在精确年代测定基础上,研究中国南方新发现的猩猩牙齿化石,是近年来猩猩化石研究的特色。中国南方猩猩化石的发现和研究深化了学术界对更新世猩猩分类、大小演化及其与环境变化之间关系的认识。本文梳理了中国南方更新世代表性的含猩猩化石遗址和猩猩化石的最新研究成果。目前发现的猩猩牙齿化石和年代学结果表明,猩猩最早出现于早更新世早期的中国南方,并持续到了晚更新世,以猩猩魏氏种(Pongo weidenreichi) 为代表。在中更新世晚期时,猩猩戴氏种(Pongo devosi) 可能首次出现在中国南方。猩猩魏氏种与猩猩戴氏种之间的关系还需要更多的化石证据来证实。更新世猩猩牙齿大小演化表现出明显的阶段性,猩猩牙齿变小主要出现在中更新世。猩猩牙齿大小的这种演化关系可能与中国南方草原环境的出现和扩张有关。
关键词: 更新世;中国南方;猩猩;大小演化;环境变化
1 引言
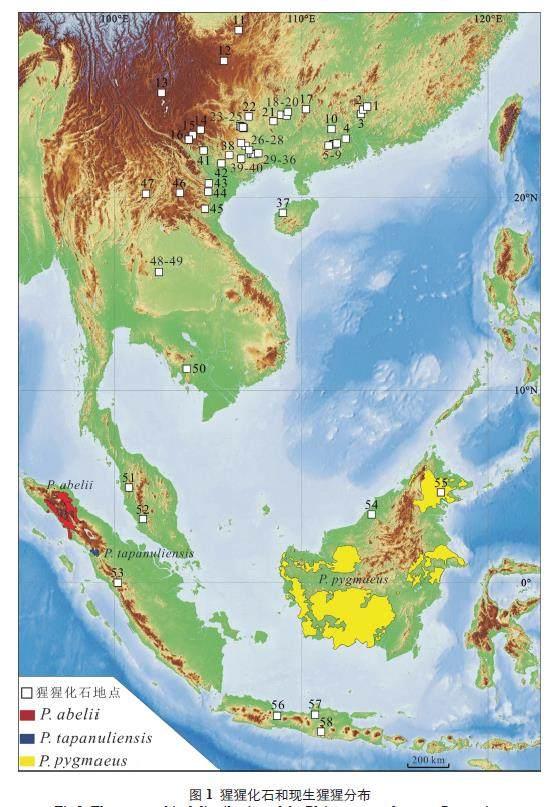
现生大型猿类是灵长类动物中与人类最接近的物种,有关其演化研究是探索人类起源的重要环节。地球上仅存的三种大型猿类中,大猩猩和黑猩猩生活在非洲。猩猩是亚洲唯一的现生大猿,目前只存活在东南亚苏门答腊和加里曼丹的热带密林中[1,2]。主要是基于基因组成、形态特征和社会习性的特征,现生猩猩被分为三个种,即苏门答腊猩猩(Pongo abelli)、婆罗洲猩猩(Pongo pygmaeus)[1,3,4] 和2017 年才确认的打巴奴里猩猩(Pongotapannuliensis)[2]。尽管现生猩猩的分布很局限,但是在地质历史时期,猩猩化石记录却非常广泛,主要分布在岭南山脉以南的东南亚大陆和岛屿上,主要包括中国南方[5-30]、越南[31-36]、老挝[37-39]、柬埔寨[40]、泰国[41-45]、马来西亚[46,47]、印度尼西亚的爪哇[33,48-50] 和苏门答腊[33,49,51,52],以及马来群岛的婆罗洲[53-55] 等(图1)。到目前为止,发现猩猩化石最为丰富的地区是中国南方。中国南方从早更新世到晚更新世的多个时期都有猩猩化石记录,分布于广西、广东、云南、贵州、和海南五省[6-15,20,21-23,26-29]。猩猩曾是中国南方更新世动物群中的常见种类,到更新世晚期,中国南方的猩猩化石才逐渐变得稀少直至绝迹[7,9]。
近年来,猩猩化石的研究进展主要集中在广西地区。其原因主要有两个,一是在广西做了大量的洞穴遗址调查和发掘工作,这才发现了丰富的猩猩牙齿化石[7-9,11,28]。从2009 年开始,广西地区新报道的猩猩牙齿化石数量超过了1000 颗,这为我们研究地质历史时期猩猩物种组成提供了难得的材料。二是洞穴遗址年代学工作的不断推进。运用最新的测年方法,主要包括古地磁[56-60]、电子自旋共振(ESR) 结合铀系[8,61-63]、铀系[8,9,28,60] 和光释光[56] 等,精确地测定了洞穴遗址的年代,这为我们研究地质历史时期猩猩演化提供了难得的时间坐标。正是由于这两方面工作的不断推进,中国南方猩猩化石研究,特别是在地质历史猩猩化石物种组成、更新世猩猩牙齿化石大小演化及其复杂性、更新世猩猩牙齿大小演化及其与环境变化之间的关系和中国南方猩猩绝迹事件等方面,取得了新的进展。本文系统地梳理了中国南方近年来新发现的、代表性的、含猩猩化石的洞穴遗址,总结目前猩猩化石的研究进展,并探讨了将来研究中需要解决的问题。
2 中国南方新发现的代表性含猩猩化石遗址
近年来,猩猩化石的发现和研究工作主要集中在中国南方地区,特别是广西地区。这些新发现的猩猩牙齿化石,为我们研究更新世猩猩演化提供了难得的材料。中国南方代表性的含猩猩化石遗址如下:
百孔洞 位于崇左市江州区,地理坐标为22°17′45.3″N, 107°29′54.4″E。百孔洞发现了29 颗猩猩牙齿化石[6,7],包括4 颗I2、2 颗M1、1 颗M2、2 颗M3、1 颗i1、3 颗p3、3 颗p4、3 颗m1、4 颗m2 和6 颗m3。百孔洞哺乳动物群[57] 中含有较多的第三纪孑遗物种,主要包括乳齿象、爪兽、双齿尖河猪和丘齿鼷鹿。绝灭属占到所有大型哺乳动物属的35%。百孔洞哺乳动物群中还含有较多的、更新世首次出现的物种,主要包括步氏巨猿、小种大熊猫、江南中华乳齿象、震旦拟豺、桑氏鬣狗、淮南剑齿象、山原貘、裴氏猪、小猪、凤岐祖鹿和广西巨羊,这些物种占到所有大型哺乳动物属种的60%。百孔洞沉积物的磁极性为负极性,再加上哺乳动物化石组成结构,百孔洞沉积物被认为沉积于松山负极性时早期[59]。因此,百孔洞猩猩化石的年代约为2.58~1.95 MaBP[60]。
巨猿洞 位于崇左市江州区,地理坐标为22°17′21.9″N, 107°30′38.8″E。巨猿洞发现了11颗猩猩牙齿化石[6,7],包括1 颗M1、1 颗i1、1 颗i2、1 颗c、1 颗p3、2 颗p4、1 颗m1 和3 颗m2。巨猿洞哺乳动物群[57,64] 中含有少量的第三纪孑遗物种,主要包括乳齿象,爪兽和双齿尖河猪。绝灭属占到所有大型哺乳动物属的25%。几种原始的哺乳动物种类,包括震旦拟豺和桑氏鬣狗,未见于巨猿洞哺乳动物群中。同时,见于百孔洞哺乳动物群中的原始的江南中国乳齿象,在巨猿洞哺乳动物群中被更进步的扬子中国乳齿象取代。尽管巨猿洞哺乳动物群中有60% 的物种与百孔洞哺乳动物群中的一样,但是巨猿洞哺乳动物群中缺乏原始的食肉类,并且还出现了更进步的扬子中国乳齿象,因此,巨猿洞哺乳动物群的年代要比百孔洞哺乳动物群的年代晚。再加上巨猿洞沉积物的磁极性为正极性,巨猿洞沉积物被认为沉积于奥杜威正极性时[59]。因此,巨猿洞猩猩化石的年代约为1.95~1.78 MaBP[60]。
三合大洞 位于崇左市江州区,地理坐标为22°16′29.6″N, 107°30′39.8″E。三合大洞发现了29 颗猩猩牙齿化石[11],包括1 颗C1、3 颗P3、4 颗P4、2 颗M1、1 颗M3、2 颗c、3 颗p3、1 颗p4、3 颗m1、7 颗m2 和2 颗m3。三合大洞哺乳动物群[57] 中第三纪孑遗物种,包括乳齿象、双齿尖河猪和丘齿鼷鹿,占到了大约18%;同时还含有较多的典型的更新世出现的物种,主要包括猕猴、剑齿象、巨羊和大额牛。三合大洞哺乳动物群中,绝灭种有23 个,占到整个哺乳动物群中大型哺乳动物种类的大约70%。绝灭种所占的比例比百孔洞和巨猿洞哺乳动物群中绝灭种所占的比例低。大熊猫小种、震旦拟豺和山原貘,分别被更进步的大熊猫武陵山种、古豺和中国貘所取代。三合大洞哺乳动物群几乎完全由东洋界的物种组成,缺乏古北界的马属物种和桑氏鬣狗。巨猿、大熊猫和貘类物种的牙齿比百孔洞和巨猿洞的大。沉积物分析表明,三合大洞下部和上部沉积物的磁极性为正极性,分别对应于奥杜威和贾拉米洛正极性时。中部含化石沉积物的极性为负极性,对应于奥杜威和贾拉米洛正极性时之间的负极性[59]。因此,三合大洞猩猩化石的年代为1.78~1.07 MaBP[60]。
缺缺洞 位于崇左市江州区,地理坐标为22°16′22″N, 107°30′22″E。缺缺洞发现了29颗猩猩牙齿化石[6,7],包括1 颗P3、2 颗P4、2 颗M1、3 颗M2、6 颗M3、2 颗p3、1 颗p4、4 颗m1、4 颗m2 和4 颗m3。缺缺洞哺乳动物群[57] 中第三纪孑遗物种的比例进一步减少,只占到所有大型哺乳动物的15%。同时,现生种在整个动物群中占到的比例高,达到30%。典型的早更新世物种继续出现,主要包括扬子中国乳齿象、中国貘和广西巨羊。缺缺洞哺乳动物群中含有中更新世的典型物种,主要包括东方剑齿象、大熊猫巴氏亚种和短角水牛。同时,巨猿、大熊猫和貘类的牙齿进一步变大。缺缺洞哺乳动物群可能代表了中国南方由早更新世向中更新世转变的过渡型动物群。缺缺洞沉积物的磁极性为正极性,再加上缺缺洞哺乳动物化石的组成结构,缺缺洞沉积物被认为沉积于贾拉米洛正极性时[59]。因此,缺缺猩猩化石的年代约为1.07~0.99 MaBP[60]。
感仙洞 位于百色市田东县,地理坐标为23°36′7″N, 106°59′52″E。感仙洞发现了106 颗猩猩牙齿化石[8],包括1 颗I1、2 颗C、10 颗P3、10 颗P4、8 颗M1、9 颗M2、20 颗M3、1 颗i1、2 颗i2、1 颗c、11 颗p3、12 颗p4、3 颗m1、9 颗m2、5 颗m3、1 颗dp3 和1 颗dp4。钙板的铀系测年结果表明,感仙洞遗址哺乳动物群的年代为362±78 kaBP 到168.9±2.4 kaBP。同时,运用电子自旋共振结合铀系测年方法得出哺乳动物化石样品的两个年代结果分别为270±26 kaBP 和229±22 kaBP。很显然,钙板的铀系测年结果与电子自旋共振结合铀系测年方法得出的年代结果相一致。感仙洞哺乳动物群[65] 主要以典型的中更新世哺乳动物种类为主,主要包括东方剑齿象、大熊猫巴氏种、中国貘和华南巨貘,同时还包括首次出现的最后鬣狗和亚洲象。感仙洞遗址的绝对年代测试结果与其哺乳动物群组成相吻合,其年代为中更新世晚期。因此,感仙洞遗址猩猩牙齿化石的年代为362±78 kaBP 到168.9±2.4 kaBP[65]。
智人洞 位于崇左市江州区,地理坐标为22°17′13.6″N, 107°30′45.1″E。除了一段古人类的部分下颌骨和两颗古人类牙齿化石之外,智人洞发现了14 颗猩猩牙齿化石[28],包括1 颗DP4、1 颗M1、3 颗M2、1 颗M3、1 颗i1、2 颗p4、1 颗m1、2 颗m2 和2 颗m3。钙板的铀系测年结果表明,智人洞遗址的年代早于106.2±6.7 kaBP[66]。古地磁的证据进一步将智人洞遗址的年代限定为116 ~106 ka[56]。最新的铀系测年结果表明,智人洞遗址的年代为190 ka 到130 kaBP[67]。木榄山智人洞哺乳动物群[68] 以江南象和亚洲象及巨獏等组合为其特征,缺乏大熊猫和剑齿象。从目前研究结果来看,智人洞遗址绝对年代测试结果与其哺乳动物群组成相吻合。该遗址是中国首次在精确年代测定基础上开展猩猩化石研究的遗址[28],具有重要意义。该遗址发现的猩猩牙齿化石为研究晚更新世早期中国南方猩猩种群提供了难得的材料。
宜村洞 位于崇左市江州区,地理坐标为22°27′48.64″N, 107°16′8.43″E。宜村洞发现了24 颗猩猩牙齿化石[9],包括1 颗I2、1 颗C1、4 颗P3、4 颗P4、5 颗M1、3 颗M2、3 颗M3、1 颗p3、1 颗p4 和1 颗m2。钙板和鹅管的铀系测年结果表明,宜村洞遗址哺乳动物群的年代为66±0.32 kaBP 到57±0.26 kaBP。宜村洞哺乳动物群主要包括亚洲象、东方剑齿象、大熊猫巴氏种和华南巨貘。宜村洞遗址的绝对年代测试结果与其哺乳动物群组成相吻合,其年代约为60 kaBP。宜村洞代表了目前有精确年代测定的、中国南方年代最晚的含猩猩化石遗址。该遗址发现的猩猩牙齿化石为研究晚更新世中国南方猩猩种群及其绝灭过程提供了难得的材料。
3 讨论
3.1 猩猩化石系统分类研究
猩猩化石的分类研究工作一直是猩猩研究的基础和热点。地质历史时期猩猩化石属种的确定,主要是依据猩猩牙齿的大小、咬合面形态特征和地理分布情况[6-9,11,28,33,36,69]。早在1935 年,裴文中就报道了来自广西南宁的13 枚猩猩牙齿化石。这些猩猩的牙齿除了比现生猩猩的大以外,并未表现出明显区别于现生猩猩的典型特征,因此,这些猩猩被归类到现生猩猩的相似种[10]。
1948 年,Hooijer 将苏门答腊岛的Sibrambang 洞、Lida Ajer 洞和Djamboe 洞以及Padang Highlands 其他洞穴的3170 枚颗猩猩牙齿化石归类到一个新的亚种,即猩猩古苏门答腊亚种(Pongo pygmaeus palaeosumatrensis)[69]。猩猩古苏门答腊亚种与现生猩猩的主要差别在于其大的牙齿,犬齿的两性差别更大,门齿、前臼齿、臼齿齿冠面积的相对比例等。依据云南富民河上洞的一颗雌性下颌犬齿化石为模式标本,Hooijer 还建立了中国首个猩猩化石新亚种,猩猩魏氏亚种(Pongo pygmaeus weidenreichi)[69]。猩猩魏氏亚种与现生猩猩的主要差别是在其牙齿大,下颌犬齿齿冠高度指数低。
1995 年,Drawhorn 认为,苏门答腊岛不同洞穴遗址的猩猩牙齿大小存在明显差异,不能只归类到猩猩古苏门答腊亚种(P. p. palaeosumatrensis) 一个种,而应进一步划分[33]。Sibrambang 洞的猩猩牙齿化石仍然被归类到猩猩古苏门答腊亚种(P. p.palaeosumatrensis),而Lida Ajer 洞和Djamboe 洞的猩猩牙齿化石归并到一起建立一个新种,Pongo duboisi。相对于现生猩猩来说,猩猩古苏门答腊亚种(P. p. palaeosumatrensis) 牙齿大,特别是前臼齿和臼齿。猩猩古苏门答腊亚种(P. p. palaeosumatrensis) 的颊齿面积平均比现生猩猩大8.6%。相对于猩猩古苏门答腊亚种(P. p. palaeosumatrensis) 和现生猩猩来说,P. duboisi 的牙齿更大,颊齿面积平均比猩猩古苏门答腊亚种(P. p. palaeosumatrensis)大10.6%,比现生猩猩大19.2%。
爪哇岛Punung 的猩猩牙齿化石被归类到Pongo pygmaeus javensis[33],其典型的牙齿特征包括:M2 特别小,P3 相对较宽,齿尖相对向中心分布和臼齿齿带更发育。颊齿面积平均比现生猩猩小10.3%[6]。
基于越南发现的猩猩牙齿化石材料,Schwartz 等于1995 年建立了一个新种Pongohooijeri( 来自于Tham Khuyen) 和四个新的亚种Pongo pygmaeus ciochoni( 来自于ThamKhuyen)、Pongo pygmaeus devosi( 来自于Hang Hum)、Pongo pygmaeus kahlkei( 来自于Tham Khuyen)和Pongo pygmaeus fromageti(来自于Tham Om)[36]。2014 年,Harrison 等认为,P. hooijeri、P. p. ciochoni、P. p. kahlkei 和P. p. fromageti 是猩猩魏氏种(P. weidenreichi) 的次异名[6]。
1987 年,顾玉珉发现我国两广地区猩猩化石的上颌前臼齿(P3 和P4)和臼齿(M1、M2 和M3)、下颌第三前臼齿和下颌第三臼齿的测量值在苏门答腊岛猩猩化石的变异范围之内;下颌门齿、下颌犬齿略小于现生猩猩,上颌犬齿、上颌前臼齿(P3 和P4)和臼齿(M1 和M2)的长、宽平均值大于现生猩猩。除上颌第三前臼齿宽度的最大值与现生猩猩相同外,上颌犬齿、上颌第四前臼齿的长、宽及上颌第一臼齿长、前宽、后宽最小和最大值的范围都大于现生猩猩;下颌中门齿、下颌犬齿的平均值小于现生种;除下颌第三前臼齿的宽度外,下颌第三前臼齿的长、下颌第四臼齿和第一臼齿的长和宽度值都大于现生猩猩[15]。顾玉珉认为两广地区的猩猩化石应归类到猩猩魏氏亚种(P. p. weidenreichi)。1995 年,Ho 等进一步描述了中国南方早更新世到晚更新世的猩猩牙齿化石,支持将中国的猩猩化石归类到猩猩魏氏亚种P. p. weidenreichi 的观点[70]。周国兴2002 年研究了中国华南发现的8 枚化石猩猩牙齿后提出建立更新世(猩猩魏氏亚种)P. p. weidenreichi 和全新世P. p. pygmaeus 两个亚种[30]。
2009 年,赵凌霞等研究了广西崇左智人洞的14 枚晚更新世猩猩牙齿化石[28],主要依据牙齿较大、颊齿咬合面釉质皱纹较简单等特征,把这些牙齿化石归类到猩猩魏氏亚种(P. p. weidenreichi)[28]。
广西崇左百孔洞、巨猿洞、三合大洞和缺缺洞的猩猩化石材料,见证了中国南方早更新世猩猩化石属种构成和大小演化。2014 年,Harrison 和Wang 等将上述四个早更新世洞穴遗址的猩猩化石材料归类到猩猩魏氏种(P. weidenreichi),主要是依据其大小比现生猩猩大[6,11]。智人洞的猩猩牙齿化石则被归类到猩猩戴氏种参考种(P. cf. devosi)[6]。同年,Harrison 等根据猩猩化石的时空分布情况,对猩猩化石提出了一种初步的系统分类方案[6]。根据这个分类方案,婆罗洲晚更新世的猩猩化石被归类到婆罗洲猩猩(P. pygmaeus),苏门答腊岛的猩猩牙齿化石被归类到猩猩古苏门答腊种(Pongo palaeosumatrensis),Lida Ayer和Djambu 的猩猩牙齿化石被归类到P. duboisi,爪哇岛Punung 的猩猩牙齿化石被归类到Pongo javensis。在中国南方和越南,早更新世和中更新世的猩猩牙齿化石都被归类到猩猩魏氏种(P. weidenreichi)。到晚更新世演化为另一种猩猩种类——猩猩戴氏种(P. devosi)。
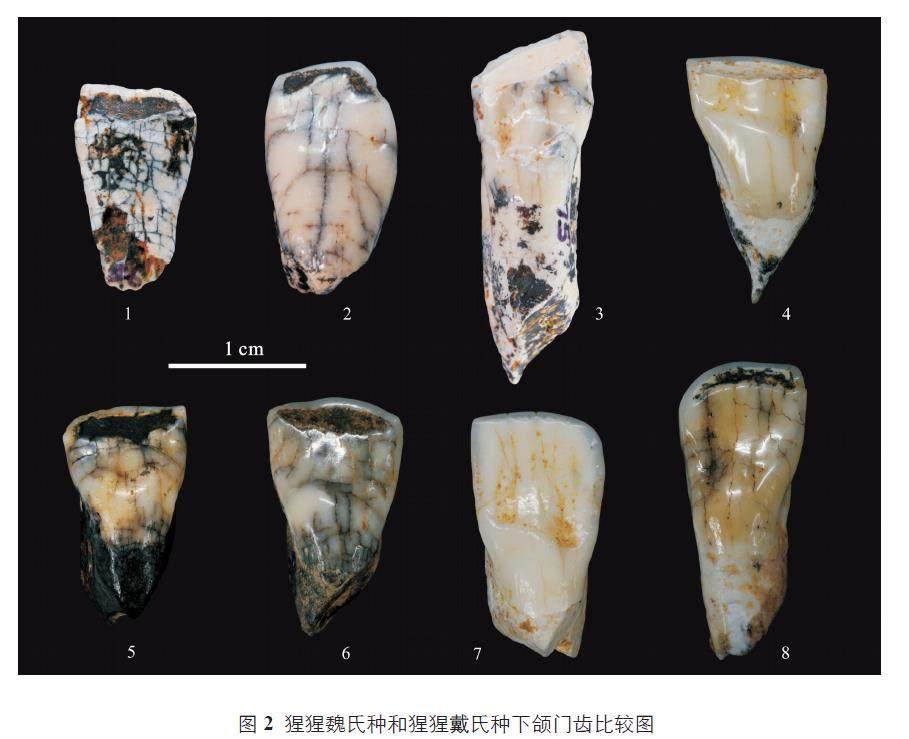
2021 年,Harrison 等进一步系统地研究了广西崇左地区的猩猩牙齿化石材料(800 多颗猩猩牙齿化石)[7]。研究结果表明,从早更新世到晚更新世,崇左地区的猩猩牙齿化石,只在整体的大小上逐渐变小,但是这些猩猩牙齿化石的典型特征并未发生改变。因此,Harrison 等将崇左地区发现的猩猩牙齿化石材料都归类到猩猩魏氏种(P. weidenreichi) 一个种,包括原先归类到猩猩戴氏种(P. devosi) 的晚更新世猩猩牙齿化石(图2)[7]。广西田东县感仙洞中更新世晚期猩猩牙齿化石支持Harrison 等将中更新世猩猩牙齿归入猩猩魏氏种(P. weidenreichi) 的观点[8]。
广西田东中山洞的猩猩牙齿进一步丰富了中国南方猩猩化石属种组成,即在中更新世晚期,中国南方可能存在猩猩戴氏种(P. devosi)[71]。中山洞的猩猩牙齿与猩猩魏氏种(P.weidenreichi) 和现生猩猩都存在较大差异。与猩猩魏氏种P. weidenreichi 相比,中山洞猩猩牙齿较小;猩猩魏氏种(P. weidenreichi) 门齿舌侧齿带发育程度低,而中山洞猩猩牙齿发育程度高;猩猩魏氏种(P. weidenreichi) 上颌臼齿舌侧齿带发育频率高(50%),中山洞猩猩牙齿发育频率低(31%);猩猩魏氏种(P. weidenreichi) 臼齿中等到重度褶皱发育频率低(54%),中山洞猩猩牙齿发育频率高(95%)。与此同时,中山洞猩猩牙齿整体上比现生猩猩大6.9%,上颌臼齿舌侧齿带发育频率比现生猩猩的高。
宜村洞的猩猩牙齿化石为研究中国南方晚更新世猩猩种群分类位置和系统发育状况提供了难得的材料[9]。从整体上来看,宜村洞猩猩牙齿尺寸主要分布在现生猩猩牙齿的偏大部分,有些牙齿大到甚至超过了现生猩猩的最大牙齿。宜村洞猩猩牙齿都比现生猩猩的平均值大,位于崇左地区早更新世百孔洞、巨猿洞和缺缺洞的猩猩牙齿大小范围之内。宜村洞猩猩牙齿要比该地区晚更新世的双坛洞、智人洞、岜仙洞和渠仔洞的大。因此,宜村洞猩猩牙齿代表了一个比该地区其他晚更新世猩猩种群牙齿更大的猩猩种群。另外,宜村洞猩猩种群还有一个典型特征是上颌和下颌臼齿上高出现率的齿带残留。除了M1 以外,在剩下的11 个臼齿上都发现了齿带残留。因此,宜村洞猩猩牙齿大小和咬合面特征与猩猩魏氏种(P. weidenreichi) 的相一致,可以被归类到猩猩魏氏种(P. weidenreichi)。宜村洞猩猩牙齿证据进一步支持Harrison 等在2021 年提出的猩猩魏氏种(P. weidenreichi) 在中国南方存活到晚更新世的观点[7]。
3.2 更新世猩猩牙齿大小演化
更新世以来猩猩牙齿大小的演化,一直是猩猩化石研究的重要领域之一。早在1935 年,裴文中就已经提出化石猩猩牙齿要比现生猩猩的大[10]。1948 年,Hooijer 比较了中国境内的化石猩猩、苏门答腊岛的化石猩猩和现生猩猩,提出猩猩从中更新世(0.5 MaBP) 开始,牙齿呈缩小变化趋势[69]。但是1959 年,Badoux 研究了Punung 晚更新世的化石猩猩,发现这些化石猩猩的牙齿位于现生猩猩的大小范围[48],并认为Hooijer 提出的猩猩牙齿从更新世到现在整体减小的观点可能不正确。1972 年,Kahlke 总结了我国及东南亚地区已报道的化石猩猩,支持Badoux 的观点[39]。
2001 年,在比较了中国、越南和苏门答腊岛的猩猩化石的大小之后,Cameron 等认为从整体上来看,从中更新世到现在猩猩牙齿有变小的趋势;但是,猩猩牙齿变小的趋势并不是严格按照时间序列逐渐变化[72]。2009 年,王翠斌等研究了我国华南地区192 颗猩猩牙齿,认为华南更新世猩猩牙齿、苏门答腊岛猩猩牙齿和现生猩猩牙齿,大小依次呈减小趋势[73]。2013 年,Ibrahim 等对马来西亚猩猩9 枚猩猩牙齿的大小研究后发现,晚更新世的Batu 洞的标本大于中更新世Badak 洞的猩猩牙齿。该研究结果进一步证实了Cameron 的观点[46]。2016 年,Tshen 等研究了早更新世到现在猩猩的分布情况,探讨不同地质年代和地理区域猩猩牙齿大小的差异,认为从早更新世到现在,猩猩牙齿总体上有减小的趋势,但不是随时间的推移而直线减小的,该结论与Cameron 和Yasamin 等的观点一致[47]。
近年来,中国南方新发现更新世不同时期的猩猩牙齿化石,特别是广西崇左地区的猩猩牙齿化石的发现进一步完善了更新世猩猩牙齿大小演化特征[6,7]。最新的研究表明,猩猩牙齿尺寸变小主要发生在中更新世,并且猩猩不同齿位牙齿尺寸可能经历了更复杂的演化过程[7,8]。
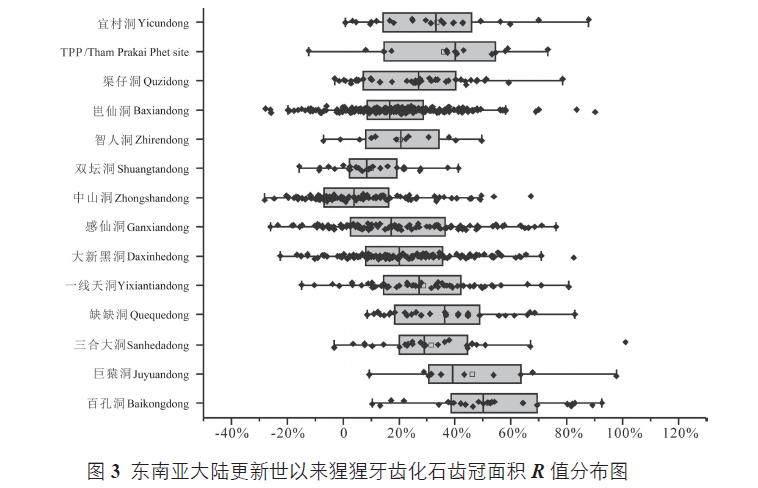
我们系统地收集了目前已经发表的东南亚大陆上猩猩牙齿的测量数据(图3)。基于同一个参考标准,即现生猩猩牙齿齿冠面积的平均值,我们计算了遗址中每一颗猩猩牙齿比现生猩猩对应齿位牙齿齿冠面积大的百分数R,计算公式为:
Ri=(Ai-Aextant)÷Aextant×100% (1)
其中,Ai 为化石猩猩齿冠面积,Aextant 为与化石猩猩对应齿位的齿冠面积。
图3 表示的是每一个遗址中猩猩牙齿R 值的分布情况。1)从整体上看,地质历史时期的猩猩牙齿要比现生猩猩的大,这个结果是与前人的研究结果相一致的;2)从早更新世到晚更新世,大陆上的猩猩牙齿可能经历了由大变小,再由小变大的过程;3)整体上,猩猩牙齿最小的情况出现在中更新世晚期,以中山洞遗址发现的猩猩牙齿为代表。当然,目前这只是一个初步的猩猩牙齿大小演化情况,需要进一步的工作来夯实,特别是各个遗址进一步精细的年代学工作。
3.3 猩猩牙齿大小演化与环境变化之间的关系
环境对现生猩猩种群的影响,是我们理解地质历史时期环境变化对化石猩猩影响的重要参考。苏门答腊岛的森林要比加里曼丹岛的森林生产力更高,主要体现在苏门答腊岛上有更高比例的结果实的树和更长的果实充足期[74-77]。现生猩猩的食物以果实为主,以树叶、嫩芽、树皮、花朵和昆虫等为辅,因此栖息地的生产力和水果的多寡会直接影响到猩猩种群[76]。栖息地的差异可能是现生苏门答腊和加里曼丹猩猩种群在种群密度[75,78-82]、头骨形态[83-85]、生殖策略和生活史[76,86,87] 等方面存在差异的主要因素。
更新世猩猩演化历史的各项研究指标中,牙齿大小是最容易测量的变量[6-8,15,33,69,73]。运用Harrison 提出的将现生猩猩作为参照标准[54],可以从整体上比较不同猩猩种群的牙齿大小变化。先前的研究表明,中国南方更新世猩猩牙齿经历了一个逐渐变小的过程[6-8]。从更大的区域来看,东南亚大陆上猩猩牙齿整体变小主要发生于早更新世中更新世之交。除此之外,中更新世猩猩种群中含有少量牙齿特别小的个体。在现生的除人类之外的灵长类中,牙齿大小与体质量成正相关关系;猩猩上颌和下颌牙齿与体质量之间的相关系数分别为0.84~0.95 和0.85~0.97[88,89]。假设地质历史时期的猩猩牙齿的大小也与体质量成正相关关系,那么就可以推断早更新世猩猩的体质量要比中更新世和晚更新世的重很多。与晚更新世的猩猩种群相比,中更新世的猩猩种群中有少量的猩猩个体,其牙齿是整个更新世以来最小的,也就是说其体质量也可能是最轻的。
我们系统地收集了东南亚大陆上更新世以来的哺乳动物化石碳同位素数据,并与猩猩种群牙齿大小比较发现,栖息地变化可能对猩猩种群的体质量产生了影响(图4)[9]。在以C3 植物为主的森林环境中,早更新世的猩猩种群从整体上来看具有较大的牙齿,也就是说整体上有较大的体质量。到了中更新世时,东南亚大陆上出现较多C4 植物为代表的稀树草原环境,环境的转变影响着猩猩种群的体质量变化即普遍降低,并出现了更新世体质量最轻的猩猩个体。从中更新世到晚更新世,森林环境的扩张可能影响了猩猩种群的体质量变化即整体上增加。
猩猩种群整体上体质量的变化与环境变化之间的关系表明,在更新世期间,树栖的猩猩种群可能受到了栖息地环境变化的影响[9]。地质历史时期栖息地环境变化与猩猩种群之间的关系,与现今苏门答腊岛和加里曼丹岛上对现生猩猩种群的实地研究结果相一致。
从苏门答腊岛到加里曼丹岛,自西向东,栖息地质量逐渐降低,猩猩种群中成年个体脑容量也呈逐渐降低的趋势;最东边的Pongo pygmaeus morio 成年个体的脑容量比大多数猩猩种群成年个体的小很多[85]。伴随着脑容量的降低,犬齿后部牙齿也变小,加里曼丹岛上婆罗洲猩猩(P. pygmaeus) 犬齿后部牙齿一般比苏门答腊岛上苏门答腊猩猩(P.abelii) 的小[72]。对加里曼丹岛上猩猩体质量的研究证明,栖息地的退化可能会导致成年个体体质量的下降[90]。最新的研究表明,研究的所有年龄—性别组中,包括发育成熟的雄性猩猩、处于发育停滞状态的雄性猩猩、成年雌性猩猩和幼年猩猩,在水果摄入量低的时期体质量都较轻[91]。因此,我们发现的栖息地变化对化石猩猩种群影响,与现生猩猩种群的研究结果相一致。猩猩种群的整体体质量大小与栖息地环境变化之间的关系表明,东南亚大陆上更新世时期树栖的猩猩种群可能深受其栖息地质量即栖息地中森林所占比例多少的影响(图4)。与现生猩猩种群中观察到的情况类似,森林环境的退化可能与地质历史时期猩猩种群整体体质量分布的变化存在关系。当然,目前得出的只是一个初步的结论,需要更多的研究来进一步验证。
3.4 展望
在更新世早期,猩猩最先出现在了东南亚大陆上。目前世界上最早的猩猩化石来自于广西崇左地区的百孔洞,这也是目前发现的最大猩猩牙齿化石。在中国南方,猩猩一直是大熊猫- 剑齿象动物群中的重要成员之一。在猩猩的演化历程中,大量与其伴生的哺乳动物逐渐走向了绝灭,主要包括巨猿、爪兽、丘齿鼷鹿、河猪、乳齿象、貘类和剑齿象,等等。猩猩最终也在东南亚大陆上绝迹了,而现生猩猩目前只生活在苏门答腊岛和加里曼丹岛上。猩猩在东南亚大陆上绝灭的时间也是学术界关注的焦点之一。最新的化石证据表明,在中国南方,猩猩至少存活到了大约距今6 万年前[9]。在越南和泰国等地,猩猩可能存活到了全新世[33]。目前对于东南亚大陆上猩猩绝灭事件的认识,只有来自于少数几个化石地点的证据。关于东南亚大陆上猩猩绝灭事件的精细时间、详细的过程及其原因,需要找寻更多的化石地点,以及做更多的年代学和古环境工作来证实。
2021 年,Harrison 等根据对800 多颗不同时期猩猩牙齿化石材料的研究发现,广西崇左猩猩牙齿的结构和形态在约200 万年的演化过程中未发生明显的变化[7]。崇左猩猩牙齿变化主要体现在牙齿逐渐变小上,且这种变小过程并未表现出明显的阶段性,因此,崇左地区更新世以来的猩猩牙齿都应该被归类到猩猩魏氏种(P. weidenreichi) 一个种[7],而不是先前认为的崇左地区早更新世和中更新世的猩猩牙齿归类到猩猩魏氏种(P. weidenreichi),而晚更新世的被归类到猩猩戴氏种(P. devosi)[6]。中国南方其他地区发现的猩猩牙齿化石都表现出比现生猩猩牙齿大的特征,也常被归类到猩猩魏氏种(P.weidenreichi)[8,9]。相对于其他哺乳动物化石来说,比如貘类、大熊猫等,在更新世的演化历程中被分为了几个不同的物种,但是从早更新世到晚更新世,整个中国南方绝大部分的猩猩牙齿都被归类到了猩猩魏氏种(P. weidenreichi)。这种分类方法可能掩盖了中国南方猩猩物种组成在空间上和时间序列上的多样性。加强化石的形态学研究,特别是猩猩牙本质面的形态学研究,可能会为更新世猩猩化石分类提供重要参考。同时,在形态学研究的基础上对猩猩牙齿开展遗传学研究工作,可能是解决这一科学问题的有效途径。
致谢:广西自然博物馆、广西民族博物馆、田东县博物馆和崇左市文物局相关同志参加了野外调查和发掘工作,审稿人在稿件修改过程中提出了宝贵的修改意见,作者在此一并表示衷心的感谢!
参考文献
[1] Groves CP. Primate Taxonomy[M]. Washington: Smithsonian Institution Press, 2001, 1-350
[2] Nater A, Mattle-Greminger MP, Nurcahyo A, et al. Morphometric, Behavioral, and Genomic Evidence for a New Orangutan Species[J]. Current Biology, 2017, 27: 3487-3498
[3] Goossens B, Chikhi L, Jalil MF, et al. Taxonomy, geographic variation and population genetics of Bornean and Sumatran orangutans[A]. In: Wich SA, Atmoko SS, Setia TM, et al(eds). Orangutans: Geographic Variation in Behavioral Ecology and Conservation[C]. New York: Oxford University Press, 2009, 363-401
[4] Xu XF, Arnason U. The mitochondrial DNA molecule of sumatran orangutan and a molecular proposal for two (Bornean and Sumatran) species of orangutan[J]. Journal of Molecular Evolution, 1996, 43: 431-437
[5] Bien M, Chia L. Cave and rock-shelter deposits in Yunnan[J]. Bulletin of the Geological Society of China, 1938, 18: 325-347
[6] Harrison T, Jin CZ, Zhang YQ, et al. Fossil Pongo from the Early Pleistocene Gigantopithecus fauna of Chongzuo, Guangxi,southern China[J]. Quaternary International, 2014, 354: 59-67
[7] Harrison T, Zhang Y, Yang L, et al. Evolutionary trend in dental size in fossil orangutans from the Pleistocene of Chongzuo,Guangxi, southern China[J]. Journal of Human Evolution, 2021, 161: 103090
[8] Liang H, Harrison T, Shao Q, et al. Middle Pleistocene Pongo from Ganxian Cave in southern China with implications for understanding dental size evolution in orangutans[J]. Journal of human evolution, 2023, 178: 103348
[9] Liao W, Harrison T, Yao Y, et al. Evidence for the latest fossil Pongo in southern China[J]. Journal of human evolution, 2022, 170: 103233
[10] Pei W. Fossil mammals from the Kwangsi caves[J]. Bulletin of the Geological Society of China, 1935, 14: 413-425
[11] Wang CB, Zhao LX, Jin CZ, et al. New discovery of Early Pleistocene orangutan fossils from Sanhe Cave in Chongzuo, Guangxi,southern China[J]. Quaternary International, 2014, 354: 68-74
[12] Wang W, Potts R, Baoyin Y, et al. Sequence of mammalian fossils, including hominoid teeth, from the Bubing Basin caves, South China[J]. Journal of Human Evolution, 2007, 52: 370-379
[13] 陈德珍,祁国琴.云南西畴人类化石及共生的哺乳动物群[J].古脊椎动物与古人类,1978, 16: 33-46
[14] 陈耿娇,王頠,莫进尤,等.广西田东雾云洞更新世脊椎动物群[J].古脊椎动物学报,2002, 40: 42-51
[15] 顾玉眠,黄万波,宋方义,等.两广部分地区猩猩化石的研究[J].人类学学报,1987, 6: 272-283
[16] 顾玉眠,王淑琴,张文定,等.广西洞穴调查报告[J].人类学学报,1986, 5: 198-199
[17] 顾玉珉,黄万波,陈大远,等.广东罗定更新世灵长类化石[J].古脊椎动物学报,1996, 34: 235-250
[18] 韩德芬.广西大新黑洞哺乳动物化石[J].古脊椎动物与古人类,1982, 20: 59-64
[19] 李有恒,吴茂霖,彭书琳,等.广西田东县祥周公社定模洞调查报告[J].人类学学报,1985, 4: 127-131
[20] 刘昌芝.粤北第四纪哺乳动物化石调查简报[J].古脊椎动物与古人类,1962, 6: 202-203
[21] 裴文中.广西柳城巨猿洞及其他山洞的第四纪哺乳动物[J].古脊椎动物与古人类,1962, 6: 211-218
[22] 宋方义,邱立诚,王令红.广东封开黄岩洞古人类文化遗址简讯[J].古脊椎动物与古人类,1981, 19: 85-86
[23] 吴茂霖,王令红,张银运,等.贵州桐梓发现的古人类化石及其文化遗物[J].古脊椎动物与古人类,1975, 13: 14-23
[24] 吴新智,越资奎,袁振新,等.广西东北地区调查简报[J].古脊椎动物与古人类,1962, 6: 408-414
[25] 张银运,王令红,董兴仁.广西巴马发现的巨猿牙齿化石[J].古脊椎动物与古人类,1975, 13: 148-153
[26] 张玉萍.广东肇庆更新世哺乳类化石[J].古脊椎动物与古人类,1959, 1: 141-144
[27] 赵凌霞,同号文,许春华,等.贵州毕节发现的巨猿牙齿化石及其意义[J].第四纪研究,2006, 26: 548-554
[28] 赵凌霞,王翠斌,金昌柱,等.广西崇左木榄山洞古人类遗址中发现的猩猩类牙齿化石及其分类演化意义[J].科学通报,2009, 54: 2920-2926
[29] 赵凌霞,张忠文,戴犁.贵州毕节团结乡麻窝口洞发现晚更新世猩猩化石[J].人类学学报,2009, 28: 191-200
[30] 周国兴.华南早期褐猿的分布与演化[J].北京自然博物馆研究报告,2002, 60: 71-87
[31] Ciochon R, Long VT, Larick R, et al. Dated co-occurrence of Homo erectus and Gigantopithecus from Tham Khuyen Cave,Vietnam[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93: 3016-3020
[32] Ciochon RL. Lang Trang Caves: a new Middle Pleistocene hominid site from northern Vietnam[J]. American Journal of Physical Anthropology, 1990, 81: 205
[33] Drawhorn GM. The systematics and paleodemography of fossil orangutans (genus Pongo)[D]. California: University of California Davis, 1995
[34] Olsen JW, Ciochon RL. A review of evidence for postulated Middle Pleistocene occupations in Vietnam[J]. Journal of Human Evolution, 1990, 19: 761-788
[35] Schwartz JH, Long VT, Cuong NL, et al. A diverse hominoid fauna from the Late Middle Pleistocene breccia cave of Tham Khuyen, Socialist Republic of Vietnam[J]. Anthropological papers of the Ameirican Museum of Natural History, 1994, 73: 1-11
[36] Schwartz JH, Long VT, Cuong NL, et al. A review of the Pleistocene hominoid fauna of the Socialist Republic of Vietnam (excluding Hylobatidae)[J]. Anthropological papers of the Ameirican Museum of Natural History, 1995, 76: 1-233
[37] Bacon AM, Demeter F, Tougard C, et al. The discovery of a Pleistocene fauna in karstic fills at Tam Hang in Laos: preliminary results[J]. Comptes Rendus Palevol, 2008, 7: 277-288
[38] Bacon AM, Duringer P, Antoine PO, et al. The Middle Pleistocene mammalian fauna from Tam Hang karstic deposit, northern Laos: New data and evolutionary hypothesis[J]. Quaternary International, 2011, 245: 315-332
[39] Kahlke H. A review of the Pleistocene history of the orang-utan (Pongo Lacépede 1799)[J]. Asian Perspectives, 1972, 15: 5-14
[40] Bacon AM, Duringer P, Westaway K, et al. Testing the savannah corridor hypothesis during MIS2: The Boh Dambang hyena site in southern Cambodia[J]. Quaternary International, 2018, 464: 417-439
[41] Filoux A, Wattanapituksakul A. The Late Pleistocene Orangutan from Tham Prakai Phet: New discoveries[J]. Annales De Paleontologie, 2019, 105: 287-293
[42] Filoux A, Wattanapituksakul A, Lespes C, et al. A Pleistocene mammal assemblage containing Ailuropoda and Pongo from Tham Prakai Phet cave, Chaiyaphum Province, Thailand[J]. Geobios, 2015, 48: 341-349
[43] Tougard C. Biogeography and migration routes of large mammal faunas in South-East Asia during the Late Middle Pleistocene:focus on the fossil and extant faunas from Thailand[J]. Palaeogeography Palaeoclimatology Palaeoecology, 2001, 168: 337-358
[44] Tougard C, Montuire S. Pleistocene paleoenvironmental reconstructions and mammalian evolution in South-East Asia: focus on fossil faunas from Thailand[J]. Quaternary Science Reviews, 2006, 25: 126-141
[45] Zeitoun V, Lenoble A, Laudet F, et al. The Cave of the Monk (Ban Fa Suai, Chiang Dao wildlife sanctuary, northern Thailand)[J].Quaternary International, 2010, 220: 160-173
[46] Ibrahim YK, Tshen LT, Westaway KE, et al. First discovery of Pleistocene orangutan (Pongo sp.) fossils in Peninsular Malaysia:Biogeographic and paleoenvironmental implications[J]. Journal of Human Evolution, 2013, 65: 770-797
[47] Tshen LT. Biogeographic distribution and metric dental variation of fossil and living orangutans (Pongo spp.)[J]. Primates, 2016, 57: 39-50
[48] Badoux D. Fossil mammals from two deposits at Punung (Java)[D]. Kemink: University of Utrecht, 1959
[49] De vos J. The Pongo faunas from Java and Sumatra and their significance for biostratigraphical and paleoecological interpretations[J]. Proceedings B, 1983, 86: 271-281
[50] Westaway KE, Morwood MJ, Roberts RG, et al. Age and biostratigraphic significance of the Punung Rainforest Fauna, East Java,Indonesia, and implications for Pongo and Homo[J]. Journal of Human Evolution, 2007, 53: 709-717
[51] Harrison T, Krigbaum J, Manser J. Primate biogeography and ecology on the Sunda Shelf Islands: a paleontological and zooarchaeological perspective[A]. In: Lehman SM, Fleagle JG, eds. Primate biogeography[C]. New York: Springer, 2006, 331-372
[52] Westaway KE, Louys J, Awe RD, et al. An early modern human presence in Sumatra 73,000-63,000 years ago[J]. Nature, 2017, 548: 322-325
[53] Harrison T. The palaeoecological context at Niah Cave, Sarawak: evidence from the primate fauna[J]. Bulletin of the Indo-Pacific Prehistory Association, 1996, 14: 90-100
[54] Harrison T. Archaeological and ecological implications of the primate fauna from prehistoric sites in Borneo[J]. Bulletin of the Indo-Pacific Prehistory Association, 2000, 20: 134-146
[55] Hooijer DA. The orang-utan in Niah Cave prehistory[J]. Sarawak Museum Journal, 1960, 9: 408-421
[56] Cai YJ, Qiang XK, Wang XL, et al. The age of human remains and associated fauna from Zhiren Cave in Guangxi, southern China[J]. Quaternary International, 2017, 434: 84-91
[57] Jin CZ, Wang Y, Deng CL, et al. Chronological sequence of the early Pleistocene Gigantopithecus faunas from cave sites in the Chongzuo, Zuojiang River area, South China[J]. Quaternary International, 2014, 354: 4-14
[58] Sun L, Deng C, Wang W, et al. Magnetostratigraphy of Plio-Pleistocene fossiliferous cave sediments in the Bubing Basin, southern China[J]. Quaternary Geochronology, 2017, 37: 68-81
[59] Sun L, Wang Y, Liu CC, et al. Magnetochronological sequence of the Early Pleistocene Gigantopithecus faunas in Chongzuo,Guangxi, southern China[J]. Quaternary International, 2014, 354: 15-23
[60] 邓成龙, 郝青振, 郭正堂,等.中国第四纪综合地层和时间框架[J].中国科学:地球科学,2019, 49: 330-352
[61] Shao Q, Bahain JJ, Wang W, et al. Coupled ESR and U-series dating of early Pleistocene Gigantopithecus faunas at Mohui and Sanhe Caves, Guangxi, southern China[J]. Quaternary Geochronology, 2015, 30: 524-528
[62] Shao Q, Wang W, Deng C, et al. ESR, U-series and paleomagnetic dating of Gigantopithecus fauna from Chuifeng Cave, Guangxi,southern China[J]. Quaternary Research, 2014, 82: 270-280
[63] Shao QF, Wang Y, Voinchet P, et al. U-series and ESR/U-series dating of the Stegodon-Ailuropoda fauna at Black Cave, Guangxi, southern China with implications for the timing of the extinction of Gigantopithecus blacki[J]. Quaternary International, 2017, 434: 65-74
[64] Wang Y, Jin CZ, Pan WS, et al. The Early Pleistocene Gigantopithecus-Sinomastodon fauna from Juyuan karst cave in Boyue Mountain, Guangxi, South China[J]. Quaternary International, 2017, 434: 4-16
[65] Liang H, Liao W, Shao Q, et al. New discovery of a late Middle Pleistocene mammalian fauna in Ganxian Cave, Southern China[J].Historical Biology, 2022, 10.1080/08912963.2022.2139180
[66] Liu W, Jin CZ, Zhang YQ, et al. Human remains from Zhirendong, South China, and modern human emergence in East Asia[J].Proceedings of the National Academy of Sciences of the United States of America, 2010, 107: 19201-19206
[67] Ge J, Deng C, Wang Y, et al. Climate-influenced cave deposition and human occupation during the Pleistocene in Zhiren Cave,southwest China[J]. Quaternary International, 2020, 559: 14-23
[68] 金昌柱,潘文石,张颖奇,等.广西崇左江州木榄山智人洞古人类遗址及其地质时代[J].科学通报,2009, 54: 2848-2856
[69] Hooijer DA. Prehistoric teeth of man and of the orang-utan from central Sumatra, with notes on the fossil orang-utan from Java and southern China[M]. Leiden: Zoologische Mededeelingen, 1948, 175-301
[70] Ho CK, Zhou GX, Swindler DR. Dental evolution of the orang-utan in China[J]. Human Evolution, 1995, 10: 249-269
[71] Liang H, Harrison T, Shao QF, et al. Evidence for the smallest fossil Pongo in southern China[J]. Submitted to Journal of Human Evolution
[72] Cameron DW. Morphometric evolutionary trends in the dental complex of Pongo[J]. Primates, 2001, 42: 253-266
[73] 王翠斌,赵凌霞,金昌柱,等.中国更新世猩猩类牙齿化石的测量研究及其分类学意义[J].人类学学报,2009, 28: 192-200
[74] Pandong J, Gumal M, Aton ZM, et al. Threats and lessons learned from past orangutan conservation strategies in Sarawak,Malaysia[J]. Biological Conservation, 2019, 234: 56-63
[75] Seaman DJI, Bernard H, Ancrenaz M, et al. Densities of Bornean orang-utans (Pongo pygmaeus morio) in heavily degraded forest and oil palm plantations in Sabah, Borneo[J]. American Journal of Primatology, 2019, 81: e23030
[76] Wich SA, de Vries H, Ancrenaz M, et al. Orangutan life history variation[A]. In: Wich SA, Atmoko SS, Setia TM, et al(eds).Orangutans: Geographic Variation in Behavioral Ecology and Conservation[C]. New York: Oxford University Press, 2009, 65-76
[77] Wich SA, Vogel ER, Larsen MD, et al. Forest Fruit Production Is Higher on Sumatra Than on Borneo[J]. Plos One, 2011, 6: e21278
[78] Husson SJ, Wich SA, Marshall AJ, et al. Orangutan distribution, density, abundance and impacts of disturbance[A]. In: Wich SA, Atmoko SS, Setia TM, et al(eds). Orangutans: Geographic Variation in Behavioral Ecology and Conservation[C]. New York: Oxford University Press, 2009, 77-96
[79] Morrogh-Bernard H, Husson S, Page SE, et al. Population status of the Bornean orang-utan (Pongo pygmaeus) in the Sebangau peat swamp forest, Central Kalimantan, Indonesia[J]. Biological Conservation, 2003, 110: 141-152
[80] Russon AE, Erman A, Dennis R. The population and distribution of orangutans (Pongo pygmaeus pygmaeus) in and around the Danau Sentarum Wildlife Reserve, West Kalimantan, Indonesia[J]. Biological Conservation, 2001, 97: 21-28
[81] van Schaik C, Priatna A, Priatna D. Population estimates and habitat preferences of orangutans based on line transects of nests[A].In: Nadler RD, Galdikas BF, Sheeran LK, et al(eds). The Neglected Ape[C]. New York: Plenum Press, 1995, 129-147
[82] Vogel ER, Harrison ME, Zulfa A, et al. Nutritional Differences between Two Orangutan Habitats: Implications for Population Density[J]. Plos One, 2015, 10: e0138612
[83] Taylor A. The functional signi?cance of variation in jaw form in orangutans: The African apes as an ecogeographic model[A]. In:Wich SA, Atmoko SS, Setia TM, et al(eds). Orangutans: Geographic Variation in Behavioral Ecology and Conservation[C]. New York: Oxford University Press, 2009, 15-32
[84] Taylor AB. Feeding behavior, diet, and the functional consequences of jaw form in orangutans, with implications for the evolution of Pongo[J]. Journal of Human Evolution, 2006, 50: 377-393
[85] Taylor AB, van Schaik CP. Variation in brain size and ecology in Pongo[J]. Journal of Human Evolution, 2007, 52: 59-71
[86] van Noordwijk MA, van Schaik CP. Development of ecological competence in Sumatran orangutans[J]. American Journal of Physical Anthropology, 2005, 127: 79-94
[87] Wich SA, Utami-Atmoko SS, Setia TM, et al. Life history of wild Sumatran orangutans (Pongo abelii)[J]. Journal of Human Evolution, 2004, 47: 385-398
[88] Conroy GC. Problems of body-weight estimation in fossil primates[J]. International Journal of Primatology, 1987, 8: 115-137
[89] Gingerich PD, Smith BH, Rosenberg K. Allometric scaling in the dentition of primates and prediction of body-weight from tooth size in fossils[J]. American Journal of Physical Anthropology, 1982, 58: 81-100
[90] Rayadin Y, Spehar SN. Body mass of wild bornean orangutans living in human-dominated landscapes: Implications for understanding their ecology and conservation[J]. American Journal of Physical Anthropology, 2015, 157: 339-346
[91] O'Connell CA, DiGiorgio AL, Ugarte AD, et al. Wild Bornean orangutans experience muscle catabolism during episodes of fruit scarcity[J]. Scientific Reports, 2021, 11: 10185
基金项目:国家自然科学基金(42002025);国家社科基金重大招标项目(20&ZD246)
