LncRNA FGD5.AS1靶向miR.16.5p/CREB1轴减轻缺氧/复氧诱导大鼠H9c2心肌细胞凋亡的机制研究
2024-06-24谢小芳赵展庆符妹垂
谢小芳 赵展庆 符妹垂
摘要 目的: 探究长链非编码RNA(LncRNA)FGD5反义RNA1(FGD5.AS1)对缺氧/复氧(H/R)诱导的大鼠H9c2心肌细胞凋亡的影响以及对微小RNA.16.5p/cAMP响应元件结合蛋白1(miR.16.5p/CREB1)轴的调节机制。 方法: 将H9c2细胞分为对照组和H/R组(缺氧6 h,复氧6 h),然后将H/R组细胞分别进行转染,分为oe.NC组、oe.FGD5.AS1组、oe.FGD5.AS1+miR.16.5p mimic.NC组、oe.FGD5.AS1+miR.16.5p mimic组。实时荧光定量逆转录聚合酶链式反应法(RT.qPCR)检测细胞中FGD5.AS1、miR.16.5p、CREB1的mRNA水平;蛋白免疫印迹(Western Blot)法测定裂解凋亡蛋白酶.3(cleaved Caspase.3)、B细胞淋巴瘤/白血病.2(Bcl.2) 和Bcl.2相关X蛋白(Bax)蛋白表达;CCK.8法测定细胞存活率;流式细胞术检测细胞凋亡率;双荧光素酶活性实验分别验证miR.16.5p 和FGD5.AS1、CREB1的靶向关系。 结果: 与对照组比较,H/R组细胞中FGD5.AS1和CREB1的mRNA水平、细胞存活率、Bcl.2蛋白表达降低( P <0.05),miR.16.5p mRNA水平、细胞凋亡率及cleaved Caspase.3、Bax蛋白表达升高( P <0.05);与H/R组和oe.NC组比较,转染过表达FGD5.AS1基因的H9c2细胞中FGD5.AS1和CREB1的mRNA水平、细胞存活率、Bcl.2蛋白表达增高,凋亡率及miR.16.5p、cleaved Caspase.3、Bax水平下降( P <0.05)。双荧光素酶活性实验验证了FGD5.AS1、CREB1均与miR.16.5p有结合位点。 结论: 过表达FGD5.AS1可能通过靶向下调miR.16.5p表达,上调CREB1表达,抑制H/R诱导的H9c2心肌细胞凋亡。
关键词 缺氧/复氧;FGD5反义RNA 1;微小RNA.16.5p/cAMP响应元件结合蛋白1轴;心肌细胞凋亡
doi: 10.12102/j.issn.1672.1349.2024.09.008
LncRNA FGD5.AS1 Targeting miR.16.5p/CREB1 Axis Alleviates Hypoxia/Reoxygenation Induced Apoptosis of Rat H9c2 Cardiomyocytes
XIE Xiaofang, ZHAO Zhanqing, FU Meichui
Hainan West Central Hospital, Danzhou 571700, Hainan, China
Corresponding Author FU Meichui, E.mail: fumeichui2022@163.com
Abstract Objective: To explore the effect of long non.coding RNA(LncRNA) FGD5 antisense RNA1(FGD5.AS1) on the apoptosis of rat H9c2 cardiomyocytes induced by hypoxia/reoxygenation(H/R) and the regulatory mechanism of microRNA.16.5p/cAMP response element.binding protein 1(miR.16.5p/CREB1) axis. Methods: H9c2 cardiomyocytes were divided into control group and H/R group(hypoxia for 6 h,reoxygenation for 6 h).H/R group cells were transfected separately,then divided into oe.NC group,oe.FGD5.AS1 group,oe.FGD5.AS1+miR.16.5p mimic.NC group,and oe.FGD5.AS1+miR.16.5p mimic group.Real.time fluorescence quantitative reverse transcription polymerase chain reaction(RT.qPCR) was used to detect the mRNA levels of FGD5.AS1,miR.16.5p and CREB1 in cells.The expression of cleaved Caspase.3,B.cell lymphoma/leukemia.2(Bcl.2) and Bcl.2 associated X protein(Bax) were measured by Western Blot.Cell survival rate was measured by CCK.8 method.The apoptosis rate was detected by flow cytometry.The targeting relationship between miR.16.5p mRNA,FGD5.AS1 and CREB1 was verified by double luciferase activity assay. Results: Compared with the control group,mRNA levels of FGD5.AS1 and CREB1,cell survival rate,and Bcl.2 protein expression in H/R group decreased( P <0.05),miR.16.5p mRNA levels,apoptosis rate,and cleaved Caspase.3 and Bax protein expressions increased( P <0.05).Compared with H/R group and oe.NC group,mRNA levels of FGD5.AS1 and CREB1,cell survival rate,Bcl.2 protein expression increased in H9c2 cells transfected with FGD5.AS1 gene overexpression,the apoptosis rate,levels of miR.16.5p,cleaved Caspase.3,and Bax decreased( P <0.05).Dual luciferase activity test verified that FGD5.AS1 and CREB1 had binding sites with miR.16.5p. Conclusion: Overexpression of FGD5.AS1 may inhibit H/R.induced apoptosis of H9c2 cardiomyocytes through targeted down.regulation of miR.16.5p expression and up.regulation of CREB1 expression.
Keywords hypoxia/reoxygenation; FGD5 antisense RNA 1; microRNA.16.5p/cAMP response element.binding protein 1 axis; myocardial cells apoptosis
心肌梗死(myocardial infarction,MI)是由于动脉壁上斑块形成导致心脏血流量减少引起的心脏病。心肌梗死有效的干预策略是缺血后再灌注,但再灌注会引起心肌缺血再灌注(I/R)损伤并可诱发氧化应激和炎性反应,进一步导致心肌细胞的凋亡和坏死 [1.2] 。因此,减少心肌细胞凋亡是心肌I/R损伤预防和治疗的关键。FGD5反义RNA 1(FGD5 antisense RNA 1,FGD5.AS1)是一种癌相关基因,也是急性心肌梗死发展中重要的长链非编码RNA(long non.coding RNA,lncRNA),可通过靶向微小RNA(miRNAs)来调节心肌I/R损伤后的心肌细胞凋亡 [3] 。miR.16.5p在心肌缺氧/复氧(hypoxia/reoxygenation,H/R)中表现为上调,且可以被lncRNA海绵化来调节H/R诱导的心肌细胞损伤 [4] 。环磷酸腺苷(cAMP)响应元件结合蛋白1(cAMP response element.binding protein 1,CREB1)是基因编码的关键转录因子,可以作为miRNA的功能靶标调节心肌梗死诱导的心肌细胞凋亡 [5] ,但其与miR.16.5p以及FGD5.AS1靶向关系的研究较少。因此,本研究基于miR.16.5p/CREB1轴探讨FGD5.AS1影响H/R诱导的心肌细胞凋亡的潜在机制。
1 材料与方法
1.1 细胞与主要试剂
大鼠H9c2心肌细胞购于中国科学院典型培养会 保藏委员会细胞库;过表达FGD5.AS1(oe.FGD5.AS1)、 miR.16.5p mimic、阴性对照oe.NC/miR.16.5p mimic.NC、 p.mirGLO.FGD5.AS1.WT/MUT、p.mirGLO.CREB1.WT/.MUT 质粒购于上海吉凯基因公司;Lipofectamine TM 3000转染试剂购于北京百奥创新科技有限公司;HiScriptⅡ一 步法实时荧光定量逆转录聚合酶链式反应法 (RT.qPCR)SYBR绿色染料试剂盒购于南京诺唯赞生物科技股份有限公司;膜联蛋白V.异硫氰酸荧光素/碘化丙啶(Annexin V.FITC/PI)细胞凋亡检测试剂盒购于北京富百科生物技术有限公司;裂解凋亡蛋白酶.3(cleaved Caspase.3)、B细胞淋巴瘤/白血病.2(Bcl.2)和Bcl.2相关X蛋白(Bax)一抗购于英国Abcam公司;细胞活性检测(CCK.8)试剂盒购于上海钰博生物科技有限公司;羊抗兔IgG(H&L)购于武汉艾美捷科技有限公司。
1.2 方法
1.2.1 细胞分组及处理
将大鼠H9c2细胞分为对照组和H/R组,对照组采用常规培养基培养,H/R组细胞先在缺氧培养箱中用不含血清的DMEM培养基培养6 h,再换成含10% 胎牛血清的DMEM培养基并在常氧培养箱中复氧 6 h [6] 。然后,将H/R组细胞按照Lipofectamine TM 3000转染试剂说明书进行转染,分为H/R组(缺氧6 h,复氧6 h)、oe.NC组(转染过表达FGD5.AS1阴性对 照)、oe.FGD5.AS1组(转染过表达FGD5.AS1)、 oe.FGD5.AS1+miR.16.5p mimic.NC组(共转染过表 达FGD5.AS1和miR.16.5p mimic阴性对照)、 oe.FGD5.AS1+miR.16.5p mimic组(共转染过表达FGD5.AS1和miR.16.5p mimic),48 h后分别提取各 组细胞的RNA,检测FGD5.AS1、miR.16.5p、CREB1 mRNA 表达情况,验证转染是否成功。
1.2.2 qRT.PCR测定FGD5.AS1、miR.16.5p和CREB1 mRNA表达
用Trizol从细胞中提取总RNA。采用HiScriptⅡ 一步法qRT.PCR SYBR绿色染料试剂盒进行RT.qPCR。 反应体系:Green Mix,10 μL;One Step SYBR Green Enzyme,1 μL;Forward Primer,0.4 μL;Reverse Primer,0.4 μL;RNA,1 μL;H 2O,7.2 μL。反应条件:95 ℃ 预变性30 s;95 ℃变性10 s,60 ℃退火30 s,40个循环。以甘油醛.3.磷酸脱氢酶(GAPDH)、U6为内参,采用2 -ΔΔCt 法计算目的基因的相对表达水平。引物序列见表1。
1.2.3 CCK.8测定细胞增殖活力
于96孔板(每孔5×10 3)每孔中所有培养细胞与10 mL CCK.8试剂在37 ℃下孵育2 h。用酶标仪在450 nm波长检测吸光值,并计算细胞存活率。
1.2.4 流式细胞术测定细胞凋亡
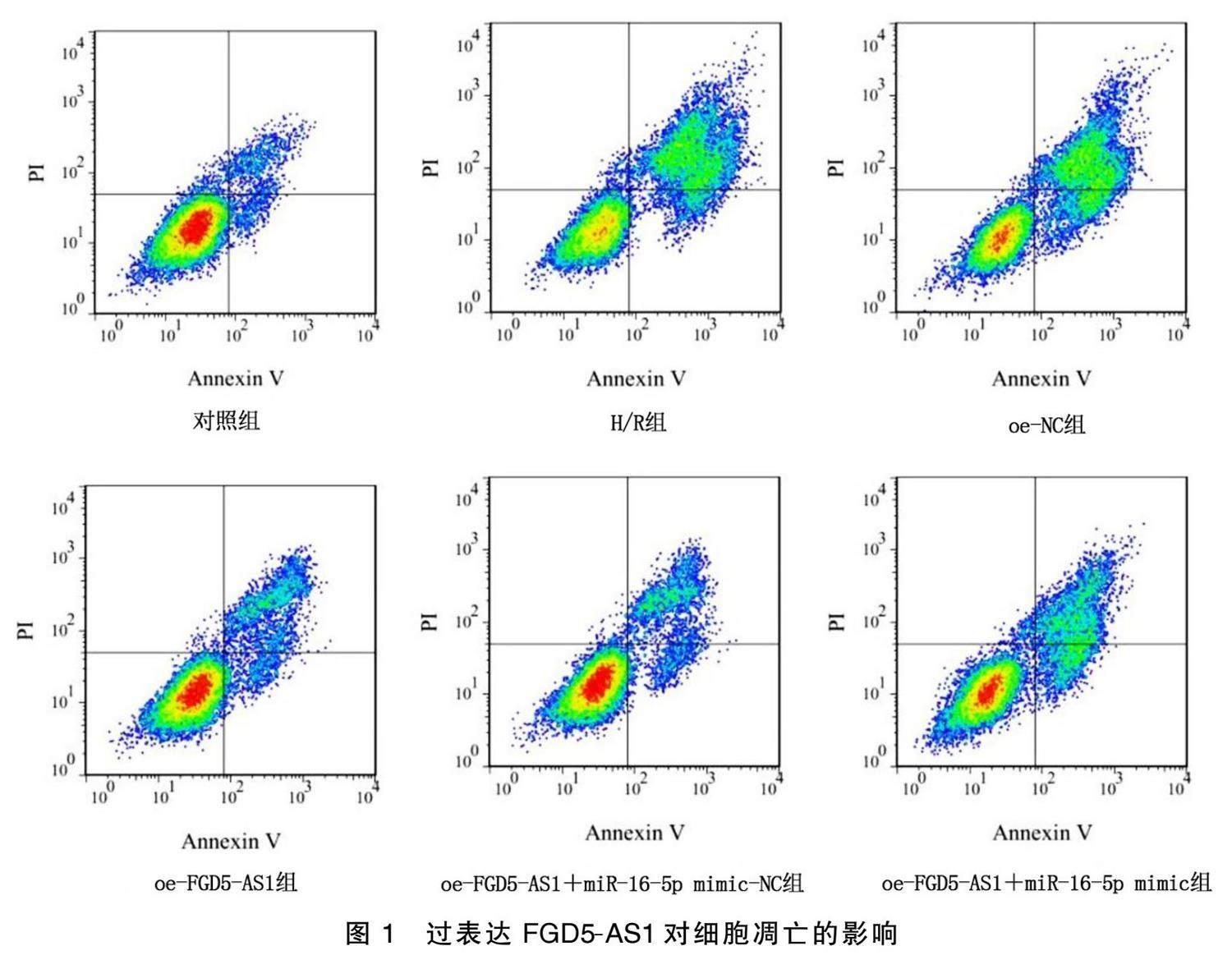
用磷酸缓冲盐溶液(PBS)洗涤处理过的细胞2次,并调整浓度至2×10 5个细胞/mL。取100 μL样品 (5×10 4个细胞)加入5 mL培养管,在管中分别加入 5 μL Annexin V.FITC和10 μL PI。将细胞轻轻旋转,在25 ℃黑暗中孵育20 min。每管加1×结合缓冲液500 μL。采用流式细胞仪立即对细胞进行分析。
1.2.5 蛋白免疫印迹(Western Blot)法测定Bax、cleaved Caspase.3、Bcl.2蛋白表达
用RIPA裂解液从H9c2细胞中提取总蛋白。蛋白样品用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS.PAGE)分离,并转移至聚偏二氟乙烯膜(PVDF)上。用5%脱脂牛奶阻断非特异性结合位点2 h。印迹用cleaved Caspase.3、Bax、Bcl.2一抗(1∶2 000)进行 探针检测。然后用辣根过氧化物酶(HRP)偶联的二抗 (1∶500)室温孵育1 h。用显色试剂孵育3~5 s。用Image J软件分析蛋白带,并归一化为甘油醛.3.磷酸脱氢酶(GAPDH)。
1.2.6 荧光素酶活性实验检测miR.16.5p与FGD5.AS1或CREB1 的靶向关系
StarBase数据库预测结果显示,miR.16.5p与 FGD5.AS1或CREB1存在结合位点。扩增FGD5.AS1和CREB1 片段,并将其插入到pmirGLO载体,建立FGD5.AS1野生型质粒(p.mirGLO.FGD5.AS1.WT)和CREB1野生型质粒(p.mirGLO.CREB1.WT)。然后通过基因突变技术将FGD5.AS1和CREB1突变,构建成FGD5.AS1突变型质粒(p.mirGLO.FGD5.AS1.MUT)和CREB1突变型质粒(p.mirGLO.CREB1.MUT)。将miR.16.5p mimic或miR.16.5p mimic.NC分别与相应的报告质粒共转染H9c2细胞。转染48 h后测定荧光酶活性。
1.3 统计学处理
采用GraphPad Prism 8.0软件进行数据分析。符合正态分布的定量资料以均数±标准差( x ± s )表示,采用单因素方差分析和SNK. q 检验。以 P <0.05为差异有统计学意义。
2 结 果
2.1 FGD5.AS1、miR.16.5p、CREB1在各组H9c2细胞中的mRNA表达
相较于对照组,H/R组FGD5.AS1 mRNA、CREB1 mRNA 表达下降,miR.16.5p mRNA表达增加( P < 0.05);与H/R组和oe.NC组比较,oe.FGD5.AS1组 FGD5.AS1 mRNA、CREB1 mRNA表达均升高, miR.16.5p mRNA表达降低( P <0.05);与oe.FGD5.AS1 和oe.FGD5.AS1+miR.16.5p mimic.NC 组比较, oe.FGD5.AS1+miR.16.5p mimic组FGD5.AS1 mRNA、CREB1 mRNA表达均降低,miR.16.5p mRNA表达升高( P <0.05)。详见表2。
2.2 过表达FGD5.AS1对细胞存活率和凋亡率的影响
H/R组与对照组比较,细胞存活率下降,凋亡率增高( P <0.05);oe.FGD5.AS1组与H/R组和oe.NC组 比较,存活率均增加,凋亡率均下降( P <0.05);与 oe.FGD5.AS1组和oe.FGD5.AS1+miR.16.5p mimic.NC组 比较,oe.FGD5.AS1+miR.16.5p mimic组细胞存活率均降低,凋亡率均升高( P <0.05)。详见图1、表3。
2.3 过表达FGD5.AS1对细胞中凋亡相关蛋白的影响
与对照组比较,H/R组Bax、cleaved Caspase.3 蛋白表达上调,Bcl.2蛋白表达下调( P <0.05);与H/R 组和oe.NC组比较,oe.FGD5.AS1组Bax、cleaved Caspase.3 蛋白表达下调,Bcl.2蛋白表达上调( P <0.05); 与 oe.FGD5.AS1组和oe.FGD5.AS1+miR.16.5p mimic.NC 组比较,oe.FGD5.AS1+miR.16.5p mimic组Bax、cleaved Caspase.3蛋白表达上调,Bcl.2蛋白表达下调( P <0.05)。详见图2、表4。
2.4 miR.16.5p与FGD5.AS1和CREB1之间的相互作用
StarBase数据库预测的miR.16.5p与FGD5.AS1、 CREB1的作用位点如图3所示。转染miR.16.5p mimic导致转染FGD5.AS1.WT或CREB1.WT的H9c2细胞荧光素酶活性下降( P <0.05),这种效应被FGD5.AS1或CREB1基因的突变所消除。详见图4、图5。
3 讨 论
冠状动脉的急性和持续性缺氧缺血会诱发心肌坏死,进而发生心肌梗死,最终导致心功能受损,并引起炎症反应、细胞凋亡等一系列生理活动 [7] 。因此,更好地了解参与心肌细胞凋亡的调节因子对研究治疗心肌梗死的新靶点至关重要。越来越多的证据表明,lncRNA已经在多种器官的I/R损伤中检测到lncRNA的异常表达。例如,lncRNA FGD5.AS1在急性心肌梗死病人和缺氧细胞中表达下调,而过表达FGD5.AS1增加了H/R处理的心肌细胞活性,降低了细胞凋 亡 [8.9] 。本研究结果发现,H/R组细胞中FGD5.AS1 mRNA 水平明显低于对照组,而与H/R组比较,oe.FGD5.AS1组细胞中FGD5.AS1 水平、细胞存活率升高,凋亡率下降,表明FGD5.AS1可加速H/R心肌细胞增殖,减轻凋亡,然而其分子机制仍需深入探讨。
目前,已经发现lncRNA可通过海绵化miRNAs,进一步调控相应靶基因的表达。miRNA作为关键的调节基因,可以与下游靶基因的3′.UTR结合以抑制靶基因表达 [10] 。已有研究发现,miR.16.5p可以通过靶向IRS1增加心肌细胞活力并抑制H/R心肌细胞凋亡 [11] 。CREB1是癌发生的相关因子,能够促进癌细胞的增殖并抑制凋亡,而另一项研究发现,CREB1通过激活miR.376a.3p可以促进心力衰竭大鼠的心脏功能恢复 [12.13] 。本研究结果显示,oe.FGD5.AS1组细胞中miR.16.5p mRNA水平降低,CREB1 mRNA水平升高。揭示了FGD5.AS1过表达可能下调miR.16.5p表达,上调CREB1表达。已知cleaved Caspase.3是细胞发生凋亡Caspase.3被切割活化形成的,促凋亡蛋白Bax和抑制凋亡蛋白Bcl.2作为Bcl.2家族成员,也 是细胞凋亡的关键标志物 [14.15] 。本研究结果发现, oe.FGD5.AS1组心肌细胞的凋亡率及cleaved Caspase.3、 Bax蛋白表达低于H/R组,细胞存活率和Bcl.2蛋白表达高于H/R组。而miR.16.5p mimic的恢复实验发现,FGD5.AS1过表达对心肌细胞凋亡的抑制作用被逆转,且StarBase数据库预测及荧光素酶报告基因实验均显示FGD5.AS1、CREB1与miR.16.5p之间均存在靶向关系,揭示了FGD5.AS1过表达抑制H/R诱导 的H9c2心肌细胞凋亡可能是通过靶向下调miR.16.5p 表达,上调CREB1表达实现的。
综上所述,FGD5.AS1过表达可通过靶向调控miR.16.5p/CREB1轴来抑制H/R诱导的H9c2心肌细胞凋亡,可能是心肌梗死等心血管疾病治疗的潜在靶点。然而,本研究未进行FGD5.AS1的敲低实验,缺乏对比,且分子机制研究不够深入,有待后续探讨。
参考文献:
[1] LIU X J, LV Y F,CUI W Z, et al. Icariin inhibits hypoxia/reoxygenation.induced ferroptosis of cardiomyocytes via regulation of the Nrf2/HO.1 signaling pathway[J].FEBS Open Bio,2021,11(11):2966.2976.
[2] HUANG Z Q, XU W,WU J L, et al. MicroRNA.374a protects against myocardial ischemia.reperfusion injury in mice by targeting the MAPK6 pathway[J].Life Sciences,2019,232:116619.
[3] CAI X Y, ZHANG P,WANG S, et al. lncRNA FGD5 antisense RNA 1 upregulates RORA to suppress hypoxic injury of human cardiomyocyte cells by inhibiting oxidative stress and apoptosis via miR.195[J].Molecular Medicine Reports,2020,22(6):4579.4588.
[4] GONG J, DOU L Q,ZHOU Y.Positive feedback loop of lncRNA SNHG1/miR.16.5p/GATA4 in the regulation of hypoxia/reoxygenation.induced cardiomyocyte injury[J].Molecular Medicine Reports,2022,25(1):28.
[5] YANG J B, LIU S W,WANG H, et al. MiR.134.5p inhibition reduces infarct.induced cardiomyocyte apoptosis via Creb1 upregulation[J].Journal of Stroke and Cerebrovascular Diseases,2020,29(8):104850.
[6] CONG L, SU Y S,WEI D Z, et al. Catechin relieves hypoxia/reoxygenation.induced myocardial cell apoptosis via down.regulating lncRNA MIAT[J].Journal of Cellular and Molecular Medicine,2020,24(3):2356.2368.
[7] WANG J H ,CHEN X,HUANG W.MicroRNA.369 attenuates hypoxia.induced cardiomyocyte apoptosis and inflammation via targeting TRPV3[J].Brazilian Journal of Medical and Biological Research,2021,54(3):e10550.
[8] CHEN Y Q, YANG X,XU W, et al. Knockdown of lncRNA TTTY15 alleviates myocardial ischemia.reperfusion injury through the miR.374a.5p/FOXO1 axis[J].IUBMB Life,2021,73(1):273.285.
[9] HAO L, WANG J,BI S J, et al. Upregulation of long noncoding RNA FGD5.AS1 ameliorates myocardial ischemia/reperfusion injury via microRNA.106a.5p and microRNA.106b.5p[J].Journal of Cardiovascular Pharmacology,2021,78(1):e45.e54.
[10] LIAO Z F ,CHEN Y L,DUAN C C, et al. Cardiac telocytes inhibit cardiac microvascular endothelial cell apoptosis through exosomal miRNA.21.5p.targeted cdip1 silencing to improve angiogenesis following myocardial infarction[J].Theranostics,2021,11(1):268.291.
[11] TORO R, PREZ.SERRA A,MANGAS A, et al. MiR.16.5p suppression protects human cardiomyocytes against endoplasmic reticulum and oxidative stress.induced injury[J].International Journal of Molecular Sciences,2022,23(3):1036.
[12] ZHANG C, WANG Q,ZHOU X W, et al. MicroRNA.138 modulates glioma cell growth,apoptosis and invasion through the suppression of the AKT/mTOR signalling pathway by targeting CREB1[J].Oncology Reports,2020,44(6):2559.2568.
[13] ZHANG T, GE J J.Mechanism of CREB1 in cardiac function of rats with heart failure via regulating the microRNA.376a.3p/TRAF6 axis[J].Mammalian Genome,2022,33(3):490.501.
[14] ESKANDARI E ,EAVES C J.Paradoxical roles of caspase.3 in regulating cell survival,proliferation,and tumorigenesis[J].The Journal of Cell Biology,2022,221(6):e202201159.
[15] VARDIYAN R ,EZATI D,ANVARI M, et al. Effect of L.carnitine on the expression of the apoptotic genes Bcl.2 and Bax[J].Clinical and Experimental Reproductive Medicine,2020,47(3):155.160.
(收稿日期:2022.11.28)
(本文编辑 邹丽)
