TET2重塑CXCR4 DNA甲基化对急性心肌梗死小鼠心肌组织自噬、炎症反应及凋亡的影响
2024-06-24毛山周明段班燕曹政李军
毛山 周明 段班燕 曹政 李军
摘要 目的: 探究急性心肌梗死(AMI)过程中内皮细胞 tet甲基胞嘧啶双加氧酶2(TET2)对趋化因子受体4(CXCR4)DNA甲基化的影响以及对AMI小鼠心肌组织自噬、炎症反应及组织细胞凋亡的影响机制,为临床探究AMI发展的分子机制提供理论依据。 方法: 8周龄雄性C57/BL6小鼠50只,制备AMI模型,尾部注射TET2、CXCR4过表达质粒;蛋白免疫印迹(Western Blot)法检测心肌组织TET2、CXCR4、微管相关蛋白3(LC3)、P62、B细胞淋巴瘤/白血病.2基因 (Bcl.2)关联X蛋白(Bax)、半胱氨酸蛋白酶3(Caspase.3)、 Bcl.2表达;甲基化检测CXCR4 DNA甲基化水平;酶联免疫吸附法(ELISA)检测心肌组织内炎性因子白细胞介素.6(IL.6)、肿瘤坏死因子.α(TNF.α)、白细胞介素.1β(IL.1β)水平;原位末端转移酶标记技术(TUNEL)检测各组心肌组织细胞凋亡指数。 结果: 与假手术组比较,模型组心肌组织内TET2、CXCR4均表达上调,TET2、CXCR4均在心肌组织内过表达,TET2过表达促进CXCR4表达,差异有统计学意义( P <0.05);与模型组比较,TET2 mimic组CXCR4启动子区域DNA甲基化程度降低,CXCR4蛋白表达升高,差异有统计学意义( P <0.05);与假手术组比较,模型组小鼠心肌组织自噬蛋白LC3、抑制细胞凋亡蛋白Bcl.2表达下调,炎性因子IL.6、TNF.α、IL.1β水平、自噬蛋白P62、促细胞凋亡蛋白Bax、cleaved Caspase.3表达上调,差异有统计学意义( P <0.05);TET2、CXCR4过表达进一步下调LC3、Bcl.2蛋白表达,上调炎性因子IL.6、TNF.α、IL.1β水平,P62、Bax、cleaved Caspase.3蛋白表达;TET2、CXCR4二者联合体现出最低LC3、Bcl.2蛋白表达,最高炎性因子IL.6、TNF.α、IL.1β水平以及P62、Bax、cleaved Caspase.3蛋白表达,差异有统计学意义( P <0.05)。 结论: AMI发展中,TET2通过降低CXCR4 DNA甲基化,促进CXCR4基因表达,进而抑制AMI小鼠心肌组织自噬,上调炎症反应及细胞凋亡程度,促进疾病发展。
关键词 急性心肌梗死;tet甲基胞嘧啶双加氧酶2;趋化因子受体4;DNA甲基化;自噬;炎症反应;凋亡
doi: 10.12102/j.issn.1672.1349.2024.09.007
Effects of CXCR4 DNA Methylation Remodeled by TET2 on Autophagy, Inflammation and Apoptosis of Myocardial Tissue in Mice with Acute Myocardial Infarction
MAO Shan, ZHOU Ming, DUAN Banyan, CAO Zheng, LI Jun
Taihe Hospital, Shiyan 442000, Hubei, China, E.mail: geshan2786397679@163.com
Abstract Objective: To explore the effect of tet methylcytosine dioxygenase 2(TET2) on DNA methylation of C.X.C motif receptor 4(CXCR4) during acute myocardial infarction(AMI),and the mechanism of its effect on myocardial autophagy,inflammation and apoptosis in AMI mice. Methods: Fifty 8.week.old male C57/BL6 mice AMI model were prepared,TET2 and CXCR4 overexpressing plasmids were injected into the tail.The expressions of TET2,CXCR4,microtubule associated protein 3(LC3),P62,B.cell lymphoma/leukemia.2 gene(Bcl.2) associated X protein(Bax),Caspase.3,and Bcl.2 in cardiac tissue were detected by Western Blot.The methylation level of CXCR4 DNA was detected.The levels of inflammatory factors interleukin.6(IL.6),tumor necrosis factor.α(TNF.α) and interleukin.1β(IL.1β) in myocardial tissue were detected by enzyme.linked immunosorbent assay(ELISA).Terminal deoxyribonucleotidyl transferase(TdT).mediated dUTP nick end labeling(TUNEL) was used to detect apoptosis index of myocardial tissue in each group. Results: Compared with sham operation group,the expressions of TET2 and CXCR4 up.regulated in myocardial tissue of model group,and both TET2 and CXCR4 overexpressed in myocardial tissue,and overexpression of TET2 promoted CXCR4 expression( P <0.05).Compared with model group,DNA methylation of CXCR4 promoter region decreased and CXCR4 protein expression increased in TET2 mimic group( P <0.05).Compared with sham operation group,expressions of autophagy protein LC3 and apoptosis inhibiting protein Bcl.2 down.regulated in myocardial tissue of mice in model group,and levels of inflammatory factors IL.6,TNF.α,IL.1β,autophagy protein P62,pro.apoptotic protein Bax,cleaved Caspase.3 up.regulated( P <0.05).Overexpression of TET2 and CXCR4 further down.regulated the expression of LC3 and Bcl.2 proteins,up.regulated the levels of inflammatory factors IL.6,TNF.α,IL.1β,and expression of P62,Bax,cleaved Caspase.3 proteins.TET2 and CXCR4 showed the lowest LC3 and Bcl.2 protein expression,the highest inflammatory factors IL.6,TNF.α,IL.1β levels,P62,Bax,cleaved Caspase.3 protein expression( P <0.05). Conclusion: In the development of AMI,TET2 can promote CXCR4 gene expression by reducing CXCR4 DNA methylation,thereby inhibiting myocardial autophagy in AMI mice,up.regulating inflammatory response and apoptosis,and promoting the development of the disease.
Keywords acute myocardial infarction; tet methylcytosine dioxygenase 2; C.X.C motif receptor 4; DNA methylation; autophagy; inflammatory response; apoptosis
急性心肌梗死(acute mycardial infarction,AMI)是临床上常见的心血管疾病之一,AMI起病较急,病死率高,病人预后差,一直是科研工作者研究的重大课题 之一 [1.2] 。心肌梗死后出现的组织损伤会迅速地激活免疫系统,产生炎症反应,梗死的心肌组织产生的促炎性因子如白细胞介素、肿瘤坏死因子等进一步激活白细胞整合素,从而吸引大量的炎性细胞进入到梗死区域。炎症反应是心脏修复的必经过程,可以促进梗死心肌组织的清除及心室重塑,然而过度的炎症反应又会加重组织的损伤,促进心肌细胞凋亡,影响心脏修复 [3.4] 。自噬在维持心脏正常结构和功能方面有重要作用,有效的自噬反应可促进心肌细胞对抗氧化应激性损伤,发挥保护作用,缺乏自噬或低效率的自噬可导致心脏扩大及心肌受损,进一步加重心肌细胞凋亡等。因此,心肌组织自噬、炎症反应、心肌细胞凋亡及趋化因子水平均为研究AMI作用机制的有效切入点 [5] 。
DNA甲基化、乙酰化、糖基化以及磷酸化等表观遗传学在诸多疾病的发生发展中发挥重要作用,调控基因表达,DNA的甲基化在AMI的病理机制中具有重要作用 [6.7] 。研究显示,趋化因子受体4(CXCR4)在炎症或损伤的组织中表达上调,同时可吸引免疫细胞到炎症组织参与炎症反应,目前关于CXCR4甲基化在AMI中的调控机制尚不清楚 [8.10] 。 tet甲基胞嘧啶双加氧酶2(tet methylcytosine dioxygenase 2,TET2)作为一种重要的表观遗传修饰酶,在抗感染炎症免疫应答及炎症消退过程中发挥重要作用 [11] 。病原体微生物入侵后,TET2在炎症免疫活化中被诱导升高,促进免疫细胞的分化扩增和免疫应答;炎症后期,可反馈性地抑制炎性因子的转录和分泌,促进炎症消退,所以,TET2是炎症类疾病重要的候选基因之一 [12.13] 。TET2在表观遗传学中的调控作用可观,可以通过基因的甲基化来调控下游靶向基因的表达,致广泛的DNA甲基化,进而对疾病发生发展过程起到调控作用。本研究探讨TET2对CXCR4 DNA甲基化及基因表达的影响,分析TET2/CXCR4轴对AMI小鼠心肌组织自噬、炎症反应及凋亡的影响机制。
1 材料与方法
1.1 实验对象
8周龄雄性C57/BL6小鼠50只,购自湖北省实验动物中心,实验动物许可证号:SCXK(鄂)2023.0089。术前小鼠均自由饮水、进食,分笼饲养,温度25~27 ℃及湿度40%~50%。
1.2 主要实验试剂
胎牛血清、胰蛋白酶购自上海钰博生物科技有限公司;甘油明胶封片剂、二喹啉甲酸(BCA)蛋白浓度测定盒、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS.PAGE)凝胶设备、电泳缓冲液、聚偏二氟乙烯(PVDF)膜、增强化学发光法(ECL)检测试剂盒等均购 自美国Gibco公司;白细胞介素(IL).6、肿瘤坏死因子.α (TNF.α)、IL.1β酶联免疫吸附法(euzymelinked immunosorbent assay,ELISA)试剂盒购自阿拉丁化学试剂有限公司;兔抗鼠TET2抗体、CXCR4抗体、兔抗鼠B细胞淋巴瘤/白血病.2(Bcl.2)相关X蛋白(Bax)、兔抗鼠Bcl.2、兔抗鼠cleaved 半胱氨酸蛋白酶.3(Caspase.3)、兔抗鼠微管相关蛋白3(LC3)抗体、兔抗鼠P62抗体、甘油醛.3.磷酸脱氢酶(GAPDH)抗体均购自美国ABC公司;辣根过氧化物酶(HRP)标记二抗购自上海碧云天有限公司;Lipofectamine2000、TET2、CXCR4模拟物及阴性对照均购自上海吉玛公司。
1.3 主要实验仪器
流式细胞仪、全自动生化检测仪、实时荧光定量聚合酶链式反应(RT.PCR)测试仪、RT.100酶标仪、Mini PRO 型电泳仪及转膜仪、电泳槽、凝胶成像系统、超净工作台、倒置显微镜均购自美国Beckman公司,台式高速离心机、微量可调节仪器等均购自美国Beckman公司;小动物呼吸机购自苏州化学设备有限公司。
1.4 实验分组
50只8周龄雄性C57/BL6小鼠按照随机数字表法将其分为假手术组、模型组、TET2 过表达质粒(mimic)组、CXCR4 mimic组、TET2+CXCR4 mimic组,每组10只。
1.5 AMI的建立 [14]
除假手术组外,各实验组小鼠连接心电图,气管插管,连接小动物呼吸机,通气,频率控制在150次/min,其呼气、吸气的时间比为5∶4;于左胸第3肋间或第4肋间开胸,暴露心脏,在左心耳与肺动脉圆锥间,以左冠状动脉主干为标志,采用8.0号缝线针穿刺结扎左前降支(LAD);观察小鼠心电图,以心电图Ⅱ导联出现ST段抬高及肉眼观察结扎区域以下组织变白等心肌缺血表现确定为结扎成功的标志;之后逐层关胸。假手术组小鼠只开胸,不结扎LAD。
1.6 药物干预
在AMI模型建立后,每天给予各组小鼠尾部静脉注射相应的TET2 mimic(5 μmol/L)、CXCR4 mimic(5 μmol/L);干预 周期为2周,术后处死小鼠,留取心肌组织用于后续实验。
1.7 ELISA检测炎性因子IL.6、TNF.α、IL.1β水平
收集小鼠心肌组织悬浮液20 μL,采用ELISA法在酶标仪于450 nm波长处检测IL.6、TNF.α、IL.1β因子水平。
1.8 DNA断裂的原位末端标记(TUNEL)检测细胞凋亡
在酶介导的作用下,采用荧光素化的dUTP标记与DNA断裂的3.OH末端,采用过氧化物酶连接到DNA的断点,加入荧光显色剂和4′,6.二脒基.2.苯基吲哚(DAPI)显色;于波长465~495 nm处在荧光显微镜下对心肌细胞的凋亡进行数据分析;根据相关数据分析,活细胞核呈弥散均匀荧光,出现细胞凋亡时,细胞核或细胞质内可见浓染致密的颗粒块状绿色荧光;最后计算心肌细胞平均凋亡指数(AI)。
1.9 CXCR4 DNA甲基化检测
重亚硫酸盐处理DNA后,未甲基化的细胞嘧啶变为尿嘧啶,而甲基化的胞嘧啶始终不变。由此设计两对甲基化特异性聚合酶链式反应(MSP)引物,通过在线甲基化软件分析确定CXCR4基因启动子与外显子区域存在多个CpG岛。CXCR4.MSP.M正向引物为5′.CTCCTGGACCTGGACCTGGGA.3′,反向引物为 5′.ACTGGGACCTGGACCTGGGAT.3′;CXCR4.MSP.U 正向引物为5′.ACTGGACCTGGACCTGGGAAT.3′,反向引物为5′.TCCTGGACCTGGGACCTGAATG.3′;引物序列由上海吉马公司合成。
取肾脏组织,制备组织悬浮液,采用Trizol法提取总RNA,采用紫外分光光度计测定RNA浓度,参照反转录试剂盒将RNA合成cDNA,严格按照RT.PCR检测试剂盒说明书的配置反应体系,将其置于实时荧光定量聚合酶链式反应(PCR)检测仪检测;RT.PCR反应条件为95 ℃预变性5 min,循环1次,95 ℃预变性15 s,60 ℃下退火60 s,72 ℃延伸30 s,循环40次,待PCR反应结束后亚硫酸盐转换DNA后再进行纯化。采用2 -ΔΔCt 法计算CXCR4 DNA甲基化的相对表达量。
1.10 蛋白免疫印迹(Western Blot)法检测相关蛋白表达
取材后加入放射免疫沉淀法裂解缓冲液(radio immunoprecipitation assay lysis buffer,RIPA)进行组织匀浆裂解,提取蛋白质,上样蛋白缓冲溶液,进行SDS.PAGE电泳分离蛋白,将检测蛋白转移到PVDF膜上,采用5%的脱脂牛奶封闭2.5 h,非离子型去污剂(TBST)清洗3次;将PVDF膜与一抗在5 ℃下孵育过夜,采用TBST清洗;PVDF膜与荧光二抗孵育1.5 h,经TBST清洗后采用红外成像系统进行扫描,采用Image软件进行灰度分析;其中一抗稀释比例为: TET2为1∶1 000,CXCR4为1∶1 000,Bax为1∶1 500, Bcl.2为1∶1 000,cleaved Caspase.3为1∶1 000,LC3为1∶1 500,P62为1∶1 500。
1.11 统计学处理
采用GraphPad Prism 8.0软件进行数据分析。符合正态分布的定量资料以均数±标准差( x ± s )表示,两组间比较采用 t 检验,多组间比较采用One.way ANOVA分析。以 P <0.05为差异有统计学意义。
2 结 果
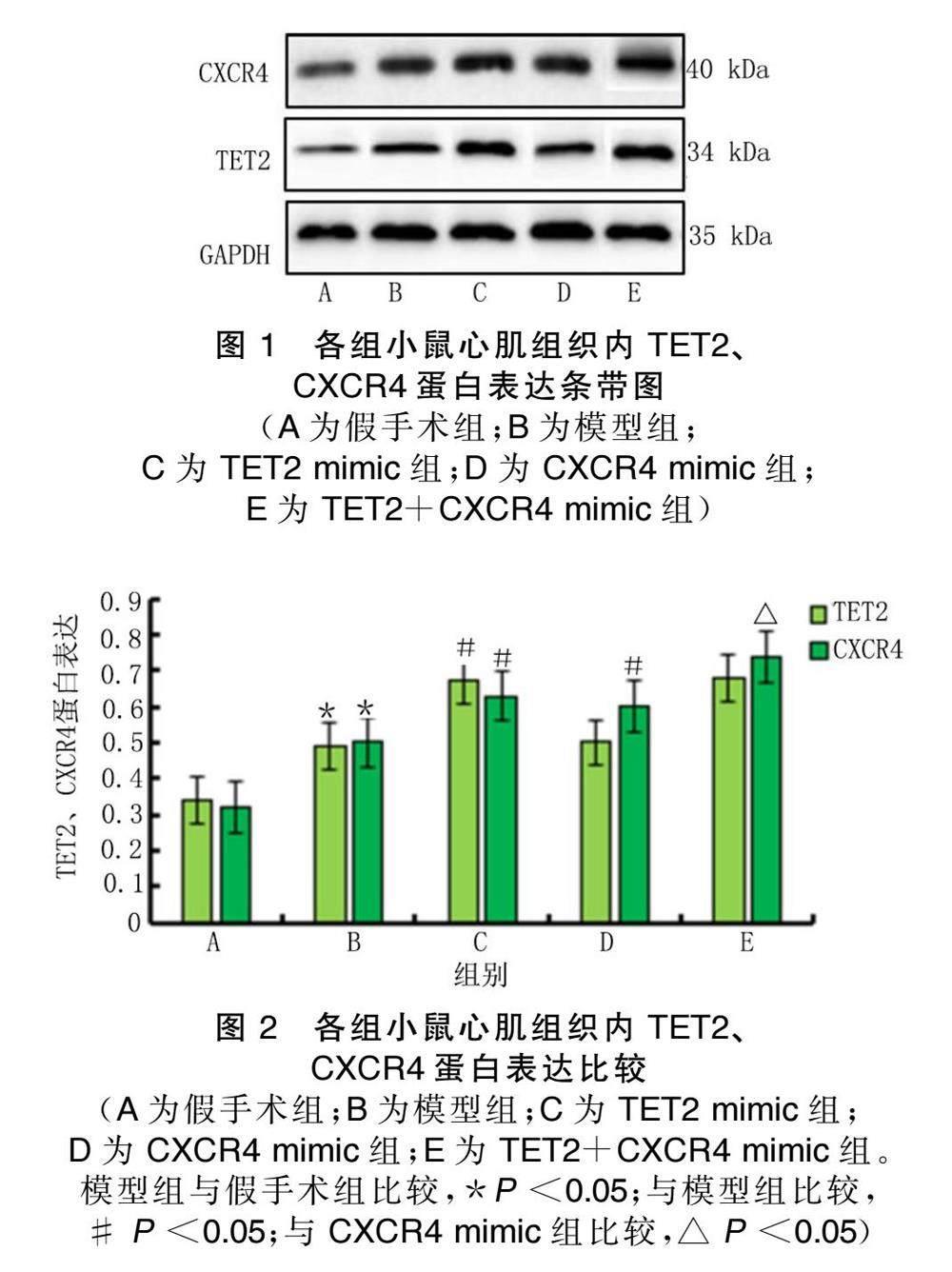
2.1 各组小鼠心肌组织内TET2、CXCR4蛋白表达比较
与假手术组比较,模型组小鼠心肌组织内TET2、CXCR4蛋白表达上调( P <0.05);TET2、CXCR4在心 肌组织内过表达,TET2过表达促进CXCR4表达 ( P <0.05)。详见图1、图2。
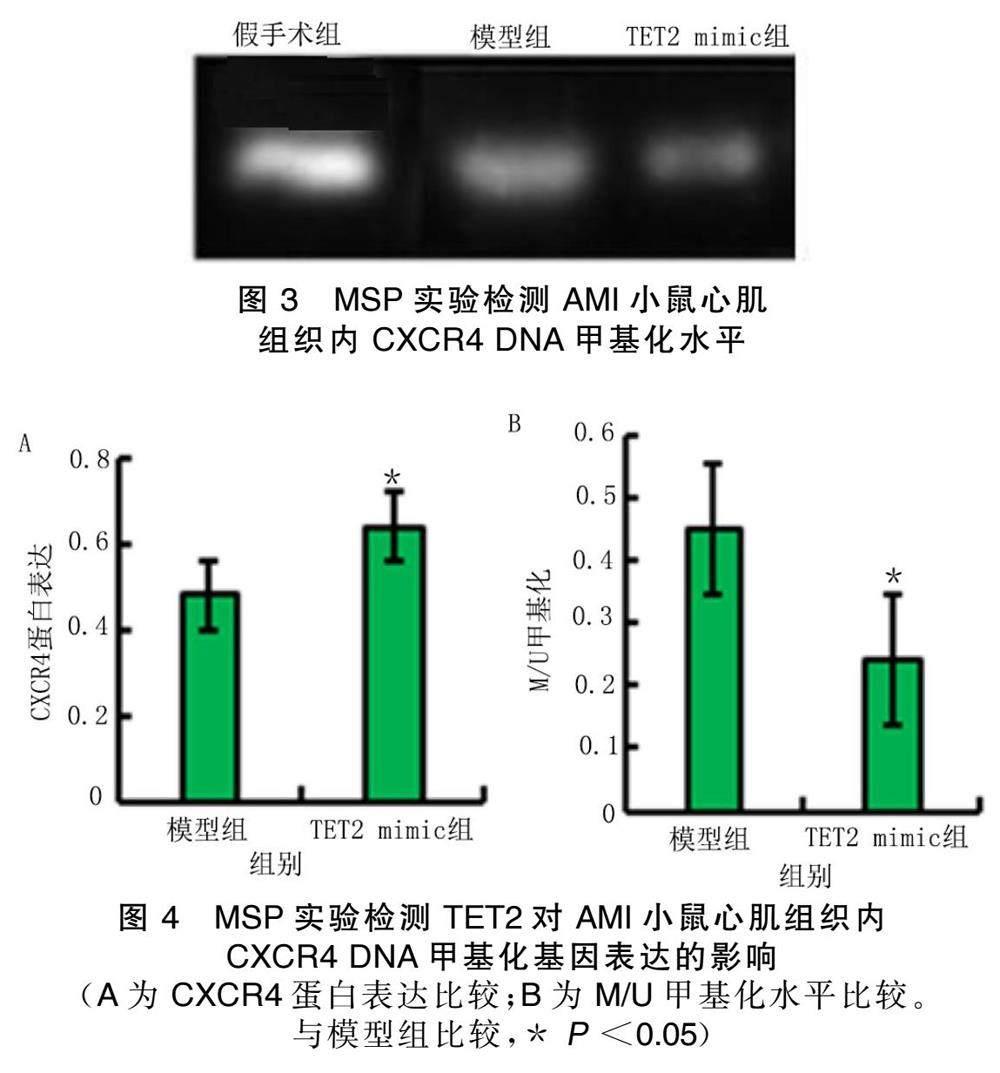
2.2 TET2重塑AMI小鼠心肌组织内CXCR4 DNA甲基化相对表达量
MSP实验显示,与模型组比较,TET2 mimic组CXCR4启动子区域DNA甲基化程度降低,CXCR4蛋白表达升高,差异有统计学意义( P <0.05)。详见图3、图4。
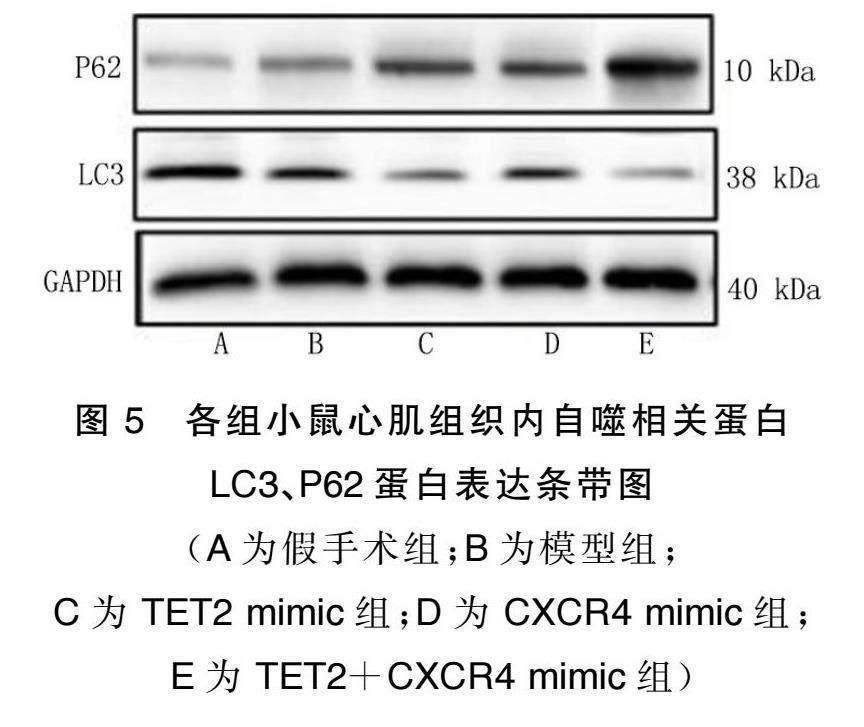
2.3 TET2重塑CXCR4 DNA甲基化对心肌组织自噬的影响
与假手术组比较,模型组小鼠心肌组织自噬蛋白 LC3表达下调,P62表达上调,差异有统计学意义( P < 0.05);TET2、CXCR4过表达下调LC3,上调P62,差异有统计学意义( P <0.05);TET2、CXCR4二者过表达进一步下调LC3表达,进一步上调P62表达,差异有统计学意义( P <0.05)。详见图5、图6。
2.4 TET2重塑CXCR4 DNA甲基化对心肌组织炎症反应的影响
与假手术组比较,模型组小鼠心肌组织炎性因子IL.6、TNF.α、IL.1β水平升高,差异有统计学意义( P <0.05);TET2、CXCR4过表达上调IL.6、TNF.α、IL.1β水平,差异有统计学意义( P <0.05);TET2、CXCR4二者过表达进一步上调IL.6、TNF.α、IL.1β因子水平,差异有统计学意义( P <0.05)。详见表1。
2.5 TET2重塑CXCR4 DNA甲基化对心肌组织凋亡的影响
2.5.1 细胞凋亡
与假手术组比较,模型组小鼠心肌组织凋亡指数上调,差异有统计学意义( P <0.05);TET2、CXCR4过 表达进一步上调凋亡指数,差异有统计学意义( P < 0.05);TET2、CXCR4二者过表达进一步提升心肌组织凋亡指数,差异有统计学意义( P <0.05)。详见图7、图8。
2.5.2 凋亡相关蛋白表达
与假手术组比较,模型组小鼠心肌组织内促凋亡 蛋白Bax、cleaved Caspase.3表达上调,抑凋亡蛋白Bcl.2表达下调,差异有统计学意义( P <0.05);与模型组比较,TET2、CXCR4过表达进一步上调Bax、cleaved Caspase.3表达,下调Bcl.2表达,差异有统计学意义( P <0.05);TET2、CXCR4二者过表达进一步提升心肌组织内Bax、cleaved Caspase.3表达,降低Bcl.2表达,差异有统计学意义( P <0.05)。详见图9、图10。
3 讨 论
心室重塑是导致机体心功能失代偿最为重要的机制,且多种因子参与心肌细胞的炎症、凋亡及自噬等过程 [15] 。心肌梗死后心室重塑的重要表现为心肌的纤维化和细胞凋亡,如何有效地减少心肌细胞凋亡,降低炎症反应,有效地控制心室重塑,仍然是临床治疗的难题之一,探索心肌梗死发生发展的有效靶点药物具有重要的意义 [16] 。目前,TET2已经被证实是维持胚胎纤维细胞多项功能的关键转录因子靶点,在多种组织中广泛表达 [17] 。TET2基因的多个突变位点与造血系统的恶性肿瘤发生发展密切相关;TET2基因突变与炎症反应的免疫调控密切相关,提示TET2可能参与心肌梗死发展及心室重塑的病理过程 [18.19] 。本研究对AMI小鼠进行TET2过表达慢病毒尾部注射处理,结果显示,TET2在AMI小鼠体内成功过表达,且TET2的过表达可明显促进AMI的病理发展过程,是AMI发展的促进性因子。
DNA甲基化是基因表达的调控方式之一,研究表明,TET家族可通过介导DNA甲基化表达来调控其基因的含量表达 [20] 。TET基因家族在胚胎发育过程中就与造血系统疾病、实体瘤的进展密切相关,同时在预后判断中发挥积极作用。然而,目前相关学者对TET家族基因调控的下游靶点以及关于TET基因家族自身表达的调控机制认识都相对局限,关于TET家族成员及其所介导的DNA甲基化在机体生长发育与疾病发生发展中的生物学机制尚需进一步研究 [21] 。CXCR4是G蛋白偶联受体家族的成员之一,与磷脂酰肌醇3激酶、核转录因子κB、活化的T细胞核转录因子、丝裂原活化蛋白激酶(MAPK)信号通路等密切相关 [22] 。CXCR4甲基化已经被证实可以充分参与到血液系统疾病中,同时与炎症免疫源性疾病的发展密切相关,尽管目前CXCR4 DNA的甲基化在诸多疾病中被相继报道,但是其在AMI发展过程中作用的报道较少 [23] 。基于此,本研究探讨了TET2重塑CXCR4 DNA甲基化的相关研究,结果显示,TET2基因的过表达可以促进CXCR4的表达,同时TET2过表达组CXCR4启动子区域DNA甲基化程度降低,CXCR4蛋白表达升高,提示TET2通过抑制CXCR4 DNA甲基化来升高CXCR4基因在AMI小鼠心肌组织中的表达,进而对其心室重塑的病理学特征进行调控。
AMI发生后,心肌组织周围会有IL.1β、TNF.α、IL.6 等炎性因子浸润,诱导炎性细胞的趋化性行为,进一步扩散至损伤的心肌组织。强烈的炎症反应可导致心肌组织细胞的凋亡加重,梗死区域面积扩大 [24] 。本研究结果显示,TET2、CXCR4过表达均可以进一步提高AMI小鼠心肌组织的炎症反应,IL.1β、TNF.α、IL.6水平明显升高,同时可以升高心肌组织细胞的凋亡能力,升高凋亡指数、促进凋亡蛋白Bax及cleaved Caspase.3蛋白的表达,提示TET2通过抑制CXCR4 DNA甲基化来促进AMI小鼠心肌组织炎症反应的程度,加重心肌组织细胞凋亡,促进疾病的发展。研究表明,自噬在维持机体心脏正常结构和功能方面具有重要作用,可充分降解自身受损细胞器和部分蛋白质等,进而可实现再循环利用 [25] 。有效的自噬作用可使心肌细胞应对外来损伤,在心肌梗死后心室重塑过程中起到保护作用。而缺乏自噬或降低效率的自噬均可进一步加重AMI后心室重塑现象,使其心功能进一步受损 [26] 。本研究结果显示,TET2、CXCR4过表达均可以降低心肌细胞的自噬能力,抑制LC3的表达,促进P62表达,提示TET2通过抑制CXCR4 DNA甲基化来抑制AMI小鼠心肌组织自噬程度,加重心肌组织细胞凋亡,促进疾病的发展。
综上所述,在AMI的发展过程中,TET2通过降低CXCR4 DNA甲基化,促进CXCR4基因表达,进而抑制AMI小鼠心肌组织自噬,上调炎症反应及细胞凋亡程度,促进疾病发展;TET2通过CXCR4 DNA甲基化在心肌梗死后心室重塑过程中发挥重要作用,有望从表观遗传的角度为治疗心肌梗死后心室重塑提供理论依据和药物作用靶点。
参考文献:
[1] 叶茂, 罗贵全,何小君,等.AMI患者血清miR.208、VEGF.B与左室重构及炎症反应的关系[J].心脑血管病防治,2020,20(2):152.155.
[2] 黄文彩, 蒋友明,范妤,等.AMI患者血清前白蛋白与炎症因子、血脂的相关性[J].现代医学,2019,47(1):78.80.
[3] 任勇, 刘海,徐果,等.两类型AMI患者临床、心功能及冠脉病变特点的差异[J].心血管康复医学杂志,2016,25(5):528.531.
[4] 张喜, 胡勇.心肌梗死(AMI)青年患者的临床特点及治疗[J].中国社区医师(医学专业),2012,14(16):66.67.
[5] MITSIS A, KADOGLOU N P E,LAMBADIARI V, et al. Prognostic role of inflammatory cytokines and novel adipokines in acute myocardial infarction:an updated and comprehensive review[J].Cytokine,2022,153:155848.
[6] MICHELUCCI E, ROCCHICCIOLI S,GAGGINI M, et al. Ceramides and cardiovascular risk factors,inflammatory parameters and left ventricular function in AMI patients[J].Biomedicines,2022,10(2):429.
[7] LUO X L, HU Y,SHEN J W, et al. Integrative analysis of DNA methylation and gene expression reveals key molecular signatures in acute myocardial infarction[J].Clinical Epigenetics,2022,14(1):46.
[8] AFANAS′EV S A ,MUSLIMOVA E F,REBROVA Т Y, et al. Peculiarities of the functional state of mitochondria of peripheral blood leukocytes in patients with acute myocardial infarction[J]. Bulletin of Experimental Biology and Medicine,2020,169(4):435.437.
[9] LI N,GUO X Y, ZHOU J, et al. Atorvastatin pretreatment ameliorates mesenchymal stem cell migration through miR.146a/CXCR4 signaling[J].Tissue Engineering and Regenerative Medicine, 2021,18(5):863.873.
[10] SONG Y L, JIANG H,JIANG N G, et al. Mesenchymal stem cell.platelet aggregates increased in the peripheral blood of patients with acute myocardial infarction and might depend on the stromal cell.derived factor 1/CXCR4 axis[J].Stem Cells and Development, 2019,28(24):1607.1619.
[11] 李佳珊, 关秀茹.体细胞基因突变在心血管疾病中的作用[J].生理科学进展,2022,53(3):195.199.
[12] 瓮佳旭, 仇鑫,李子孝.TET2突变相关不确定潜能的克隆性造血与卒中发生发展的研究进展[J].中国卒中杂志,2022,17(4):413.417.
[13] 胡颖楚, 胡豪畅,林少沂,等.DNA羟甲基化调控动脉粥样硬化的研究进展[J].遗传,2020,42(7):632.640.
[14] ZHANG Y J, HUA W J,DANG Y N, et al. Validated impacts of N6.methyladenosine methylated mRNAs on apoptosis and angiogenesis in myocardial infarction based on MeRIP.seq
analysis[J].Frontiers in Molecular Biosciences,2022,8:789923.
[15] 杨立慧, 丁伟平.核素显像技术与急性心梗后心室重构患者免疫炎性损伤关系研究[J].影像科学与光化学,2021,39(6):840.844.
[16] 李莉, 牛培,谭文长.大鼠心梗前后心肌纵向和周向应变与心室重构的相关性研究[J].医用生物力学,2019,34(S1):78.
[17] WU Y Z, JIANG T,HUA J H, et al. Integrated bioinformatics.based analysis of hub genes and the mechanism of immune infiltration associated with acute myocardial infarction[J].Frontiers in Cardiovascular Medicine,2022,9:831605.
[18] ZHAO W X, ZHANG C H,LI Y M, et al. The prognostic value of the interaction between ASXL1 and TET2 gene mutations in patients with chronic myelomonocytic leukemia:a meta.analysis[J].Hematology,2022,27(1):367.378.
[19] BAESSLER A, NOVIS C L,SHEN Z L, et al. Tet2 coordinates with Foxo1 and Runx1 to balance T follicular helper cell and T helper 1 cell differentiation[J].Science Advances,2022,8(24):eabm4982.
[20] KRUG A, TARI G,SAIDANE A, et al. Novel T follicular helper.like T.cell lymphoma therapies:from preclinical evaluation to clinical reality[J].Cancers,2022,14(10):2392.
[21] 李路安, 吴清蕊,李倩,等.DNA加双氧酶TET1在高压诱导心肌纤维化中的作用研究[J].中国药理学通报,2021,37(7):922.928.
[22] 彭娟, 唐志晗,任重,等.TET2参与ox.LDL对人脐静脉内皮细胞 CSE/H2S体系的调控作用[J].中国病理生理杂志,2015,31(10):1809.
[23] 陶冶, 徐明国.SDF.1α/CXCR4轴在心血管系统疾病中的研究进展[J].海南医学,2021,32(15):2007.2011.
[24] BNNER F, GASTL M,NIENHAUS F, et al. Regional analysis of inflammation and contractile function in reperfused acute myocardial infarction by in vivo 19F cardiovascular magnetic resonance in pigs[J].Basic Research in Cardiology,2022,117(1):21.
[25] JIANG Y C, LI X,XU H, et al. Tumour necrosis factor receptor.associated factors:interacting protein with forkhead.associated domain inhibition decreases inflammatory cell infiltration and cardiac remodelling after acute myocardial infarction[J]. Interactive Cardiovascular and Thoracic Surgery,2020,31(1):85.92.
[26] 金元媛, 洪思婷,刘越.线粒体自噬与心血管疾病[J].临床与病理杂志,2022,42(3):750.756.
(收稿日期:2022.10.29)
(本文编辑 邹丽)
