舒血宁注射液抑制线粒体过度分裂和凋亡减轻阿霉素诱导的心脏毒性的机制研究
2024-06-24荣卓邵静马素娟苗莹莹
荣卓 邵静 马素娟 苗莹莹

摘要 目的: 探讨舒血宁注射液对阿霉素诱导的心脏毒性的影响及可能机制。 方法: 48只Sprague.Dawley雄性大鼠随机分为空白 组、阿霉素组、舒血宁注射液低剂量组、舒血宁注射液高剂量组,每组12只。空白组腹腔注射生理盐水;阿霉素组腹腔注射阿霉素 2 mg/kg;舒血宁注射液低剂量组腹腔注射阿霉素2 mg/kg,同时腹腔注射1 mL/kg的舒血宁注射液;舒血宁注射液高剂量组腹腔注射阿霉素2 mg/kg,同时腹腔注射2 mL/kg的舒血宁注射液。每日干预1次,连续干预7 d,建立心脏损伤模型。检测各组大鼠血流 动力学指标,观察大鼠心肌组织的病理形态学变化,检测血清肌钙蛋白T(cTnT)含量及大鼠心肌组织B细胞淋巴瘤/白血病.2(Bcl.2)、 Bcl.2相关X蛋白(Bax)、剪切的半胱天冬氨酸蛋白酶3(cleaved Caspase.3)、Phospho.动力蛋白相关蛋白.1(Drp1)和视神经萎缩相关蛋白1(OPA1)的蛋白表达水平。 结果: 与空白组比较,阿霉素组大鼠心脏左室压力上升最大速率(+dp/dt max )和左室压力下降最 大速率(-dp/dt max )绝对值降低( P <0.01),部分心肌纤维断裂、排列紊乱,血清cTnT增加( P <0.01),cleaved Caspase.3、Bax、p.Drp1 蛋白表达增加( P <0.01),Bcl.2、OPA1蛋白表达降低( P <0.01)。与阿霉素组比较,经舒血宁注射液干预后,大鼠心脏功能和结构明显改善( P <0.01),血清cTnT水平降低( P <0.01),cleaved Caspase.3、Bax、p.Drp1表达减少( P <0.05或 P <0.01),Bcl.2、 OPA1表达增加( P <0.05或 P <0.01)。 结论: 舒血宁注射液可能通过抑制线粒体过度分裂和细胞凋亡减轻阿霉素诱导的心脏毒性。
关键词 心脏毒性;舒血宁注射液;阿霉素;凋亡
doi: 10.12102/j.issn.1672.1349.2024.09.006
Mechanism of Shuxuening Injection Inhibiting Excessive Mitochondrial Fission and Apoptosis Alleviating Doxorubicin.induced Cardiotoxicity
RONG Zhuo, SHAO Jing, MA Sujuan, MIAO Yingying
Sanquan College of Xinxiang Medical University, Xinxiang 453000, Henan, China
Corresponding Author SHAO Jing, E.mail: shaojing1390@163.com
Abstract Objective: To investigate the effect and possible mechanism of Shuxuening injection on doxorubicin.induced cardiotoxicity. Methods: Forty.eight Sprague.Dawley male rats were randomly divided into blank group,doxorubicin group,low.dose Shuxuening injection group and high.dose Shuxuening injection group,with 12 rats in each group.The blank group was intraperitoneally injected with normal saline,doxorubicin group was intraperitoneally injected with doxorubicin 2 mg/kg,low.dose Shuxuening injection group was intraperitoneally injected with doxorubicin 2 mg/kg and Shuxuening injection 1 mL/kg;high.dose Shuxuening injection group was intraperitoneally injected with doxorubicin 2 mg/kg and Shuxuening injection 2 mL/kg.The heart injury model was established after intervention once a day for 7 days.The hemodynamic indexes of rats in each group were detected.The pathological changes of myocardial tissue were observed.Serum troponin T(cTnT) and protein expression levels of B.cell lymphoma/leukemia.2(Bcl.2),Bcl.2 associated X protein(Bax),cleaved Caspase.3,phospho.dyne.associated protein.1(Drp1),and optic atrophy associated protein 1(OPA1) were detected. Results: Compared with the blank group,the maximum rate of left ventricular pressure rise(+dp/dt max ) and the absolute values of maximum rate of left ventricular pressure fall(-dp/dt max ) in the doxorubicin group decreased( P <0.01),muscle fibers were broken and arranged disorderly,the content of cTnT in serum increased( P <0.01),the protein expressions of cleaved Caspase.3,Bax and p.Drp1 increased( P <0.01),and the protein expressions of Bcl.2 and OPA1 decreased( P <0.01).Compared with the doxorubicin group,the cardiac function and structure of the rats in the Shuxuening injection group improved( P <0.01),the serum cTnT level decreased( P <0.01),and the expressions of cleaved Caspase.3,Bax and p.Drp1 decreased( P <0.05 or P <0.01),the expression of Bcl.2 and OPA1 increased( P <0.05 or P <0.01). Conclusion: Shuxuening injection may alleviate doxorubicin.induced cardiotoxicity by inhibiting excessive mitochondrial fission and apoptosis
Keywords cardiotoxicity; Shuxuening injection; doxorubicin; apoptosis
阿霉素是一种蒽环类药物,是较常用的抗癌化疗药物之一,自20世纪60年代末以来,广泛用于治疗包括白血病和淋巴瘤在内的恶性肿瘤疾病 [1.2] 。然而,阿霉素具有明显的进行性和不可逆转的心脏毒性副作用,会导致心肌细胞的丢失和充血性心力衰竭,因此,该药物的临床应用往往受到限制 [3] 。研究发现,根据累积剂量的不同,阿霉素的心脏毒性发生率为11%~18% [4] 。阿霉素致心脏毒性的具体发病机制尚未明确。研究表明,阿霉素引起的心脏毒性与DNA损伤、活性氧生成增加、自噬抑制、钙稳态紊乱和内质网介导的细胞凋亡有关 [5] 。尽管阿霉素心脏毒性涉及多种信号通路,但最终会激活细胞凋亡,导致心肌收缩功能的进行性丧失,最终出现心力衰竭 [6] 。因此,探讨阿霉素诱导心脏毒性的作用机制,并积极寻找可防治阿霉素致心脏毒性的药物对于阿霉素的临床应用至关重要。
在阿霉素治疗期间利用中草药和天然产物或其衍生物来减轻化疗引起的不良反应,能降低心脏毒性,提高病人存活率 [7] 。研究表明,在阿霉素治疗期间使用银杏叶提取物可通过减少心肌细胞的脂质过氧化减轻大鼠心肌病的发展 [8] 。舒血宁注射液是一种主要成分为银杏叶提取物的灭菌溶液,其有效成分主要为总黄酮苷和银杏内酯类物质,具有扩张血管、改善微循环、清除氧自由基和保护心肌组织的作用 [9] 。已有临床研究表明,舒血宁辅助化疗可减轻阿霉素引起的心脏毒性,但其作用机制尚不明确 [10] 。因此,本研究采用腹腔注射阿霉素的方式构建大鼠心肌损伤模型,探讨舒血宁注射液对阿霉素诱导的心脏毒性的保护作用及其相关机制。
1 材料与方法
1.1 实验动物
无特定病原体(SPF)级健康Sprague.Dawley雄性大鼠48只,6~8周龄,体质量180~220 g,购自郑州市惠济区华兴实验动物养殖场,动物许可证编号为SCXK(豫)2019.0002。饲养于河南中医药大学第一附属医院中心实验室SPF环境中,室温23~25 ℃,相对湿度50%~60%。动物实验经河南中医药大学第一附属医院动物伦理审查委员会批准,审核批号为YFYDW2020019。
1.2 药物与试剂
阿霉素(批号:D8740)购自北京索莱宝生物科技有限公司,舒血宁注射液(批号:Z11021350)购自北京华润高科天然药物有限公司,水合氯醛(货号:HG3.1004.76)购自天津市致远化学试剂有限公司,苏木精.伊红(HE)染色试剂盒(货号:G1120)购自北京索莱宝生物科技有限公司,大鼠心肌肌钙蛋白T(cTnT)酶联免疫吸附法(ELISA)测定试剂盒(货号:E.EL.R0151c)购自武汉伊莱瑞特生物科技股份有限公司,磷酸缓冲盐溶液(货号:G0002)、4′,6.二脒基.2.苯基吲哚(DAPI)(货号:G1012)、末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(TUNEL)试剂盒(货号:G1502)购自武汉赛维尔生物科技有限公司,视神经萎缩相关蛋白1(OPA1)多克隆抗体(货号:YN2976)、B细胞淋巴瘤/白血病.2(Bcl.2)多克隆抗体(货号:YT0470)、Bcl.2相关X蛋白(Bax)多克隆抗体(货号:YT0455)均购自美国Immunoway公司,剪切的半胱天冬氨酸蛋白酶3(cleaved Caspase.3)抗体(货号:ab2302)、5.单磷酸腺苷活化蛋白激酶(AMPK)抗体(货号:ab3760)购自Abcam公司;核因子E2相关因子2(Nrf2)抗体(货号:bs.2013)购自美国Affinity公司,Phospho.动力蛋白相关蛋白.1(Drp1)(Ser637)抗体(货号:4867S)购自美国Cell Signaling Technology公司,甘油醛.3.磷酸脱氢酶(GAPDH) 抗体(货号:GTX28245)购自美国GeneTex公司,辣根过氧化物酶(HRP)标记山羊抗兔二抗(货号:SA00001.2)、HRP标记山羊抗鼠二抗(货号:SA00001.1)均购自武汉三鹰生物技术有限公司。
1.3 实验仪器
PowerLab型多导生理记录仪(上海然哲仪器设备有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);Nikon Eclipse E100型正置光学显微镜(日本尼康公司);Multiskan GO型全波长酶标仪(美国Thermo公司);GNP.9080BS.Ⅲ型电热恒温培养箱(上海新苗医疗器械制造有限公司);D3024型高速离心机(北京大龙兴创实验仪器有限公司);KZ.Ⅲ.FP型低温高速研磨仪(-30 ℃)(武汉赛维尔生物科技有限公司);164.5050型电泳仪电源、Mini.PROTEAN型垂直电泳槽、Mini Trans.Blot型电泳转印仪(美国 BioRad公司);QuickChemi 5200型化学发光成像系统(武汉莫纳生物科技有限公司)。
1.4 实验方法
1.4.1 分组、造模与给药
将大鼠随机分为空白组、阿霉素组、舒血宁注射液低剂量组、舒血宁注射液高剂量组,每组12只。 空白组腹腔注射生理盐水;阿霉素组腹腔注射阿霉素2 mg/kg; 舒血宁注射液低剂量组腹腔注射阿霉素2 mg/kg,同时腹腔注射1 mL/kg的舒血宁注射液;舒血宁注射液 高剂量组腹腔注射阿霉素2 mg/kg,同时腹腔注射 2 mL/kg的舒血宁注射液。每日干预1次,连续干预7 d, 建立心脏损伤模型。模型建立的方法和药物浓度均参照文献[9,11]。
1.4.2 血流动力学指标的检测
各组大鼠药物干预7 d后,使用10%水合氯醛 3 mL/kg腹腔注射麻醉大鼠,结扎颈动脉远端,插入套管,连接多导生理记录仪,测量并记录大鼠血流动力学指标左室压力上升最大速率(+dp/dt max )和左室压力下降最大速率(-dp/dt max )。
1.4.3 ELISA检测血清生化指标
各组大鼠药物干预7 d后,使用10%水合氯醛3 mL/kg腹腔注射麻醉大鼠,腹主动脉采血,室温下放置 30 min,3 000 r/min离心15 min。收集血清,于-80 ℃ 下保存。根据相关试剂盒操作说明,ELISA法检测cTnT指标。
1.4.4 心肌组织HE染色观察大鼠心肌组织形态变化
各组大鼠药物干预7 d后,使用10%水合氯醛 3 mL/kg腹腔注射麻醉大鼠,快速取出心脏,放入提前预冷的磷酸缓冲盐溶液中冲洗干净,并立即在4%多聚甲醛组织固定剂中固定48 h。将样品脱水,常规石蜡包埋切片后进行HE染色,普通光学显微镜下观察。
1.4.5 TUNEL检测心肌细胞凋亡
制备大鼠缺血心肌组织石蜡切片,按照TUNEL试剂盒操作说明步骤进行,使用荧光显微镜下进行拍摄。经过Image J软件分析,计算细胞凋亡率。细胞凋亡指数=凋亡细胞数/细胞总数×100%。
1.4.6 蛋白免疫印迹(Western Blot)法检测心肌组织Bcl.2、Bax、cleaved Caspase.3、p.Drp1和OPA1蛋白的表达
取适量心肌组织,剪碎后匀浆裂解取上清液,二喹啉甲酸法(BCA)测定总蛋白浓度后,样品蛋白变性,收入-20 ℃冰箱保存备用。取各组蛋白经凝胶电泳分离后,聚偏二氟乙烯(PVDF)转膜,浸入5%脱脂奶粉封闭液中,加一抗(cleaved Caspase.3、Bax、p.Drp1、Bcl.2和OPA1一抗的稀释比例为1∶1 000,GAPDH一抗的稀释比例为1∶10 000)4 ℃孵育摇床过夜,洗膜3次后将二抗(稀释比例为1∶5 000)加入孵育槽中,放置摇床上慢摇,室温下孵育1 h。洗膜后加显影液平铺于凝胶扫描仪下,根据不同的发光强度调整曝光条件显影。扫描存档后,用Image J软件对目的条带进行定量分析。
1.5 统计学处理
采用SPSS 19.0软件进行数据分析。符合正态分布的定量资料以均数±标准差( x ± s )表示,组间比较采用单因素方差分析,两两比较采用LSD. t 检验。以 P <0.05为差异有统计学意义。
2 结 果
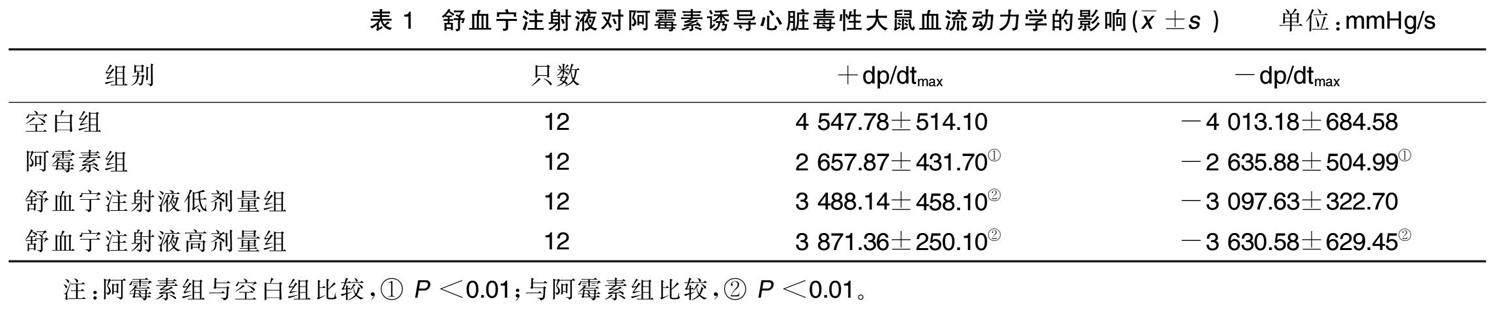
2.1 舒血宁注射液对阿霉素诱导心脏毒性大鼠血流动力学的影响
与空白组比较,阿霉素组+dp/dt max 和-dP/dt max 绝对值降低( P <0.01);与阿霉素组比较,舒血宁注射液低剂量组、舒血宁注射液高剂量组+dp/dt max 升高,舒 血宁注射液高剂量组-dp/dt max 绝对值升高( P < 0.01)。详见表1。
2.2 舒血宁注射液对阿霉素诱导心脏毒性大鼠心肌病理形态损伤的影响
与空白组比较,阿霉素组大鼠部分心肌纤维断裂、排列紊乱;与阿霉素组比较,舒血宁注射液低剂量组、舒血宁注射液高剂量组大鼠心肌组织病理损伤均有所减轻,舒血宁注射液高剂量组较舒血宁注射液低剂量组更加显著。详见图1。
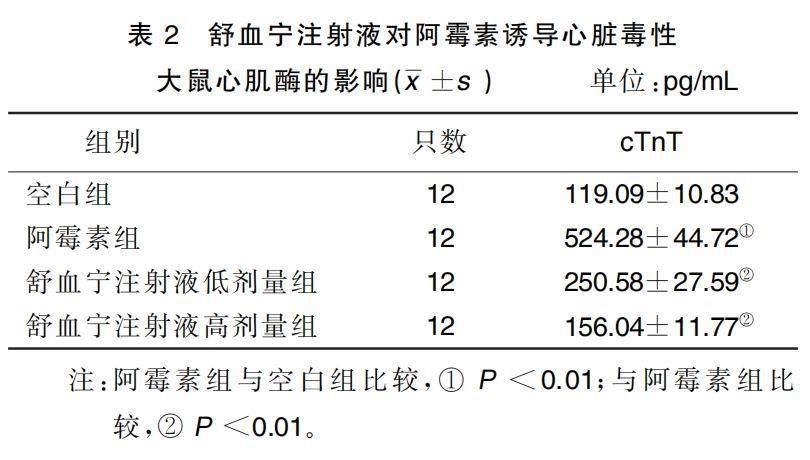
2.3 舒血宁注射液对阿霉素诱导心脏毒性大鼠心肌酶的影响
与空白组比较,阿霉素组大鼠血清cTnT水平升高( P <0.01);与阿霉素组比较,舒血宁注射液低剂量组、舒血宁注射液高剂量组大鼠血清cTnT水平降低( P <0.01)。详见表2。
2.4 舒血宁注射液对阿霉素诱导心脏毒性大鼠心肌细胞凋亡的影响
与空白组比较,阿霉素组大鼠心肌细胞凋亡率升高( P <0.01);与阿霉素组比较,舒血宁注射液低剂量组、舒血宁注射液高剂量组心肌细胞凋亡率显著降低( P <0.01)。详见图2、表3。
2.5 舒血宁注射液对阿霉素诱导心脏毒性大鼠心肌组织凋亡相关蛋白表达的影响
与空白组比较,阿霉素组大鼠cleaved Caspase.3和Bax蛋白表达增加( P <0.01),Bcl.2蛋白表达减少( P <0.01);与阿霉素组比较,舒血宁注射液低剂量组Bax蛋白表达减少,Bcl.2蛋白表达增加( P <0.05);与阿霉素组比较,舒血宁注射液高剂量组大鼠cleaved Caspase.3和Bax蛋白表达减少( P <0.01),Bcl.2蛋白表达增加( P <0.01)。详见图3、表4。
2.6 舒血宁注射液对阿霉素诱导心脏毒性大鼠心肌组织中线粒体分裂融合相关蛋白表达的影响
与空白组比较,阿霉素组大鼠p.Drp1蛋白表达增加,OPA1蛋白表达减少( P <0.01);与阿霉素组比较,舒血宁注射液低剂量组、舒血宁注射液高剂量组大鼠p.Drp1蛋白表达减少( P <0.05或 P <0.01),OPA1 蛋白表达增加( P <0.05或 P <0.01)。详见图4、表5。
3 讨 论
癌症是全身性疾病,其高发病率和高死亡率给社会带来了巨大的经济负担。阿霉素是一种高效的抗肿瘤化疗药物。然而,由于阿霉素具有严重的剂量依赖性心脏毒性副作用,因此被视为一把双刃剑 [12] 。阿霉素的毒性造成心肌细胞损伤,最终导致病理性心肌病。心脏毒性已成为阿霉素治疗的主要副作用,超过30%的病人在阿霉素化疗后5年内受到了心脏毒性的影响 [13] 。尽管在过去的几十年中进行了广泛的研究来解释阿霉素心脏毒性的分子机制,但是到目前为止,临床上还没有有效的预防或治疗措施。银杏叶的主要成分黄酮和萜类化合物(如银杏内酯B)具有较高的抗氧化活性 [14] 。舒血宁注射液是一种主要成分为银杏叶提取物的灭菌溶液,临床上被应用于治疗脑栓塞、脑血管痉挛、动脉粥样硬化、冠心病、心绞痛等疾病 [15] 。
血流动力学是评价心脏功能的重要指标。本研究通过大鼠腹腔注射阿霉素后发现,与空白组比较,阿霉素组大鼠心脏+dp/dt max 和-dp/dt max 绝对值降低,说明阿霉素能够造成心脏功能障碍;经过舒血宁注射液干预后,大鼠+dp/dt max 和-dp/dt max 绝对值提高,说明舒血宁注射液能够改善阿霉素造成的心脏功能障碍。同时,通过对心肌组织的HE染色发现,阿霉素组大鼠心肌组织结构模糊,心肌纤维形态紊乱、断裂,部分细胞核消失;而舒血宁注射液能够有效减轻阿霉素心脏毒性大鼠心肌组织病理损伤。心肌酶cTnT值能够反映心肌细胞受损程度。本研究发现,舒血宁注射液能够显著降低阿霉素心肌损伤后血清cTnT含量。这些结果证明舒血宁注射液能改善阿霉素诱导的心脏毒性,具有一定的心肌保护作用。
越来越多的证据表明,凋亡通路的过度激活是阿 霉素诱发心脏毒性的重要病理生理机制 [16] 。Bax、Bcl.2 和半胱氨酸蛋白酶.3(Caspase.3)是细胞凋亡过程中的关键分子。抗凋亡成员Bcl.2抑制细胞凋亡,促凋亡成员Bax与Bcl.2结合形成复合体,促进Bcl.2的降解,从而缓解Bcl.2对细胞凋亡的抑制作用。cleaved Caspase.3是细胞凋亡的关键执行因子,可降解DNA复制相关蛋白、凋亡抑制蛋白和细胞骨架蛋白等,从而促进细胞凋亡 [17] 。本实验通过TUNEL法检测显示,与空白组比较,阿霉素组大鼠心肌细胞凋亡率明显增加,舒血宁注射液能够有效降低心肌细胞凋亡率。本研究通过分离大鼠心肌,并进行Western Blot分析和定量,结果证实阿霉素组大鼠心肌中Bcl.2的表达明显减少,而Bax和cleaved Caspase.3的表达明显增加,与阿霉素组大鼠心肌细胞凋亡率升高相一致,表明阿霉素致心脏毒性大鼠存在心肌细胞凋亡的过度激活。给予舒血宁注射液干预后,大鼠心肌Bcl.2的表达明显增加,而Bax和cleaved Caspase.3的表达明显降低,表明舒血宁注射液能够在一定程度上减轻阿霉素诱导的心肌细胞凋亡。
线粒体损伤是阿霉素诱导心肌细胞损伤的另一种典型的病理改变 [18] 。研究表明,阿霉素处理增加了心肌细胞活性氧的产生,而活性氧的增加会导致线粒体融合和分裂的失衡,抑制病理上的线粒体过度分裂,具有心脏保护作用 [19] 。线粒体分裂主要由Drp1控制,而OPA1则参与调节线粒体内膜的融合 [20] 。本研究发现,阿霉素组大鼠心肌中OPA1的表达明显减少,而p.Drp1的表达明显增加;给予舒血宁注射液干预后,大鼠心肌中OPA1的表达明显增加,而p.Drp1的表达明显降低,表明舒血宁注射液能够在一定程度上抑制阿霉素诱导的心肌细胞线粒体的过度分裂。因此,这些结果表明舒血宁注射液调控线粒体融合和分裂平衡可能是治疗阿霉素诱导心脏毒性的潜在策略。
综上所述,本研究结果表明,细胞凋亡和线粒体过度分裂是阿霉素诱导心脏毒性的重要机制。而舒血宁注射液可以通过抑制线粒体过度分裂和凋亡减轻阿霉素诱导的心脏毒性。本研究为阐明阿霉素诱导心脏毒性的机制提供了实验证据,并为临床上舒血宁注射液治疗阿霉素诱导的心脏毒性提供了新的理论依据。
参考文献:
[1] MCGOWAN J V, CHUNG R,MAULIK A, et al. Anthracycline chemotherapy and cardiotoxicity[J].Cardiovascular Drugs and Therapy,2017,31(1):63.75.
[2] CHATTERJEE K ,ZHANG J Q,HONBO N, et al. Doxorubicin cardiomyopathy[J].Cardiology,2010,115(2):155.162.
[3] VOLKOVA M, RUSSELL R 3rd.Anthracycline cardiotoxicity:prevalence,pathogenesis and treatment[J].Current Cardiology Reviews,2011,7(4):214.220.
[4] CURIGLIANO G, CARDINALE D,DENT S, et al. Cardiotoxicity of anticancer treatments:epidemiology,detection,and management[J].CA,2016,66(4):309.325.
[5] ABDEL. DAIM M M,KILANY O E,KHALIFA H A, et al. Allicin ameliorates doxorubicin.induced cardiotoxicity in rats via suppression of oxidative stress,inflammation and apoptosis[J].Cancer Chemotherapy and Pharmacology,2017,80(4):745.753.
[6] OCTAVIA Y, TOCCHETTI C G,GABRIELSON K L, et al. Doxorubicin.induced cardiomyopathy:from molecular mechanisms to therapeutic strategies[J].Journal of Molecular and Cellular Cardiology,2012,52(6):1213.1225.
[7] HU L F, LAN H R,LI X M, et al. A systematic review of the potential chemoprotective effects of resveratrol on doxorubicin.induced cardiotoxicity:focus on the antioxidant,antiapoptotic,and anti.inflammatory activities[J].Oxidative Medicine and Cellular Longevity,2021,2021:2951697.
[8] JASIM S T, AL.KURAISHY H M,AL.GAREEB A I.Gingko Biloba protects cardiomyocytes against acute doxorubicin induced cardiotoxicity by suppressing oxidative stress[J].JPMA,2019,69(Suppl 3): S103.S107.
[9] WANG R Y, WANG M,ZHOU J H, et al. Shuxuening injection protects against myocardial ischemia.reperfusion injury through reducing oxidative stress,inflammation and thrombosis[J].Annals of Translational Medicine,2019,7(20):562.
[10] 卢朝辉, 宗强,陈士利,等.舒血宁治疗阿霉素引起的心脏毒性的临床研究[J].临床和实验医学杂志,2014,13(22):1870.1872.
[11] 王宏波, 杨冬梨,徐宗佩,等.参附注射液对大鼠阿霉素心肌损伤的影响[J].中医学报,2021,36(4):813.816.
[12] SCHIRONE L, D′AMBROSIO L,FORTE M, et al. Mitochondria and doxorubicin.induced cardiomyopathy:a complex interplay[J].Cells,2022,11(13):2000.
[13] ZAMORANO J L, LANCELLOTTI P,RODRIGUEZ MUOZ D, et al. 2016 ESC position paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines:the task force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology(ESC)[J].European Heart Journal,2016,37(36):2768.2801.
[14] ZHU P C,T ONG Q,ZHUANG Z, et al. Ginkgolide B for myocardial ischemia/reperfusion injury:a preclinical systematic review and meta.analysis[J].Frontiers in Physiology,2019,10:1292.
[15] XIAO G X, LYU M,WANG Y L, et al. Ginkgo flavonol glycosides or ginkgolides tend to differentially protect myocardial or cerebral ischemia.reperfusion injury via regulation of TWEAK.Fn14 signaling in heart and brain[J].Frontiers in Pharmacology,2019,10:735.
[16] KONG C Y, GUO Z,SONG P, et al. Underlying the mechanisms of doxorubicin.induced acute cardiotoxicity:oxidative stress and cell death[J].International Journal of Biological Sciences,2022,18(2):760.770.
[17] ESTEBAN. FERNNDEZ DE VILA B,RAMREZ.HERRERA D E, CAMPUZANO S, et al. Nanomotor.enabled pH.responsive intracellular delivery of caspase.3:toward rapid cell apoptosis[J].ACS Nano,2017,11(6):5367.5374.
[18] CHEN D S, YAN J,YANG P Z.Cardiomyocyte atrophy,an underestimated contributor in doxorubicin.induced cardiotoxicity[J].Frontiers in Cardiovascular Medicine,2022,9:812578.
[19] WU B B, LEUNG K T,POON E N Y.Mitochondrial.targeted therapy for doxorubicin.induced cardiotoxicity[J].International Journal of Molecular Sciences,2022,23(3):1912.
[20] CAO Y P ,ZHENG M.Mitochondrial dynamics and inter.mitochondrial communication in the heart[J].Archives of Biochemistry and Biophysics,2019,663:214.219.
(收稿日期:2022.11.14)
(本文编辑 邹丽)
