淫羊藿次苷Ⅱ调节海马tau蛋白磷酸化水平改善慢性脑低灌注大鼠的学习记忆功能障碍
2024-06-24尹彩霞崔婷张珏
尹彩霞 崔婷 张珏

【摘 要】 目的: 研究淫羊藿次苷Ⅱ(ICS Ⅱ)抗慢性脑低灌注(CCH)诱导的大鼠学习记忆功能减退的作用及其可能的作用机制。 方法: Morris水迷宫实验检测大鼠学习记忆能力,HE染色观察海马神经元的形态,Nissl染色观察海马神经元的存活数量,Western blot检测海马tau蛋白在丝氨酸199位点磷酸化(p-Ser 199-tau)、丝氨酸396位点磷酸化(p-Ser 396-tau)、丝氨酸404位点磷酸化(p-Ser 404-tau)及苏氨酸231位点磷酸化(p-Thr 231-tau)的水平。 结果: ICS Ⅱ(16 mg/kg)能改善CCH大鼠的学习记忆障碍,减轻海马CA1区神经元结构损伤,增加海马CA1区存活神经元数量,降低海马p-Ser 199-tau、p-Ser 396-tau、p-Ser 404-tau、p-Thr 231-tau的水平。 结论: ICS Ⅱ 具有改善CCH所致大鼠学习记忆功能减退及海马神经元损伤的作用,其机制可能与下调tau蛋白异常磷酸化水平有关。
【关键词】 淫羊藿次苷Ⅱ;tau蛋白;慢性脑低灌注;学习记忆;海马神经元
【中图分类号】R96
【文献标志码】 A 【文章编号】1007-8517(2024)08-0037-07
DOI:10.3969/j.issn.1007-8517.2024.08.zgmzmjyyzz202408009
Icariside II Improves Learning and Memory Impairments Induced by Chronic Cerebral Hypoperfusion
Through Regulating Tau Phosphorylation Levels in Rat Hippocampus
YIN Caixia CUI Ting ZHANG Jue
Zunyi Medical And Pharmaceutical College,Zunyi 563006,China
Abstract:
Objective To investigate the effect of icariside II (ICS II) on learning and memory impairments induced by chronic cerebral hypoperfusion(CCH)and the possible mechanisms in rats. Methods The learning and memory function of rats were detected by Morris water maze; morphology of hippocampal neurons were detected by HE staining; Neuronal survival quantity of hippocampus were detected by Nissl staining; Western blot was used to examine the levels of p-Ser199-tau, p-Ser396-tau, p-Ser404-tau and p-Thr231-tau. Results ICS Ⅱ (16 mg/kg) could improve learning and memory induced by CCH in rats, attenuate the hippocampal CA1 region neurons injury, increase the number of surviving neurons in hippocampal CA1 region, and decrease the levels of p-Ser 199-tau, p-Ser 396-tau, p-Ser 404-tau, p-Thr 231-tau in hippocampus. Conclusion Icariside II has an improvement effect on CCH-induced learning and memory impairments and neuronal injury of hippocampus in rats. The mechanism may be related to the down-regulation of tau phosphorylation levels.
Key words:
Icariside II; Tau; Chronic Cerebral Hypoperfusion; Learning and Memory; Hippocampal Neurons
血管性痴呆(vascular dementia, VD)是一种由缺血性中风、出血性脑卒中或脑血管疾病等引起的神经退行性疾病 [1-2] 。其典型的临床特征为严重的认知功能障碍、记忆能力减退及人格改变 [1] 。研究 [3] 证实VD最主要的发病机制是慢性脑低灌注(chronic cerebral hypoperfusion,CCH)。CCH是一种以持续性脑血流量减少为特征的病理变化过程,可诱发认知功能障碍、损伤海马CA1区神经元,过程的发生与其促进tau蛋白过度磷酸化密切相关 [4-6] 。Tau蛋白过度磷酸化可形成神经原纤维缠结,产生神经毒性作用,加重学习记忆能力减退,促进皮质和海马部位神经元的损伤 [6-7] 。研究 [6] 显示tau蛋白异常磷酸化水平的降低可有效改善CCH诱导的VD大鼠模型的认知功能障碍及神经元凋亡。由此可见,下调tau蛋白异常磷酸化水平对于改善CCH诱导的学习记忆功能减退及海马神经元损伤具有重要作用。目前,临床尚无理想的VD治疗药物。故而,基于VD的发病机制继续探寻安全、高效的VD治疗药物刻不容缓。
淫羊藿次苷II(Icariside II,ICS II)是从贵州道地中药材淫羊藿中提取得到的一种黄酮类化合物,其药理作用非常广泛,如抗骨质疏松、抗性功能障碍、抗衰老、抗糖尿病、抗炎、抗肿瘤及抗缺血性脑损伤等 [8-13] 。近年来,ICS II在改善痴呆大鼠模型的学习记忆障碍及神经元损伤方面取得了较好的效果 [14] 。特别是,ICS II可通过抑制β-淀粉样蛋白(amyloid β-protein,Aβ)的产生及促进Aβ的降解减轻CCH诱导的大鼠学习记忆减退及海马神经元损伤,从而发挥抗VD的作用 [15] 。然而,ICS II抗VD的作用是否还与其降低tau蛋白异常磷酸化水平有关尚不清楚。因此,实验采用双侧颈总动脉结扎(bilateral common carotid artery ligation,BCCAO)诱导CCH,制备VD样大鼠模型,选用ICS II有效剂量 16 mg/kg,以初步观察ICS II对该模型大鼠学习记忆能力减退及海马神经元损伤的影响,并探究其机制是否与下调tau蛋白异常磷酸化水平有关,为ICS II用于VD的治疗提供更深入的基础药理学依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级雄性SD大鼠由重庆腾鑫华阜实验动物销售有限公司提供,体重230~ 250 g ,许可证号为SCXK-(京)2019-0008。将SD大鼠适应性饲养(每笼5只)7 d后进行后续实验。
1.1.2 仪器 BX43正置显微镜(日本Olympus 公司);DDY-10型电泳仪及DDY-7BⅢ型电转仪(美国BIO-RAD公司);RM2245轮转式切片机(德国Leica公司)。TopScan Version 3.00水迷宫测试系统(北京吉安得尔科技有限公司)。
1.1.3 材料 淫羊藿次苷II(纯度98%,CAS号:113558-15-9,上海毕得医药科技股份有限公司);尼氏染色液(货号:G1436,北京索莱宝科技有限公司);p-Ser199-tau兔多克隆抗体(货号:# 29957S,Cell Signaling 公司);p-Ser396-tau兔单克隆抗体(货号:ab32057)、p-Ser404-tau兔单克隆抗体(货号:ab92676)、p-Thr231-tau兔单克隆抗体(货号:ab151559)均购于英国Abcam有限公司;Tau 兔多克隆抗体(货号:bs-20443R,北京博奥森生物技术有限公司);GAPDH抗体(武汉三鹰生物技术有限公司)。
1.2 实验方法
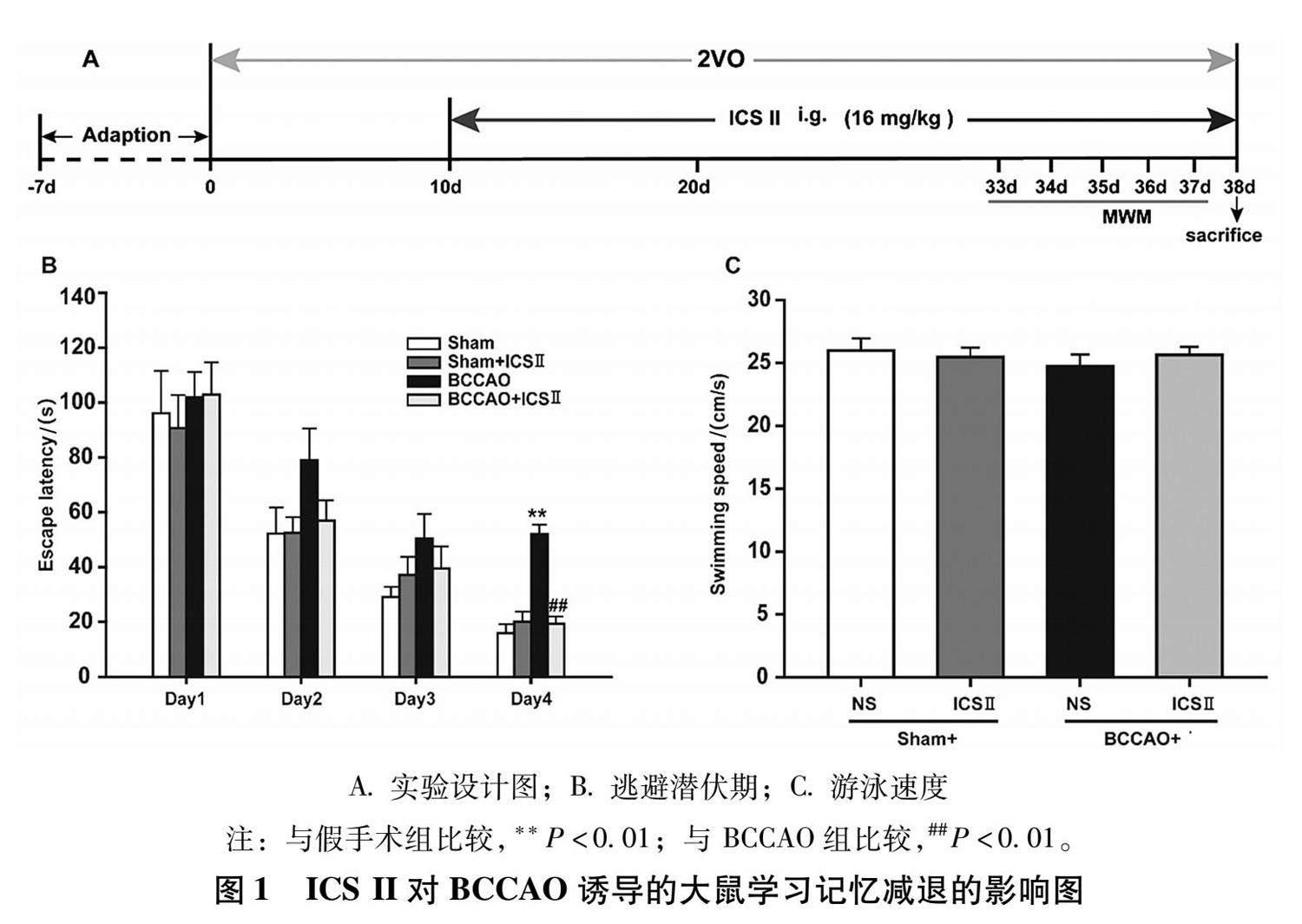
1.2.1 动物分组、造模及给药方法 将25只成年雄性SD大鼠随机分为4组:假手术组( n= 6)、假手术给药组( n= 6)、BCCAO组( n= 7)及BCCAO给药组( n= 6)。大鼠经7% 水合氯醛溶液麻醉后以仰卧位固定于大鼠手术板上,然后用眼科剪沿颈部正中位置剪一2 cm切口,小心将左侧和右侧的颈总动脉从迷走神经、颈动脉鞘和胸骨舌骨肌中分离出来,并不可逆地将两侧颈总动脉进行结扎,制备CCH诱导的VD大鼠模型,同法分离假手术组和假手术给药组大鼠的双侧颈总动脉,但不结扎。研究证实大鼠造模后需经9 d才可形成CCH [16] 。因此,手术结束后第10天开始给药,假手术给药组及BCCAO给药组每日一次灌胃给予 ICS II 16 mg/kg,假手术组及BCCAO组灌胃等体积生理盐水,连续给药28 d。
1.2.2 学习记忆能力测试 给药第24天行Morris水迷宫实验检测大鼠学习记忆能力,连续检测 5 d。 其中,包括4天的定位航行和1天的空间探索。在定位航行实验中,所有大鼠每天被检测2次,同时记录大鼠的逃避潜伏期,若大鼠在规定时间内(120 s)未找到站台,则大鼠逃避潜伏期记为 120 s, 并引导大鼠于站台上停留15 s。 将站台撤去后进行空间探索实验,所有大鼠被检测1次,同时记录大鼠在120 s内穿过目标象限的次数、在目标现象停留的时间百分比及游泳速度。根据Morris水迷宫视频跟踪系统记录的数据,进行Repeated measures ANOVA和One-Way ANOVA统计学分析。
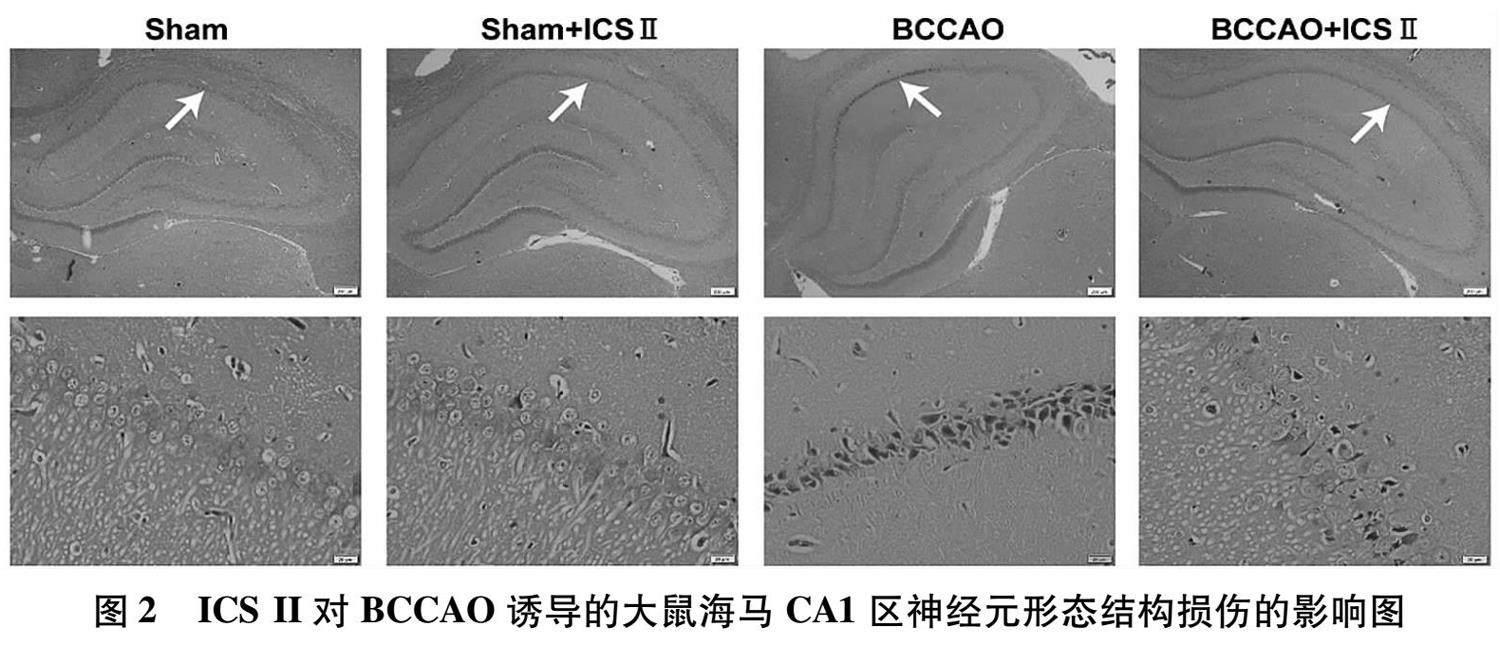
1.2.3 海马神经元形态结构及存活数量的观察 5天的Morris水迷宫实验结束后,每组大鼠随机选取3只进行麻醉,后用PBS缓冲液和4%多聚甲醛对该大鼠作透灌处理,随即断头 并小心剥离出全脑,此时,再继续用4%多聚甲醛溶液将上述全脑固定7 d,固定好的全脑经石蜡包埋及冠状切片(厚度为5 μm)后分别用苏木素-伊红和甲苯胺蓝行HE染色和Nissl染色,最后用BX43正置光学显微镜观察海马部位神经元的形态结构及神经元的存活数量。
1.2.4 Tau蛋白各位点磷酸化水平的检测 各组剩余大鼠经麻醉后断头取脑,大脑置于平整的冰袋上进行双侧海马的分离,分离出来的海马组织保存于-80 ℃低温冰箱,后用Western blot法检测该海马组织中tau蛋白各位点磷酸化水平。操作如下:RIPA裂解液提取海马组织总蛋白→BCA试剂盒测定蛋白浓度→用PBS和5×上样缓冲液制备实验样本(含20 μg蛋白)→配制10% SDS-聚丙烯酰胺凝胶→将实验样本加入该凝胶孔道中进行电泳→通过电转将凝胶上的蛋白转移至PVDF膜→ 用5%脱脂牛奶封闭该PVDF膜(封闭时间为2 h)→封闭好的膜加入对应一抗(p-Ser199-tau, 1∶ 1000 ;p-Ser396-tau,1∶ 1000;p-Ser404-tau,1∶ 1000;p-Thr231-tau.,1∶ 1000;tau, 1∶ 2000 ;GAPDH,1∶ 5000)→4 ℃过夜孵育→加入对应二抗(过氧化物酶标记山羊抗兔 IgG(H+L),1∶ 2000)→常温反应60 min→用ECL发光剂显影→结果用ImageJ软件进行定量分析。
1.3 统计学分析 采用SPSS 16.0统计软件分析本实验所有数据,同时用均数加减标准差( x ±SEM)表示。水迷宫实验中的逃避潜伏期采用Repeated measures ANOVA进行分析,其余数据均用One-Way ANOVA进行分析。 P< 0.05为有统计学意义; P< 0.01为有显著统计学意义。
2 结果
2.1 ICS II对BCCAO诱导的大鼠学习记忆减退的影响 Morris水迷宫检测各组大鼠学习记忆能力。如表1及图1B所示,各组大鼠在定位航行实验中的逃避潜伏期随着时间的延长基本呈下降趋势。与假手术组比较,BCCAO组大鼠的平均逃避潜伏期在Morris水迷宫实验的第4天明显延长( P< 0.01);与BCCAO组大鼠比较,BCCAO给药组大鼠的平均逃避潜伏期在Morris水迷宫实验的第4天明显缩短( P< 0.01)。如表2及图1C所示,各组大鼠在空间探索实验中的游泳速度无明显差异,说明大鼠的运动功能对逃避潜伏期无影响。
2.2 ICS II对BCCAO诱导的大鼠海马CA1区神经元形态结构损伤的影响 HE染色观察海马CA1区神经元的形态。如图2所示,与假手术组大鼠比较,BCCAO组大鼠海马CA1区神经元发生变性和萎缩;与BCCAO组大鼠比较,BCCAO给药组大鼠海马CA1区神经元形态结构趋于正常,没有出现明显的变性和萎缩现象。
2.3 ICS II阻遏BCCAO诱导的大鼠海马CA1区存活神经元数目的减少 Nissl染色观察海马神经元的存活数量。如表3及图3所示,与假手术组大鼠比较,BCCAO组大鼠海马CA1区存活神经元数目明显减少( P< 0.01);与BCCAO组大鼠比较,BCCAO给药组大鼠海马CA1区存活神经元数目增加( P< 0.05)。
2.4 ICS II对各组大鼠海马p-Ser199-tau、p-Ser396-tau水平的影响 Western blot检测大鼠海马p-Ser199-tau、p-Ser396-tau水平。如表4及图4所示,与假手术组比较,BCCAO组p-Ser199-tau、p-Ser396-tau水平显著增加( P< 0.01);ICS II 16mg/kg连续给药28 d后,减少了BCCAO组大鼠海马p-Ser199-tau、p-Ser396-tau水平( P< 0.01; P< 0.05)。
2.5 ICS II对各组大鼠海马p-Ser404-tau、p-Thr231-tau水平的影响 Western blot检测大鼠海马p-Ser404-tau、p-Thr231-tau水平。如表5及图5所示,与假手术组大鼠比较,BCCAO组p-Ser404-tau、 p-Thr231-tau水平显著增加( P< 0.01);ICS II 16mg/kg连续给药28 d天后,明显减少了BCCAO组大鼠海马p-Ser404-tau、 p-Thr231-tau水平( P< 0.01)。
3 讨论
VD所表现出来的渐进性认知功能障碍主要由CCH引起。CCH会导致脑血流量缺乏而减少大脑的能量供应,从而促进脑内tau蛋白异常磷酸化、Aβ沉积、海马神经元变性及学习记忆能力减退等,最终产生与VD相似的行为学特征 [15, 17, 18] 。双侧颈总动脉结扎(bilateral common carotid artery ligation,BCCAO)能够成功地模拟人类CC H的病理学状态,且被广泛应用于VD的相关研究中 [4, 15, 19-21] 。实验采用BCCAO诱导CCH,制备类VD样大鼠模型,观察ICS II 是否能够改善该模型大鼠的学习记忆障碍及海马CA1区神经元损伤,并探寻其初步机制。本实验Morris水迷宫结果与前期研究 [22] 一致,均证实了BCCAO诱导的CCH会引发大鼠学习记忆功能退化,提示本实验类VD样大鼠模型的制备较为成功。值得关注的是,ICS II 16 mg/kg能明显缩短BCCAO组大鼠的逃避潜伏期而不影响大鼠的游泳速度,提示本实验所用SD大鼠的运动功能对该行为学结果无影响,更能证实ICS II具有改善类VD 样大鼠学习记忆功能障碍的作用。
学习记忆能力的获取与大脑海马的结构及功能密切相关。海马主要由3个区域组成,分别为CA1区、CA3区及DG区。其中,CA1区能完成记忆的编码,CA3区能介导完整记忆的提取,DG区能产生新生神经元而协调空间记忆的格局分离。当海马神经元发生凋亡、损伤或丢失时,会降低海马突触的可塑性,减弱长时程增强效应,最终造成空间学习记忆功能减退 [23-25] 。而且,研究 [3] 表明BCCAO诱导的CCH可导致海马CA1区神经元形态结构发生明显的病理学改变。因而,本实验采用HE染色观察各组大鼠海马CA1区神经元的形态结构,结果与上述研究类似,BCCAO组大鼠海马CA1区神经元发生明显变性和萎缩,提示BCCAO诱导的CCH可能会通过干扰海马CA1区正常的记忆编码而使学习记忆能力退化。然而,ICS II 16 mg/kg的长期治疗能够明显缓解其海马CA1区神经元变性和萎缩的现象,提示ICS II 16 mg/kg对海马CA1区神经元有保护作用。另外,海马神经元损伤还可引起尼氏小体溶解或消失,使得存活神经元数目减少,而尼氏染色法可将尼氏小体染成蓝色而反应存活神经元数量。故而,本实验采用尼氏染色的方法检测各组大鼠海马CA1区神经元存活情况,结果显示BCCAO组大鼠海马CA1区存活神经元数目显著减少,与Wang等 [19] 的研究结果一致。同时,大鼠经ICS II 16 mg/kg治疗28 d后,其海马CA1区存活神经元数目呈增加趋势,提示ICS II 16 mg/kg对BCCAO诱导的大鼠海马CA1区存活神经元数目的减少有阻遏作用,这一作用可能会促进海马CA1区记忆编码的稳定,有助于改善学习记忆能力。
Tau蛋白异常磷酸化导致的海马神经元损伤是诱发学习记忆功能减退的主要机制之一 [26] 。实际上,在大脑的神经元内,tau蛋白是一种含量较高且携带多种磷酸基团的微管相关蛋白,其主要作用是与微管结合而调节微管结构和轴突运输,进而达到维持并固定神经细胞骨架的作用 [27] 。但是,当tau蛋白在多个位点发生异常磷酸化后会干扰其与微管的结合而降低神经细胞骨架的稳定性。同时,异常磷酸化的tau蛋白会在脑内聚集形成神经原纤维缠结而产生神经毒性,最终会导致神经元损伤及学习记忆功能障碍 [28-29] 。更为重要的是,有文献 [30] 报道在BCCAO诱导的类VD样大鼠模型的脑内tau蛋白异常磷酸化的水平过高,而通过抑制tau蛋白的异常磷酸化可减轻该大鼠模型的学习记忆功能障碍 [30] 。因此,本实验采用Western blot法检测大鼠海马tau蛋白在不同位点的磷酸化水平,结果显示BCCAO组大鼠海马tau蛋白在丝氨酸199(serines 199,Ser 199)、丝氨酸396(serines 396,Ser 396)、丝氨酸404(serines 404,Ser 404)以及苏氨酸231(threonines 231,Thr 231)四个位点的磷酸化水平高于假手术组,即BCCAO组大鼠海马p-Ser 199-tau、p-Ser 396-tau、p-Ser 404-tau及p-Thr 231-tau的水平高于假手术组,与前期研究结果 [27] 一致。然而,BCCAO组大鼠经ICS II 16 mg/kg治疗后其脑内tau蛋白在上述四个位点的磷酸化水平降低,提示ICS II 16 mg/kg可通过减少海马p-Ser 199-tau、p-Ser 396-tau、p-Ser 404-tau及p-Thr 231-tau的水平,阻遏BCCAO诱导的类VD样大鼠模型的神经元损伤及存活神经元数目的减少,发挥抗VD的作用。
综上所述,实验主要证实了p-Ser 199-tau、p-Ser 396-tau、p-Ser 404-tau及p-Thr 231-tau等四个磷酸化的tau蛋白能促进BCCAO诱导的大鼠学习记忆功能减退及海马神经元损伤的发生与发展,进一步加深了笔者对VD发病机制的认识。ICS II能改善BCCAO诱导的大鼠学习记忆功能减退及海马神经元损伤,其作用机理与减少tau蛋白的异常磷酸化水平有关。
参考文献
[1]赵见文. 血管性痴呆概述[J]. 人人健康, 2023,(9): 23.
[2]王丹, 史宏硕, 王宗浩, 等. 葛根素治疗血管性痴呆作用机制研究进展[J]. 现代中药研究与实践, 2023, 37(2): 98-102.
[3]李菲, 蔡锐, 刘波, 等. 淫羊藿苷调节海马BDNF通路减轻血管性痴呆大鼠的学习记忆障碍[J]. 中国新药与临床杂志, 2020, 39(8): 489-493.
[4]ZHANG J, LIU Y, ZHENG Y, et al. TREM-2-p38 MAPK signaling regulates neuroinflammation during chronic cerebral hypoperfusion combined with diabetes mellitus [J]. J Neuroinflammation, 2020, 17(1): 1-16.
[5]YAN N, XU Z, QU C, et al. Dimethyl fumarate improves cognitive deficits in chronic cerebral hypoperfusion rats by alleviating inflammation, oxidative stress, and ferroptosis via NRF2/ARE/NF-kappaB signal pathway [J]. Int Immunopharmacol, 2021(98): 1-12.
[6]TAN Z, CHEN Y, XIE W, et al. Nimodipine attenuates tau phosphorylation at Ser396 via miR-132/GSK-3beta pathway in chronic cerebral hypoperfusion rats [J]. Eur J Pharmacol, 2018(819): 1-8.
[7]KANDIMALLA R, MANCZAK M, YIN X, et al. Hippocampal phosphorylated tau induced cognitive decline, dendritic spine loss and mitochondrial abnormalities in a mouse model of Alzheimers disease [J]. Hum Mol Genet, 2018, 27(1): 30-40.
[8]ZHENG Y, DENG Y, GAO J M, et al. Icariside II inhibits lipopolysaccharide-induced inflammation and amyloid production in rat astrocytes by regulating IKK/IkappaB/NF-kappaB/BACE1 signaling pathway [J]. Acta Pharmacol Sin, 2020, 41(2): 154-162.
[9]LIU M B, WANG W, GAO J M,et al. Icariside II attenuates cerebral ischemia/reperfusion-induced blood-brain barrier dysfunction in rats via regulating the balance of MMP9/TIMP1 [J]. Acta Pharmacol Sin, 2020, 41(12): 1547-1556.
[10] XU F, WU Q, LI L,et al. Icariside II: Anticancer Potential and Molecular Targets in Solid Cancers [J]. Front Pharmacol, 2021(12):1-10.
[11]FU S, LI Y, WU Y, et al. Icariside II improves myocardial fibrosis in spontaneously hypertensive rats by inhibiting collagen synthesis [J]. J Pharm Pharmacol, 2020, 72(2): 227-235.
[12]韦余, 高健美, 陆国辉, 等. 淫羊藿次苷Ⅱ的药理作用及机制研究进展[J]. 中国新药与临床杂志, 2018, 37(9): 509-514.
[13]田雨, 肖洪贺, 陈吉聪, 等. 淫羊藿次苷Ⅱ对H2O2诱导N2a细胞损伤的保护作用研究[J]. 现代中药研究与实践, 2022, 36(2): 38-43.
[14]邓艳, 尹彩霞, 高健美, 等. 淫羊藿次苷Ⅱ抑制慢性脑低灌注大鼠海马PDE 4、PDE 5蛋白表达及TGF-β1/Smad2信号通路[J]. 遵义医学院学报, 2019, 42(2): 148-152.
[15]YIN C, DENG Y, LIU Y, et al. Icariside II Ameliorates Cognitive Impairments Induced by Chronic Cerebral Hypoperfusion by Inhibiting the Amyloidogenic Pathway: Involvement of BDNF/TrkB/CREB Signaling and Up-Regulation of PPARalpha and PPARgamma in Rats [J]. Front Pharmacol, 2018(9): 1-14.
[16]LI W X, DENG Y Y, LI F, et al. Icariin, a major constituent of flavonoids from Epimedium brevicornum, protects against cognitive deficits induced by chronic brain hypoperfusion via its anti-amyloidogenic effect in rats [J]. Pharmacol Biochem Behav, 2015(138):40-48.
[17]LEE J I, LIM J S, HONG J H, et al. Selective neurodegeneration of the hippocampus caused by chronic cerebral hypoperfusion: F-18 FDG PET study in rats [J]. PLoS One, 2022, 17(2): 1-16.
[18]QIU L, NG G, TAN E K,et al. Chronic cerebral hypoperfusion enhances Tau hyperphosphorylation and reduces autophagy in Alzheimers disease mice [J]. Sci Rep, 2016(6):1-9.
[19]WANG X, YANG X, HAN F, et al. Propofol improves brain injury induced by chronic cerebral hypoperfusion in rats [J]. Food Sci Nutr, 2021, 9(6): 2801-2809.
[20] BHATIA P, KAUR G,SINGH N. Ozagrel a thromboxane A2 synthase inhibitor extenuates endothelial dysfunction, oxidative stress and neuroinflammation in rat model of bilateral common carotid artery occlusion induced vascular dementia [J]. Vascul Pharmacol, 2021(137): 1-12.
[21]孙旭, 王蕾, 赵婧, 等. 血管性痴呆动物模型研究概述[J]. 广州中医药大学学报, 2022, 39(10): 2465-2470.
[22]蔡锐, 刘波, 龚其海, 等. 淫羊藿苷通过促血管新生改善双侧颈总动脉结扎大鼠的学习记忆功能[J]. 中国新药与临床杂志, 2016, 35(4): 287-293.
[23]GOODE T D, TANAKA K Z, SAHAY A, et al. An Integrated Index: Engrams, Place Cells, and Hippocampal Memory [J]. Neuron, 2020, 107(5): 805-820.
[24]COOPER C, MOON H Y,PRAAG H. On the Run for Hippocampal Plasticity [J]. Cold Spring Harb Perspect Med, 2018, 8(4):1-31.
[25]YIN C, DENG Y, GAO J,et al. Icariside II, a novel phosphodiesterase-5 inhibitor, attenuates streptozotocin-induced cognitive deficits in rats [J]. Neuroscience, 2016(328): 69-79.
[26]陈艳清, 田喜慧, 贾炳泉, 等. 阿尔茨海默病中Tau蛋白的异常磷酸化及其机制[J]. 脑与神经疾病杂志, 2019, 27(10): 645-650.
[27]巴智胜, 蔡锐, 尹彩霞, 等. 金钗石斛总生物碱改善链脲佐菌素所致大鼠海马神经元损伤 [J]. 中国新药与临床杂志, 2017, 36(6): 340-346.
[28]WEGMANN S, BIERNAT J,MANDELKOW E.A current view on Tau protein phosphorylation in Alzheimers disease [J]. Curr Opin Neurobiol, 2021(69): 131-138.
[29]ITTNER A, ITTNER L M. Dendritic Tau in Alzheimers Disease [J]. Neuron, 2018, 99(1): 13-27.
[30]SHI R, ZHENG C B, WANG H, et al. Gastrodin Alleviates Vascular Dementia in a 2-VO-Vascular Dementia Rat Model by Altering Amyloid and Tau Levels [J]. Pharmacology, 2020, 105(7-8): 386-396.
(收稿日期:2023-07-24 编辑:刘 斌)
