艾叶多酚提取工艺优化及抗氧化活性分析
2024-06-23徐源刁婷婷杨立军毋尚枫王琳
徐源 刁婷婷 杨立军 毋尚枫 王琳
摘要 [目的]以艾叶为研究对象,探索艾叶多酚的最佳提取工艺及其抗氧化活性。[方法]采用单因素试验分别考察乙醇浓度、液料比、超声提取时间对艾叶多酚提取量的影响,通过Box-Behnken响应面分析法优化其提取工艺,并以清除DPPH自由基和羟基自由基的能力评价艾叶多酚的抗氧化活性。[结果]艾叶多酚最佳提取工艺为乙醇浓度77%、液料比24∶1(mL∶g)、提取时间53 min,此时艾叶多酚提取量为41.31 mg/g。抗氧化活性分析表明艾叶多酚有较好的抗氧化能力,对DPPH自由基和羟基自由基的半抑制浓度(IC50)分别为0.050 4和0.031 1 mg/mL。[结论]采用超声辅助法,在最佳提取工艺条件下艾叶多酚提取量达到41.31 mg/g,该条件下提取的艾叶多酚有良好的抗氧化性,该方法提取简单、易操作、得率高。
关键词 艾叶多酚;单因素试验;响应面法;提取工艺优化;抗氧化活性
中图分类号 R284 文献标识码 A 文章编号 0517-6611(2024)11-0154-05
doi:10.3969/j.issn.0517-6611.2024.11.033
Optimization of Extraction Process and Antioxidant Activity of Polyphenols from Artemisia argyi
XU Yuan,DIAO Ting-ting,YANG Li-jun et al
(Xinyang Agriculture and Forestry University,Xinyang,Henan 464000)
Abstract [Objective]Taking Artemisia argyi leaves as the research object,in order to explore the optimal extraction process and antioxidant activities of polyphenols from Artemisia argyi.[Method]Single-factor test was used to investigate the influence of ethanol concentration,liquid-material ratio and ultrasonic extraction time on the extraction amount of Artemisia argyi polyphenols.On this basis,the extraction process was optimized by Box-Behnken response surface analysis,and the antioxidant activity of polyphenols was evaluated by the ability to remove DPPH free radicals and hydroxyl radicals.[Result]The optimal process was 77% ethanol concentration,material-liquid ratio 24∶1 (mL∶g) and the extraction time 53 min.Under the above conditions,the extraction amount of polyphenols was 41.31 mg/g.Antioxidant activity analysis showed that polyphenols had good antioxidant ability.The semi-inhibition concentrations (IC50) of DPPH free radicals and hydroxyl radicals were 0.050 4 and 0.031 1 mg/mL respectively.[Conclusion]Using ultrasound assisted method,the extraction amount of Artemisia argyi polyphenols reached 41.31 mg/g under the optimal extraction process conditions.The extracted Artemisia argyi polyphenols under these conditions had good antioxidant properties.This method was simple,easy to operate and had a high yield.
Key words Artemisia argyi polyphenols;Single factor test;Response surface method;Optimization of extraction process;Antioxidant activity
基金项目 信阳农林学院青年基金项目(QN2022023)。
作者简介 徐源(1988—),女,河南信阳人,助教,硕士,从事天然产物开发与研究工作。*通信作者,讲师,博士,从事有机合成方面研究。
收稿日期 2023-08-03;修回日期 2023-09-05
艾叶(Folium artemisiae argyi)为菊科植物艾草的干燥叶[1]。现代药理研究表明,艾叶具有抗菌、抗氧化、抗病毒等功效[2-5],主要含有多糖、黄酮类、酚类、桉叶烷等药理活性的化合物,其中艾叶多酚可有效清除体内的氧自由基、延缓衰老,也可修复细胞等,另外它在抗病毒[6]、抗氧化[7]、抗菌[8-9]及降血脂[10]方面也具有显著效果。因此艾叶多酚的分离、提取工艺引起大家的关注。植物多酚常见的提取方法主要有浸泡法、超声辅助法、微波辅助法、超临界流体萃取法、超声辅助乙醇提取法等[11-12]。超声波辅助法通过机械波的空化效应加速目标物质溶出而提高提取效率,而乙醇可以降低提取液的极性,使其更容易破坏艾叶中多酚类物质与多糖或蛋白质等物质之间的氢键,从而使艾叶中的多酚更容易溶出,因此此次试验将两者结合,采取超声波辅助乙醇提取法对艾叶多酚进行探究。多酚提取及相关健康产品的开发利用成为近年来研究的热点,而艾叶多酚提取工艺鲜有报道,笔者利用超声辅助乙醇提取法,在单因素试验基础上通过响应面法分析液料比、提取时间和乙醇浓度对艾叶多酚提取量的影响,优化艾叶多酚的提取工艺,并在最佳提取条件下研究艾叶多酚的抗氧化活性,为艾叶多酚的工业化生产奠定基础,为艾叶资源的开发利用提供理论依据。
1 材料与方法
1.1 试材与试剂 艾叶,购自南阳老艾岭股份集团有限公司。没食子酸标准品,购自上海源叶生物科技有限公司;硫酸亚铁,购自天津市达茂化学试剂有限公司;福林酚试剂,购自上海蓝季生物有限公司;无水碳酸钠(分析纯)、无水乙醇(分析纯)、水杨酸(分析纯)、维生素C(分析纯)、H2O2(分析纯),购自天津科密欧化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),购自福州飞兴生物科技有限公司。
1.2 仪器与设备
电子分析天平,上海良平仪器仪表有限公司;恒温水浴锅,浙江聚能仪器设备有限公司;超声波提取仪,长沙明杰仪器有限公司;高速粉碎机-6202型,河南立鑫机械设备有限公司;高速离心机,南京伊若达仪器有限公司;双光束紫外可见分光光度计,北京普析通用仪器有限公司;循环水式多用真空泵,南京嘉美伦科学仪器有限公司。
1.3 试验方法
1.3.1 没食子酸标标准液的制备。
根据龙小妹等[13]的方法,首先配制0.11 mg/mL的没食子酸标准溶液以待备用,然后通过没食子酸-福林酚-Na2CO3测定,在波长760 nm处测其吸光度,以浓度C(mg/mL)为横坐标、吸光度A为纵坐标绘制标准曲线,所得多酚标准曲线方程为Y=99.87X+0.005(R2=0.999 6),表明没食子酸标准品在1~5 μg/mL线性关系良好。
1.3.2 艾叶多酚
提取率的测定。将艾叶干燥粉碎后,称取1.0 g艾叶粉末,以乙醇为提取溶剂,按一定液料比、提取时间、乙醇浓度进行超声提取[14],取其滤液,以7 000 r/min 离心5 min,取上清液,先稀释50倍,再用移液管移取0.5 mL样液于25 mL棕色容量瓶,随后滴加福林酚试剂0.5 mL、20% Na2CO3溶液1.5 mL,补蒸馏水定容,摇匀后静置30 min,在760 nm处测其吸光度,根据标准曲线计算其浓度,然后根据以下公式计算艾叶多酚提取率(Y)[15]:
Y(mg/g)=CNVm×10-3
式中:C为待测液浓度(mg/mL);V为样品液体积(mL);N为总稀释倍数;m为艾叶质量(g)。
1.3.3 单因素试验设计。在研究提取时间梯度(20、35、50、65、80 min)时,设定液料比为15∶1(mL∶g),乙醇浓度为60%;在研究液料比梯度(15∶1、20∶1、25∶1、30∶1、35∶1)时,设定时间为40 min,乙醇浓度为60%;在研究乙醇浓度梯度(60%、65%、70%、75%、80%)时,设置提取时间为40 min,液料比为15∶1;分别考察液料比、提取时间、乙醇浓度对艾叶多酚含量的影响,并计算多酚的提取量,以期得到各单因素梯度下艾叶多酚提取的最佳条件。
1.3.4 响应面优化试验设计。
依照单因素试验结果,根据Box-Behnken原理,通过Design-Expert 13.0软件,选取提取时间(A)、液料比(B)、乙醇浓度(C)3个因素,设计出3因素3水平共17组试验对其进行优化组合,试验因素和水平见表1,通过响应面试验数据分析得到艾叶多酚最佳提取工艺数据,并在最优工艺条件下,计算艾叶多酚的提取量。
1.3.5 艾叶多酚抗氧化活性分析。
1.3.5.1 清除DPPH自由基的能力。
参考张洋洋等[16]清除DPPH自由基能力的方法,吸取2 mL DPPH溶液和2 mL不同浓度的样液于试管中,用蒸馏水作对照,在517 nm处测吸光度A0。将DPPH替换成体积分数为75%乙醇溶液,其他试剂和试验条件不变,测量此时的吸光度A1;同法,将样品液替换成75%乙醇溶液,测得吸光度A2。再以与艾叶多酚提取液相同浓度的VC溶液替换样液,同法进行重复试验,计算VC对DPPH自由基的清除率,以此作为参照。DPPH自由基的清除率公式如下:
清除率=A2-A0+A1A2×100%
1.3.5.2 清除羟基自由基的能力。
参考王艳英等[17]清除羟基自由基能力的方法,吸取6 mmol/L FeSO4溶液2 mL、不同浓度的艾叶多酚提取液1 mL和H2O2 2 mL于试管内,10 min后加入6 mmol/L水杨酸溶液2 mL,在517 nm处测得吸光度A1。同法,将不同浓度的艾叶多酚提取液替换成蒸馏水,测量此时的吸光度,记为A0;同样,将水杨酸替换成蒸馏水,测得吸光度A2。再配制与艾叶多酚提取液相同浓度梯度的VC溶液来替换艾叶多酚提取液,同法,计算VC对羟基自由基的清除率。羟基自由基的清除率公式如下:
清除率=A0-A1+A2A0×100%
1.4 数据处理
将单因素试验结果和抗氧化活性结果进行整理分析。采取Design-Expert 13.0软件绘制响应面图进一步分析,并优化提取工艺。
2 结果与分析
2.1 单因素试验
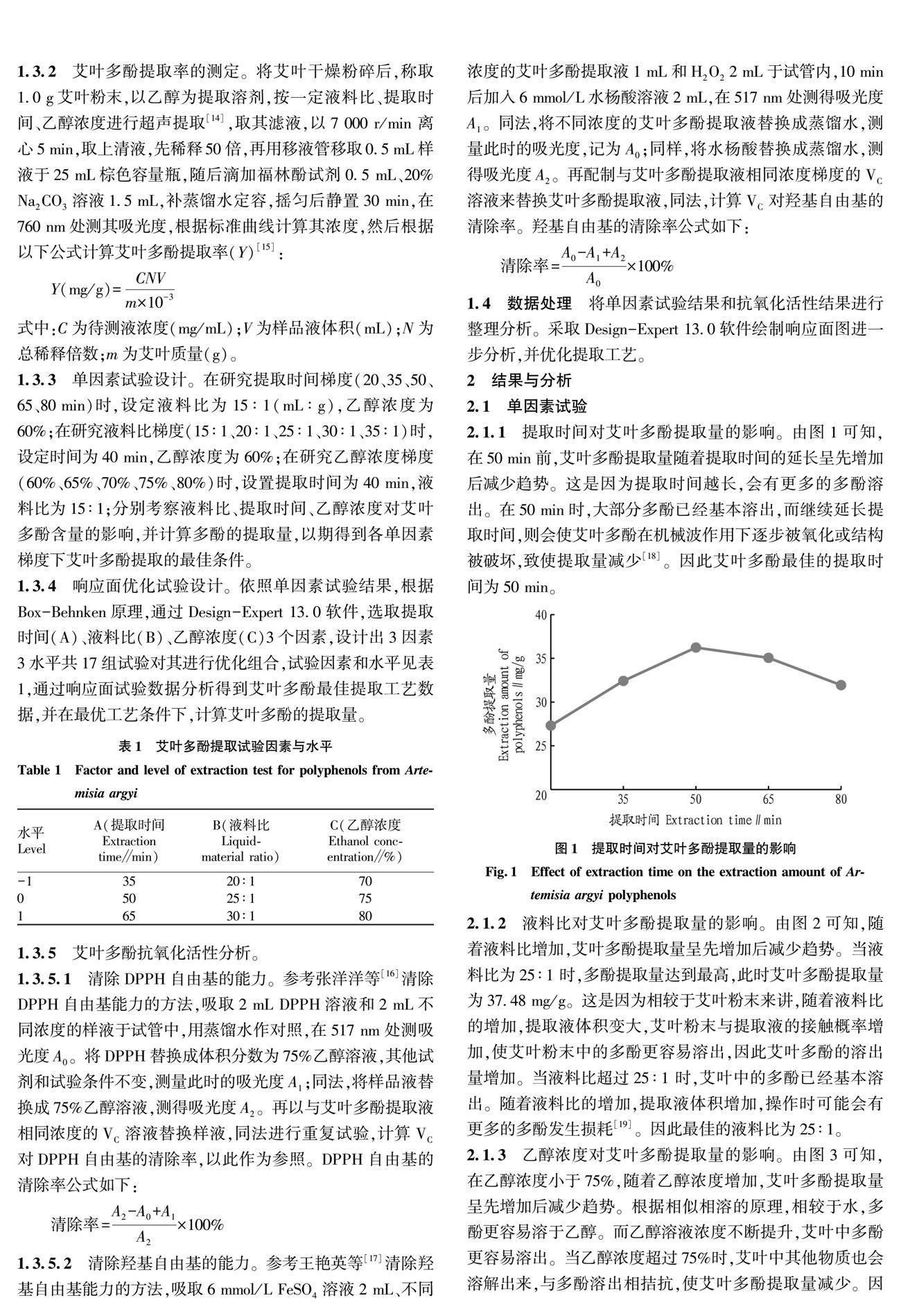
2.1.1 提取时间对艾叶多酚提取量的影响。
由图1可知,在50 min前,艾叶多酚提取量随着提取时间的延长呈先增加后减少趋势。这是因为提取时间越长,会有更多的多酚溶出。在50 min时,大部分多酚已经基本溶出,而继续延长提取时间,则会使艾叶多酚在机械波作用下逐步被氧化或结构被破坏,致使提取量减少[18]。因此艾叶多酚最佳的提取时间为50 min。
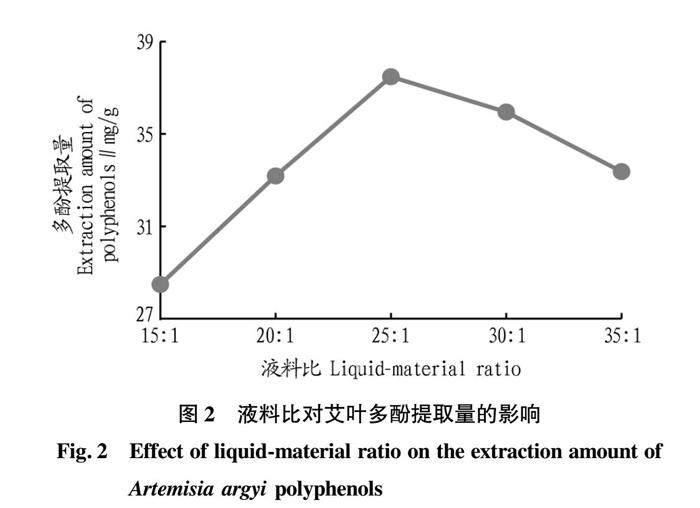
2.1.2 液料比对艾叶多酚提取量的影响。
由图2可知,随着液料比增加,艾叶多酚提取量呈先增加后减少趋势。当液料比为25∶1 时,多酚提取量达到最高,此时艾叶多酚提取量为37.48 mg/g。这是因为相较于艾叶粉末来讲,随着液料比的增加,提取液体积变大,艾叶粉末与提取液的接触概率增加,使艾叶粉末中的多酚更容易溶出,因此艾叶多酚的溶出量增加。当液料比超过25∶1 时,艾叶中的多酚已经基本溶出。随着液料比的增加,提取液体积增加,操作时可能会有更多的多酚发生损耗[19]。因此最佳的液料比为25∶1。
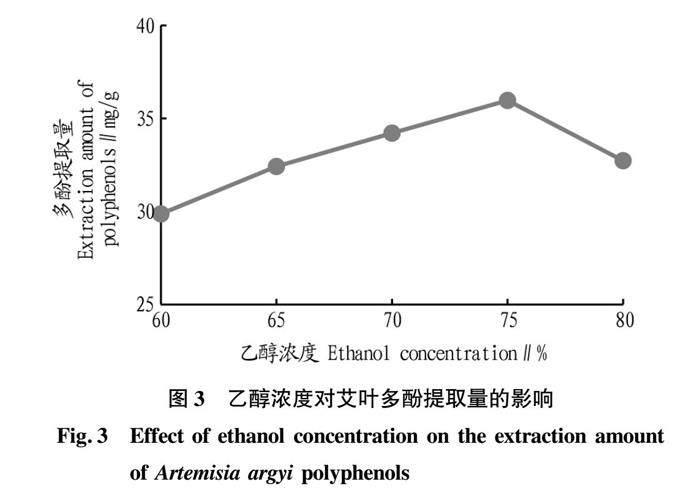
2.1.3 乙醇浓度对艾叶多酚提取量的影响。
由图3可知,在乙醇浓度小于75%,随着乙醇浓度增加,艾叶多酚提取量呈先增加后减少趋势。根据相似相溶的原理,相较于水,多酚更容易溶于乙醇。而乙醇溶液浓度不断提升,艾叶中多酚更容易溶出。当乙醇浓度超过75%时,艾叶中其他物质也会溶解出来,与多酚溶出相拮抗,使艾叶多酚提取量减少。因此乙醇最优浓度为75%。
2.2 响应面试验
2.2.1 响应面试验设计及结果分析。该试验以单因素试验为基础,建立了3因素3水平的响应面优化试验,根据Box-Behnken原理并利用Design-Expert 13.0软件进行试验结果分析,见表2。数据方差分析结果见表3。
通过Design-Expert 13.0软件对表2进行拟合分析,得到二次多项回归方程:
Y(mg/g)=41.22+0.461 3A-1.610 0B+0.626 0C-1.400 0AB+0.532 5AC-1.100 0BC-2.54A2-6.01B2-2.51C2
响应面模型的方差分析见表3。由表3可知,回归模型P<0.000 1,达到极显著水平,失拟项P=0.100 1,不显著,表明拟合程度较好,模型契合,准确可靠[20];模型的决定系数R2=0.996 6,表明该模型拟合度良好;校正决定系数R2adj=0.992 3,两者数值相差较小,表明约99.66%的响应值(Y)变化可以用该模型解释。结果显示,各因素对艾叶多酚提取量的影响由大到小依次为液料比(B)>乙醇浓度(C)>提取时间(A),通过对表3中P值的分析可得出,一次项B,交互项AB、BC,二次项A2、B2、C2的影响极显著(P<0.001);AC的P值<0.05,影响显著。综上分析,该模型能正确反映提取因素与响应值之间的关系,模型契合。
根据响应面数据模拟结果,绘制三维响应面图和等高线图,如图4所示。通过比较响应面和等高线图发现,3D响应面图呈现凸起峰值,峰值与最低处的趋势越陡峭,此因素对响应面影响越大,表明该交互项对响应值的影响越大,2D等高线图呈椭圆状且分布集中时,则说明2个单因素交互作用达到显著。由图4可知,响应面陡峭顺序为AB>BC>AC,提取时间(A)和液料比(B)的交互作用极显著、液料比(B)和乙醇浓度(C)的交互作用显著,提取时间(A)和乙醇浓度(C)的交互作用的影响最低,3个单因素的交互作用与方差分析结果(表3)一致。
2.2.2 最佳工艺条件验证。
采用Design-Expert 13.0软件对所建模型进行参数优化,得出艾叶多酚的最佳提取工艺条件为提取时间52.87 min,液料比23.94∶1、乙醇浓度76.67%,此时艾叶多酚提取量的理论值为41.38 mg/g。根据实际操作设定提取条件为提取时间53 min,液料比24∶1、乙醇浓度77%,按照此工艺进行3次平行试验,测得艾叶多酚平均提取量为41.31 mg/g,与理论结果接近,表明此模型准确可靠,可以作为提取工艺优化的模型依据。
2.3 艾叶多酚抗氧化活性分析
2.3.1 清除DPPH自由基的能力。由图5可知,当艾叶多酚提取液浓度越大,清除率越高。在多酚浓度达到0.10 mg/mL时对DPPH自由基的清除率为82.27%,而VC的清除率为89.17%,相差并不大。对数据进行处理得到艾叶多酚对DPPH自由基的半抑制浓度(IC50)为0.050 4 mg/mL,表明艾叶多酚有良好的抗氧化能力。
2.3.2 清除羟基自由基的能力。
由图6可知,随着艾叶多酚提取液浓度增加,羟基自由基清除率也随之增加,具有较为明显的量效关系,并且清除率与VC逐渐接近,在浓度为1.00 mg/mL时对羟基自由基的清除率达到了92.04%,略低于VC的清除率(93.06%)。对数据进行处理得到艾叶多酚对羟基自由基的半抑制浓度(IC50)为0.031 1 mg/mL,表明艾叶多酚对羟基自由基有良好的清除能力。
3 结论
该研究主要对艾叶中有效成分多酚进行研究,对艾叶多酚的提取工艺进行优化,以多酚提取量为考察指标,分别考察了液料比、提取时间、乙醇浓度对多酚提取量的影响,在单因素试验基础上,根据Box-Behnken原理,通过Design-Expert 13.0软件对单因素进行优化组合,结果表明,提取时间、液料比和乙醇浓度这3个因素对艾叶多酚提取量的影响顺序为液料比>乙醇浓度>提取时间,艾叶多酚的最佳提取工艺为提取时间53 min、液料比24∶1(mL∶g)、乙醇浓度77%,在此工艺条件下,艾叶多酚提取量为41.31 mg/g。通过VC作对照,以DPPH自由基和羟基自由基的清除率作为评定,其对DPPH自由基和羟基自由基的IC50分别为0.050 4和0.031 1 mg/mL,可见艾叶多
酚具有较好的抗氧化活性,可以作为天然的抗氧化剂来源。
该研究通过优化艾叶多酚提取工艺来提高多酚得率,并分析了艾叶多酚抗氧化活性,这可以为艾叶及相关产品进一步的开发利用提供理论依据。
参考文献
[1]何树苗,陈元堃,曾奥,等.基于网络药理学与分子对接技术预测艾叶抗动脉粥样硬化的分子机制[J].海南师范大学学报(自然科学版),2021,34(1):49-58.
[2] 李小妞,陈志坚,关强强,等.艾叶提取物对大肠杆菌抑菌活性的研究[J].黑龙江畜牧兽医,2019(6):140-142,173.
[3] 曹玲,于丹,崔磊,等.艾叶的化学成分、药理作用及产品开发研究进展[J].药物评价研究,2018,41(5):918-923.
[4] 冯诗杨.艾叶挥发油纳米结构脂质载体的制备及其抗乙肝病毒活性的研究[D].郑州:郑州大学,2017:73-77
[5] 陈娟,徐兴燕,林林,等.艾草的药理作用研究进展[J].药学研究,2021,40(12):807-811.
[6] YANG Z F,BAI L P,HUANG W B,et al.Comparison of in vitro antiviral activity of tea polyphenols against influenza A and B viruses and structure-activity relationship analysis[J].Fitoterapia,2014,93:47-53.
[7] 柳梅,任璇,姚玉军,等.沙棘叶多酚提取物抗氧化及体外降血糖活性研究[J].天然产物研究与开发,2017,29(6):1013-1019.
[8] 兰晓燕,张元,朱龙波,等.艾叶化学成分、药理作用及质量研究进展[J].中国中药杂志,2020,45(17):4017-4030.
[9] CAO J H,HAN J,XIAO H,et al.Effect of tea polyphenol compounds on anticancer drugs in terms of anti-tumor activity,toxicology,and pharmacokinetics[J].Nutrients,2016,8(12):1-10.
[10] BANSODE R R,RANDOLPH P,HURLEY S,et al.Evaluation of hypolipidemic effects of peanut skin-derived polyphenols in rats on Western-diet[J].Food chemistry,2012,135(3):1659-1666.
[11] 刘涵,李倩倩,程婷婷,等.滇产刺梨果总多酚的提取工艺优化及抗氧化活性研究[J].农业科技与信息,2023,20(2):129-134.
[12] SUN F L,NING J Y,WANG Y J,et al.Optimization of ultrasound-assisted cloud point extraction of polyphenols from pomegranate peels[J].Journal of biotech research,2023,14:160-170.
[13] 龙小妹,李蓉,夏宗霄,等.正交实验法优选藏药三果汤中没食子酸水提取工艺研究[J].特产研究,2023,45(2):35-39,46.
[14] 葛亮,李琦,李森,等.沙棘果总多酚提取工艺的优化及其稳定性研究[J].化学与生物工程,2023,40(3):30-35.
[15] 贺银菊,张旋俊,杨再波,等.响应面优化艾叶多酚提取工艺及抗氧化活性研究[J].食品科技,2020,45(6):278-284.
[16] 张洋洋,张作法,宋婷婷,等.瓦尼桑黄多酚类化合物纯化及抗氧化活性[J].菌物学报,2023,42(4):973-983.
[17] 王艳英,田周萍,康臆玲,等.羊栖菜多酚的制备及抗氧化活性研究[J].福建师范大学学报(自然科学版),2023,39(3):63-69,77.
[18] 曹叶霞,李慧卿,尹爱萍,等.超声辅助提取罗望子中总多酚及其抗氧化性研究[J].粮食与油脂,2023,36(1):131-134,138.
[19] 李美凤,赵建伟,王晓雅,等.松露多酚的提取纯化工艺研究[J].中国调味品,2023,48(5):131-135.
[20] 李剑梅,朱万芹,柴林山,等.蛹虫草多酚提取工艺优化及其抗氧化活性[J].食品研究与开发,2023,44(8):111-117.
