“疲惫式衰老”:压力,活性氧与炎症
2024-06-16黄焱姜山山YoussefMaach刘玮
黄焱 姜山山 Youssef Maach 刘玮
本文探讨了现代生活中压力如何通过增加活性氧(ROS)和炎症反应促进衰老。压力不仅会引起心理和生理疲劳,还会进一步导致ROS累积过度,所引起的氧化应激致DNA断裂,细胞增殖受损,最终致使细胞衰老。此外,慢性压力还通过影响免疫系统,加剧免疫衰老。细胞衰老与长期压力之间存在一定相关性,各类生活压力引起的皮肤困扰已成为现代人群广泛关注的焦点问题,也为皮肤护理行业提供新的产品开发思路。
关键词:应激反应,氧化应激,自由基,细胞衰老
随着社会经济水平发展,中国居民的生活条件大幅改善,但现代生活方式也伴随着种种压力,社交媒体上频繁出现“累丑”“疲惫式衰老”“熬夜脸”等说法。各类生活压力引起的皮肤困扰已成为现代人群广泛关注的焦点问题,这值得皮肤相关研究者引起注意。
消费者口中提到的“疲惫式衰老”,从研究角度来说,指由于压力/应激反应(stress response)引起的衰老。从心理学观点来看,压力是一种个体内部的紧张状态和情绪。从生理学观点来看,压力是一种对躯体的唤醒,也可以说是人体的一种生理防御反应 机制[1],人体在面对压力时会激活一系列复杂的生理过程,以恢复内稳态、保护生命,并最终实现物种的进化成功。压力反应的重要性在于其通过神经和激素网络优化认知、心血管、免疫和代谢功能,从而提高生存机会。下丘脑-垂体-肾上腺轴(hypothalamic–pituitary– adrenal axis, HPA)是人类应对压力反应的关键性调节系统,HPA轴输出的皮质醇通过抗炎作用、调节免疫反应、影响代谢和情绪认知,对生理机能产生广泛影响[2]。
适度压力有助于机体调节内稳态,但过度压力/应激反应会对机体产生不利影响,主要表现之一则是产生疲劳。疲劳是一种复杂的生理和心理现象,早在20世纪初就已经存在相关研究[3]。疲劳在人们日常生活中分为多种,比如学习疲劳、职业疲劳等等,是指个体在工作学习等劳动中产生的一种倦怠感。疲劳通常伴随着困倦、无力、烦躁等主观感受,表现为精神水平或身体活动能力的下降[4]。生活中如果疲劳感严重,不仅影响工作效率,还会 因疲劳累积而导致心理和生理方面发生各种不适。心理方面表现在出现低迷、烦躁、低落等负面情绪反应;生理方面如腰、颈、肩等部位出现酸痛和酸麻,这些心理和生理变化可能也会影响到皮肤状态,如面部皮肤出现出油氧化、暗沉、细纹等问题。
衰老(Aging)是一个自然发生、复杂的整体性生理过程。其特点是生理完整性逐渐丧失,导致功能受损,甚至死亡。López-Otín C等在2013年和2023年共提出与衰老相关的12个分子、细胞和系统特征(hallmarks),12个特征之间互相作用制衡,彼此密切相关,且每个特征都可被视为探索衰老过程和开发新式抗老产品的切入点。12个衰老特征模型中:①基因组不稳定(genome instability)主要涉及DNA损伤和修复机制的失衡导致基因突变累积,这可能影响干细胞功能,加速组织老化和增加老年病风险;②端粒是染色体末端的保护帽,端粒磨损(telomere attrition)与细胞分裂能力下降相关,可能导致细胞衰老或凋亡;③细胞衰老(cellular senescence)是由于细胞经历一定次数的分裂后进入永久性的生长停滞状态,这些细胞可能通过分泌炎症因子影响周围细胞;④慢性炎症(chronic inflammation)则是随着年龄的增长,体内炎症水平上升,可能导致组织损伤和修复能力下降[5,6]。皮肤作为人体最大的器官,不仅在保护身体免受外界侵害中起着关键作用,而且其衰老过程与整体性老化紧密相关。皮肤衰老的特征是结构、细胞和分子层面的变化,以及衰老细胞的累积。衰老细胞,即处于永久性细胞周期停滞的细胞,会分泌衰老相关分泌表型(SASP),这些因子能诱导邻近正常细胞进入衰老状态[7]。
本文基于以上四个衰老特征,结合胞内氧化应激引起的细胞增殖受损和胞外炎性因子对免疫系统造成的损伤,讨论了压力反应对整个机体衰老的影响,以及近年来压力应激和衰老两个领域的研究内容对皮肤护理行业的启发,并展望护肤品行业未来潜在的应用场景。
Part 1
压力/应激造成的氧化应激过度会加速衰老
近年来,越来越多证据表明,伴随氧化应激出现的ROS上调被学术界认为是人体衰老的关键因素之一[8]。随着年龄的增长,人体各个层面的功能逐渐下降,对压力、损伤和疾病的抵抗力逐年降低。除了基因表达和受代谢所控的生理自然变化以外,与衰老速度有关的还与高水平的ROS和/或RNS(活性氧和活性硝化物)的产生有关。
研究表明,ROS水平的特定增加可能对细胞衰老过程的诱导和维持起到关键作用。ROS、衰老、衰老相关病理和细胞衰老之间的因果关系正在被广泛研究。由内源性和外源性诱因产生的ROS,包括H2O2、超氧自由基、阴离子自由基和羟基自由基,以环境依赖的方式抑制细胞生长,诱导细胞死亡和衰老[9]。
综上,对于ROS的深入研究,可以帮助研究者更进一步讨论研究由压力引起的氧化应激。
1.1 ROS
自由基理论最早由 Denham Harman提出[10] 。自由基是指原子中含有一个或多个未成对电子的任何存在物种。包括活性氧(Reactive Oxygen Species, ROS)和活性氮(Reactive Nitrogen Species, RNS),二者在衰老过程中起到关键作用[11]。
ROS 是分子氧(O2)的代谢产物,其反应活性高于O2。ROS 包括超氧自由基(O2·ˉ)和羟自由基(HO·)等不稳定氧自由基,以及过氧化氢(H2O2)等非自由基分子。这些 ROS 是正常有氧代谢不断产生的副产物,尤其出现在线粒体的呼吸作用中。可以从外部环境中吸收,在压力和病理条件下细胞也会产生更多的 ROS。由此可见,生活在有氧环境中的所有生物都会持续暴露于ROS中[12,13]。
ROS参与调节生理功能,包括信号转导、基因表达和细胞增殖。 ROS 在众多信号通路中作为信号分子发挥作用,目前关于ROS的研究已不再被视为单纯的细胞代谢副产物研究,而被视作“氧化还原生物学”的重要组成部分[14]。
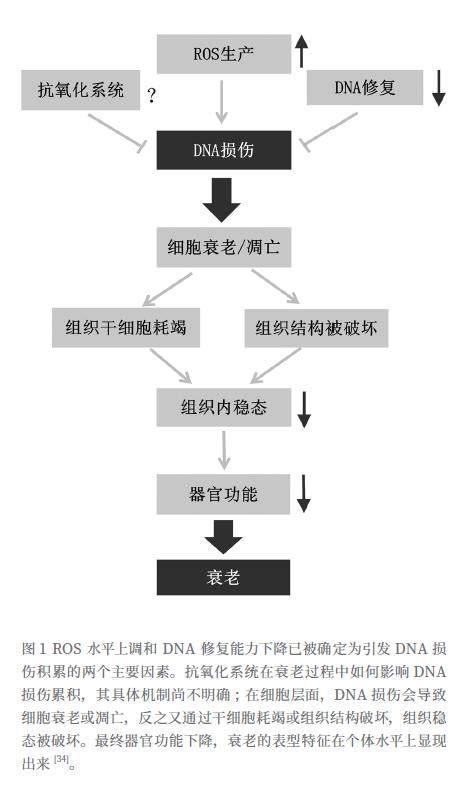
通常维持在正常水平的ROS能够诱导适应性反应(adaptive response)来强化防御机制,对寿命延长和抵御应激反应均有益处;但长期暴露于环境压力中,ROS的产生量骤增或抗氧化剂水平不足会导致ROS水平异常,机体适应性反应不足(insufficient adaptive response),细胞中的促氧化-抗氧化剂平衡(pro-oxidant/anti-oxidant balance)被破坏。平衡向促氧化方向移动,过量ROS 超过细胞解毒(抗氧化)能力,对包括 DNA 在内的重要生命物质(如核酸、脂质、蛋白质、多不饱和脂肪酸、碳水化合物)造成氧化损伤,这种状态又被称为氧化应激(oxidative stress)[9,15]。
氧化应激损伤根据不同应激源,一般分为外源性和内源性损伤。外源性损伤包括紫外线照射、电离辐射和其它环境有害物质(重金属、有害化学物质、空气污染、噪音污染等),机体暴露于这类外源性损伤则会产生过量ROS。人体内源性损伤往往来自长期不健康的生活方式,一般包含几个方面:①高 糖、高脂肪、高盐等不健康饮食;② 缺乏运动;③吸烟、酗酒、熬夜等不良习惯;④工作、学习、人际等带来的压力和焦虑。内源性损伤同样会引起人体ROS过度累积,产生氧化应激[16]。以上因素造成的ROS累积过度也会对胎儿产前发育造成不利影响[17]。
对皮肤这一代谢旺盛的屏障器官而言,其高速周转有赖于表皮祖细胞的快速增殖和代谢活性,并依赖线粒体呼吸产生的三磷酸腺苷(ATP)来满足能量需求。线粒体呼吸过程由位于线粒体内膜上的一系列统称为电子传递链(Electron Transport Chain, ETC)的蛋白质复合物,通过线粒体内的氧化磷酸化(OXPHOS)驱动产生ATP。不光皮肤细胞增殖相关,整个机体生命活动都需要 ATP 来满足能量需求。但线粒体呼吸过程中不可避免地会产生活性氧(ROS),如超氧化物、单线态氧和过氧化物。如前文所述,如果这些ROS不能被抗氧化系统淬灭,就会破坏大分子和细胞结构。线粒体DNA(mtDNA)编码13个OXPHOS蛋白质,由于mtDNA与ETC在线粒体中距离相近,mtDNA极易因ROS骤增发生突变,而突变必然会破坏 OXPHOS,引发 ROS 生成增加和 mtDNA 损伤的恶性循环[18]。有研究表明,H2O2或抑制抗氧化酶的外源性处理会引起人成纤维细胞的过早衰老[19]。同样地,在高氧浓度环境下生长的细胞通常会出现衰老,而与生理相关的低氧条件下生长的细胞增殖周期则会延长[20,21]。并且细胞衰老后,线粒体是首先受到影响的细胞器,生产ATP的能力也会因此受损,形成恶性循环。
细胞呼吸产生ROS所造成的氧化损伤已被证实是包括衰老和癌症在内的多种病理生理状况的分子基础。不光是皮肤,氧化应激损伤的渐进和不可逆积累会导致机体全身性生理功能受损、疾病发病率增加,从而加速机体衰老过程,这是目前氧化应激领域研究者的普遍共识[22]。
1.2 ROS导致DNA断裂
ROS 尤其是羟基自由基会对 DNA 造成氧化损伤,其中包括 ① 碱基突变;②单链和双链断裂;③DNA 蛋白交联;④形成 DNA 加合物[23]。已有证据表明,ROS 作为突变因子造成的 DNA 损伤会参与诱导、延长细胞衰老过程[24]。根据衰老自由基理论,ROS是细胞衰老的诱因,包括超氧自由基(O2·ˉ)、羟自由基(HO·),以及过氧化氢(H2O2)。作为具有膜渗透性和长寿命的分子,H2O2可以直接影响细胞DNA,诱导单链和双链断裂(分别为Single-strand breaks, SSBs和Double-strand breaks,DSBs)。其中双链断裂是较为严重的DNA 损伤反应(DNA damage response, DDR)形式。通常DDR激活通过启动p53/p21 [25,26]或p16/pRb途径导致细胞周期阻滞。p53/p21WAF1/CIP1在端粒损耗、氧化或致癌压力导致的DNA损伤时被激活。连续的DNA损伤应答(DDR)信号导致p53长期激活,从而诱导细胞衰老[27,28]。持续的、未经修复的DNA双链断裂是细胞衰老的一个广泛特征[29,30,31]。
DNA 损伤后,DNA 损伤反应(DNA damage response, DDR)被激活,细胞周期停止,以重塑和修复 DNA。DNA 损伤反应(DDR)是细胞对 DNA 损伤做出反应时启动的分子途径。DNA 损伤反应可导致细胞发生三种情况:暂时性细胞周期停滞、细胞衰老(永久性细胞周期停滞)或细胞凋亡 [32]。如果未能得到修复,DNA损伤会导致各种突变,并破坏翻译和转录的稳定性[33];如果损伤被修复,DDR 介导的细胞周期停滞是短暂的(暂时性细胞周期停滞),细胞会重新进入细胞周期。但如果 DNA 损伤水平过高,无法被修复,则会发生永久性细胞周期停滞,细胞随即进入衰老或凋亡[23]。
以UV对表皮干细胞造成的损伤为例,紫外线辐射诱导的表皮干细胞 DNA 损伤会导致皮肤老化。如前文所述,紫外线辐射是外在的主要应激源之一,紫外线造成的DNA损伤会导致细胞周期停滞和DNA修复蛋白激活、干细胞龛及真皮成纤维细胞受损。这些都会加速干细胞耗竭和细胞外基质(ECM)完整性的丧失,从而导致皮肤过早老化[35]。
1.3 DNA损伤导致细胞增殖受阻,细胞衰老
细胞周期是一系列与细胞分裂有关的过程,整个过程高度有序,目的是将遗传信息从一代细胞准确复制到下一代,对多细胞生物体的发育和生存至关重要。此过程分为以下阶段:G0期、M期、 G1期、S期、G2期。其中G1、S 和 G2 期称为间期。G1期是有丝分裂(M 期)和 DNA 合成(S 期)之间的间隔期。在 G1 期,细胞受到胞外有丝分裂原和生长因子的刺激,在这些刺激下,细胞经过 G1 期,在 S 期进行 DNA 合成。G2 期是 DNA 合成(S 期)和有丝分裂之间的间隔期。M 期则是纺锤体形成、姐妹染色单体分离和细胞分裂时期。G0期是指处于静止状态(暂时或永久脱离周期)的细胞。正常细胞依靠外部刺激(有丝分裂原或生长因子)脱离 G0期,进入 G1 早期[36]。
衰老细胞的生长停滞则发生在G1期,以防止受损细胞的 DNA 复制启动[37];也可能停止在 G2 期,以阻止 DNA 损伤前提下的有丝分裂 [38]。如果细胞在S期遇到氧化损伤,更有可能进入永久周期阻滞并经历过早衰老[39]。
以人类成纤维细胞为例,进入衰老状态时,细胞增殖受阻同样发生在G1期[40]。且衰老成纤维细胞的G1期增殖受阻不可逆,细胞不再对有丝分裂信号作出反应。并且与年轻成纤维细胞相比,衰老的成纤维细胞中ROS水平更高 [41]。
综合以上证据,细胞衰老虽然受多方面因素影响,但细胞周期被抑制是其决定性特征,细胞周期长期受到阻滞则意味着细胞无法继续分裂,增殖受阻,这是细胞发生衰老不可或缺的重要标志之一。细胞周期停滞可能是异常增殖或有害应激刺激引发的警报,以防止功能失调细胞的异常增殖,一般认为对所有细胞衰老表型(SASP)的发生和持续起关键作用[42]。
Part 2
压力/应激损伤免疫细胞导致衰老水平加剧
人类的压力反应(stess response)是为了在真实或感知的压力条件下维持体内内环境平衡而进化而来的,压力反应是一种机制,可以通过下丘脑-垂体-肾上腺轴(hypothalamic–pituitary– adrenal axis, HPA)、中枢和外周自主神经系统和免疫系统之间的复杂相互作用来恢复内稳态过程并促进自我保护[2]。神经内分泌系统和免疫系统之间的联系在不同的研究中均有所报道[43,44]。有研究表明,慢性压力会影响免疫系统,诱发大脑和外周免疫系统的炎症变化 [45,46,47]。从而抑制和失调免疫功能,导致免疫衰老[48,49]。压力会激活HPA轴,下丘脑分泌的促肾上腺皮质激素释放激素通过介导肾上腺释放糖皮质激素来抑制免疫反应。免疫系统与HPA轴相互作用,形成负反馈机制。研究发现,糖皮质激素能抑制淋巴细胞的增殖,对免疫系统也有促炎作用,糖皮质激素通过应答ATP提高 IL-1β分泌量,以此增强炎性小体NLRP3的功能[50,51]。炎症体是多种蛋白质复合物,可感知外部和内部危险信号,导致促炎细胞因子裂解为成熟的细胞因子,包括 IL-1β 和 IL-18。另一方面,糖皮质激素也能减少多种促炎细胞因子的表达,如白细胞介素IL-6 和肿瘤坏死因子TNF-α,并能增加抗炎细胞因子(如 IL-10 和 TNF-β)的表达[52,53,54]。
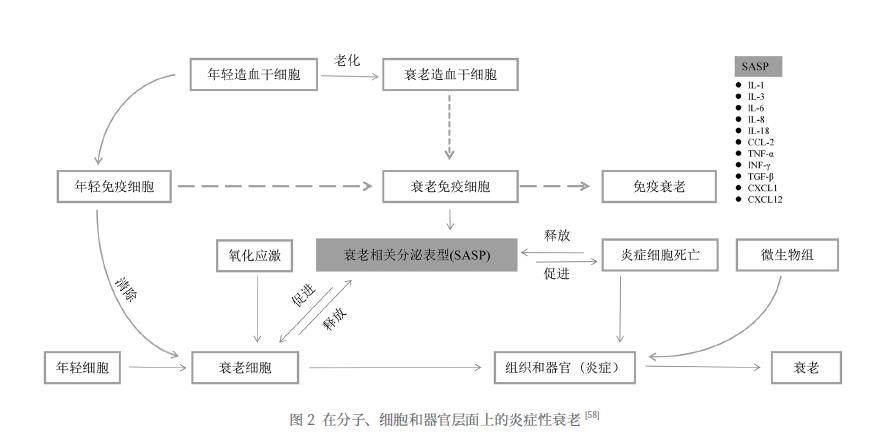
除了分裂周期永久性停滞,炎症也是机体防御机制的一部分。当免疫系统识别、消除内部或外来有害刺激并开始愈合时就会引发炎症。炎性衰老(inflammaging)这一概念是从免疫衰老(immunosenescence)延伸出的。衰老过程中,机体由于持续性的抗原刺激和压力诱导,出现应对应激能力下降,促炎反应慢性进行性加重,是免疫衰老最显著的后果之一。免疫系统衰老后,无法清除衰老细胞和促炎因子,炎症水平会相应升高;而当低水平的慢性炎症逐渐累积,会进一步加剧衰老,形成恶性循环[55]。
衰老是一种复杂通路交错的细胞生理过程,其特点是细胞周期不可逆转的停滞和促炎症表型,通常称为衰老相关分泌表型(SASP)[56]。从分子层面来看,细胞衰老后会分泌促炎因子,SASP 促进衰老细胞的细胞周期停滞,刺激免疫系统清除潜在的致癌细胞,限制纤维化,促进伤口愈合和组织再生;但另一方面,SASP 也会促进慢性炎症发生,推动正常细胞步入衰老进程。随着年龄的增长,机体的免疫功能下降、自噬失调和端粒缩短等变化导致衰老细胞的积累增多,从而引发了炎症因子水平的上升,这可能进一步促使各种疾病发生。因此,SASP 可被视为细胞老化的一个重要特征[57]。从细胞层面上看,免疫细胞是衰老细胞的关键调节因子,肩负着清除衰老细胞的重任,一直是衰老研究的重点。免疫细胞由骨髓造血干细胞分化而来,造血干细胞衰老后,免疫细胞会发生功能障碍,加剧免疫系统衰老。并且,随着生命的流逝,大部分免疫细胞各自呈现出衰老特征,对内表现为清除衰老或损伤细胞困难,对外表现为机体抵抗力减弱[58]。
研究指出, IL-6与由DNA损伤引起的角质细胞、黑素细胞和成纤维细胞的老化过程相关联[59]。在老化的成纤维细胞、上皮细胞以及由化疗诱导的老化肿瘤细胞中,IL-1的表达增加,能够与IL-1 受体或Toll 样受体结合, 进而激活NF-kB, 促进SASP 的表达[60]。Quan 等在年龄老化和光老化的皮肤中观察到MMPs 的高水平表达,以及胶原蛋白基质的快速降解[61,62]。
在人的一生中,细胞衰老、炎症和皮肤功能低下之间的关系可能会循环往复,衰老细胞产生的促炎症皮肤环境加速了皮肤 ECM 的损伤和重塑,同时破坏人体细胞的适应性免疫过程。此外,衰老免疫细胞的积累和适应性免疫反应下降,可能会促进衰老皮肤细胞的存活以及胞外基质的破坏[63]。
Part 3
小结和展望
综合压力对机体氧化损伤的累积和炎性因子上升来看,细胞衰老和机体经历的长期压力之间存在高度相关性:随着外源压力和内源压力不断积累,ROS 因氧化损伤上升,导致细胞增殖受阻,衰老细胞的积累增多;老化细胞影响其邻近细胞的健康状态,并改变细胞间通讯,扰乱内环境稳态。另一方面,免疫功能下降,炎症因子水平同步上调,进一步促使机体细胞衰老发生。日常生活中不同应激源导致的衰老是一个综合衰老状态,各类细胞长期处于慢性压力应激下,细胞功能下降,主观感受包括但不限于“困倦/疲倦感”“皮肤状态不佳”等等。如文中所述,细胞增殖从启动到终止的整个过程都需要能量代谢的参与。持续的能量供给才能保障机体持续新生的需求。基于以上调研,能量供给和细胞增殖之间存在着紧密的关联。综合上述的机制分析,促进细胞新生增殖能力和提升细胞新生相关的能量,不失为一个最具应用前景的抗“疲倦式衰老”解决方案。希望基于该篇综述,应激反应导致的衰老机理可以展开更深入的讨论研究,能引起皮肤护理等行业重视,为开发抗衰功效型产品提供更多的方向和解决思路。
作者介绍
黄 焱:化工博士 主要从事化妆品科学机理及应用研究 供职于上海黛芊信息科技有限公司。
姜山山:医学博士 主要从事化妆品科学机理及应用研究 供职于上海自然堂集团有限公司。
Youssef Maach:药学博士 主要从事化妆品科学机理及应用研究 供职于上海自然堂集团有限公司
通讯作者:
刘 玮:主任医师 教授 博士生导师 医学博士 主要研究方向为化妆品皮肤科学,涉及光敏感性皮肤病、化妆品不良反应以及化妆品功效研究等,供职于空军特色医学中心。
[ 参考文献]
[1] 季桐宇. 初中生学业压力、心理疲劳和学习拖延的关系及干预研究[D].扬州大学,2023.
[2]Russell G, Lightman S. The human stress response[J]. Nature reviews endocrinology, 2019, 15(9): 525-534.
[3] 杨小涵. 疲劳对建筑工人注意力影响的ERP 研究[D]. 重庆大学,2022.
[4] 朱小芳, 刘玉平, 孟冉. 护士职业疲劳现状及影响因素研究[J]. 全科护理,2023,21(21):3020-3024.
[5] López-Otín C, Blasco M A, Partridge L, et al. The hallmarks of aging[J]. Cell, 2013, 153(6): 1194-1217.
[6] López-Otín C, Blasco M A, Partridge L, et al. Hallmarks of aging: An expanding universe[J]. Cell, 2023, 186(2): 243-278.
[7]Franco A C, Aveleira C, Cavadas C. Skin senescence: mechanisms and impact on whole-body aging[J]. Trends in molecular medicine,2022, 28(2): 97-109.
[8] Cencioni C, Spallotta F, Martelli F,et al. Oxidative Stress and Epigenetic Regulation in Ageing and Age-Related Diseases[J]. Int JMol Sci. 2013,14:17643–17663.
[9]Davalli P, Mitic T, Caporali A, et al. ROS, cell senescence, and novel molecular mechanisms in aging and age-related diseases[J]. Oxid Med Cell Longev. 2016,2016:3565127.
[10]Harman D.Aging: A Theory Based on Free Radical and Radiation Chemistry[J].Journal of Gerontology, 1956.[11]Nayan R B, Pankaj B N, Acharya R N, et al. Evaluation of in vitro Antioxidant activity of Flowers of Cassia fistula Linn[J]. International Journal of Pharm Tech Research, 2011, 3(1): 589-599.
[12]Kregel K C, Zhang H J. An integrated view of oxidative stress in aging: basic mechanisms, functional effects, and pathological considerations[J]. American Journal of Physiolog y-Regulator y,Integrative and Comparative Physiology, 2007, 292(1): R18-R36.
[13]Beckman K B, Ames B N. The free radical theor y of agingmatures[J]. Physiological reviews, 1998.
[14]Schieber M, Chandel N S. ROS function in redox signaling and oxidative stress[J]. Current biology, 2014, 24(10): R453-R462.
[15]Videla L A. Oxidative stress signaling underlying liver disease and hepatoprotective mechanisms[J]. World journal of hepatology, 2009,1(1): 72.
[16]Aseervatham G S B, Sivasudha T, Jeyadevi R, et al. Environmental factors and unhealthy lifestyle influence oxidative stress in humans—an overview[J]. Environmental Science and Pollution Research, 2013,20: 4356-4369.
[17]Al-Gubory K H. Environmental pollutants and lifestyle factors induce oxidative s tre s s and poor prenat al de velopment[J].Reproductive biomedicine online, 2014, 29(1): 17-31
[18]Sreedhar A, Aguilera-Aguirre L, Singh K K. Mitochondria in skin health, aging, and disease[J]. Cell death & disease, 2020, 11(6): 444.
[19]Blander G, De Oliveira R M, Conboy C M, et al. Superoxide dismutase1 k n o c k - d o w n i n d u c e s s e n e s c e n c e i n h uma n fibroblasts[J]. Journal of Biological Chemistry, 2003, 278(40): 38966-38969.
[20]Chen Q, Fischer A, Reagan J D, et al. Oxidative DNA damage and senescence of human diploid fibroblast cells[J]. Proceedings of the National Academy of Sciences, 1995, 92(10): 4337-4341.
[21]Packer L, Fuehr K. Low oxygen concentration extends the lifespan of cultured human diploid cells[J]. nature, 1977, 267(5610): 423-425.
[22]Shmulevich R, Krizhanovsky V. Cell senescence, DNA damage, and metabolism[J]. Antioxidants & Redox Signaling, 2021, 34(4): 324-334.
[23]Zhao Z, Dong Q, Liu X, et al. Dynamic transcriptome profiling in DNA damage-induced cellular senescence and transient cell-cycle arrest[J]. Genomics, 2020, 112(2): 1309-1317.
[24]Van Deursen J M. The role of senescent cells in ageing[J]. Nature,2014, 509(7501): 439-446.
[25]Campisi J, d'Adda di Fagagna F. Cellular senescence: when bad things happen to good cells. Nat Rev Mol Cell Biol. 2007;8(9):729-740
[26]Miyauchi H, Minamino T, Tateno K, et al. Akt negatively regulates the in vitro lifespan of human endothelial cells via a p53/p21-dependent pathway. EMBO J. 2004;23(1):212-220.
[27]Beausejour CM, Krtolica A, Galimi F, et al. Reversal of human cellular senescence: roles of the p53 and p16 pathways. EMBO J.2003;22:4212–4222.
[28]Shao L, Li H, Pazhanisamy SK, et al. Reactive oxygen species and hematopoietic stem cell senescence. Int J Hematol. 2011;94:24–32.
[29]Slawińska N, Krupa R. Molecular aspects of senescence and organismal ageing—DNA damage response, telomeres, inflammation and chromatin[J]. International journal of molecular sciences, 2021,22(2): 590.]
[30]Giorgio M, Trinei M, Migliaccio E, et al. Hydrogen peroxide: a metabolic by-product or a common mediator of ageingsignals? Nat Rev Mol Cell Biol. 2007;8:722–728.
[31]Sedelnikova O A, Horikawa I, Zimonjic D B, et al. Senescing human cells and ageing mice accumulate DNA lesions with unrepairable double-strand breaks[J]. Nature cell biology, 2004, 6(2): 168-170.
[32]D'adda Di Fagagna F. Living on a break: cellular senescence as a DNA-damage response[J]. Nature Reviews Cancer, 2008, 8(7): 512-522.
[33]Polo, S.E., Jackson, S.P. Dynamics of DNA damage response proteins at DNA breaks: A focus on protein modifications. Genes Dev.2011, 25, 409–433.
[34]Jian-Hua Chen, C. Nicholes Hales, Susan E. Ozanne.DNA damage, cellular senescence and organismal ageing: causal or correlative?, Nucleic Acids Research, Volume 35, Issue 22, 15 December 2007, Pages 7417–7428.
[35]Panich U, Sittithumcharee G, Rathviboon N, et al. Ultraviolet radiation-induced skin aging: the role of DNA damage and oxidative stress in epidermal stem cell damage mediated skin aging[J]. Stem cells international, 2016, 2016.
[36]Israels E D, Israels L G. The cell cycle[J]. The oncologist, 2000, 5(6): 510-513.
[37]Campisi J, d'Adda di Fagagna F. Cellular senescence: when bad things happen to good cells[J]. Nature reviews Molecular cell biology, 2007, 8(9): 729-740.
[37]Roger L, Tomas F, Gire V. Mechanisms and regulation of cellular senescence[J]. International journal of molecular sciences, 2021, 22(23): 13173.
[39]Chen J H, Ozanne S E, Hales C N. Heterogeneity in premature senescence by oxidative stress correlates with differential DNA damage during the cell cycle[J]. DNA repair, 2005, 4(10): 1140-1148.
[40]Stein G H, Dulic V. Origins of G1 arrest in senescent human fibroblasts[J]. Bioessays, 1995, 17(6): 537-543.
[41]Hütter E, Unterluggauer H, ?berall F, et al. Replicative senescence of human fibroblasts: the role of Ras-dependent signaling and oxidative stress[J]. Experimental gerontology, 2002, 37(10-11): 1165-1174
[42]Kumari R, Jat P. Mechanisms of cellular senescence: cell cycle arrest and senescence associated secretory phenotype[J]. Frontiers in cell and developmental biology, 2021, 9: 485.
[43]Arambula, S.E.; McCarthy, M.M. Neuroendocrine-immune crosstalk shapes sex-specific brain development. Endocrinology 2020, 161, bqaa055.
[44]Quatrini, L.; Vivier, E.; Ugolini, S. Neuroendocrine regulation of innate lymphoid cells. Immunol. Rev. 2018, 286, 120–136.
[45]Rohleder, N. Stimulation of systemic low-grade inflammation by psychosocial stress. Psychosom. Med. 2014, 76, 181–189.
[46]Calcia, M.A.; Bonsall, D.R.; Bloomfield, P.S.; et al. Stress and neuroinflammation: A systematic review of the effects of stress on microglia and the implications for mental illness. Psychopharmacology 2016, 233, 1637–1650.
[47]Liu, Y.-Z.; Wang, Y.-X.; Jiang, C.-L. Inflammation: The common pathway of stress-related diseases. Front. Hum. Neurosci. 2017, 11, 316.
[48]Mathur M B, Epel E, Kind S, et al. Perceived stress and telomere length: A systematic review, meta-analysis, and methodologic considerations for advancing the field[J]. Brain, behavior, andimmunity, 2016, 54: 158-169.
[49]Seiler A, Fagundes C P, Christian L M. The impact of everyday stressors on the immune system and health[J]. Stress challenges and immunity in space: From mechanisms to monitoring and preventive strategies, 2020: 71-92.
[50]Sherr, C.J.; Roberts, J.M. CDK inhibitors: Positive and negative regulators of G1-phase progression. Genes Dev. 1999, 13, 1501–1512.
[51]Coppé, J.-P.; Rodier, F.; Patil, C.K.;et al. Tumor Suppressor and Aging Biomarker p16INK4a Induces Cellular Senescence without the Associated Inflammatory Secretory Phenotype. J. Biol. Chem. 2011, 286, 36396–36403.
[52]Storer M, Mas A; Robert-Moreno A, et al. Senescence Is a Developmental Mechanism that Contributes to Embryonic Growth and Patterning. Cell 2013, 155, 1119–1130.
[53]Roger L, Tomas F, Gire V. Mechanisms and regulation of cellular senescence[J]. International journal of molecular sciences, 2021, 22(23): 13173.
[54]Kim I B, Lee J H, Park S C. The relationship between stress, inflammation, and depression[J]. Biomedicines, 2022, 10(8): 1929.
[55]王秋懿,靳建亮.衰老对免疫系统的影响及其干预机制的研究进展[J].医学研究与战创伤救治,2023,36(03):311-316.
[56]Martini H, Passos J F. Cellular senescence: all roads lead to mitochondria[J]. The FEBS Journal, 2023, 290(5): 1186-1202.
[57]He S, Sharpless N E. Senescence in health and disease[J]. Cell, 2017, 169(6): 1000-1011.
[58]Li X, Li C, Zhang W, et al. Inflammation and aging: signaling pathways and intervention therapies[J]. Signal Transduction and Targeted Therapy, 2023, 8(1): 239.
[59]Ghosh K, Capell B C. The senescence-associated secretory phenotype: critical effector in skin cancer and aging[J]. Journal of Investigative Dermatology, 2016, 136(11): 2133-2139.
[60]Chang B D, Swift M E, Shen M, et al. Molecular determinants of terminal growth arrest induced in tumor cells by a chemotherapeutic agent[J]. Proceedings of the National Academy of Sciences, 2002, 99(1): 389-394.
[61]Quan T, Fisher G J. Role of age-associated alterations of the dermal extracellular matrix microenvironment in human skin aging: a mini-review[J]. Gerontology, 2015, 61(5): 427-434.
[62]王珏,王佳琦,陈珩,等.皮肤衰老相关的生物标志物及其作用机制的研究进展[J].组织工程与重建外科,2023,19(06):586-590.
[63]Lee Y I, Choi S, Roh W S, et al. Cellular senescence and inflammaging in the skin microenvironment[J]. International journal of molecular sciences, 2021, 22(8): 3849.