精加工聚丙交酯及聚己内酯基心血管支架研究进展
2024-06-14侯君孝王羽唐璐董志红
侯君孝 王羽 唐璐 董志红


收稿日期:2023-10-07
基金项目:四川省科技厅科技成果转化示范项目(23ZHSF0321);国家级大学生创新创业训练计划创业实践与创业训练项目 (2022110790015);省级大学生创新创业训练计划创业实践与创业训练项目 (S202311079008X)
作者简介:侯君孝(1997—),男,硕士研究生,从事生物活性材料应用研究.Email:384991150@qq.com
通信作者:董志红(1978—),女,博士,教授,从事生物活性陶瓷材料用于组织修复的应用研究.Email:zhdong@cdu.edu.cn
摘要:临床上治疗心血管疾病,通常在狭窄部位安置高分子可降解聚合物基血管支架,其主要作用是封堵破口及支撑血管真腔(3~12月),保持长期血管通透性.然而,术后并发症,如血管再狭窄阻碍了血管支架长期使用,并给患者带来高昂医疗费用.针对这一问题,介绍了血管支架的加工方法,以及聚丙交酯与聚己内酯基可降解聚合物支架材料研究进展与临床应用,并对聚合物材料在心血管支架中的应用研究进行了展望.
关键词:聚丙交酯;聚己内酯;精加工;心血管支架
中图分类号:R318.08
文献标志码:A
0引言
心血管疾病包括冠心病、冠状动脉疾病和急性冠脉综合征.目前,冠状动脉疾病的主要治疗方法包括经皮冠状动脉治疗(PCI)和冠状动脉旁路移植术,其中PCI治疗更为常用.近年来,支架的提出和发展促进了PCI在临床上的应用,1986年临床上首次将裸金属支架(316L SS)植入患者体内,促进血管的高通畅率,但免疫排斥反应严重,植入2~3个月内,支架再狭窄率高达30%,后期会形成血栓和双重抗血小板出血,另外支架的弹性扩张会导致血管损伤和一系列愈合反应[1].随着科学研究的不断深入,为解决心血管狭窄,临床上出现了很多产品.例如,基于不锈钢平台的第一代药物洗脱支架,其中最具代表的是负载紫杉醇的Taxus支架[2]和负载西罗莫司的Cypher支架[3],成功将支架内的狭窄率下降至5%以下,不足之处在于,药物释放不可控,血液相容性差,晚期血栓的形成使死亡率仍高达30%.而第二代药物洗脱支架在材料和载药上均有所改进,选用了更具弹性和强度的钴铬(CoCr)或铂钴(PtCo)合金取代不锈钢材料[4].在药物方面,选择抗增殖作用更强的依维莫司[5]和他克莫司,其中,依维莫司Xience V支架具有出色的临床表现,但2年后仍具有形成血栓的风险.自此之后,生物可降解支架成为新的替代品,其优势在于不仅具有较好生物学特性,还具有较低的径向力和较快的降解时间,本文重点阐述精加工心血管支架的制备方法及高分子聚丙交酯(PLA)和聚己内酯(PCL)降解聚合物支架材料在心血管疾病中的应用研究.
1生物降解聚合物支架的制备方法
由于血管支架的尺寸小,所以对支架的精度有较高要求,材料本身的性质对加工方法也有一定限制,故制备方法对支架的性质和能否植入成功起着至关重要的作用,常见的制备方法有注塑成型、激光切割、静电纺丝和3D打印等[6].
1.1注塑成型
注塑成型是一种简单且通用的加工技术,其机制是将热塑性材料或热固性材料注入要求的血管支架模具中以制备血管支架,通过这种方法可以大量制备相同结构和规格的血管支架[7].Xu等[8]用PCL作为原料,通过微型注塑机设计了2种类型的支架,不同部件被组装并焊接成3~5 mm的支架,这些支架为球囊膨胀,且自带锁定设计,该支架在降解实验中,抗压强度和塌陷压力没有明显降低,依然保持稳定.Lee等[9]通过注塑和热点焊接制备了PCL可生物降解分叉支架,可生物降解的分叉支架将主血管和2个分支整合为1个部分,特别是在冠状动脉吻合处.特殊设计可以防止动脉吻合部位的再狭窄,还可以表现出与商业金属支架相当的机械性能.然而血管支架体积较小,结构复杂,故注塑成型的方法难以达到较严格的精度要求,同时,支架的填充和脱模过程较为困难,且模具的单一性难以满足个体化医疗[10].Li等[11]提出了一种自适应优化算法,通过研究利用克里金模型以改善PLA支架注塑成型工艺参数,减少计算时间,与同类设计结果相比,残余应力降低了20.3%,而翘曲减少了44.6%,同时运行基于MOLDFLOW的有限元方法对支架的注塑工艺进行建模(见图1),以获得特定工艺参数组合下成型质量的响应,数值结果与研究的设计优化方法相结合,有助于进一步优化和开发通过微注射成型工艺制备聚合物支架的方法.
1.2激光切割
激光切割可分为2种:1)是在聚合物板上雕刻所需的平面形状,将雕刻板压成圆柱体,然后将两端熔化并黏合制成血管支架;2)使用高分子材料制造管状材料,通过激光切割在聚合物管上雕刻所需的结构,最后将血管支架与管子切断.Abizaid等[13]使用二氧化碳(CO2)激光切割250 mm厚的聚(L丙交酯)(PLLA)和聚(丙交酯乙醇酸)(PLGA)片材以制备聚合物支架.激光参数优化后,支架支柱的厚度可以控制在300 μm以内.力学性能测试表明,CO2激光器制备的单元杨氏模量和极限抗拉强度优于准分子激光器.CO2激光产生的边缘可以增强支架的机械性能.因此,证实了用CO2激光制备支架的可行性.Giglio等[14]探索了通过1.08 μm波长光纤激光器制备血管支架的可行性.结果表明,PCL板材切割具有可行性,锥角小于95.75°时,PCL板材的切割精度可达0.033%以上.随着激光产生能量密度输入的增加,结晶度百分比增加.此外,光纤激光工艺对聚合物的机械性能影响很小.这项研究表明了1.08 μm波长光纤激光器制备PCL支架的可行性.然而,其适用性仍然有限,如在制备过程中容易形成热损伤,导致支架表面形成轻微裂痕和条纹,这对支架的机械性能可能会有影响;同时,激光切割可能会形成过于锋利的血管边缘导致血管损伤[15].超短脉冲激光切割(如皮秒和飞秒)的高峰值功率将使材料在很短的时间内达到汽化温度,材料的快速升温将使长脉冲激光切割过程中存在的缺陷最小化,但仍存在烧蚀率低、购置成本昂贵与维护成本高等缺点,故在临床上尚未实现商业化应用.
1.3静电纺丝
静电纺丝在制备用于发育血管的纤维支架方面显示出巨大的潜力.其可以生产纤维直径可控的微纳米级无缝纤维管.在技术上,静电纺丝涉及1个物理过程,其中黏弹性溶液在高静电力下拉伸成溶液射流并固化形成细纤维.静电纺丝纤维的形态会受静电纺丝参数的影响,如溶液黏度、电导率、聚合物分子量、施加电压、聚合物溶液的流速、纺丝距离、湿度和温度等[16].研究表明,增加聚合物浓度、聚合物分子量或溶液黏度会导致纤维直径增加,因此,提高聚合物溶液的电导率在一定程度上可减小静电纺丝纤维直径.静电纺丝应用于多种聚合物的制备加工,其中包括合成聚合物、天然聚合物和混合聚合物.通过静电纺丝制备平均纤维直径为500~2 500 nm的纳米纤维支架和1.9 μm的PCL微纤维支架,血管直径分别为2 mm和4 mm[17].杨磊等[18]报道了PCL电纺丝过程中的旋转速度越高,纤维分布越窄,弹性模量越高.例如,以250 r/min制备的纤维支架的弹性模量高达10 MPa,而以1 500 /min制备的支架的弹性模量高达58 MPa.采用静电纺丝技术逐层制备双层管状静电纺丝纤维支架,内层为柔软的PCL,外层为硬质的PLA,柔软的PCL层模仿天然血管的内膜层,而坚韧的PLA层模仿天然血管的外膜层.静电纺丝PCL/PLA纤维支架显示出较好的机械性能,杨氏模量为(30.9±6.6)MPa,接近于PCL支架的3倍[18].天然聚合物也可用于制备血管,如丝素蛋白(SF)和明胶等,但较合成聚合物相比,其机械性能较低.Zhou等[19]优化了SF血管的制造工艺,采用静电纺丝法制备SF纤维支架,再经甲醇处理,拉伸强度值从0.36 MPa增加到3.57 MPa.经处理的SF支架比未经处理的SF支架结晶性更高.差示扫描量热法(DSC)分析测得的熔融/分解温度(T)和焓值(ΔH)通过延长甲醇处理时间至15 min可使T和ΔH都提升至较高值,对于未处理样品.T和ΔH分别为279.70 ℃和130.13 J/g,对于甲醇处理的样品,T和ΔH分别为287.20 ℃和138.44 J/g.明胶被认为是构成天然血管的主要成分,静电纺丝明胶纳米纤维管状支架,内径为5 mm,平均纤维直径为067 μm[16].而交联后,可提高材料的溶解性,当用作血管移植物时,交联支架相较于天然胶原蛋白表现出更合适的机械性能.例如,交联支架的杨氏模量在轴向上约为33.8 MPa,而天然胶原蛋白的杨氏模量为5~10 MPa[20].使用混合聚合物制备血管支架,表现出良好的机械性能和生物相容性,由PLLA/PCL(70∶30)制成的小直径血管(内径3 mm)在圆周方向上的拉伸强度为(3.9±0.3)MPa,而天然腹主动脉在同一方向上的拉伸强度为5.29 MPa,表现出良好的润湿性(接触角为0°)[21].
1.43D打印
3D打印支架可以根据患者特定的病变环境和复杂的几何形状进行设计,并优化机械行为[22].通常用于制造血管支架的3D打印包括挤出3D打印、喷墨3D打印和紫外线辅助3D打印.挤出3D打印是最常见的打印方法,Attalla等[23]制造了一种具有3层空心通道的装置来制备异质血管支架,3个喷嘴通过微流体通道连接,用于将生物墨水引导到相应通道的中心.通过将各种材料装入不同的喷嘴并调整其尺寸,可以制造异质和中空结构,但打印高分辨率结构时易受到限制.Jin等[24]开发了一种优化的打印路径,以提高结构质量,通过应用设计的隐式算法使角度减小,并通过优化路径上点的位置实现了均匀的间距,这种方法提高了结构质量.然而,对于具有任意形状结构的3D打印,路径规划需要进一步研究.Geng等[25]通过3D打印熔融沉积建模增材技术制造了一个扁平支架,并将扁平支架折叠起来形成可生物降解的PCL支架.力学测试表明,3D打印在变力作用下表现出优异的性能.在喷墨3D打印中,液滴通过小直径喷嘴喷射以选择性沉积,执行器的大部分功率是热功率或压电功率.基于多组分材料,还可以通过喷墨3D打印不同颜色的结构.Hewes等[26]通过喷墨3D打印制备了具有圆形图案打印路径的血管支架,内皮细胞负载的生物墨水由藻酸盐和纤维蛋白原组成.然而,用这种方法很难制备复杂的结构,且传统的喷墨3D打印对支架的打印速度较慢,通常还需要辅助固化装置.电流动力学喷墨(EHD)3D打印作为一种新兴的打印方式,其原理为高压电场驱动的液滴喷射,高压电场在喷嘴和基板之间产生.Lee等[27]研究了一种基于EHD 3D打印和熔融沉积成型(FDM)技术的直接书写系统.在这种情况下,通过电场快速切换到EHD 3D打印和FDM 3D打印的模式,基于微尺度喷墨3D打印和宏观尺度FDM 3D打印,制备了多尺度支架.紫外线辅助3D打印原理为印刷材料在紫外线照射过程中固化,与挤出式和喷墨式相比,可以实现更高的结构精度,更适用于血管的复杂结构[28].但传统的紫外线辅助存在的劣势包括低光穿透、高光漂白和对细胞的损害等,故紫外线辅助3D打印可能仅为一个临时的选择[29].
生物降解聚合物支架制备方法的比较见表1.
2可降解聚合物支架的应用
作为体内支架材料,应具有良好的生物相容性,并且无毒与无致畸.在促进组织生长及愈合时,能及时降解,即可避免产生免疫排斥反应,因此好的生物降解材料要满足降解和组织生长相匹配,并随着汗液和尿液等代谢排出,但是这样的材料开发起来难度较大,本文针对广泛研究的PLA和PCL可降解材料,进行阐述.
2.1PLA
PLA是一种可生物降解的聚合物,对于血管支架而言,PLA具有高生物相容性、良好的加工性和良好的机械性能,可在2~3年内完全降解,是第三代血管支架的常用材料.但PLA也存在韧性差、机械强度低、降解速度慢及难以进行表面改性等缺点,使得新生内膜增生、血管反冲和冠状动脉再狭窄(ST)发生率增高[30].为了增强PLA基支架的力学性能和降解行为,可对PLA基进行复合.
2.1.1PLA/金属复合
镁(Mg)是支架制备的最有前途元素之一,因为其具有高强度,相对无毒性且具有最为关键的生物相容性[31],纯PLA支架至少6个月的医学图像显示了其降解速率令人难以接受.Hasanpur等[32]通过卷起薄复合薄膜中采用激光切割网格并使用激光束焊接连接末端制造PLA/Mg支架,该复合支架在结晶度、微晶分布和聚合物吸水方面均优于纯PLA支架;另一方面,人体内的腐蚀环境会导致Mg颗粒逐渐侵蚀,留下多孔结构,Mg降解产生的碱性环境也可以中和体内的酸性物质并缓解炎症.
2.1.2PLA/天然高分子聚合物复合
纳米纤维素是一种天然高分子材料,主要通过形成氢键、逾渗网络、链缠结及促进结晶等方式来增强复合材料的强度.贾李涵等[33]采用了FDM 3D打印技术制备了纳米纤维素增强的PLA血管支架,该复合支架较PLA支架径向支撑性能提高了47.6%,纵向柔顺性提升了20.2%.
2.1.3PLA/合成高分子聚合物复合
Mawath等[34]制备了PCL/PLA复合支架,结果显示,PCL支架组的细胞增殖率为12.46%,PLA则为8.28%,且无论如何分层,复合支架的降解速率和机械模量都呈现在中等水平,且在膨胀过程中突出了PCL的弹性优势,在反冲过程中表现出PLA刚性优势.奥林巴斯公司用PLLA、聚双旋乳酸(PDLLA)和PCL 3种可降解聚合物材料制备支架,该支架采用分区涂层技术在铝和管腔侧涂有西罗莫司和内皮祖细胞(EPCs)捕获抗体,临床使用光学相干断层扫描技术(OCT)和定性比较分析(QCA)对支架进行临床前评估,结果显示,其可以减少ST,并避免延长的双重抗血小板治疗.Naderi等[35]使用壳聚糖(CS)/聚氨酯(PU)/PLA与明胶结合在铁纳米颗粒上进行聚乙二醇化,在25 ℃,pH值为7.4时,测量体外切片利钠肽(NPs)的释放,还用药物检查NPs的毒性.结果表明,改进后的支架具有更高的稳定性和耐用性.
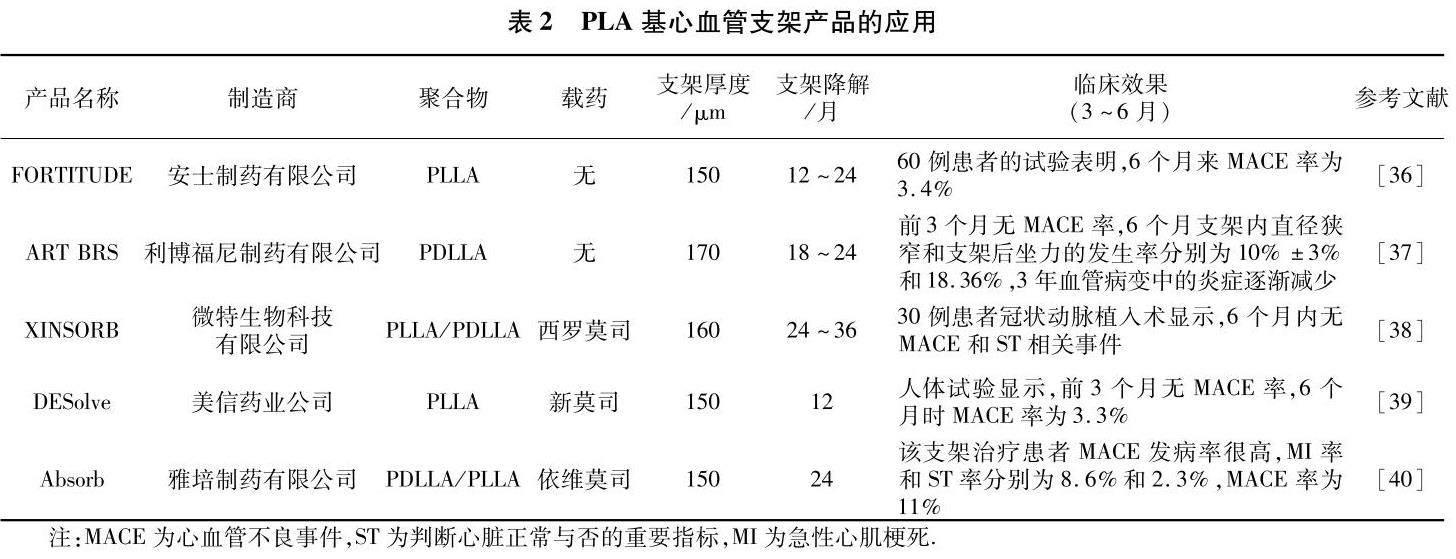
几种PLA基心血管支架产品的应用见表2.
2.2PCL
PCL是一种脂肪族可生物降解聚酯,其作为血管支架的优势在于其优异的力学性能,即柔韧性和可塑性;同时,PCL的降解速率较慢,可保证血管材料的通畅性,减小再狭窄几率.其代谢产物为己酸,可被受体所接受,同时提高细胞增殖的机会[41].PCL也常常被复合使用.
2.2.1PCL/天然高分子聚合物复合
PCL可与CS、明胶和角蛋白等构成复合支架.CS不仅具有优良的生物可降解性.生物相容性和生物黏附性,而且方便加工.杨文静等[42]通过静电纺丝制备CS/PCL支架,当CS/PCL质量比达到0.5时,血管支架的弹性达到最大值31.64%,血管支架黏附率可达95.1%,同时也证明了该支架适合细胞增殖生长与黏附.Ivchenko[43]通过同轴静电纺丝制备了PCL芯和功能化明胶壳组成的核壳纤维网,在紫外光交联下,促进血管组织再生.通过将明胶掺入纤维中可以减小与水的接触角,从而提高材料的亲水性.与传统的单组分纤维相比,核壳纳米纤维具有良好的机械性能和低承载能力.此外,通过调整外壳的特性,如厚度和成分,可以更容易地获得持续的药物释放曲线,同时保护核壳纳米纤维免受周围环境的影响.黄杰[44]通过PCL与角蛋白共静电纺丝,研制了一种用于血管组织工程的一氧化氮(NO)生成支架.该种生物复合支架选择性地增强了内皮细胞(ECs)的黏附和生长,同时抑制了谷胱甘肽(GSH)和S亚硝基谷胱甘肽(GSNO)存在下平滑肌细胞(SMCs)的增殖.此外,通过延长血液凝固时间表现出优异的血液相容性.
2.2.2PCL/合成高分子聚合物复合
PCL可与PLGA、聚三亚甲基碳酸酯(PTMC)和聚L丙交酯己内酯(PLCL)等高分子聚合物制备复合支架.Bazgir等[45]通过静电纺丝制备了PLGA/PCL基纳米纤维支架,在拉伸强度测试中,PCL 和 PLGA 支架的测量值分别为(1.492±0.378)MPa和(1.764±0.7982)MPa,且表现出疏水性.支架持续降解,且孔径和孔隙率减少,表明新生组织生成.PTMC与PCL同属线性脂肪族聚酯,在体内的生物相容性和毒性实验显示,PTMC对身体心脏、肝脏、脾脏、肺脏和肾脏等主要器官均无伤害.PTMC较PCL的优势在于PTMC具有更高的弹性,且能够快速降解.张国权等[46]通过静电纺丝技术制备PCL/PTMC支架,该复合支架在细胞相容性、拉伸弹性及降解速率方面都表现良好,支架材料内形成比较平衡的生物降解和组织重塑现象.PLCL是一种非常柔软但具有橡胶一样弹性的材料,高孔隙度的PLCL支架显示出200%的伸长率,但在拉伸实验中恢复率超过85%.Lee等[47]通过凝胶纺丝的方法制备了管状纤维PLCL支架,结果显示,支架的拉伸强度和弹性模量分别为3.39 MPa和1.22 MPa,支架的断裂伸长率为500%~600%,拉伸强度模量也大约是挤出式PLCL支架的4~5倍,细胞接种效率也比挤出式高2倍.这些结果表明,凝胶纺纤维PLCL支架是血管组织工程应用的首选.Shao等[48]通过摩擦加静电纺丝技术制备了具有小双层结构的PLCL/PCL接枝SF支架,在前期研究中发现,单层血管支架在植入实验中发生变形且难以恢复,与传统的纳米纤维血管支架相比,移植SF的PLCL /PCL支架轴向和径向抗拉强度分别提高86%和34%,且在接枝后表现出良好的亲水性和蛋白吸附性能.此外,体外细胞培养结果表明,SMCs和血管内皮细胞(VECs)在纱线中均沿纳米纤维方向生长,接枝SF可显著改善细胞在PLCL/PCL内外层的黏附和增殖.
3结语
理想的血管支架,通常具有良好的生物相容性、柔韧性和电导率,合适的径向力,以及在透视下优良的不透射性.在临床病例的长期随访中,发现理想的装置还需要具备降低血栓形成率、新生儿内膜增生率和支架血栓形成率的能力.为更好地提高冠状动脉疾病治疗的效率,支架可以与活性再狭窄药物相互作用,但是要控制药物的释放速率在一个合适的区间,且支架需具有生物惰性和良好的机械稳定性,目的就是对血管壁的损伤降低到最小程度,使得炎症反应降低到最低,进行更好地内皮化,为血管提供支架,最终促进血管愈合和重塑.
聚合物材料具有许多优点,例如,血管支架的良好加工性、生物相容性和载药效率等.然而,其机械性能明显低于金属支架.由于原始聚合物材料的机械性能差,聚合物支架尺寸和轮廓的增加是不可避免的,这可能导致输送能力下降、血流紊乱和支架植入的临床结果较差.为了克服这些限制,聚合物支架开发的重点是改善聚合物材料的机械性能,包括成分的改性和工艺的优化.目前,聚合物支架在市场及临床中的应用仍低于金属支架,故其安全评估还需要进一步验证.下一代支架需满足的第一个要求是生物可降解性,含有耐久聚合物或金属的不可吸收药物在人体内产生耐受性,可引起局部炎症、新动脉粥样硬化和ST段等长期不良反应.尽管支架材料与天然组织具有生物相容性,但作为人体的异物,其通过优秀的组织重塑再生能力,以及完全降解从而从体内排出.支架材料的第二个要求是超薄支柱,根据先前的研究,薄支柱通过保留内皮进行血液输送,在小血管支架置入术中提供更好的性能,从而减少对血管壁的创伤并最大限度地减少SMCs的增殖和迁移.对外部应力的高机械强度,低内膜增生和ST,促进组织重塑及良好的机械传导,抗血管后坐力,高内皮化,均需要在临床上有额外的要求.然而直到最近,研究者们发现导电性可能成为下一代血管支架的关键因素,为了从植入的支架上接收诊断反馈并促进治疗启动,支架必须具备导电性,以便使用带有天线单元的无线电子设备.
虽然基于血管支架组织工程已取得重大进展,但是3D打印的方法仍存在瓶颈,其中涉及建模、油墨成分设计和制备工艺等方面的障碍.机器学习技术的发展促进了其在支架建模和墨水成分设计中的应用.机器学习的目标之一是创建血管支架的最佳模型,与参数建模和逆向工程相比,这种技术能更好地拟合血管的形状;另一个目标是设计油墨的成分,机器学习可以省略不必要的实验验证,例如,可以通过少量实验研究不同浓度成分的形状精度和挤出性,建立组分浓度与3D打印参数之间的函数关系来预测挤出性和形状精度.在此基础上,油墨的设计将得到简化和定向.利用近红外光聚合技术3D打印血管支架也是一个新兴的研究领域.一般来说,紫外线照射不利于细胞生长,但大多数光敏材料都适用于紫外线.近红外线能提高光聚合的穿透性和范围,以及彩色结构的可印刷性,但工艺参数优化、材料开发和设备制造等方面还需进一步研究,除了与紫外辅助3D打印类似的工艺参数外,近红外光到紫外光的转化率、辐照剂量和上转换纳米粒子的浓度也需要研究.应用 4D 打印技术制备血管支架是未来的发展方向之一,与3D打印相比,4D 打印的一个特点是在外部刺激(如温度、pH 值、光线和化学物质等)下结构可变形.4D打印可以提高支架的精度和分辨率,因为 4D 打印不仅可以通过外部刺激直接形成血管支架,还可以在处理后收缩 3D 打印支架.在 4D 打印中,材料选择和结构设计是确保支架成型的重要因素.因此,4D 打印的可行方案是使用多喷射 3D 打印或多步骤 3D 打印工艺打印分层材料.4D打印在未来有望得到深入研究和应用,尤其是在制造高分辨率结构方面.
参考文献:
[1]Alfonso F,Byrne R A,Rivero F,et al.Current treatment of instent restenosis [J].J Am Coll Cardiol,2014,63(24):2659-2673.
[2]Xiong X Y,Gou J B,Liao Q G,et al.The taxus genome provides insights into paclitaxel biosynthesis [J].Nat Plants,2021,7(8):1026-1036.
[3]Gwon H C,Hahn J Y,Park K W,et al.Sixmonth versus 12month dual antiplatelet therapy after implantation of drugeluting stents the efficacy of xience/promus versus cypher to reduce late loss after stenting (excellent) randomized,multicenter study [J].Circulation,2012,125(3):505-513.
[4]Kheiri B,Osman M,Bachuwa G,et al.Trial sequential analysis of drugeluting stents versus baremetal stents in saphenous vein graft intervention [J].Am J Cardiol,2019,124(5):823-824.
[5]Ellis S G,Kereiakes D J,Metzger D C,et al.Everolimuseluting bioresorbable scaffolds for coronary artery disease [J].N Engl J Med,2015,373(20):1905-1915.
[6]Zhang F,King M W.Biodegradable polymers as the pivotal player in the design of tissue engineering scaffolds [J].Adv Healthc Mater,2020,9(13):1901358-1-1901358-22.
[7]Yang H,Zhou W C,Gao X Q,et al.Dynamic numerical simulation and experiment results of oscillating packing injection molding [J].Acta Polym Sin,2019,50(12):1348-1356.
[8]Xu Y,Xiong Y,Guo S.Effect of liquid plasticizers on crystallization of PCL in soft PVC/PCL/plasticizer blends [J].J Appl Polym Sci,2020,137(23/24):48803-1-48803-11.
[9]Lee C H,Chen C J,Liu S J,et al.The development of novel biodegradable bifurcation stents for the sustainable release of antiproliferative sirolimus [J].Ann Biomed Eng,2012,36(28):1470-1489.
[10]Li X Q,Kanjwal M A,Stephansen K,et al.Preparing poly (caprolactone) microparticles through solventinduced phase separation [J].Mater Lett,2012,75(21):189-191.
[11]Li H X,Liu K,Zhao D Y,et al.Multiobjective optimizations for microinjection molding process parameters of biodegradable polymer stent [J].Materials,2018,11(11):1961-1970.
[12]Deng Y D,Zhang X Y,Shen H B,et al.Application of the nanodrug delivery system in treatment of cardiovascular diseases [J].Front Bioeng Biotechnol,2020,7(5):00489-1-00489-18.
[13]Abizaid A,Brachmann J,Costa J D,et al.Tct39 12month angiographic and clinical results of the rezolve(r) sirolimuseluting bioresorbable coronary scaffold:The restore trial [J].J Am Coll Cardiol,2013,62(9):13-15.
[14]Giglio N C,Hutchens T C,Perkins W C,et al.Rapid sealing and cutting of porcine blood vessels,ex vivo,using a highpower,1470nm diode laser [J].J Biomed Opt,2014,19(3):38002-1-38002-5.
[15]Chen C S,Lin S Y,Chou N K,et al.Optimization of laser processing in the fabrication of stents [J].Mater Trans,2012,53(11):2023-2027.
[16]Salifu A A,Nury B D,Lekakou C.Electrospinning of nanocomposite fibrillar tubular and flat scaffolds with controlled fiber orientation [J].Ann Biomed Eng,2011,39(10):2510-2520.
[17]李岩,黄争鸣.聚合物的静电纺丝 [J].高分子通报,2006,19(5):12-19.
[18]杨磊,李霞飞,董玉珍,等.小口径组织工程血管支架:如何产生一种具有生理重塑活性的材料 [J].中国组织工程研究,2020,24(22):3579-3586.
[19]Zhou J,Cao C B,Ma X L.A novel threedimensional tubular scaffold prepared from silk fibroin by electrospinning [J].Int J Biol Macromol,2009,45(5):504-510.
[20]Kroon M.A constitutive model for smooth muscle including active tone and passive viscoelastic behaviour [J].Math Med Biol,2009,27(2):129-155.
[21]吴桐,黄晨,莫秀梅.新型组织工程血管材料:静电纺复合纳米纤维小口径管状支架 [J].中国组织工程研究,2013,17(29):5387-5394.
[22]Huang J H,Li G,Wang W,et al.3D printing guiding stent graft fenestration:A novel technique for fenestration in endovascular aneurysm repair [J].Vascular,2017,25(4):442-446.
[23]Attalla N.3D bioprinting of heterogeneous bi and trilayered hollow channels within gel scaffolds using scalable multiaxial microfluidic extrusion nozzle [J].Biofabrication,2019,11(1):112-119.
[24]Jin Y,Du J K,Ma Z Y,et al.An optimization approach for path planning of highquality and uniform additive manufacturing [J].Int J Adv Manuf Technol,2017,32(27):279-290.
[25]Geng M R,Zhang Q Q,Gu J N,et al.Construction of a nanofiber network within 3D printed scaffolds for vascularized bone regeneration [J].Biomaters Sci,2021,9(7):2631-2646.
[26]Hewes S,Wong A D,Searson P C.Bioprinting microvessels using an inkjet printer [J].Bioprinting,2017,7(6):25-34.
[27]Lee V K,Kim D Y,Ngo H,et al.Creating perfused functional vascular channels using 3D bioprinting technology [J].Biomaterials,2014,35(28):8092-8102.
[28]郭文文,曹慧,刘静.3D打印技术在生物医学领域的应用 [J].中国临床研究,2016,29(8):1132-1133.
[29]唐蒙,徐会.联合morc2idh1检测对胶质母细胞瘤放化疗患者分子分型价值 [J].中华放射肿瘤学杂志,2019,28(6):401-404.
[30]Li J F,Jiang P F,Yang J W,et al.Shape memory properties of 3dprinted selfexpandable poly(lactic acid) vascular stents with longchain branched structures [J].Polym Adv Technol,2022,33(12):4098-4111.
[31]Dong H Z,Li D K,Mao D Y,et al.Enhanced performance of magnesium alloy for drugeluting vascular scaffold application [J].Appl Surf Sci,2018,435(27):320-328.
[32]Hasanpur E,Ghazavizadeh A,Sadeghi A,et al.In vitro corrosion study of pla/mg composites for cardiovascular stent applications [J].J Mech Behav Biomed Mater,2021,124(4):12-17.
[33]贾李涵,李岩.3D打印纳米纤维素增强聚乳酸血管支架的体外力学性能研究 [J].复合材料科学与工程,2021,48(5):61-67.
[34]Mawath Q,Feng W,Manjusri M,et al.Experimental design of sustainable 3dprinted poly(lactic acid)/biobased poly(butylene succinate) blends via fused deposition modeling [J].ACS Sustainable Chem Eng,2019,7(17):14460-14470.
[35]Naderi S,Esmaeili A.Preparation of 3Dprinted (CS/PLA/PU) scaffolds modified with plasma and hybridization by fe@pegca for treatment of cardiovascular disease [J].New J Chem,2020,44(28):4471-4481.
[36]Tamai H,Igaki K,Kyo E,et al.Initial and 6month results of biodegradable polyllactic acid coronary stents in humans [J].Circulation,2000,102(4):399-411.
[37]Shen L,Wang Q B,Wu Y Z,et al.Shortterm effects of fully bioabsorbable plla coronary stents in a porcine model [J].Polym Bull,2012,68(4):1171-1181.
[38]Sean M M,Nicky B,Jochen S,et al.Bioresorbable polymer stents:A review of material progress and prospects [J].Prog Polym Sci,2018,83(9):79-96.
[39]Ormiston J A,Serruys P W,Regar E,et al.A bioabsorbable everolimuseluting coronary stent system for patients with single denovo coronary artery lesions (absorb):A prospective openlabel trial [J].The Lancet,2008,371(9616):899-907.
[40]Nef H M,Wiebe J,Foin N,et al.A new novolimuseluting bioresorbable coronary scaffold:Present status and future clinical perspectives [J].Int J Cardiol,2017,227(19):127-133.
[41]Xu K,Zhu C S,Xie J H,et al.Enhanced vascularization of pcl porous scaffolds through vegffc modification [J].J Mater Chem B,2018,78(208):1468-1480.
[42]杨文静,付静,何磊,等.静电纺丝制备壳聚糖/聚己内酯血管支架及表征 [J].复合材料学报,2011,28(1):104-108.
[43]Ivchenko P.Chainend functionalization of poly(εcaprolactone) for chemical binding with gelatin:Binary electrospun scaffolds with improved physicomechanical characteristics and cell adhesive properties [J].Polymers,2022,14(19):4203-4209.
[44]黄杰.改性聚己内酯/丝素蛋白电纺纤维膜的制备及性能研究 [D].昆明:昆明医科大学,2017.
[45]Bazgir M,Elies J,Saeinasab M,et al.Degradation and characterisation of electrospun polycaprolactone (PCL) and poly(lacticcoglycolic acid) (PLGA) scaffolds for vascular tissue engineering [J].Materials,2021,14(17):4773-4781.
[46]张国权,王宇,周栋,等.聚己内酯/聚三亚甲基碳酸酯静电纺丝支架材料的制备与组织相容性研究 [J].山西医科大学学报,2018,49(3):251-257.
[47]Lee S,Lee H S,Chung J J,et al.Enhanced regeneration of vascularized adipose tissue with dual 3Dprinted elastic polymer/decm hydrogel complex [J].Int J Mol Sci,2021,22(6):2886-2895.
[48]Shao W,Cui C,Xiong J,et al.Smalldiameter PLCL/PCL nanofiber grafted tsf vascular scaffolds with a doublelayer structure for vascular tissue engineering [J].Macromol Mater Eng,2021,306(11):1-10.
(责任编辑:伍利华)
