盐酸丁卡因胃/肠镜润滑剂在比格犬体内的药动学和毒性研究
2024-06-14李云峰梁十曾业文罗挺凌雪荧关业枝欧阳惠君
李云峰 梁十 曾业文 罗挺 凌雪荧 关业枝 欧阳惠君


收稿日期:2023-10-30
基金项目:广东省重点领域研发计划项目(2022B1111020005);惠州市科技计划项目(2020SD0410038)
作者简介:李云峰(1975—),男,硕士,高级工程师,从事药物安全性评价研究.Email:lyf@gdlami.com
通信作者:欧阳惠君(1982—),女,副教授,从事血液检验研究.Email:25514618@qq.com
摘要:通过对比格犬单次灌胃或直肠给予盐酸丁卡因胃/肠镜润滑剂,观察动物的临床反应,测定盐酸丁卡因在体内的浓度,对主要的组织脏器进行大体剖检,并测量脏器重量及系数,以了解其在动物体内的药动学和毒性反应.将8只普通级比格犬,随机分为灌胃组和直肠组,每只犬分别单次灌胃或直肠给予10 mL盐酸丁卡因胃/肠镜润滑剂(含盐酸丁卡因80 mg).结果显示,各动物的外观体征、行为活动、呼吸和粪便等均未见明显异常,摄食正常,体重正常增长;与给药前相比,各动物在给药后4 h体温下降、心率减慢、QT间期和T波时间延长,为盐酸丁卡因的麻醉药效作用所致;各动物的血液学、血液生化学、主要脏器重量和系数及大体剖检均未见明显异常;单次灌胃或直肠给予后的平均达峰时间分别为0.63和0.44 h,平均消除半衰期分别为1.20和3.36 h,平均药时曲线下面积分别为60.44和60.19 μg/L*h,提示吸收进入血液的药量较少,大部分留在局部发挥润滑和麻醉作用.
关键词:盐酸丁卡因;胃/肠镜润滑剂;比格犬;药动学;毒性
中图分类号:R96
文献标志码:A
0引言
盐酸丁卡因胃/肠镜润滑剂是一种体腔器械导入润滑液,临床主要用于胃、肠和肛门等插管镜检或手术时的局部润滑麻醉.盐酸丁卡因胃/肠镜润滑剂是一种新的器械治疗辅助性药物,是由二甲硅油、甘油、盐酸丁卡因和纯化水组成.本研究通过对比格犬单次灌胃或直肠给予盐酸丁卡因胃/肠镜润滑剂,观察动物的各种临床反应,测定盐酸丁卡因在体内的浓度,对主要的组织脏器进行大体剖检,并测量脏器重量及系数,以了解其在动物体内的药效作用、药动学和毒性反应.
1材料与方法
1.1仪器
Waters Xevo TQS型三重四极杆液质联用仪(沃特世科技有限公司),Hettich Universal 320R型冷冻离心机(德国Hettich科学仪器有限公司),MS3 Basic型振荡器(德国艾卡有限公司),ECG2303B型数字心电图机(广州三锐电子科技有限公司),SYSMEX XN1000型全自动模块式血液分析仪、CS1300型全自动凝血分析仪(日本希森美康株式会社),3100型全自动生化分析仪(株式会社日立制作所),CPA225D型电子精密天平(赛多利斯公司),XK3190A6型电子台秤(上海耀华称重系统有限公司).
1.2试剂与试药
盐酸丁卡因胃/肠镜润滑剂(批号,20210127),购自深圳市盛康泰医疗器械有限公司,10 mL/支,含盐酸丁卡因浓度8 mg/mL;盐酸丁卡因标准品(批号,100456201602),购自中国食品药品检定研究院,含量按C15H24N2O2·HCl计,为100.0%;甲醇与甲酸等均为色谱纯,乙酸乙酯为分析纯,水为超纯水.
1.3动物
普通级比格犬8只,体质量为6.89~7.26 kg,雌雄各4只,购自仪征安立卯生物科技有限公司(SCXK(苏)20210006).动物饲养在广东省实验动物监测所普通环境动物房,实验动物使用许可证号为SYXK(粤)20210122.动物实验开展经过广东省实验动物监测所动物使用与管理委员会审批,编号为IACUC2021188,广东省动物实验证明号为00292919.动物饲养环境温度为20.5~24.5 ℃,相对湿度为42.8%~68.9%,12 h/12 h明暗交替.
1.4剂量设计与动物分组
本实验设灌胃组(1组)与直肠组(2组),动物按体重随机分为2组,每组雌雄各2只.经口灌胃或直肠给药1次,给药量均为10 mL/只.
1.5指标检测方法与频率
1.5.1一般状况
每天对动物的外观体征、行为活动、呼吸、分泌物、摄食、粪便及神经系统等进行观察记录,给药当天从给药后开始连续观察4 h,其后每日观察1次.分别在动物检疫1 d、给药前(D0)、给药后第7 d和第14 d各称重1次.
1.5.2心电图和体温
分别于D0、给药后4 h(D1)、给药后第7 d和第14 d各测量1次,Ⅱ导联指标包括心率、PR间期、QRS时间、QT间期、QTC间期和T波时间等.
1.5.3血液学
在采血前空腹12 h以上(不禁水),分别于D0、给药后4 h、第7 d和第14 d采用真空采血管在动物前肢静脉处采血.用枸橼酸钠抗凝管采血约2 mL,采集后立即上下颠倒混匀,3000 r/min离心15 min,取血浆用凝血分析仪测定凝血酶原时间(PT)和活化部分凝血活酶时间(APTT).用乙二胺四乙酸(EDTA)抗凝管采血约1 mL,采集后立即上下颠倒混匀,采用血液分析仪测定红细胞数(RBC)、网织红细胞数(RET)、白细胞数(WBC)、血红蛋白量(HGB)、红细胞平均血红蛋白含量(MCH)、红细胞平均血红蛋白浓度(MCHC)、血小板数(PLT)、中性粒细胞数(NEUT)、淋巴细胞数(LYMPH)、单核细胞数(MONO)、嗜酸性粒细胞数(EO)、嗜碱性粒细胞数(BASO)、中性粒细胞比率(NEUT%)、淋巴细胞比率(LYMPH%)、单核细胞比率(MONO%)、嗜酸性粒细胞比率(EO%)、嗜碱性粒细胞比率(BASO%)、网织红细胞比率(RET%)、未成熟网织红细胞比率(IRF%)、低荧光强度网织红细胞比率(LFR%)、中荧光强度网织红细胞比率(MFR%)和高荧光强度网织红细胞比率(HFR%)等指标.
1.5.4血液生化学
真空采血约2 mL,血液不抗凝,在室温静置30~50 min后,3 000 r/min离心15 min;分离所有血清置已编号标记的塑料离心(EP)管中,用全自动生化分析仪测定天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、尿素氮(UREA)和肌酐(CREA)等指标.
1.5.5比格犬血液样品采集、测定及参数计算
1)血液样品采集:采用一次性注射器真空肝素管针头刺入前肢或后肢静脉,以适当速度采血.分别在D0(0 h)及给药后0.25、0.5、1、2、4、6、12和24 h采集血液约2 mL,在4 h内进行离心,4 000 r/min离心10 min,取上层血浆,分别转移至已标记的EP管中,置超低温冰箱(-80 ℃)冷冻保存至测定.
2)血浆样品测定:于2 mL EP管中加入200 μL血浆样品,加入氢氧化钠溶液40 μL,混匀后加入甲醇50 μL,涡旋混匀;再加入1 mL乙酸乙酯,涡旋10 min后,在4 ℃下以4 000 r/min离心10 min;将上层有机相移至另一个EP管中,置50 ℃水浴氮气吹干.残渣用200 μL的70%甲醇溶液溶解,在4 ℃下以10 000 r/min离心10 min后,转移至进样瓶中进行测定.色谱柱为Waters UPLC BEH C18(2.1 mm×100 mm,1.7 μm),流动相为0.1%甲酸水溶液—甲醇,采用梯度洗脱方式,流速0.4 mL/min;电喷雾离子源ESI+模式,离子源温度150 ℃,洗脱溶剂温度400 ℃,毛细管电压3.0 kV,锥孔电压26 V,MS碰撞能4 eV,丁卡因定量检测离子对为m/z 265→176.
3)药时数据处理:采用液质联用仪配有的UNIFI软件对待测样品进行定量处理,采用DAS3.0药代动力学软件对药时数据进行处理,计算药时曲线下面积(AUC)、峰浓度(Cmax)、达峰时间(Tmax)、消除半衰期(t1/2β)及平均滞留时间(MRT)等参数.
1.5.6大体剖检与组织病理学检查
全部存活动物采用氯胺酮(20 mg/kg)—速眠新Ⅱ(2 mg/kg)合剂肌肉注射麻醉放血处死后,进行大体解剖检查,肉眼观察各组织和器官的变化,同时取脑、心脏、肝脏、脾脏、肾脏、胸腺、肾上腺和甲状腺等主要脏器进行称重,并计算脏器系数(脏器系数=脏重/体重×100%).各组织器官放入10%中性福尔马林溶液中固定备查,对发现异常的组织或脏器需要进行取材和制片等处理,然后进行显微镜检查.
1.6数据处理和统计分析
体重、体温、心电图、血液学、血液生化学、脏器重量及脏器系数等数据均以平均值±标准差表示,使用SPSS软件进行t检验统计分析,以P<0.05为统计差异进行判断.
2结果
2.1一般状况和体重
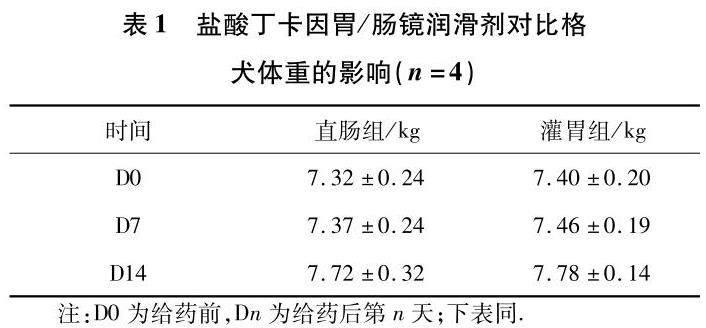
实验期间,各动物的皮毛、行为活动、呼吸、粪便及尿液等均未见明显异常,摄食正常,未见剩余饲料.给药后未见动物出现嗜睡或昏睡、狂躁不安、寒颤或震颤、麻疹或荨麻疹等异常反应,摄食正常,体重正常增长,结果见表1.
2.2体温
给药后4 h与D0相比,各动物的体温均显著下降(P<0.05),考虑为受试物盐酸丁卡因的麻醉药效作用所致;在给药后第7 d和14 d均未见显著性差异(P>0.05),结果见表2.
2.3心电图
与D0相比,在给药后4 h,各动物的心率均显著减慢、QT间期和T波时间显著延长(P<0.05或0.01);在给药后第7 d,各动物的QT间期仍显著延长(P<0.05或P<0.01);在给药后第14 d,各动物的心电图指标均未见显著性差异(P>0.05).这些指标值变化考虑为盐酸丁卡因的药效作用所致,结果见表3.
2.4血液学
与D0相比,给药后4 h,各动物的IRF%和MFR%显著降低(P<0.05),LFR%显著升高(P<0.05),RET%和HFR%有所下降,但未见显著性差异(P>0.05);这些指标在给药后第7 d和第14 d均没有显著差异,考虑为动物采血后的正常生理性变化,与盐酸丁卡因胃/肠镜润滑剂无关.其余各指标均未见异常,结果见表4.
2.5血液生化学
与D0相比,给药后4 h、第7 d和第14 d,各动物的UREA和CREA均有所升高,但未见显著性差异(P>0.05),且在正常值范围内,考虑为动物的生理波动性变化,与盐酸丁卡因胃/肠镜润滑剂无关.其余各指标均未见显著性差异,结果见表5.
2.6血药浓度和药动学参数
比格犬经口单次灌胃或直肠给予盐酸丁卡因内镜润滑剂10 mL后,在不同时间点均能在其血浆中检测到丁卡因.其中,在给药后0.25 h的血药浓度分别为(19.49±20.61)和(12.53±11.25)ng/mL,与动物个体吸收差异有关.平均Tmax分别为(0.63±0.25)和(0.44±0.13)h,平均Cmax分别为(33.65±17.61)和(15.12±10.64)ng/mL,平均t1/2β分别为(1.20±0.61)和(3.36±1.5)h;平均AUC分别为(60.44±11.45)和(60.19±42.65)μg/L*h,提示吸收进入血液的药量较少,大部分留在局部,有利于镜检或手术顺利进行.血药浓度及药代学参数结果见表6.
2.7脏器重量和系数
各动物的脑、心脏、肝脏、脾脏、肾脏、胸腺、肾上腺和甲状腺等主要脏器的重量和系数均未见明显变化,结果见表7;心脏、肝脏(含胆囊)、脾脏、肾脏、睾丸、附睾、子宫(含子宫颈)、卵巢、胸腺、肾上腺、甲状腺(含甲状旁腺)和脑等组织器官大体剖检均未见异常改变,无需进行组织学检查,各动物均未有肉眼可见的毒性病理改变.
3讨论
临床上进行胃/肠镜检查或手术时,患者经常因器械的进入刺激引起呛咳、呕吐与疼痛等症状,导致不少患者对此项检查产生恐惧甚至拒绝,为减轻患者的痛苦,顺利实施胃/肠镜检查或手术,胃/肠镜润滑剂产品的研发十分必要.盐酸丁卡因胃/肠镜润滑剂是在肠镜润滑剂的制备与胃镜润滑剂的应用等研究[1-3]基础上研发出来的新产品,将其涂抹在胃/肠镜器械表面,其中的二甲硅油和甘油可减少胃/肠镜器械的刺激性,同时增加润滑度,盐酸丁卡因通过胃/肠表皮黏膜吸收后起到局部麻醉的作用,从而减轻患者因胃/肠镜器械进入胃/肠腔内引起的恶心、呕吐与疼痛等症状.
已有研究表明,丁卡因用于麻醉有较大毒性作用[4-5],在本研究中,比格犬单次灌胃或直肠给予盐酸丁卡因胃/肠镜润滑剂后,各组动物的外观体征、行为活动与呼吸等均未见明显异常,摄食和体重均正常,也未见动物出现狂躁不安、抽搐或惊厥等毒性反应.但在给药后4 h出现了体温下降、心率减慢、QT间期和T波时间延长等现象,应为盐酸丁卡因的麻醉药效作用所致,与吸收进入血液的丁卡因药量较少结果相一致,且灌胃与直肠给予方式间没有差异.
盐酸丁卡因含量测定的方法主要有紫外分光光度法、高效液相法[6-7]和毛细管电泳法[8]等.本研究参照文献报道的方法,采用甲醇和乙酸乙酯混合液沉淀蛋白法处理比格犬血浆样品,采用液质联用仪进行测定,具有灵敏度高、提取回收率高、检测时间短与操作简便等优点.药动学参数平均Tmax分别为0.63和0.44 h,表明吸收起效较快;平均AUC分别为60.44和60.19 μg/L*h,提示吸收进入血液的药量较少,大部分留在局部,有利于镜检或手术顺利进行,且灌胃与直肠给予方式间没有差异.
与D0相比,给药后4 h,各组动物的IRF%和MFR%显著降低,LFR%显著升高(P<0.05),RET%和HFR%略有下降;但在给药后第7 d和第14 d,未见显著性差异.给药后4 h、第7 d和第14 d,各动物的UREA和CREA均有所升高,但未见显著性差异.这些指标均在正常值范围内,应为动物采血后的正常生理性变化.
综上所述,8只比格犬分别在单次灌胃或直肠给予盐酸丁卡因胃/肠镜润滑剂10 mL后观察14 d,各动物的一般状况观察、体重、血液学、血液生化学、主要脏器重量和系数与病理大体剖检等均未见明显异常;在给药后4 h,各动物因盐酸丁卡因的麻醉药效作用而出现体温下降、心率减慢与QT间期延长等;吸收进入血液的药量较少,大部分留在局部发挥润滑和麻醉作用,有利于镜检或手术顺利进行;未见与盐酸丁卡因胃/肠镜润滑剂相关的毒性反应.
参考文献:
[1]邓昌国,李叶,童丽健,等.肠镜润滑剂的制备及质量控制[J].中国药房,2010,21(9):833-834.
[2]林亚雪,林秀丽,许亚娥.胃镜检查术前使用胃镜润滑剂的效果观察[J].当代医学(学术版),2008,2(6):63.
[3]张维珍,潘海燕,姚燕萍,等.胃镜润滑剂在上消化道肿瘤手术患者术前留置胃管中的应用[J].护理学报,2011,18(17):71-73.
[4]Patel D,Chopra S,Berman M D.Serious systemic toxicity resulting from use of tetracaine for pharyngeal anesthesia in upper endoscopic procedures[J].Dig Dis Sci,1989,34(6):882-884.
[5]金大源,姜丽丽.新药注射用盐酸丁卡因急性毒性和刺激性试验[J].浙江中医学院学报,2003,27(2):77-78.
[6]王英超,王鹏,赵海艳,等.高效液相色谱法测定丁卡因软膏中盐酸丁卡因的含量[J].中国临床药理学杂志,2019,35(15):1657-1659.
[7]王美云.高效液相色谱法测定盐酸丁卡因注射液中盐酸丁卡因的含量[J].山西医药杂志,2017,46(11):1363-1365.
[8]孙汉文,问海芳,苏明,等.毛细管电泳—联吡啶钌电化学发光法对血浆中丁卡因与普鲁卡因的同时测定[J].分析测试学报,2009,28(2):168-172.
(责任编辑:伍利华)
