Valsa侵染库尔勒香梨树后抗性酶活性变化规律
2024-06-08唐丽邵延慧李春艳张王斌
唐丽 邵延慧 李春艳 张王斌
摘要: 新疆阿克苏地区由Valsa mali var.pyri、Valsa sordida引起的腐烂病是制约库尔勒香梨发展的重要病害,為研究库尔勒香梨感染腐烂病后与防御酶活性的变化关系,以库尔勒香梨为试验材料,分别采集同一株树不同发病组织和不同发病程度枝条韧皮部,研究其抗性相关酶活性变化。结果表明:病害在完全侵入组织后,SOD活性呈下降的趋势,在发病组织,POD、CAT活性最高,PAL在病健交界处活性最高。随着发病程度的增加,SOD活性整体呈先上升后下降的趋势,POD活性呈逐渐上升的趋势,CAT活性先下降后上升,PAL活性先上升后下降, PPO 总体呈下降趋势。库尔勒香梨抗性相关酶活性呈现不同变化响应Valsa侵染。在Valsa与库尔勒香梨互作系统中,抗性酶可作为抗病性和检测病害指标,为检测库尔勒香梨腐烂病发病程度提供理论依据。
关键词: 库尔勒香梨; 腐烂病; 抗性相关酶
中图分类号: S 562 文献标识码: A 文章编号:1001 - 9499(2024)03 - 0006 - 06
Changes of Resistance Enzyme Activity in Korla
pear after Valsa Infection
TANG Li SHAO Yanhui LI Chunyan ZHANG Wangbin**
(Talimu University, Xinjiang Alaer 843300)
Abstract In order to study the changes of resistance related enzyme activities in Korla pear infected with Valsa canker, Collecting different diseased tissues and phloem of branches of the same tree in Korla pear to study the changes of resistance related enzyme activities. The results showed that after the disease completely invaded tissues, SOD activity showed a downward trend, POD and CAT activities were the highest in the diseased tissues, PAL activity was the highest at the junction of disease and health. With the increase of the severity of the disease, SOD activity increased first and then decreased, POD activity increased gradually, CAT activity decreased first and then increased, PAL activity increased first and then decreased, and PPO activity generally decreased. The resistance related enzyme activity of Korla pear showed different changes in response to Valsa infection
Key words Korla pear; Valsa canker; resistance-related enzyme
库尔勒香梨(Pyrus spp)是中国种植范围较广的树种之一,因其具有色浓味甜、皮薄肉细、酥脆汁多、营养丰富等特点,被誉为“梨中珍品”、“果中王子”,主要分布在新疆巴州库尔勒和阿克苏地区,是新疆林果产业的重要组成部分。库尔勒香梨种植产业面积发展速度快,年平均增长达到 6%,种植面积为 4.06 万hm2,结果面积 3.11 万hm2,产量 55.6 万t,产值 230,019 万元[ 1 ]。在库尔勒香梨主产区,腐烂病严重制约了库尔勒香梨产业的发展。近年来,梨树病害频发,其中腐烂病是香梨种植区的主要病害[ 2 ]。库尔勒香梨腐烂病是由真菌Valsa mali var.pyri、Valsa sordida引起的病害,属于黑腐皮壳属,主要危害梨树的韧皮部,树体在感染腐烂病后树皮会变柔软、腐烂,甚至整株枯死[ 3 ]。腐烂病病原菌主要是通过风媒、虫媒和雨水传播,还可侵入伤口以及坏死组织,腐烂病危害重、防治难、传染力强,严重时可造成“毁园”[ 4 ]。因环境和栽培管理措施的影响,库尔勒香梨的发病率逐年上升,一些发病较重的梨园发病率在90%以上[ 5 ]。
ROS(reactive oxygen species, ROS)作为第二信使参与新陈代谢,调控细胞生长和程序性死亡等,在植物体内处于动态平衡状态[ 6 ]。植物体在受到逆境,如干旱、盐害、虫害、病菌等的胁迫时,往往会产生大量活性氧,ROS大量积累,加速细胞膜脂过氧化过程,导致蛋白质失活、DNA损伤等[ 7 ]。植物的抗性酶系包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)及其同工酶,是控制植物健康生长和应激反应的重要信号分子[ 8 ],和内源抗氧化物共同作用,调节体内ROS的平衡,防御酶作为抗病性指标,被广泛应用。植物的抗性酶系在植物遭受病害时,活性会发生变化,以此来应对病害胁迫,保护植物免受病害侵害。在植物生长发育、代谢以及对应激(生物和非生物)条件的响应等不同过程的调节中发挥关键作用[ 9 ]。本研究通过对库尔勒香梨树皮SOD、POD、CAT、PAL、PPO抗性相关酶活性与腐烂病的研究,旨在探明库尔勒香梨抗性酶与腐烂病入侵间的关系。
1 材料与方法
1. 1 研究区自然状况
阿拉尔市地处新疆阿克苏地区旁,位于80°30′~81°58′E, 40°22′~40°57′N,北起天山南麓山地,南至塔克拉玛干沙漠北缘,属塔里木河冲积细土平原,沿河岸及冲沟两侧略有抬升,地势由西北向东南倾斜。阿拉尔市属暖温带极端大陆性干旱荒漠气候,具典型荒漠地貌特点,昼夜温差大,垦区雨量稀少,冬季少雪,地表蒸发强烈,总面积6 923.4 km2[ 10 ]。
1. 2 样本采集
于香梨腐烂病发生盛期(5-6月),在新疆阿拉尔市周边香梨园内,选取典型发病的树体,采集同一株树发病组织、健康组织及病健交界组织(距离发病组织2~10 cm)的韧皮部,放入冰盒内,迅速带回实验室,用液氮快速冷冻,放进超低温冰箱(-80 ℃)保存。
参照邵延慧[ 10 ]的病情分级标准,在阿拉尔市周边的一个库尔勒香梨园内,采集发病0-4级的香梨树1年生枝条,每个等级采集5棵树。分别采集每棵树的东南西北4个方向的1年生枝条,每棵树采集20个枝条,分别将每个发病等级样品100个混合。放入冰盒内,迅速带回实验室处理。用蒸馏水冲洗干净枝条并拭干,剥取韧皮部,剪成2 cm长的小段,用液氮快速冷冻,放进超低温冰箱(-80 ℃)保存,用于后续试验。
1. 3 抗性酶活性测定
同一棵树发病组织、健康组织、病健交界抗性酶活性均采用由苏州科铭生物技术有限公司提供的试剂盒测定。超氧化物歧化酶(SOD):称取0.1 g组织,加入1 mL 提取液(试剂盒内已配好),进行冰浴匀浆;8 000 g 4 ℃离心 10 min,取上清,置冰上待测,按试剂盒内步骤配制各试剂,充分混匀,室温静置 30 min 后,560 nm 处测定各管吸光值。过氧化物酶(POD)、过氧化氢酶(CAT)、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)的测定均采用试剂盒内步骤进行,各试剂按使用说明配置和保存。
1. 4 数据处理
采用 Microsoft Excel 进行数据统计,用 SPSS 进行差异显著性检验。
2 结果与分析
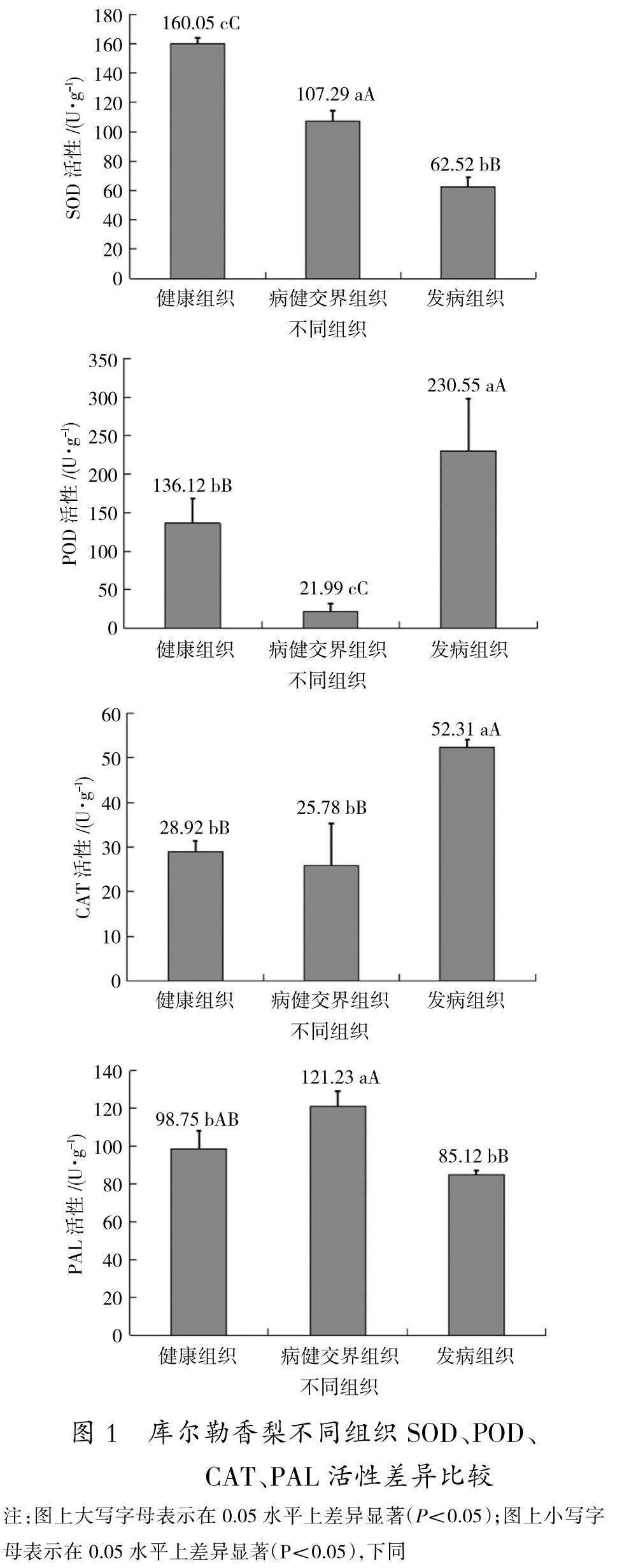
2. 1 库尔勒香梨病健不同组织抗性酶活性测定
对库尔勒香梨同一株树发病组织、健康组织、病健交界组织的酶活性进行测定(图1),研究表明,库尔勒香梨不同组织SOD、POD、CAT、PAL活性差异变化不同。健康组织中SOD活性为160.05U/g,显著大于病健交界组织和发病组织,并且达到极显著差异,病健交界组织SOD活性为107.29 U/g,显著低于健康组织,高于发病组织,发病组织的SOD活性最低,为62.52 U/g。
不同组织的POD活性间存在极显著差异,其中发病组织POD活性最高,为230.55 U/g,显著高于健康组织与病健交界组织,且健康组织的POD活性显著高于病健交界组织,为136.12 U/g。
发病组织CAT活性为52.31 U/g,显著高于健康组织和病健交界组织,健康组织CAT活性略高于病健交界组织,但差异不显著。病害在初期侵入组织后,CAT活性变化不大,在病害完全侵入组织后,CAT活性最高。
库尔勒香梨PAL活性在病健交界组织最高,为121.23 U/g,发病组织PAL活性最低,显著低于病健交界组织,存在极显著差异;健康组织PAL活性低于病健交界组织,高于发病组织,PAL活性整体呈现先升高后降低的趋势。
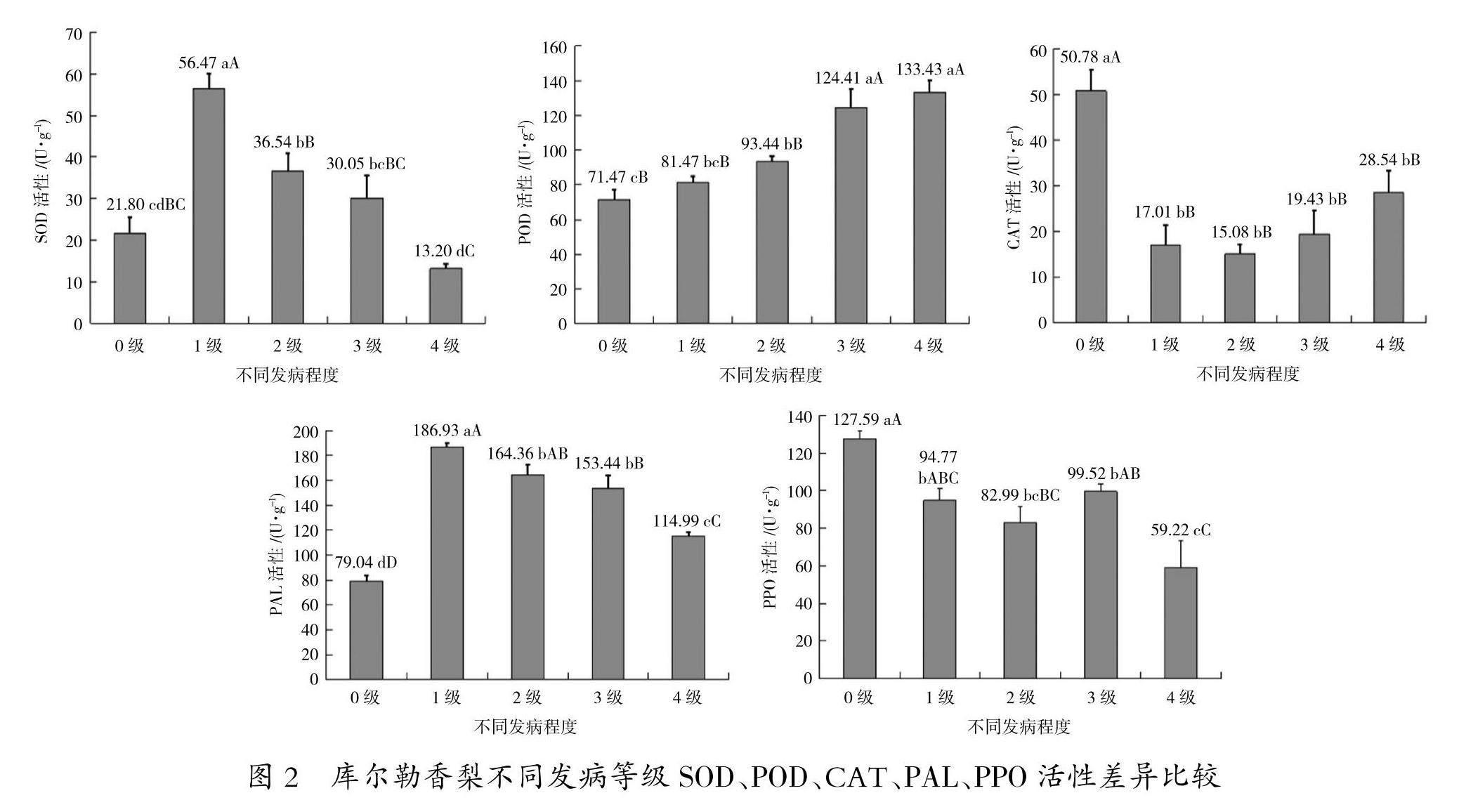
2. 2 不同发病程度库尔勒香梨树体组织抗性酶活性测定
对库尔勒香梨发病不同等级枝条韧皮部SOD、POD、CAT、PAL、PPO活性进行测定,酶活性变化各有差异。由图 2 可知,不同发病等级枝条韧皮部SOD活性有显著性差异,发病为1级时,SOD活性为56.47 U/g,显著高于其他等级;发病等级为4级的SOD活性最低,为13.20 U/g;0级显著低于1级、2级和3级,并显著低于0级。随着发病程度的增加,SOD活性整体呈先上升后下降的趋势。
不同发病程度尔勒香梨枝条韧皮部POD活性有一定差异,0级POD活性为71.47 U/g,显著低于其他等级;4级树体枝条韧皮部POD活性最高,为133.43 U/g,显著高于0级、1级和2级;1级和2级显著低于3级和4级;3级和4级枝条韧皮部POD活性差异不显著,随着发病程度的增加,POD活性呈逐渐上升的趋势。
在不同发病等级枝条韧皮部CAT的活性有差异,其中0级CAT活性为50.78 U/g,显著高于其他等级,并达到极显著差异。从0级到2级,枝条韧皮部CAT活性呈下降的趋势,从2级到4级,CAT活性又开始上升,但4级的CAT活性依然低于0级,1级、2级、3级、4级枝条韧皮部CAT活性差异不显著。
不同等级枝条韧皮部PAL活性差异显著,健康树体枝条韧皮部PAL活性最低,显著低于发病树体,发病树体1级枝条韧皮部PAL活性最高,为186.93 U/g,且显著高于2级、3级、4级;4级枝条韧皮部PAL活性最低,为114.99 U/g,从0级到1级PAL活性升高,1级到4级PAL活性下降,但4级PAL活性依然高于0级,并达极显著水平,PAL活性整体呈先升高后降低的趋势。
不同发病等级,枝条韧皮部的PPO活性之间有显著差异。健康树体枝条韧皮部PPO活性显著高于发病树体,0级活性最高,为127.59U/g,显著高于其他等级;4级PPO活性最低,为59.22 U/g;在3级时,PPO的活性呈现短暂的上升,总体来看,PPO活性随着发病程度的增加,整体呈现降低的趋势。
3 讨 论
腐烂病是侵染库尔勒香梨韧皮部的真菌病害,严重制約了库尔勒香梨产业发展。当树体感染腐烂病后,如果不及时处理,极易影响树势,导致枝条或整株树死亡,给果农造成了严重的损失。在库尔勒香梨韧皮部含有大量的抗性酶,不同组织和不同发病程度,相关抗性酶会发生不同变化以调节病害对树体的损伤,是抗氧化防卫反应的一种机制。植物的防御酶系超氧化物歧化酶( SOD )、过氧化物酶( POD )、过氧化氢酶( CAT )、苯丙氨酸解氨酶( PAL )和多酚氧化酶( PPO )及其同工酶在植物组织受到病害侵染时,会产生相应变化以应对病害的伤害[ 11 ]。病害侵染植物后,植物会产生多种防御反应。其中抗氧化代谢对植物的抗病性有关键作用,抗性酶是植物中的保护酶,其活性直接影响植株抵抗病害的能力。本研究结果显示,同一棵树,其健康组织 SOD、PAL、PPO 活性高于发病组织的,同一果园内,发病程度低的枝条韧皮部 SOD、PPO 显著高于发病等级较高的活性。
SOD和POD 具有特定的生物催化功能,广泛的存在于植物、动物各个器官和组织中,细菌、真菌、藻类等有机体也广泛存在,是清除H2O2重要的保护酶。作为清除活性氧(ROS)的第一道防线,SOD发挥着重要作用,保护细胞和机体,抵御病害[ 12 ]。本研究中,同一株树,库尔勒香梨不同组织其抗性酶变化趋势不同,SOD在健康组织活性最高,在组织发病后,活性降低,随着发病程度活性增加先上升后下降,说明SOD在抵御腐烂病病原菌侵染是有一定阈值的。Aamir[ 13 ],Sgherri [ 14 ],龙艳玲[ 15 ]等都证实,当病害侵入植株后,植株体内活性氧增加,SOD活性上升,以此来抵御病害对植株造成的伤害。POD 的活性升高能降低由病原菌引起的活性氧的积累对植株造成的伤害。程帆等[ 16 ]研究发现,随着细菌病害角斑病侵染黄瓜病害程度逐渐加剧,POD 酶活性呈现上升后下降的趋势。周博如等[ 17 ]通过研究不同抗性大豆品种感染细菌性疫病后其 POD 活性的变化,发现POD 活性与大豆的抗病性成正相关。而黄凤莲[ 18 ]的结果表明,辣椒感染疫病后,POD 活性与抗病性呈负相关。本研究中,POD在库尔勒香梨发病组织活性最高,随着腐烂病侵染树体后,升高活性来抵御病原菌的侵染,且活性随着发病程度增加呈上升趋势,POD活性升高,为抵御病害作出重要贡献。
CAT广泛分布在植物体中,与 SOD、POD 相互协调配合,保持体内自由基处于动态平衡状态[ 19 ],清除H2O2,以防止活性氧自由基对植物体造成损伤[ 20 ]。本研究中,CAT在发病组织活性最高,其活性随着发病程度增加先下降后上升,CAT随着SOP和POD活性的变化,为清除过多的活性氧,提高活性,抵御病害。
PAL 是连接初级代谢和苯丙烷类代谢的关键酶,是苯丙烷类代谢第一步反应的限速酶,在细胞分化、木质化、及植物抗逆过程中都有非常重要的作用[ 21 ],在高等植物中参与次级代谢途径,主要参与防御机制。PAL在植物抵御病害发挥重要的作用,植物体受病原物侵染后,苯丙烷代谢途径被激活是植物细胞的抗性特征反应之一。多研究表明, PAL 与植物抗病性有关系,组织体内的 PAL 活性在短时间迅速升高,以抵御病原菌的侵染[ 22 - 23 ]。本研究中,PAL在库尔勒香梨病健交界处活性最高,在病原菌入侵前期,活性升高以抵御侵染,在病原菌完全侵入后活性降低。其活性随着发病程度增加先上升后下降,在病害入侵后,活性逐渐降低。
PPO是一种含铜的氧化酶,当植物细胞受到病原菌侵染或入侵破坏时,PPO会发生生理反应,产生酚类物质,防止植物受病害侵染,甚至杀死病原菌。研究表明,PPO 活性的提高,有利于细胞木质化或木栓化,提高植物受创伤的组织愈合速度,以此有效抵御病原菌侵染。王曼[ 23 ]研究发现,褐斑病入侵苹果后,PPO活性有显著变化。本研究中 PPO 随着库尔勒香梨发病程度总体呈下降趋势,病害严重时,其活性逐渐降低。
在病健不同组织抗性酶活性和不同发病程度库尔勒香梨树体组织抗性酶活性呈现不规律性的变化,总体来看,在不同组织上,酶活性呈现不同变化,病害对酶活性有不同影响,而随着发病程度的增加,酶活性最终都呈下降趋势,说明病害程度对酶活性的影响显著,随着病害加剧,酶活性降低,也可能是腐烂病发病的重要原因之一。
4 结 论
刘招龙等[ 24 ]和李春燕等[ 25 ]都证明,病原菌入侵寄主后,抗性酶呈规律性变化,抗性酶与病原菌入侵显著相关。本研究通过对库尔勒香梨不同病健组织类型和不同发病程度的枝条内的抗性相关酶活性研究,发现库尔勒香梨在受到腐烂病侵染时,病健不同组织内SOD、POD、CAT、PAL、PPO等防御酶均有所变化,变化规律不一致。病害在完全侵入组织后,SOD活性呈下降的趋势,在发病组织,POD、CAT活性最高,PAL在病健交界处活性最高。随着发病程度的增加,SOD活性整体呈先上升后下降的趋势,POD活性呈逐渐上升的趋势,CAT活性先下降后上升,PAL活性先上升后下降, PPO 总体呈下降趋势。研究结果表明,抗性相关酶与腐烂病病原菌关系密切,且参与了库尔勒香梨抵御腐烂病的过程,因其功能各不相同,在不同组织和不同病害程度下,抗性酶活性的变化表现不同。在植物体中,各抗性相关酶相互影响,相互配合,在病原菌与库尔勒香梨互作系统中,抗性酶作为抗病性和检测病害指标,发挥着重要作用。
参考文献
[1] 张子钊. 库尔勒香梨产业发展现状及建议[J]. 合作经济与科技, 2023(5): 30 - 32.
[2] 范瑛阁. 库尔勒香梨腐烂病的发生规律及防治技术[J]. 农业科技与信息,2010(9): 21.
[3] 刘龙, 荣华, 郑童童, 等. 莫海威芽孢杆菌对梨腐烂病的抑菌防病效果[J]. 中国农学通报, 2022, 38(18): 140 - 146.
[4] 古丽孜热·曼合木提, 徐琳赟, 李燕, 等. 库尔勒香梨腐烂病拮抗菌的筛选及其防效测定[J]. 中国农学通报, 2020, 36(19): 127 - 134.
[5] 宋博, 艾米都拉·克尤木, 朱曉锋, 等. 库尔勒香梨腐烂病发生及防治药剂筛选[J]. 新疆农业科学, 2020, 57(8): 1527 - 1534.
[6] 魏婧, 徐畅, 李可欣, 等. 超氧化物歧化酶的研究进展与植物抗逆性[J]. 植物生理学报, 2020, 56(12): 2571 - 2584.
[7] 余经, 林育钊, 范中奇, 等. 果蔬采后病害的发生与活性氧和膜脂代谢的关系研究进展[J]. 亚热带农业研究, 2020, 16(2): 132 - 137.
[8] Tripathy B C, Oelmüller R. Reactive oxygen species generation and signaling in plants[J]. Plant Signal, 2012, 7: 1621 - 1633.
[9] Pande A, Mun B G, Khan M, et al. Nitric Oxide Signaling and Its Association with Ubiquitin-Mediated Proteasomal Degradation in Plants[J]. Int. J. Mol. Sci. 2022, 23: 5628 - 5630.
[10] 赵亚冲, 邓岚, 王雄, 等. 阿拉尔垦区新疆杨农田防护林防风效果研究[J]. 塔里木大学学报, 2023, 4(35): 106 - 112.
[11] 邵延慧. 库尔勒香梨腐烂病发生与营养及抗性酶活性关联分析[D]. 阿拉尔: 塔里木大学, 2018.
[12] 阳传和. 树皮内酚类物质的含量及苯丙氨酸解氨酶的活性与杨树抗溃疡病的关系[J]. 林业科学, 1989,25(4): 311 - 316.
[13] 魏婧, 徐暢, 李可欣, 等. 超氧化物歧化酶的研究进展与植物抗逆性[J]. 植物生理学报, 2020, 56(12): 2571 - 2584.
[14] Aamir M, Kashyap SP, Zehra A, et al. Trichoderma erinaceum Bio-Priming Modulates the WRKYs Defense Programming in Tomato Against the Fusarium oxysporum f. sp. lycopersici (Fol) Challenged Condition[J]. Front Plant Sci, 2019, 10: 911 - 932.
[15] Sgherri C, Ranieri A, Quartacci M F. Antioxidative responses in vitis vinifera infected by grapevine fanleaf virus[J]. J Plant Physiol , 2013, 170(2): 121 - 128.
[16] 龙艳玲, 苏基平, 胡军华, 等. 柑桔褐斑病菌侵染对不同抗性柑桔种质防御酶活性的影响[J]. 中国南方果树, 2018, 47: 6 - 16.
[17] 程帆, 赵艳茹, 余克强, 等. 基于高光谱技术的病害早期胁迫下黄瓜叶片中过氧化物酶活性的研究[J]. 光谱学与光谱分析, 2017, 37(6): 1861 - 1865.
[18] 周博如, 刘太国, 杨微, 等. 不同抗性的大豆品种感染细菌性疫病后 POD,PPO 变化的研究[J]. 大豆科学,2002, 21(3): 183 - 186.
[19] 黄凤莲, 刘寿明, 曾端香, 等. 湘研辣椒品种抗疫病筛选及抗性机制研究[J]. 湖南农业大学学报, 1999, 25(4): 303 - 308.
[20] Farkas G L,Kiraly Z. Enzymological aspects of plant diseases,I. Oxidative enzymes[J]. Phytopathol. Z, 1958, 31: 251 - 272
[21] Yang T, Poovaiah BW. Hydrogen peroxide homeostasis: activation of plant catalase by calcium/calmodulin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(6): 4097 - 4102.
[22] 范丽娟. 黄耆苯丙氨酸解氨酶基因参与植物抗逆性的功能解析[D]. 哈尔滨: 东北林业大学, 2020.
[23] 程水源, 陈昆松, 刘卫红, 等.植物苯丙氨酸解氨酶基因的表达调控与研究展望[J]. 果树学报, 2003, 20(5): 351 - 357.
[24] Mario Monizdesa. Rapid activation of phenylpropanoid metabolism in elicitor treated hybrid Poplar (Populus trichocarpa Tarr &Gray X Populus deltoids Marsh) suspensioncultured cells[J]. Plant Physiology, 1992, 98: 728 - 737.
[25] 王曼. 两个苹果品种叶片接种褐斑菌后抗病相关酶活性变化研究[D].杨凌: 西北农林科技大学, 2013.
[26] 刘招龙, 张绍铃, 孙益林. 梨叶片感染轮纹病菌后的生理变化[J]. 植物保护, 2006, 32(6): 78 - 80.
[27] 李春艳, 朱宗财, 张王斌, 等. 杨树响应腐烂病菌侵染后抗性酶变化规律[J]. 林业科技, 2022, 47(3): 31 - 35.
