湖南省1日龄雏鸡肌胃腺胃炎流行病学调查及其致病因素研究
2024-06-04徐钰栋郭阳浩肖骞珣刘勃攻宋泽和贺喜刘自逵
徐钰栋 郭阳浩 肖骞珣 刘勃攻 宋泽和 贺喜 刘自逵

摘 要:为探究湖南省1日龄雏鸡肌胃腺胃炎的流行情况及其致病原因,本研究于2023年对湖南省11个不同种鸡场进行了15次1日龄雏鸡的肌胃腺胃炎流行病学调查及肌胃腺胃样品采集,进行病理剖检、病理评分、病理切片观察、炎症因子基因表达测定和霉菌毒素含量测定,并收集血清测定免疫球蛋白含量。结果表明,15次流行病学调查肌胃腺胃炎患病率为62.1%,病理剖检和病理切片观察发现患病雏鸡肌胃腺胃都出现了比较明显的溃疡和病灶以及黏膜层破损溃烂、炎性细胞浸润和肌层肌纤维疏松。患病雏鸡肌胃腺胃内炎症因子(IL-1β、IL-6和TNF-ɑ)基因表达和肌胃腺胃组织内玉米赤霉烯酮和T-2毒素的含量均显著高于正常雏鸡(P<0.05),血清中IgA、IgM和IgG含量均显著低于正常雏鸡(P<0.05)。综上所述,湖南省内1日龄雏鸡肌胃腺胃炎流行程度较为严重,种蛋中的霉菌毒素对肌胃腺胃的毒性作用及其所导致的鸡胚免疫能力下降可能是导致1日龄雏鸡肌胃腺胃炎的重要因素。
关键词:1日龄雏鸡;肌胃腺胃炎;流行病学调查;炎症因子;霉菌毒素;血清免疫球蛋白
中图分类号:S858.3 文獻标识码:B 文章编号:1673-1085(2024)05-0014-11
基金项目:湖南家禽产业技术体系
第一作者:徐钰栋(1999—),男,硕士,研究方向为兽药创制与临床应用研究,E-mail:791819417@qq.com
*通信作者:刘自逵(1965—),男,教授,硕士生导师,研究方向为兽用中药资源与中兽药创制,E-mail:lzk7035@sina.com
*并列通信作者:贺喜(1977—),男,教授,博士生导师,研究方向为家禽营养,E-mail:hexi111@126.com
肌胃腺胃炎是鸡常见的一种消化道疾病[1],临床表现精神萎靡、食欲不振、虚弱等症状,剖检可见腺胃肿胀、乳头扁平甚至消失、肌胃溃疡出血、角质层增厚、破损易剥离等病变,这极大地影响了鸡只的消化功能和健康状况,增加了鸡群料肉比和患病风险,给肉鸡养殖带来巨大的经济损失[2]。近年来我国华北、华东和东北地区相继发生大面积肌胃腺胃炎[3],且研究发现该病在1日龄雏鸡中也时有发生[4]。有文献报道,饲料霉菌毒素污染等非传染性因素以及网状内皮增生状病毒[5,6]、腺胃坏死病毒[7]、腺胃型传染性支气管炎病毒[8]和传染性法氏囊病毒[9]感染等传染性因素均可导致鸡只出现肌胃腺胃炎。1日龄雏鸡由于尚未进食饲料,其发生肌胃腺胃炎的原因可能与父母代种鸡日粮霉菌毒素污染或病毒感染等因素相关[4],但目前尚未有相关研究报道。本试验通过调研湖南省内多个种鸡场1日龄雏鸡肌胃腺胃炎发病情况并对相关潜在致病因素进行了分析,以期为1日龄雏鸡肌胃腺胃炎的防控提供数据和理论支撑。
1 材料与方法
1.1 主要试剂及仪器
1.1.1 主要试剂 生理盐水、60%甲醇溶液、80%甲醇溶液、10%甲醛溶液、SteadyPure通用型RNA提取试剂盒、Evo M-MLV反转录试剂盒、SYBR Green嵌合荧光定量染料,购于湖南艾科瑞生物工程有限公司;鸡免疫球蛋白(IgA、IgM和IgG)酶联免疫吸附试验(ELISA)试剂盒,购于上海酶联生物科技有限公;霉菌毒素含量ELISA试剂盒,购于普瑞邦生物科技有限公司。
1.1.2 主要仪器 离心机(TDL5E 型, 长沙英泰仪器有限公司)、光学显微镜(ML31型,广州市明美光电技术有限公司)、分光光度计(Nanodrop One 型,美国赛默飞世尔科技公司)、移液器(美国Gilson公司)、荧光定量PCR仪(LightCycler480Ⅱ型,瑞士罗氏公司)、匀浆机(JXFSTPRP-96L型,上海净信实业发展有限公司)、酶标仪(Infinite M PLEX型,瑞士帝肯公司)。
1.2 样品来源
对湖南省11个规模化种鸡场的15批不同品种的1日龄雏鸡进行肌胃腺胃炎流行病学调查和样品采集,采样地点及具体信息见表1。
1.3 样品采集和处理
各批次雏鸡均采用颈静脉取血并收集于促凝管中,血液样品于室温放置30 min,3 000 r/min离心10 min分离血清,将血清分装至1.5 mL 冻存管后放置于-80 ℃冰箱中保存待测。雏鸡使用CO2窒息致死后,分离肌胃和腺胃,剖检并拍照用于病理评分;拍照后取肌胃腺胃样品2份,一份样品于生理盐水中漂洗干净,放入10%甲醛溶液固定,用于制作组织切片;另一份样品于液氮中速冻,放置于-80 ℃冰箱保存,待测。
1.4 肌胃腺胃炎患病率的统计及病理评分
肌胃和腺胃病理评分按照本研究自行设计的病理等级评分标准进行病理评分,病理评分标准参照图1。0分(正常):肌胃腺胃表面呈鲜黄色,无任何炎症、溃疡和病变部位;1分(低程度患病):肌胃腺胃表面呈黄色,出现些许点状炎症、溃疡和病变部位;2分(中程度患病):肌胃腺胃表面呈暗黄色或褐色,出现有一定面积的炎症、溃疡和病变部位;3分(高程度患病):肌胃腺胃表面呈暗黄色、褐色甚至是黑色,出现大面积炎症、溃疡和病变部位。
1.5 肌胃腺胃组织病理学检查
10%甲醛溶液固定的肌胃腺胃样品,经脱水、透明、石蜡包埋、切片、H&E染色后,每个样本选择整体伸展良好、无过渡拉伸和压缩的组织切片,在光学显微镜下进行观察并拍照取样,使用Image-Pro Plus 6.0软件在100×倍数下观察肌胃腺胃黏膜层组织病变和肌层肌纤维组织病变情况,并在400×倍数下观察肌胃腺胃黏膜层和肌层炎性细胞浸润情况。
1.6 肌胃腺胃内炎症因子相关基因mRNA表达的测定
选取15批次中患病率和病情严重程度最高的2批组织样品(下同),用RNA裂解液匀浆后,按照SteadyPure通用型RNA提取试剂盒说明书操作进行肌胃腺胃组织RNA提取。使用核酸蛋白测定仪测定其浓度和纯度,按照Evo M-MLV反转录试剂盒说明书进行操作,反转录采用20 μL体系:gDNA Clean Reaction Mix Ver.2 2 μL,5× Evo M-MLVRT Reaction Mix Ver.2 4 μL,RNA (1000/浓度)μL,RNase free water (14-RNA加入量)μL,反转录得到cDNA。使用SYBR Green嵌合荧光法进行实时荧光定量PCR检测。
10 μL反应体系:cDNA 2 μL,5×SYBR 5 μL,上游引物 0.5 μL,下游引物0.5 μL,RNase-free water 2 μL。白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-ɑ(TNF-ɑ)引物参照Li等[10]的设计,并由生工生物工程(上海)有限公司合成,序列见表2;以β-肌动蛋白(β-actin)作为内参基因,根据2-ΔΔCt法对定量结果进行计算分析。
1.7 血清免疫球蛋白的测定
2批血清样品中免疫球蛋白(IgA、IgM和IgG)采用酶联免疫吸附检测试剂盒测定。
1.8 肌胃腺胃内霉菌毒素含量的测定
2批肌胃腺胃组织样品中霉菌毒素含量的测定参考Wang等[11]研究中的方法,使用酶联免疫吸附实验进行测定。具体操作如下:
取肌胃腺胃样品0.150 g于1.5 mL匀浆管中(4份),分别加入300 μL 60%甲醇溶液(用于测定玉米赤霉烯酮)、60%甲醇溶液(用于测定黄曲霉毒素)、蒸馏水(用于测定呕吐毒素)和80%甲醇溶液(用于测定T-2毒素),加入匀浆珠2颗,置于匀浆机中充分匀浆5 min后于室温4 000 r/min离心5 min,取上清液,使用定性滤纸过滤并收集滤液,并采用酶联免疫吸附检测试剂盒对待测液进行测定。
1.9 数据处理与分析
数据经Excel 2016整理后采用SPSS 22.0软件进行单因素方差分析(ONE-WAY ANOVA),使用Duncan氏多重比较法对实验结果的差异显著性进行处理分析,以P<0.05为显著性水平,数据用“平均数±标准差”表示。相关性分析是通过R语言自编程序来计算炎症因子、血清免疫球蛋白和肌胃腺胃内各类霉菌毒素含量之间的 person 相关系数。
2 结果与分析
2.1 1日龄雏鸡肌胃腺胃炎检测结果分析
本次调研对湖南省11个种鸡场内15批次1日龄雏鸡进行了肌胃腺胃炎流行病学调查,共采集样品1 303份,其中正常雏鸡493只、患病雏鸡810只,患病率为62.1%。
2.2 1日龄雏鸡肌胃腺胃剖检及病理评分结果分析
由表3可见,本次调研患病雏鸡的病情较为严重,低患病程度(1分)雏鸡和中患病程度(2分)雏鸡分别占比32%和23%,高患病程度(3分)雏鸡占比7%。
2.3 1日龄雏鸡肌胃腺胃H&E染色切片病理觀察结果分析
由图2中A~H可见,患病雏鸡肌胃腺胃的黏膜层破损溃疡,肌胃腺不同程度的断裂,肌胃腺胃的肌层肌纤维密度显著低于正常雏鸡,且这些病理现象随着患病程度的升高而呈现更加严重的趋势;由图2中I~P所见,患病雏鸡肌胃腺胃的黏膜层和肌层出现比较明显的炎性细胞浸润和红细胞渗出,这些病理现象同样随着患病程度的升高而呈现更加严重的趋势。
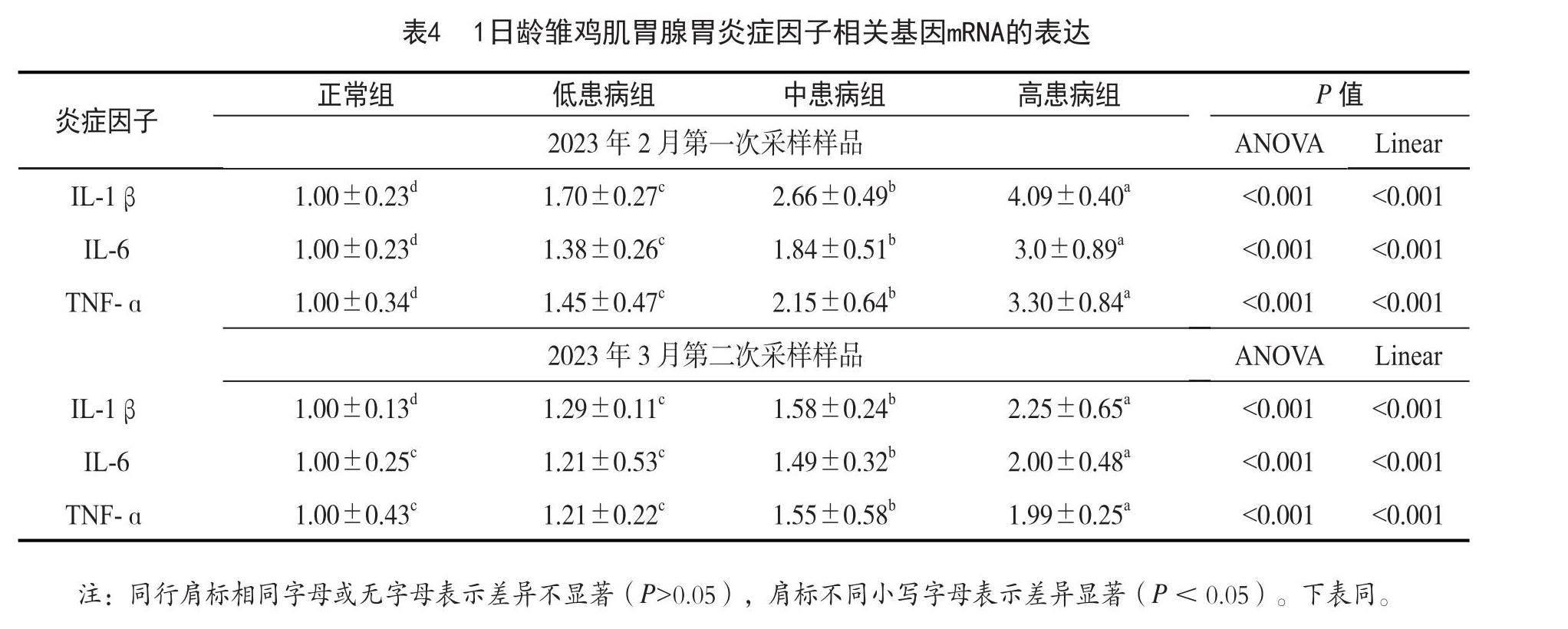
2.4 1日龄雏鸡肌胃腺胃炎症因子相关基因mRNA的表达结果分析
结果见表4所示。低患病组、中患病组、高患病组的肌胃腺胃组织内炎症因子(IL-1β、IL-6和TNF-ɑ)基因表达显著高于正常组(P<0.05),且炎症因子(IL-1β、IL-6和TNF-ɑ)基因的表达随着肌胃腺胃炎病情严重程度的增加而呈显著线性上升(P<0.05)。
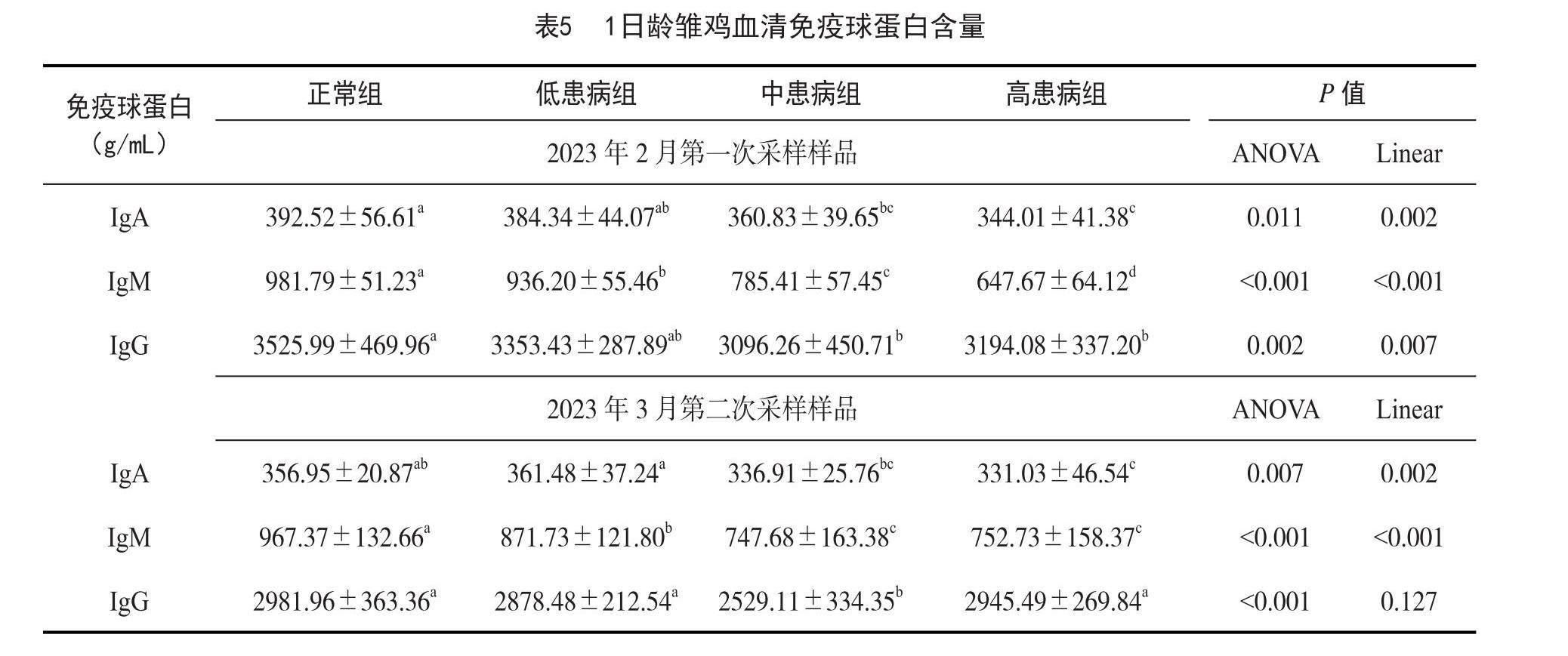
2.5 1日龄雏鸡血清免疫球蛋白含量结果分析
结果见表5所示。低患病组、中患病组、高患病组的血清免疫球蛋白IgA、IgM含量显著低于正常组(P<0.05),且雏鸡血清IgA、IgM含量随着病情严重程度的增加而呈显著线性下降(P<0.05);中患病组、高患病组的血清IgG的含量显著低于正常组和低患病组(P<0.05),但各组数据之间并无显著线性关系(P>0.05)。
2.6 1日龄雏鸡肌胃腺胃内各类霉菌毒素的含量结果分析
结果见表6所示。由表6可知,各患病组肌胃腺胃内呕吐毒素(DON)和黄曲霉毒素(AFB1)含量与正常组相比,无显著差异(P>0.05),且各组数据之间并无显著线性关系(P>0.05);中患病组、高患病组肌胃腺胃内的玉米赤霉烯酮和T-2毒素含量显著高于正常组(P<0.05),且肌胃腺胃内玉米赤酶烯酮(ZEN)和T-2毒素(T-2toxin)的含量随着病情严重程度的增加而呈显著线性上升(P<0.05)。
2.7 1日龄雏鸡肌胃腺胃炎症因子基因的表达、霉菌毒素的含量以及血清免疫球蛋白间的pearson相关性分析
结果见图3所示。雏鸡肌胃腺胃内玉米赤霉烯酮含量同雏鸡肌胃腺胃内 IL-1β 基因表达呈正相关(P<0.05),雏鸡肌胃腺胃内T-2毒素含量同雏鸡肌胃腺胃内TNF-ɑ基因表达呈正相关(P<0.05);雏鸡肌胃腺胃内T-2毒素含量同雏鸡血清IgM含量呈负相关(P<0.01),雏鸡肌胃腺胃内玉米赤霉烯酮含量同雏鸡血清IgM含量呈负相关(P<0.05),雏鸡肌胃腺胃内黄曲霉毒素含量同雏鸡血清IgG含量呈负相关(P<0.001);雏鸡肌胃腺胃的炎症因子基因表达与雏鸡血清免疫球蛋白的含量呈显著负相关的关系(P<0.001)。
3 讨论
3.1 1日龄雏鸡肌胃腺胃炎流行病学调查及剖检和镜检观察的意义
该病主要降低消化功能、降低饲料转化率,同时增加其他疾病的发病风险,导致鸡只大量死亡,进而对养殖业造成巨大的经济损失[3,4]。本试验通过对湖南省内11个种鸡场的15批次1日龄雏鸡进行肌胃腺胃炎流行病学调查,发现1日龄雏鸡肌胃腺胃炎患病率为62.1%,说明肌胃腺胃炎不止成年鸡发生[12],在1日龄雏鸡中同样流行广泛。通过对雏鸡的肌胃、腺胃进行剖检和病理评分,本研究发现患病雏鸡的肌胃腺胃出现了明显溃疡、炎症、出血,这些症状和伍娟等[13]攻毒试验中提到的典型的肌胃腺胃炎症状一致。病理切片观察结果显示,患病雏鸡的肌胃腺胃黏膜层出现明显的破损、破裂和炎性细胞浸润,肌层肌纤维密度出现明显的下降。这些组织病理学变化与郭剑英等[14]通过高铜饲料攻毒造成肌胃腺胃炎后观察到患病鸡肌胃肌纤维变得较为稀疏的结果和Lemiere S等[15]研究提到的患有肌胃腺胃炎肉鸡肌胃角质层退化、黏膜坏死破损、细胞核内包含体及炎性细胞浸润的结果相一致。
3.2 1日龄雏鸡肌胃腺胃内炎症因子测定的意义
炎症因子是一种可以反映炎症反应的剧烈程度及其所导致的损伤程度的重要指标[16]。IL-1β 是一种重要的促炎性细胞因子,参与多种自身免疫性炎症反应和多种细胞活动,包括细胞增殖、分化和凋亡,也诱导诸如 IL-6、TNF-ɑ等其他细胞因子的产生,进而一同发挥促进炎症的作用[17-18]。为确定患病雏鸡肌胃腺胃炎症反应的剧烈程度及损伤程度,本研究抽取了15批次流行病学调查中患病率最高、患病程度最严重的2批次样品,测定了样品中炎症因子的基因表达,发现患病雏鸡促炎性细胞因子(IL-1β、IL-6 和 TNF-ɑ)基因表达相较正常雏鸡显著上升,说明肌胃腺胃剖检和镜检出现的病理变化可能与肌胃腺胃炎症反应相关。这些结果与夏楠等[19]收集到的21日龄患有肌胃腺胃炎的肉鸡血清 IL-1β、IL-6、IL-8、TNF-ɑ 炎症因子含量显著高于对照组的结果相似。本试验结果说明,1日龄雏鸡肌胃腺胃炎的流行情况严峻且患病鸡肌胃腺胃的病理变化可能是由机体内源性炎症反应导致的。
3.3 1日龄雏鸡肌胃腺胃内霉菌毒素含量测定的意义
研究发现,成年肉鸡患肌胃腺胃炎与霉菌毒素污染密切相关[1,10,20,21]。霉菌毒素是由各种真菌产生的天然有毒的次级代谢物,包括曲霉菌、镰刀菌等产生的毒素,其中黄曲霉毒素B1、呕吐毒素、T-2毒素和玉米赤霉烯酮是污染饲料及饲料原料的主要毒素[22]。种鸡饲料中的霉菌毒素被种鸡食用后可以通过体循环沉积到种蛋中,这得到了相关研究的证实。Zahoor 等[23]研究发现,持续使用黄曲霉毒素污染的谷物喂养种鸡,饲喂后的第5天可在其产下的鸡蛋中检测出黄曲霉毒素,停止饲喂后的第6天在鸡蛋中消除完全。Sypecka 等[24]的研究发现,分别使用含有5、7.5、10 mg/kg呕吐毒素的饲料饲喂蛋鸡,均可在其产下的鸡蛋中检测出呕吐毒素。在胚胎发育过程中,鸡胚吸收可能含有霉菌毒素的卵黄与卵白以获得生长所需要的营养物质[25],上述研究结果说明沉积到鸡蛋中的霉菌毒素可以与发育中的鸡胚接触,对其肌胃腺胃发挥毒性作用。本试验结果发现,患有肌胃腺胃炎的雏鸡肌胃腺胃内T-2毒素和玉米赤霉烯酮含量显著高于正常雏鸡,但呕吐毒素和黄曲霉毒素含量却没有显著差异,这说明垂直传递至种蛋或者种蛋内滋生的T-2毒素和玉米赤霉烯酮可能是1日龄雏鸡肌胃腺胃炎的重要致病因素之一。
3.4 1日龄雏鸡血清内免疫球蛋白含量测定的意义
作为机体免疫系统的重要组成部分,由浆细胞合成和分泌的血清球蛋白是动物体内能够抵抗外源性病毒或细菌的具有免疫功能的蛋白质[26]。Islam等[27]的研究发现,暴露于玉米赤霉烯酮的小鼠脾脏以及肠系膜淋巴结(MLN)中的CD4+和CD8+等免疫细胞出现显著下降;Cai等[28]的研究发现,玉米赤霉烯酮可诱导MAPK过度激活,促进T淋巴细胞的凋亡,从而降低机体的免疫功能。Chen等[29]的研究发现,肉鸡饲喂含有T-2毒素的饲料后,暴露于 T-2 毒素的肉鸡表现出脾脏相对重量和大小下降、脾细胞凋亡百分比增加,且随着T-2毒素剂量的增加,CD4+/CD8+ T细胞比率也随之降低增加。上述研究结果说明,玉米赤霉烯酮和T-2毒素可以抑制机体免疫反应,从而降低其对某些传染性病毒的抵抗力。本试验结果发现,患有肌胃腺胃炎的雏鸡血清IgA、IgM和IgG含量显著低于正常雏鸡,这与Wu等[30]的研究中使用玉米赤霉烯酮攻毒后造成大鼠血清免疫球蛋白IgG含量下降的结果以及Rahman等[31]的研究中使用T-2毒素攻毒后造成大鼠血清免疫球蛋白IgA、IgG、IgM含量呈剂量依赖性下降的结果均相似。这说明鸡胚中霉菌毒素引起的肉鸡免疫能力下降可能是造成肌胃腺胃炎的致病因素之一。
3.5 1日龄雏鸡肌胃腺胃炎症因子基因表达、霉菌毒素含量以及血清免疫球蛋白间的pearson相关性分析的意义
综合所测的霉菌毒素和生化指标数据,通过皮尔森相关性分析发现,肌胃腺胃内T-2毒素、玉米赤霉烯酮和肌胃腺胃炎症因子指标成正相关,与血清IgM成负相关;而雏鸡肌胃腺胃的炎症因子的基因表达则是与雏鸡血清免疫球蛋白的含量呈显著负相关的关系。
上述结果表明,鸡胚中玉米赤霉烯酮和T-2毒素的毒性作用及其引起的鸡胚免疫能力下降可能是1日齡雏鸡肌胃腺胃炎的重要致病因素。
4 结论
本研究结果显示,2023年湖南省内部分地区种鸡场1日龄雏鸡肌胃腺胃炎检出率为62.1%,患病雏鸡的肌胃腺胃出现明显组织病变和促炎性细胞因子基因表达上升,这可能是由垂直传递至种蛋或者种蛋内滋生的玉米赤酶烯酮和T-2毒素直接与发育中的肌胃腺胃接触产生毒性作用,或间接降低鸡胚免疫力而使得鸡胚对传染性病毒性因素的抵抗力下降共同导致的。
参考文献:
[1] 张瑜,任杰,韩建鹏,等.加味健胃散对肉鸡腺胃炎、生长性能及免疫性能的影响[J].中国饲料,2021,(17):61-64.
[2] 谢怀平. 浅析家禽发生腺胃炎和肌胃糜烂的原因[J]. 中国动物保健,2021,23(09):47-48.
[3] 孔倩倩,郭良慧,朱育玮,等. 浅谈当前鸡腺胃炎病因学研究概况[J]. 家禽科学,2019,302(12):47-51.
[4] 孙静,王晓艺,常维山. 雏鸡肌腺胃炎的综合防治[J]. 山东畜牧兽医,2017,38(4):82.
[5] 谢泽鑫. 鸡腺胃炎的病理模型建立及防治方法的研究[D].武汉:华中农业大学,2023.
[6] 杜建才,王桂花,杨洁,等. 网状内皮组织增生病病毒、鸡贫血病毒、大肠杆菌混合感染诱导肉鸡腺胃炎[J]. 中国兽医杂志,2022,58(1):117-121.
[7] ?MIALEK M,GESEK M,DZIEWULSK D,et al. Transmissible Viral Proventriculitis Caused by Chicken ProVentricular Necrosis Virus Displaying Serological Cross-Reactivity with IBDV[J]. Animals (Basel),2020,11(1):8.
[8] 韩振兴,任庆贤,孙书旺,等.中药复方制剂对鸡腺胃炎的治疗效果评价及机制研究[J].北方牧业,2023(24):22.
[9] GRAU-ROMA L,MARCO A,MART?NEZ J,et al. Infectious bursal disease-like virus in cases of transmissible viralproventriculitis[J]. Veterinary Record,2010,167(21):836.
[10] LI T,YU H,SONG Y,et al. Protective effects of Ganoderma triterpenoids on cadmium-induced oxidative stress and inflammatory injury in chicken livers[J]. Journal of trace elements in medicine and biology,2019,52:118-125.
[11] WANG Y,QUAN H,Li X,et al. Contamination With Fumonisin B and Deoxynivalenol Is a Threat to Egg Safety and Contributes to Gizzard Ulcerations of Newborn Chickens[J]. Front Microbiol.2021,12:676671.
[12] 陈君,李秀,戚南山,等.粤东地区鸡传染性病毒性腺胃炎流行病学调查[J]. 广东畜牧兽医科技,2022,47(6):63-69.
[13] 伍娟. “肌腺胃溃康”联合金板青颗粒对白羽肉鸡腺胃炎的防治研究[D].成都:四川农业大学,2016.
[14] 郭剑英,白雨曼,廖建昭,等. 高铜诱导肉鸡肌胃和腺胃发生自噬与凋亡[J]. 中国兽医科学,2020,50(7):930-938
[15] Stephane Lemiere. 家禽腺胃炎和肌胃糜烂的研究动态[J]. 中国家禽,2010,32(15):42-44.
[16] ZHU L,WEI T,GAO J,et al. The cardioprotective effect of salidroside against myocardial ischemia reperfusion injury in rats by inhibiting apoptosis and inflammation[J]. Apoptosis,2015,20(11):1433-1443.
[17] MANTOVANI A,DINARELLO CA,MOLGORA M,et al. Interleukin-1 and Related Cytokines in the Regulation of Inflammation and Immunity[J]. Immunity,2019,50(4):778-795.
[18] 唐静,马旭升,石正旺,等. 非洲猪瘟病毒C84L蛋白通过激活NLRP3炎症小体上调炎症因子的表达[J]. 中国兽医科学,2024,54(1):1-11.
[19] 夏楠,张亚莉,王仁虎,等. 鸡发生传染性腺胃炎后炎症因子的变化[J]. 中国兽医杂志, 2017,53(9):20-22.
[20] 宋雪梅,王寧. 鸡腺胃炎的发病规律及综合防控[J]. 中国动物保健,2023,25(7):59-60.
[21] 寇连文. 鸡腺胃炎的发病规律与综合防控[J].中国动物保健,2024,26(03):57-58.
[22] 刘建高,厉学武,彭哲,等.2021年我国饲料原料中常见霉菌毒素污染情况调查[J]. 中国家禽,2023,45(10):70-75.
[23] ZAHOOR Ul HASSAN,KHAN MZ,KHAN A,et al. Effects of individual and combined administration of ochratoxin A and aflatoxin B1 in tissues and eggs of White Leghorn breeder hens[J]. Journal of the science of food and agriculture,2012,92(7):1540-1544.
[24] SYPECKA Z,KELLY M,BRERETON P. Deoxynivalenol and zearalenone residues in eggs of laying hens fed with a naturally contaminated diet: effects on egg production and estimation of transmission rates from feed to eggs[J]. Journal of Agricultural and Food Chemistry,2004,52(17):5463-5471.
[25] GIVISIEZ PEN,MOREIRA FILHO ALB,SANTOS MRB,et al. Chicken embryo development: metabolic and morphological basis for in ovo feeding technology[J]. Poultry Science,2020,99(12):6774-6782.
[26] ZAHIRIAN M,SEIDAVI A,SOLKA M,et al. Dietary supplementation of Aspergillus oryzae meal and its effect on performance, carcass characteristics, blood variables, and immunity of broiler chickens[J]. Trop Anim Health Prod,2019,51(8):2263-2268.
[27] ISLAM MR,KIM JW,ROH YS,et al. Evaluation of immunomodulatory effects of zearalenone in mice[J]. Journal of immunotoxicology,2017,14(1):125-136.
[28] CAI G,SUN K,XIA S,et al. Decrease in immune function and the role of mitogen-activated protein kinase (MAPK) overactivation in apoptosis during T lymphocytes activation induced by zearalenone, deoxynivalenol, and their combinations[J]. Chemosphere,2020,255:126999.
[29] CHEN Y,HAN S,WANG Y,et al. Oxidative Stress and Apoptotic Changes in Broiler Chicken Splenocytes Exposed to T-2 Toxin[J]. Biomed research international,2019:5493870.
[30] WU F,CUI J,YANG X,et al. Effects of zearalenone on genital organ development, serum immunoglobulin, antioxidant capacity, sex hormones and liver function of prepubertal gilts[J]. Toxicon,2021,189:39-44.
[31] RAHMAN S,SHARMA AK,SINGH ND,et al. Immunopathological effects of experimental T-2 mycotoxicosis in Wistar rats[J]. Human & Experimental toxicology,2021,40(5):772-790.
Epidemiological survey of myogastric adenogastritis in 1-day-old chicks in Hunan Province and preliminary study on the causative factors of the disease
XU Yudong1,GUO Yanghao2,3,XIAO Qianxun2,3,LIU Bogong2,4,SONG Zehe2,3,HE Xi2,3,
LIU Zikui1
(1.College of Veterinary Medicine,Hunan Agricultural University,Changsha 410128,China;2.College of Animal Science and Technology, Hunan Agricultural University,Changsha 410128,China;3.Ministry of Education Engineering Research Center of Feed Safety and Efficient Use,Changsha 410128,China;4. Hunan Engineering Research Center of Poultry Production Safety,Changsha 410128,China)
Abstract: This exprement was conducted to investigate the prevalence of myogastric adenogastritis and its causative factors in 1-day-old chicks in Hunan province, this study conducted 15 epidemiological surveys and collected myogastric adenogastric samples from 11 different breeder farms in Hunan province in 2023. Samples of the myogastric glandular stomach were dissected, scored, and sectioned for pathological observation. The expression of inflammatory factors and mycotoxin levels were also determined. Additionally, serum was collected to determine immunoglobulin levels.The prevalence of myogastric adenogastritis was found to be 62.1% in 15 epidemiological surveys. Pathological dissection and section observations showed that diseased chicks had ulcers, lesion, broken and ulcerated mucosal layers, inflammatory cell infiltration, and laxity of the muscle fibers in the myogastric layer. The gene expression of pro-inflammatory factors IL-1β, IL-6, and TNF-ɑ, as well as the levels of zearalenone and T-2 toxin in the myogastric tissues of diseased chicks, were significantly higher than those in normal chicks (P < 0.05). Additionally, the serum levels of immunoglobulins IgA, IgM, and IgG were significantly lower in diseased chicks than in normal chicks (P < 0.05). In conclusion, the incidence of myogastric adenogastritis in 1-day-old chicks in Hunan Province is relatively high. One of the possible contributing factors to this condition is the presence of mycotoxins in eggs, which can lead to reduce immunocompetence of chicken embryos.
Keywords: 1-day-old chicks;myogastric adenogastritis;epidemiological investigation;inflammatory factors;mycotoxins;Serum immunoglobulin
