无机化学实验“硫酸亚铁铵的制备”教学案例的设计*
2024-05-30杜意恩郭少华兰姝宁高润凤
杜意恩,郭少华,兰姝宁,高润凤,何 婧
(1 晋中学院化学化工系,山西 晋中 030619;2 南京大学现代工程与应用科学学院,江苏 南京 210093)
无机化学实验是面向化学、应用化学、环境科学与工程以及食品科学与工程等专业开设的一门必修专业核心课程,对学生的科学思维能力、实事求是的科学态度、良好的实验素养和环境保护意识、实验操作技能以及独立工作能力的培养具有十分重要的作用。如何在无机化学实验教学过程中将课程思政与教学内容巧妙结合,在潜移默化中将严谨、求真、务实的科学态度和“绿水青山就是金山银山”的发展理念润物细无声地融入学生的心中,培养学生的安全意识、环保意识、节约意识、创新意识、职业道德、社会责任感、使命感、民族自豪感和家国情怀,形成无机化学实验课程与思政课程同心同向的育人格局,需要无机化学实验课程教师进行深入细致的研究和实践[1-2]。
“硫酸亚铁铵的制备”是大学无机化学实验中的一个典型设计实验,通过本实验的教学可以使学生根据制备原理及数据,设计并制备出复盐硫酸亚铁铵;可以使学生进一步掌握水浴加热、溶解、过滤、蒸发、结晶、干燥等基本操作;可以培养学生的分析能力、探究精神和严谨的科学态度以及培养学生的资源节约意识、环保意识、创新意识、团队合作意识和实践能力等[3]。我校无机化学实验课程选用的教材是赵新华主编的《无机化学实验》[4],其中硫酸亚铁铵的制备教学部分主要包括:(1)根据实验原理,设计出制备硫酸亚铁铵复盐的方法;(2)列出实验所需的仪器、药品及材料;(3)制备硫酸亚铁铵;(4)产品检验——Fe3+的限量分析,以确定产品等级。
针对上述教学内容,我们设计的教学思路为:(1)铁屑的净化;(2)硫酸亚铁的制备;(3)硫酸亚铁铵的制备;(4)产品的级别确定。该部分计划教学时数为3学时,在教学设计中科学合理地融入思政要素,可以更好地落实“立德树人”根本任务,构建“三全育人”工作体系,开创“思政育人”育人格局,其设计方案如图1所示。
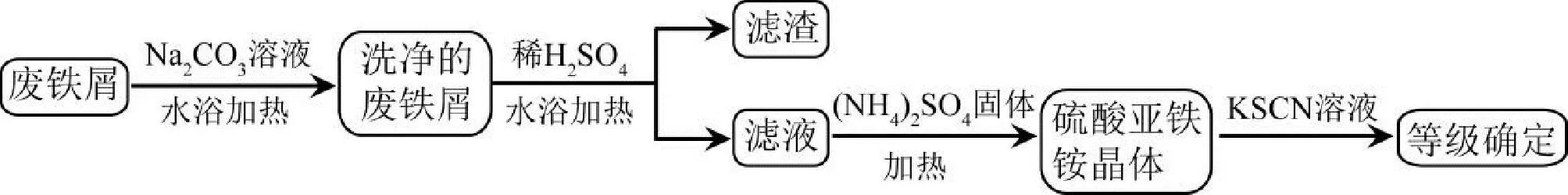
图1 “硫酸亚铁铵的制备”实验设计方案Fig.1 Experimental design scheme of Preparation of Ammonium Ferrous Sulfate

图2 硫酸亚铁铵的晶体结构Fig.2 Crystal structure of ammonium ferrous sulfate
近年来,关于硫酸亚铁铵的制备的研究很多,但鲜有关于硫酸亚铁铵晶体结构和形貌的报道。如,武警学院王永明[5]从实验材料、药品相对使用量、反应温度和酸碱度的选择等方面对硫酸亚铁铵的制备条件进行了探讨。西南科技大学钟国清等[6]对传统的硫酸亚铁铵制备实验内容进行了绿色化改造,利用 X-射线粉末衍射、红外光谱、热重差热分析等仪器对制备的晶体进行了表征。乐山师范学院杨孝容等[7]对不同原料配比制备的硫酸亚铁铵的稳定性进行了研究。衡阳师范学院刘洋等[8]以还原铁粉、4 mol/L H2SO4和(NH4)2SO4溶液固体为反应物,考查了溶液体积和加热方式对硫酸亚铁铵结晶的影响。

基于学生在硫酸亚铁铵制备过程中出现的情况,本研究根据北京师范大学化学学院赵新华主编的《无机化学实验》(第四版)[6]教材内容,系统探究以废铁屑、H2SO4和(NH4)2SO4为反应原料制备(NH4)2SO4·FeSO4·6H2O的工艺条件(反应物料配比、加热方式)对产物颜色、结构、形貌和等级的影响,激发学生的实验兴趣,从而培养学生的“绿水青山就是金山银山”的发展理念,提高学生的实验操作技能,并激发其科研创新意识。
1 实验设计
1.1 实验原理
铁屑与硫酸反应生成硫酸亚铁溶液:
Fe+H2SO4=FeSO4+H2↑
硫酸亚铁溶液与硫酸铵反应生成硫酸亚铁铵复合晶体:
FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O
20 ℃时,(NH4)2SO4·FeSO4·6H2O在水中的溶解度(36.5 g/100 g H2O)比组成它的组分FeSO4(48.0 g/100 g H2O)或(NH4)2SO4(75.4 g/100 g H2O)的溶解度都小。因此将含有FeSO4和(NH4)2SO4的溶液经加热浓缩、冷却结晶后可得到硫酸亚铁铵复盐晶体。
1.2 试剂与仪器
试剂:废铁屑,晋中学院工程训练中心;硫酸(H2SO4,分析纯),四川西陇化工有限公司、硫酸铵((NH4)2SO4,分析纯),天津市大茂化学试剂厂;无水碳酸钠(Na2CO3,分析纯),天津市恒兴化学试剂制造有限公司;无水乙醇(C2H5OH,分析纯),天津市科密欧化学试剂有限公司;去离子水。
仪器:酒精灯(150 mL)、JYT-1架盘药物天平,上海医用激光仪器厂;烧杯(100 mL、250 mL、500 mL);锥形瓶(100 mL);玻璃漏斗;蒸发皿;铁架台、石棉网;SHZ-D(III)循环水式多用真空泵,巩义市科瑞仪器有限公司;XRD-6100X-射线衍射仪;SU8100场发射扫描电子显微镜。
1.3 实验内容
1.3.1 废铁屑的净化
用架盘药物天平称取2.0 g废铁屑(图3),放入100 mL锥形瓶中,加入20 mL 1 mol·L-1Na2CO3溶液(或氢氧化钠溶液),在75 ℃下水浴加热15 min,以除去铁屑表面的油污。用倾析法除去碱液(倒入250 mL烧杯中,作尾气吸收备用),再用水把废铁屑上碱液冲洗干净,以防止在加入H2SO4后产生Na2SO4晶体混入FeSO4中。通过废铁屑的净化处理,增强学生的环保意识,培养学生有效利用废物资源、变废为宝的可持续发展理念。

图3 净化前的废铁屑(a)和净化后的废铁屑照片(b)Fig.3 Photos scrap iron filings before purification (a) and after purification(b)
1.3.2 硫酸亚铁的制备
向盛有洁净废铁屑的100 mL锥形瓶内加入15 mL 3 mol·L-1H2SO4,用双孔胶塞塞住,其中一个小孔中插入吸有3 mL 1 mol·L-1H2SO4的胶头滴管,另一孔中插入导气管,导气管的末端与玻璃漏斗相连,将漏斗倒扣在盛有碱液的250 mL烧杯的液面上方(吸收废铁屑中硫、磷等杂质与硫酸反应时产生的H2S、PH3等危害师生的身体健康的刺鼻、呛人的有毒气体),将锥形瓶放在盛有水的500 mL烧杯中,水浴加热,温度控制在70~80 ℃,实验装置如图4所示。使铁屑与硫酸完全反应(约50 min),在反应过程中,应不时地往锥形瓶中挤压1 mol·L-1H2SO4溶液,以补充被蒸发掉的水分和保持反应溶液的pH在2以下,趁热减压过滤,将浅绿色滤液转入100 mL蒸发皿或烧杯中。用少量热水洗涤锥形瓶及漏斗上的残渣,抽干后称量,从而计算出FeSO4溶液中所溶解的铁屑的质量。通过硫酸亚铁铵的制备过程及尾气处理操作,减少废物排放,实现制备过程的绿色化,能够增强学生的设计能力、动手操作能力和环保意识,培养学生“绿水青山就是金山银山”可持续发展理念。
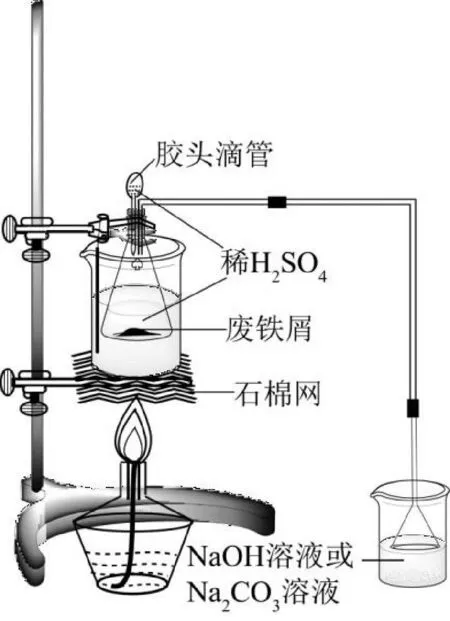
图4 硫酸亚铁制备反应装置Fig.4 Preparation reaction device of ferrous sulfate
1.3.3 硫酸亚铁铵的制备
根据实际反应的废铁屑的质量,计算出生成的FeSO4溶液中溶质的理论产量,然后根据反应FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O,计算所需(NH4)2SO4固体的质量。(1)称取(NH4)2SO4固体,加入上述盛有FeSO4溶液的蒸发皿或烧杯中,搅拌使其完全溶解,得到硫酸亚铁铵溶液,调节其pH为1~2。①将盛有硫酸亚铁铵溶液的蒸发皿放到铁圈中,用酒精灯上加热,蒸发浓缩至表面出现一层晶体薄膜后停止加热,放置、自然冷却,制得硫酸亚铁铵晶体。②将盛有硫酸亚铁铵溶液的100 mL烧杯,放入盛有水的250 mL烧杯中,用试管夹夹住100 mL烧杯,防止倾倒,用酒精灯加热(即水浴加热),蒸发浓缩至表面出现一层晶体薄膜后停止加热,放置、自然冷却,制得硫酸亚铁铵晶体。(2)称取(NH4)2SO4固体,配制成(NH4)2SO4饱和溶液,加入到上述盛有FeSO4溶液的蒸发皿或烧杯中,搅拌使其完全溶解,得到硫酸亚铁铵溶液,调节其pH为1~2。①将盛有硫酸亚铁铵溶液的蒸发皿放到铁圈中,用酒精灯上加热,蒸发浓缩至表面出现一层晶体薄膜后停止加热,放置、自然冷却,制得硫酸亚铁铵晶体。②将盛有硫酸亚铁铵溶液的100 mL烧杯,放入盛有水的250 mL烧杯中,用试管夹夹住100 mL烧杯,防止倾倒,用酒精灯加热(即水浴加热),蒸发浓缩至表面出现一层晶体薄膜后停止加热,放置、自然冷却,制得硫酸亚铁铵晶体。用减压过滤法除去母液(用无水乙醇冲洗烧杯或蒸发皿中的晶体),将晶体转移到表面皿上晾干,观察晶体的颜色和形状,最后称量,计算产率。
1.3.4 产品的检验
(1)Fe3+标准溶液的配制
用分析天平称量0.086 3 g铁铵矾(NH4Fe(SO4)2·12H2O,M=482.192 0 g/mol),加入盛有少量去离子水的100 mL烧杯中,用吸量管移取2.5 mL浓H2SO4溶液加入到上述烧杯中,用玻璃棒搅拌均匀后,转移到容量为1 000 mL的容量瓶中,用去离子水洗涤烧杯2~3次,洗涤液一并转入到容量瓶中,然后用去离子水稀释至刻度,摇匀[4]。此溶液含Fe3+为0.01 g/L,即0.01 mg/mL。
(2)标准色阶的配制
用移液管吸取5.00 mL Fe3+标准溶液于25.00 mL比色管中,向其中加入2.00 mL 2.0 mol/L HCl溶液和0.50 mL 1.0 mol/L KSCN溶液,然后向其中加入含氧较少的去离子水(取略多于所需量的去离子水于锥形瓶中,在石棉网上小心加热煮沸10~20 min,冷却后即可使用)稀释至刻度,配制成相当于Ⅰ级试剂的标准液(含Fe3+0.05 mg/g,即质量分数w为0.005%)[4]。
同样,分别取10.00 mL和20.00 mL Fe3+标准溶液配制成相当于Ⅱ级和Ⅲ级试剂的标准液(含Fe3+分别为0.10 mg/g,0.20 mg/g,即质量分数w分别为0.01%和0.02%)[4]。
(3)产品级别的确定
称1.00 g样品置于25.00 mL比色管中,加入15.00 mL含氧较少的去离子水溶解,待其全部溶解后,再加入2.00 mL 3.0 mol/L HCl溶液和0.50 mL 1.0 mol/L KSCN溶液,继续加含氧较少的去离子水至25.00 mL刻度线,摇匀,与标准溶液进行目视比色,确定产品等级。
1.4 晶体表征
采用X-射线衍射仪(XRD)和场发射扫描电子显微镜(FESEM)分析样品的结构和形貌。
2 结果和讨论
2.1 XRD表征
反应物的状态和加热方式对所制备的产物的结构和形貌有较大的影响。图5为不同条件下制备的硫酸亚铁铵晶体,所得产物的颜色、质量和产率列于表1。图5(a)和(b)是将(NH4)2SO4固体直接加入到FeSO4溶液中,分别通过常规加热和水浴加热所制备的样品。图5(c~d)和图5(e) 是将NH4)2SO4饱和溶液加入到FeSO4溶液中,分别通过水浴加热和常规加热所制备的样品。
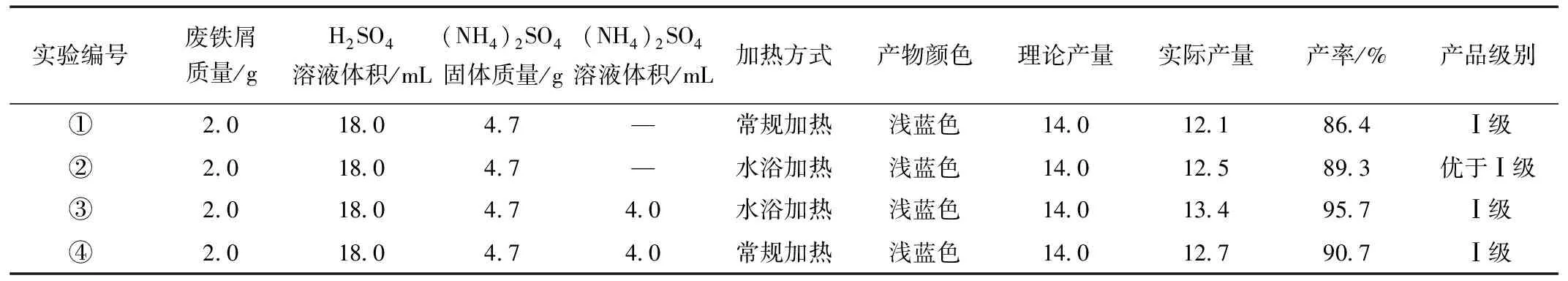
表1 不同条件下所制备的硫酸亚铁铵晶体Table 1 Ammonium ferric sulfate crystals prepared under different conditions

图5 不同条件下所制备的硫酸亚铁铵的晶体照片Fig.5 Crystal photos of ammonium ferrous sulfate prepared under different conditions
由图5和表1可知,在不同条件下所制备的硫酸亚铁铵均为淡蓝色晶体。当与FeSO4溶液反应制备硫酸亚铁铵时,采用(NH4)2SO4饱和溶液为反应物制备的晶体的质量大,产率高(如①和④相比,④的产率高;②和③相比,③的产率高)。与常规加热法相比,水浴加热时制备的硫酸亚铁铵晶体的质量大,产率高(如①和②相比,②的产率高;③和④相比,③的产率高)。此外,不同条件下所制备的硫酸亚铁铵的产品级别均符合要求。
图6为在不同条件下所制备晶体的XRD图。图6(a)和(b)是将(NH4)2SO4固体直接加入到FeSO4溶液中,分别通过常规加热和水浴加热所制备的样品。图6(c)和(d)是将(NH4)2SO4饱和溶液加入到FeSO4溶液中,分别通过水浴加热和常规加热所制备的样品。从图6中可以看出,在2θ为14.84°、16.44°、21.20°、23.46°、29.51°、35.07°、42.30°、43.12°和50.23°处的衍射峰分别对应于(NH4)2SO4·FeSO4·6H2O (JCPDS卡:35-0764)的(001)、(011)、(-201)、(130)、(-112)、(112)、(-242)、(420)和(113)晶面,表明所合成的晶体都是纯相。从图6还中可以看出,(-201)晶面对应的衍射峰强度增加的顺序为(d)<(c)<(b)<(a),表明将(NH4)2SO4固体直接加入到FeSO4溶液中,通过常规加热法制备的硫酸亚铁铵晶体的颗粒最大。通过对制备的样品进行XRD表征,可以使同学们懂得XRD表征是确定晶体结构的一种重要表征手段,根据XRD衍射图谱可以获得所测样品的晶型、平均颗粒尺寸、结晶度、物相的含量等信息,有利于激发学生进行科学探索的兴趣,从而培养学生严谨的科学思维。

图6 不同条件下所制备的硫酸亚铁铵的XRD图Fig.6 XRD patterns of ammonium ferrous sulfate prepared under different conditions
2.2 扫描电镜表征
图7为不同条件下所得产物的FESEM图。从图7(a~b)中可以看出,当将(NH4)2SO4固体直接加入到FeSO4溶液中,通过常规加热法所得产物硫酸亚铁铵的形貌为不规则的微米颗粒,且颗粒团聚在一起。从图7(b~d)中可以看出,当将(NH4)2SO4固体直接加入到FeSO4溶液中,通过水浴加热法所得产物硫酸亚铁铵的形貌大都为棒状,除此之外,还存在一些不规则形貌的纳米粒子。从图7(f~g)中可以看出,当将(NH4)2SO4饱和溶液加入到FeSO4溶液中,通过水浴加热法所得产物硫酸亚铁铵的形貌为六方柱状和一些不规则的形貌。从图7(h~i)中可以看出,当将(NH4)2SO4饱和溶液加入到FeSO4溶液中,通过常规加热法所得产物硫酸亚铁铵为不规则颗粒,且发生的了严重的团聚,这可能是由于硫酸亚铁铵分子间存在氢键造成的。通过对所制备的样品进行扫描电镜表征,可以获得物质表面的微观形貌,以此引导学生从宏观辨识过渡到微观探析,有利于激发学生的科研兴趣,培养学生的科学思维。

图7 不同条件下所制备的硫酸亚铁铵的FESEM图Fig.7 FESEM images of ammonium ferrous sulfate prepared under different conditions
3 结 语
在无机化学实验教学中融入“课程思政”元素,有助于学生对实验内容的深入理解和掌握,有助于学生动手操作能力和设计创新能力的提高,有助于学生的责任担当意识和科技强国使命感的增强,有助于“绿水青山就是金山银山”理念和可持续发展意识的树立,有助于学生不畏挫折、勇攀高峰的科研品质和家国情怀的培养。
