蟾蜍他灵对人结直肠癌细胞HCT116增殖、迁移、侵袭和上皮间质转化的影响
2024-05-29王艳王莎莎朱春阳董晨王瑞邱文生
王艳 王莎莎 朱春阳 董晨 王瑞 邱文生
[摘要] 目的 探討不同浓度蟾蜍他灵(BT)对人结直肠癌细胞HCT116增殖、迁移、侵袭和上皮间质转化的影响。
方法采用CCK-8实验检测不同浓度(0、10、20、40、80、160、320 nmol/L)的BT处理24和48 h后的细胞活力,并计算半抑制浓度(IC50);平板克隆实验验证0、12.5、25.0 nmol/L BT(设为A、B、C组)处理14 d后对HCT116细胞集落形成能力的影响;使用划痕和Transwell实验验证0、25、50 nmol/L BT(设为A、C、D组)处理24 h后对HCT116细胞迁移和侵袭能力的影响;应用Western blot实验检测A、C、D组处理24 h后HCT116细胞中E-cadherin和N-cadherin蛋白表达水平。
结果CCK-8实验结果显示,BT处理HCT116细胞24或48 h后,随着BT的浓度增加,其抑制HCT116细胞增殖的作用显著增强(F=2 106.00、3 725.00,P<0.05),处理24和48 h的IC50分别为49.59、24.10 nmol/L;平板克隆实验结果显示,B、C组细胞的集落数量显著少于A组(F=159.30,t=12.40、17.32,P<0.05);划痕和Transwell实验结果显示,C、D组细胞迁移率和侵袭细胞数量显著低于A组(F=120.30、296.80,t=12.71~21.27,P<0.05);Western blot实验结果显示,BT显著上调HCT116细胞内E-cadherin蛋白表达(F=2 736.00,P<0.05),其中C、D组显著高于A组(t=50.27、72.13,P<0.05);而BT显著下调N-cadherin蛋白表达(F=626.80,P<0.05),其中C、D组显著低于A组(t=26.54、33.57,P<0.05)。
结论BT可明显抑制人结直肠癌细胞HCT116的增殖、迁移、侵袭和上皮间质转化过程,有望成为结直肠癌治疗的潜在候选药物。
[关键词] 结直肠肿瘤;HCT116细胞;蟾酥甾类;细胞增殖;细胞运动;肿瘤浸润;上皮-间质转化
[中图分类号] R735.34
[文献标志码] A
Effect of bufotalin on the proliferation, migration, invasion, and epithelial-mesenchymal transition of human colorectal cancer HCT116 cells
WANG Yan, WANG Shasha, ZHU Chunyang, DONG Chen, WANG Rui, QIU Wensheng
(Faculty of Medicine, Qingdao University, Qingdao 266071, China)
;[ABSTRACT] Objective To investigate the effect of different concentrations of bufotalin (BT) on the proliferation, migration, invasion, and epithelial-mesenchymal transition of human colorectal cancer HCT116 cells.
Methods CCK-8 assay was used to measure cell viability after 24 and 48 h of BT treatment at different concentrations (0, 10, 20, 40, 80, 160, and 320 nmol/L), and the half-maximal inhibitory concentration (IC50) was calculated. The plate colony formation assay was used to verify the effect of BT treatment at the concentrations of 0, 12.5, and 25.0 nmol/L for 14 days on the colony formation ability of HCT116 cells (established as groups A, B, and C). The wound healing assay and the Transwell assay were used to verify the effect of BT treatment at the concentrations of 0, 25, and 50 nmol/L for 24 h on the migration and invasion abilities of HCT116 cells (established as groups A, C, and D). Western blot was used to measure the protein expression levels of E-cadherin and N-cadherin in HCT116 cells after 24 h of treatment in groups A, C and D.
Results CCK-8 assay showed that after HCT116 cells were treated by BT for 24 or 48 h, the inhibitory effect of BT on the proliferation of HCT116 cells increased significantly with the increase in the concentration of BT (F=2 106.00,3 725.00,P<0.05), with an IC50 value of 49.59 nmol/L for 24-hour treatment and 24.10 nmol/L for 48-hour treatment. The plate colony formation assay showed that groups B and C had a significantly lower number of colonies of cells than group A (F=159.30,t=12.40,17.32,P<0.05). The wound healing assay and the Transwell assay showed that compared with group A, groups C and D had significantly lower cell migration rate and number of invading cells (F=120.30,296.80,t=12.71-21.27,P<0.05). Western blot showed that BT significantly upregulated the protein expression level of E-cadherin in HCT116 cells (F=2 736.00,P<0.05), and groups C and D had a significantly higher expression level than group A (t=50.27,72.13,P<0.05); BT significantly downregulated the protein expression level of N-cadherin (F=626.80,P<0.05), and groups C and D had a significantly lower expression level than group A (t=26.54,33.57,P<0.05).
Conclusion BT can significantly inhibit the proliferation, migration, invasion, and epithelial-mesenchymal transition of human colorectal cancer HCT116 cells and is expected to become a potential candidate for the treatment of colorectal cancer.
[KEY WORDS] Colorectal neoplasm; HCT116 cells; Bufanolides; Cell proliferation; Cell movement; Neoplasm invasiveness; Epithelial-mesenchymal transition
结直肠癌在全球发病率居第三位,死亡率仅次于肺癌[1]。近年来,尽管手术和药物治疗有了重大进展,但晚期结直肠癌患者预后仍然很差。据统计,Ⅰ期结直肠癌患者的5年生存率为90%,而Ⅳ期患者的5年生存率下降至10%左右[2]。因此,迫切需要寻找新的治疗药物,使结直肠癌患者获益。
蟾蜍他灵(BT)是一种从中药蟾酥中分离出来的蟾蜍二烯内酯[3]。其已被证明具有强心、镇痛、抗病毒、抗炎、抗肿瘤等多种药理活性[4-6]。近年来,BT因其显著的抗肿瘤活性而受到广泛的关注。研究发现,BT可诱导人恶性黑色素瘤A375细胞发生细胞周期停滞和凋亡,从而抑制其增殖[7];BT还可以通过抑制STAT3/上皮间质转化(EMT)轴来抑制三阴性乳腺癌MDA-MB-231细胞和HCC1937细胞的增殖、迁移和侵袭[8]。另外,在非小细胞肺癌细胞A549异种移植模型中,5、10 mg/kg的BT可显著抑制肿瘤生长[9]。然而,BT是否具有抑制结直肠癌细胞的作用尚不明确。本研究通过使用不同浓度BT处理人结直肠癌HCT116细胞后,检测BT对HCT116细胞增殖、集落形成、迁移和侵袭能力的影响,并探究BT对HCT116细胞EMT的影响,旨在为结直肠癌新药研发提供理论依据。
1 材料与方法
1.1 细胞和试剂
人正常肠上皮细胞系NCM460、人结直肠癌细胞系HCT116由武汉普诺赛生命科技有限公司提供, CCK-8试剂盒及BT购自上海陶术生物科技有限公司, BCA蛋白浓度测定试剂盒、蛋白酶抑制剂购自武汉伊莱瑞特生物科技股份有限公司,E-cadherin和N-cadherin单克隆抗体购于美国Cell Signaling Technology(CST),GAPDH多克隆抗体和羊抗兔二抗购于上海爱必信生物科技有限公司。
1.2 细胞培养
将NCM460和HCT116细胞置于含10%胎牛血清和1%青霉素/链霉素溶液的DMEM培养基中,于37 ℃、潮湿、含体积分数0.05 CO2的细胞培养箱中培养,传2~3代且待细胞处于对数生长期时用于后续实验。
1.3CCK-8实验检测细胞活力
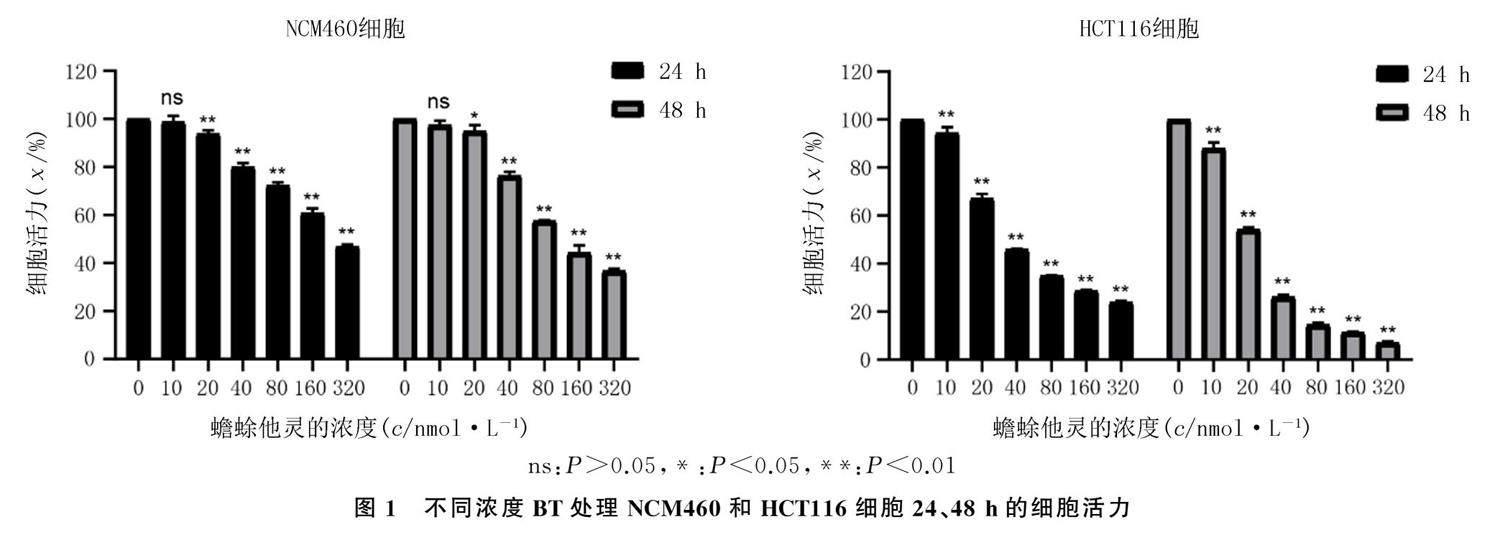
将处于对数生长期的NCM460和HCT116细胞以10 000个/孔接种至96孔板,在细胞培养箱中孵育24 h以后,分别使用浓度为0、10、20、40、80、160、320 nmol/L的BT处理细胞,第24、48小时时分别向各孔细胞中加入10 μL的CCK-8检测试剂孵育1 h,使用酶标仪检测波长450 nm处各孔的吸光度(A)值。
使用Graphpad Prism 8.0软件计算半抑制浓度(IC50)。以BT处理HCT116细胞第24、48 小时的IC50为依据,选择合适的浓度用于后续实验。
1.4 平板克隆实验检测细胞集落形成能力
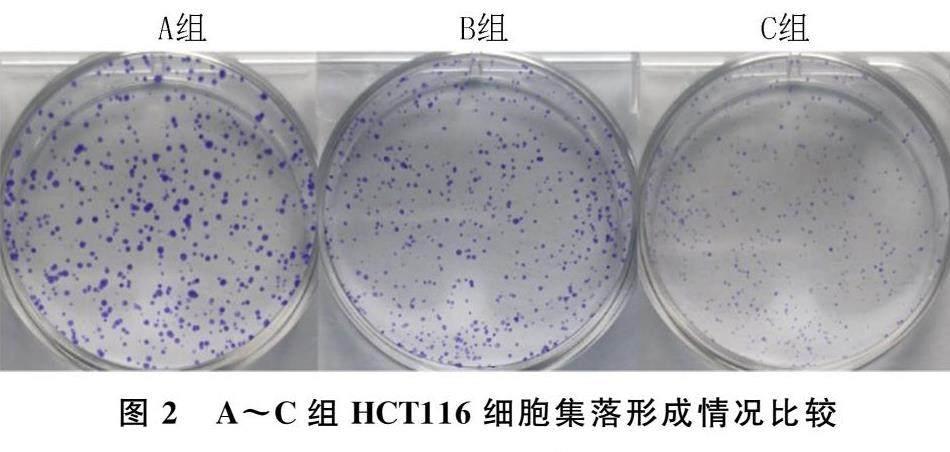
取处于对数生长期的HCT116细胞以800个/孔接种至6孔板,在37 ℃培养箱中孵育24 h后,每孔中分别加入2 mL浓度为0、12.5、25 nmol/L的BT培养液处理细胞(设为A、B、C组),继续在细胞培养箱中培养14 d,每3 d换液一次。当肉眼观察到有细胞集落形成时,取出6孔板,去除原培养液,每孔加入4%多聚甲醛固定30 min,以0.1%结晶紫溶液染色20 min,拍照并使用Image J软件计算各组集落数量。
1.5 划痕实验检测细胞迁移能力
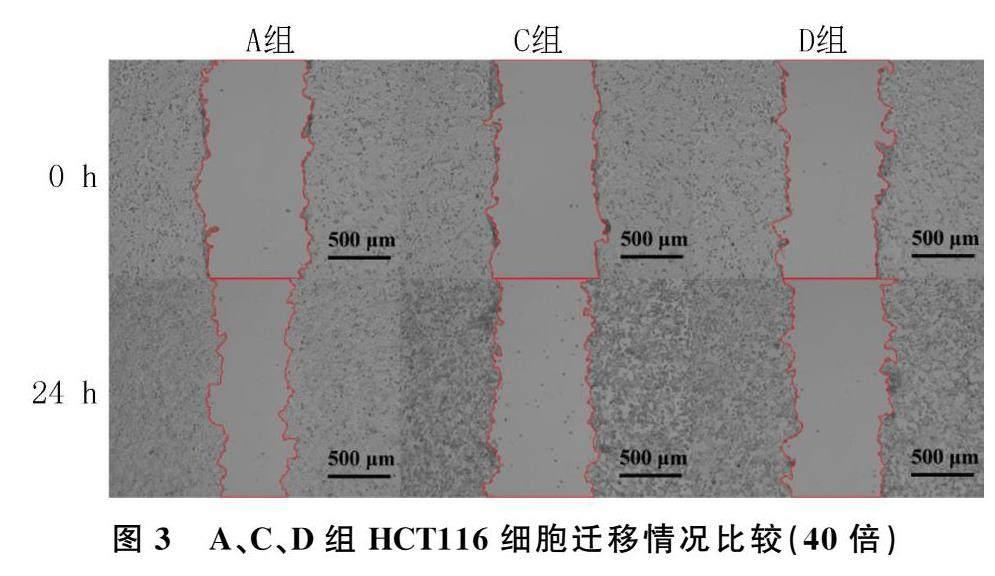
准备6孔板,用马克笔在其背后画横线,横线相隔0.5 cm。取处于对数生长期的HCT116细胞接种在6孔板上,待细胞生长密度达到约90%时,用100 μL无菌移液器吸头垂直于6孔板背后横线在孔板内进行划痕,用PBS冲洗3次,然后在每孔中分别加入2 mL浓度为0、25、50 nmol/L的BT培养液处理细胞(设为A、C、D組),用显微镜在第0、24小时时拍摄划痕愈合情况,并计算细胞迁移率。
1.6 Transwell实验检测细胞侵袭能力
准备含有Matrigel胶的Transwell小室。在24孔板中加入含10%血清的培养基,然后用镊子将小室置于24孔板内,取在6孔板中处理24 h的A、C、D组HCT116细胞分别以50 000个/孔混合200 μL无血清培养基加入小室,最后放入培养箱中培养。待24 h后,去除原培养液,使用4%多聚甲醛固定30 min,以0.1%结晶紫溶液染色20 min。于倒置显微镜下观察,并随机选取3个视野拍照,使用Image J软件进行计数。
1.7 Western blot实验检测细胞中E-cadherin和N-cadherin蛋白表达水平
取接种于培养皿处理24 h的A组、C组、D组HCT116细胞,将含有蛋白酶抑制剂的RIPA裂解液加入细胞内进行充分裂解后,提取细胞总蛋白,使用BCA蛋白检测试剂盒检测蛋白浓度,根据蛋白浓度配置等量等体积的蛋白样本,随后100 ℃煮沸5 min,放入-20 ℃冰箱保存备用。用10% SDS-PAGE凝胶分离蛋白样本,然后转移到PVDF膜上。用5%脱脂奶粉常温封闭2 h,然后加入一抗于4 ℃冰箱孵育过夜。第2天用二抗常温孵育1 h,使用显影仪显影获取蛋白条带。以GAPDH作为内部参照,计算目的蛋白相对表达量。
1.8 统计学分析
采用Graphpad Prism 8.0软件进行统计学分析,采用Image J软件处理图像。所有实验均独立重复3次,计量资料以 ±s表示,多组之间比较采用单因素方差分析,多重比较采用Dunnett方法,两组之间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1BT对HCT116细胞活力的影响
CCK-8实验结果显示,经不同浓度(0、10、20、40、80、160、320 nmol/L)的BT处理24或48 h,随着浓度的升高,BT对NCM460细胞活力的抑制能力逐渐增强(F=478.70、659.90,P<0.05)。经不同浓度(0、10、20、40、80、160、320 nmol/L)的BT处理24或48 h,随着浓度的升高,BT对HCT116细胞活力的抑制能力逐渐增强(F=2 106.00、3 725.00,P<0.05)。详见图1。BT处理NCM460细胞24和48 h后的IC50分别为261.40、141.10 nmol/L,BT处理HCT116细胞24和48 h的IC50分别为49.59、24.10 nmol/L。根据BT处理HCT116细胞24和48 h的IC50值,后续选择浓度0、12.5、25 nmol/L的BT用于平板克隆实验,浓度0、25、50 nmol/L的BT用于其他实验。
2.2BT对HCT116细胞集落形成能力的影响
平板克隆实验结果显示,A~C组HCT116细胞的集落数量分别为(453.00±17.00)、(301.00±8.89)、(240.70±17.56)个,各组间比较差异有显著性(F=159.30,P<0.05),其中B、C组显著少于A组(t=12.40、17.32,P<0.05),C组显著少于B组(t=4.92,P<0.05)。见图2。
2.3BT对HCT116细胞迁移能力的影响
划痕实验结果显示,A、C、D组HCT116细胞的迁移率分别为(28.84±3.00)%、(4.22±2.38)%、(1.63±1.49)%,各组间比较差异有显著意义(F=120.30,P<0.05),其中C、D组显著低于A组(t=12.71、14.05,P<0.05),D组与C组比较无显著差异(P>0.05)。见图3。
2.4BT对HCT116细胞侵袭能力的影响
Transwell实验结果显示,A、C、D组HCT116细胞的侵袭数量分别为(781.00±77.00)、(21.33±1.53)、(8.67±0.58)个,各组间比较差异具有显著性(F=296.80,P<0.05),其中C、D组显著少于A组(t=20.92、21.27,P<0.05),D组与C组比较无显著差异(P>0.05)。见图4。
2.5BT对HCT116细胞EMT的影响
Western blot实验结果显示,A组、C组、D组HCT116细胞中E-cadherin的蛋白相对表达量分别为1.00±0.00、2.02±0.03、2.47±0.04,N-cadhe-
rin的蛋白相对表达量分别为1.00±0.00、0.48±0.02、0.34±0.04。随着BT的浓度增加,E-cadherin蛋白表达显著上调(F=2 736.00,P<0.05),其中C、D组显著高于A组(t=50.27、72.13,P<0.05),D组显著高于C组(t=21.86,P<0.05);而N-cadherin蛋白表达则显著下调(F=626.80,P<0.05),其中C、D组显著性低于A组(t=26.54、33.57,P<0.05),D組显著低于C组(t=7.03,P<0.05)。见图5。
3 讨 论
结直肠癌是一种始于结肠和直肠的癌症。国际癌症研究机构估计,到2040年,全球结直肠癌新发病例数将明显增加,死亡率将明显增高[10]。目前结直肠癌的临床治疗主要包括手术和化疗,然而耐药性的发生和化疗相关的毒副作用是结直肠癌患者化疗失败或停药的主要原因[11-12]。中药因其在缓解症状、降低放化疗引起的不良反应、延长生存期等方面的独特优势,成为肿瘤治疗的一个研究热点[13]。BT是一种从中药蟾酥中提取的类固醇内酯类化合物[14]。蟾酥是中华大蟾蜍或黑眶蟾蜍有毒分泌物中的干燥产物,其在中国用于疾病的治疗已有数百年的历史[15]。其中蟾蜍二烯内酯被认为是蟾酥最主要的活性成分之一,其对多种肿瘤具有显著的抑制作用[16]。
既往研究表明,BT对食管鳞状细胞癌细胞系Eca-109、EC9706、TE5、Hec2、TE11均有明显的抑制作用[17]。成骨细胞瘤细胞U2OS异种移植模型小鼠经0.5~1 mg/kg的BT处理后,小鼠体内肿瘤生长受到了显著抑制[18]。然而,BT在结直肠癌中的抗肿瘤作用知之甚少。无限复制是癌细胞生长所获得的一种表型,癌细胞通过修复端粒来获得无限倍增的能力[19]。因此,本研究首先探究了不同浓度(0、10、20、40、80、160、320 nmol/L)BT对人结直肠癌细胞HCT116增殖活力的影响,结果显示,随着浓度的升高,BT对HCT116细胞增殖的抑制能力逐渐增强,并呈剂量依赖性,24和48 h的IC50分别为49.59、24.10 nmol/L。此外,本研究还设置了人正常肠上皮细胞NCM460作为对照,结果发现BT对于NCM460细胞有一定的抑制作用,24和48 h的IC50分别为261.40、141.10 nmol/L。与HCT116细胞比较,BT处理NCM460细胞24和48 h的IC50更高,这表明NCM460细胞比HCT116细胞更能耐受BT的毒副作用。另有研究表明BT可抑制成骨细胞瘤细胞MG63和非小细胞肺癌细胞A549的集落形成能力[9,18]。因此,本研究也进一步观察了BT对HCT116细胞集落形成能力的影响,本研究以BT处理HCT116细胞24 h后的IC50为依据,设置0、12.5、25.0 nmol/L的浓度梯度处理HCT116细胞,结果显示随着BT浓度增加,HCT116细胞存活的集落数量显著减少。以上这些结果表明,BT对结直肠癌细胞具有明显的细胞毒作用。
近几年研究发现,BT可以抑制三阴性乳腺癌MDA-MB-231细胞、HCC1937细胞的迁移和侵袭能力[8]。转移是肿瘤患者死亡的主要原因。在转移过程中,肿瘤细胞离开原发部位并扩散到全身,形成继发肿瘤并最终致器官衰竭[20]。转移级联反应的第一步是侵袭,肿瘤细胞穿透其周围的基底膜并通过细胞外基质迁移到周围组织[21]。因此,本研究探究了BT是否会影响结直肠癌细胞的迁移和侵袭,以BT处理HCT116细胞24和48 h后的IC50为依据,设置0、25、50 nmol/L的浓度梯度处理HCT116细胞。划痕和Transwell实验的结果显示,随着BT浓度增加,HCT116的细胞迁移率和细胞侵袭数量显著减少,表明其能够抑制结直肠癌细胞的迁移和侵袭。
EMT被认为是癌细胞一种关键的表型改变,其将上皮细胞转化为间充质细胞,因此对肿瘤的发生、侵袭和转移至关重要[22]。一些分子标志物的表达水平可以揭示EMT的程度,如癌组织或癌细胞内E-cadherin表达降低和N-cadherin表达增加可显著性诱导EMT过程[23-24]。有研究证实,BT可以通过增加三阴性乳腺癌细胞中E-cadherin蛋白表达和降低N-cadherin、Vimentin蛋白表达,来抑制EMT过程[8]。在本研究中,BT处理可以显著上调HCT116细胞中E-cadherin蛋白表达,同时下调N-cadherin蛋白表达,这表明BT可以抑制结直肠癌细胞的EMT过程,进而抑制结直肠癌细胞的迁移和侵袭。
综上所述,BT是一种有前途的天然抗癌药物,能明显抑制人结直肠癌细胞的增殖、集落形成、迁移、侵袭和EMT过程,可为结直肠癌抗肿瘤治疗药物的开发提供新的思路。但是本研究仍然存在诸多不足之处,仅局限于细胞水平的实验研究,后续应考虑构建结直肠癌和转移瘤动物模型,进一步深入研究BT在动物体内的抗癌作用及其分子机制。
作者声明: 王艳、邱文生、王莎莎负责研究构思和实验设计;王艳负责细胞培养和实验操作;朱春阳、董晨、王瑞负责实验数据处理。所有作者均参与该论文写作和修改并同意发表,且均声明无利益冲突。
[参考文献]
[1]BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024. DOI:10/gtp98r.
[2] FAN A H, WANG B D, WANG X, et al. Immunotherapy in colorectal cancer: Current achievements and future perspective[J]. Int J Biol Sci, 2021,17(14):3837-3849.
[3] YE M, GUO D A. Analysis of bufadienolides in the Chinese drug ChanSu by high-performance liquid chromatography with atmospheric pressure chemical ionization tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2005,19(13):1881-1892.
[4] 陈文杰,胡耀廷,王如锋,等. 蟾蜍二烯酸内酯类成分的生物转化和生物合成研究進展[J]. 中草药, 2021,52(15):4741-4751.
[5] SU C L, LIN T Y, LIN C N, et al. Involvement of caspases and apoptosis-inducing factor in bufotalin-induced apoptosis of Hep 3B cells[J]. J Agric Food Chem, 2009,57(1):55-61.
[6] EL-SEEDI H R, YOSRI N, EL-AARAG B, et al. Chemistry and the potential antiviral, anticancer, and anti-inflammatory activities of cardiotonic steroids derived from toads[J]. Molecules, 2022,27(19):6586.
[7] PAN Z H, QU C J, CHEN Y, et al. Bufotalin induces cell cycle arrest and cell apoptosis in human malignant melanoma A375 cells[J]. Oncol Rep, 2019,41(4):2409-2417.
[8] PARK S J, JUNG H J. Bufotalin suppresses proliferation and metastasis of triple-negative breast cancer cells by promoting apoptosis and inhibiting the STAT3/EMT axis[J]. Molecules, 2023,28(19):6783.
[9] ZHANG W, JIANG B P, LIU Y X, et al. Bufotalin induces ferroptosis in non-small cell lung cancer cells by facilitating the ubiquitination and degradation of GPX4[J]. Free Radic Biol Med, 2022,180:75-84.
[10] IONESCU V A, GHEORGHE G, BACALBASA N, et al. Colorectal cancer: From risk factors to oncogenesis[J]. Medi-
cina (Kaunas), 2023,59(9):1646.
[11] HUANG X M, YANG Z J, XIE Q, et al. Natural products for treating colorectal cancer: A mechanistic review[J]. Biomed Pharmacother, 2019,117:109142.
[12] WANG Q L, LI Z H, GUO J, et al. Effect of Chinese herbal medicine formula on progression-free survival among patients with metastatic colorectal cancer: Study protocol for a multi-center, double-blinded, randomized, placebo-controlled trial[J]. PLoS One, 2022,17(12):e0275058.
[13] ZHANG X Y, QIU H, LI C S, et al. The positive role of traditional Chinese medicine as an adjunctive therapy for cancer[J]. Biosci Trends, 2021,15(5):283-298.
[14] HUANG Y, YANG G X, FEI J, et al. Bufotalin ameliorates experimental Sjgrens syndrome development by inhibiting Th17 generation[J]. Naunyn Schmiedebergs Arch Pharmacol, 2020,393(10):1977-1985.
[15] LI F J, HU J H, REN X, et al. Toad venom: A comprehensive review of chemical constituents, anticancer activities, and mechanisms[J]. Arch Pharm, 2021,354(7):e2100060.
[16] KOLODZIEJCZYK-CZEPAS J, STOCHMAL A. Bufadieno-
lides of Kalanchoe species: An overview of chemical structure, biological activity and prospects for pharmacological use[J]. Phytochem Rev, 2017,16(6):1155-1171.
[17] LIN S H, LV J H, PENG P L, et al. Bufadienolides induce p53-mediated apoptosis in esophageal squamous cell carcinoma cells in vitro and in vivo[J]. Oncol Lett, 2018,15(2):1566-1572.
[18] ZHU Y R, XU Y, FANG J F, et al. Bufotalin-induced apoptosis in osteoblastoma cells is associated with endoplasmic reticulum stress activation[J]. Biochem Biophys Res Commun, 2014,451(1):112-118.
[19] HANAHAN D, WEINBERG R A. The hallmarks of cancer[J]. Cell, 2000,100(1):57-70.
[20] LAMBERT A W, PATTABIRAMAN D R, WEINBERG R A. Emerging biological principles of metastasis[J]. Cell, 2017,168(4):670-691.
[21] KRAKHMAL N V, ZAVYALOVA M V, DENISOV E V, et al. Cancer invasion: Patterns and mechanisms[J]. Acta Naturae, 2015,7(2):17-28.
[22] PASTUSHENKO I, BLANPAIN C. EMT transition states during tumor progression and metastasis[J]. Trends Cell Biol, 2019,29(3):212-226.
[23] GRAVDAL K, HALVORSEN O J, HAUKAAS S A, et al. A switch from E-cadherin to N-cadherin expression indicates epithelial to mesenchymal transition and is of strong and independent importance for the progress of prostate cancer[J]. Clin Cancer Res, 2007,13(23):7003-7011.
[24] CHEN L, MUOZ-ANTONIA T, CRESS W D. Trim28 contributes to EMT via regulation of E-cadherin and N-cadherin in lung cancer cell lines[J]. PLoS One, 2014,9(7):e101040.
(本文編辑 耿波 厉建强)
