高考化学实验考向分析及备考策略
2024-05-29岳庆先
岳庆先


一、高考化学实验试题的考向分析
在高考化学试题中,实验题的呈现方式可能不尽相同,但考查的核心知识相对稳定。内容上,一般以无机实验或有机实验为载体,主要考查化学方程式的书写、化学实验基本操作的描述和实验方案的设计等;原理上,所涉及内容均源于教材,又略高于教材;要求上,试题重视对实验基本操作和基本能力的考查,将实验方法渗透于试题,加大了对实验设计和实验评价的考查力度;设问上,由易到难,梯度明显,既有教材知识的考查,又有对实验综合内容的考查,同时兼顾化学实验基础知识、基本技能和基本方法。
2024年河南省高考理综将使用新课标卷。预测2024年的全国新课标卷高考化学实验试题,还会延续往年的命题风格,表格型和实验装置评价型命题的概率会较大。表格型试题包括实验目的、实验操作、实验现象和实验结论,体现在选择题上考查;实验装置型试题主要涉及制备原理、制备装置、分离和除杂装置、收集装置以及仪器的使用和实验计算等,体现在综合实验题上考查。
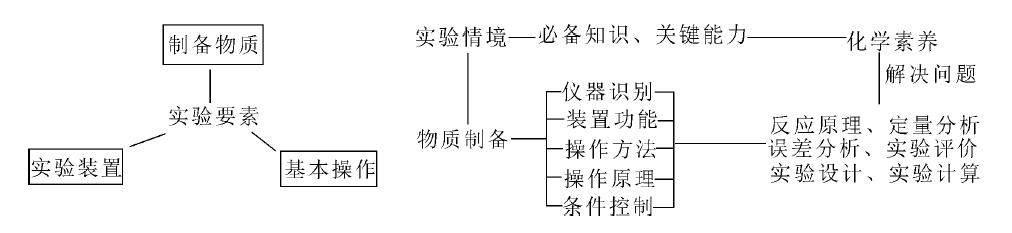
二、实验题的构成要素和解题思维
1.化学实验题的构成要素包括题目中的物质、实验装置和实验基本操作,其考查关系如下。
2.化学实验题的一般解题思路如下。
三、实验题的答题规范
实验题中的简答题相对较多,答题时要注意实验语言的规范化和准确性训练,全面考虑,避免不必要的失分。一是答题时要注意指向明确,避免万能答法,如吸收有毒尾气时要指明具体是哪种气体,不能泛泛答“吸收有毒气体”;解释原因时既要有“前因”,还要有“后果”,如甲装置中因产生气体将其中的溶液通过导管压入乙装置,如果让解释液体从甲装置压入乙装置的原因,不仅要答出“甲装置气体压强增大”,还要首先答出压强增大的原因是“甲中产生气体”。二是答题时要答出本质,如“长期存放的CuSO4 ·5H2O 中,会出现少量白色固体,原因是什么”,如果仅仅答出胆矾风化或胆矾失水,就很难得到满分,必须答出胆矾失去全部结晶水或胆矾失水生成了CuSO4 才能得到满分。三是操作顺序不能随意调整,如分离溶液中的可溶性物质时,操作顺序是“蒸发浓缩、冷却结晶、过滤、洗涤、干燥”,答成“蒸发浓缩、过滤、冷却结晶、洗涤、干燥”就不合适。四是回答问题要全面,回答某反应现象,要兼顾“海”(溶液颜色变化)“陆”(固体变化)“空”(气体生成)三方面的变化。
例题 莫尔盐[(NH4)2Fe(SO4)2·6H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验(如图1)制备少量的莫尔盐并测定其纯度。
回答下列问题:
Ⅰ.制取莫尔盐。
(1)连接装置,检查装置气密性。将0.1 mol (NH4)2SO4 晶体置于玻璃仪器_____中(填仪器名称),将6.0 g洁净铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0 mL 2 mol·L-1 稀硫酸后关闭K1。A 装置中反应的离子方程式为_____。
②待大部分铁屑溶解后,打开K3,关闭K2,此时在A、B 中可以看到的现象为_____,原因是_____。
③关闭活塞K2、K3,采用100 ℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、_____、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH 在1~2 之间,其目的为_____。
④装置C 的作用为_____,装置C 存在缺点是_____。
Ⅱ.测定莫尔盐样品的纯度。
(3)称取所得莫尔盐样品10.0 g,用煮沸后冷却的蒸馏水配成100 mL溶液,取20.00 mL溶液加入稀硫酸,用0.1 mol·L-1 的KMnO4溶液滴定, 达到滴定终点时消耗10.00 mL KMnO4 溶液。滴定反应的离子方程式为_____,该样品的纯度为_____。
解析:本题以莫尔盐的制取为载体,考查化学仪器的使用、实验现象的观察、物质的分离与净化、实验计算及化学反应原理等综合实验知识。本实验的制取过程是,按图示连接好实验装置,检查装置气密性完好后,将0.1 mol(NH4)2SO4 晶体置于三颈烧瓶中,将6.0 g洁净铁屑加入锥形瓶中,然后关闭活塞K3、打开K2、K1,硫酸流入锥形瓶后关闭K1,硫酸与铁屑发生反应Fe+2H+ =Fe2+ +H2↑,产生的氢气将系统内的空气排出,待大部分铁屑溶解后,打开K3,关闭K2,由于装置A 中产生氢气,使装置A 中压强增大,装置A 中的液体被压入装置B 中,关闭活塞K2、K3,采用100 ℃水浴蒸发装置B 中水分,(NH4)2SO4 和FeSO4 在加热条件下生成莫尔盐,液面产生晶膜时,停止加热,冷却结晶、过滤、用无水乙醇洗涤晶体,得到产品。生成莫尔盐的反应中,为抑制Fe2+ 水解,硫酸需过量,保持溶液的pH 在1~2之间。为防止产品被氧化,本实验在装置末采用了水封法,但缺点是没有对氢气做进一步的处理。用KMnO4 溶液滴定莫尔盐的离子方程式为5Fe2+ + MnO- 4 +8H+ =5Fe3+ + Mn2+ +4H2O,10.00 mL 0.1 mol·L-1 KMnO4 溶液可氧化Fe2+ 的物质的量为0.1×10.00×5×10-3 mol=5×10-3 mol,则100 mL 溶液中含Fe2+ 为100/20 ×5×10-3 mol=2.5×10-2mol,含莫尔盐的质量为392×2.5×10-2g=9.8 g, 样品的纯度为9.8 g/10 g ×100%=98%。
答案: (1)三頸烧瓶(三口烧瓶)
(2)①Fe+2H+ =H2↑+Fe2+
②装置A 中的液体被压入装置B 中装置A 中产生氢气,使装置A 中压强增大③过滤 抑制Fe2+ 水解
④液封作用,防止空气进入三颈烧瓶氧化Fe2+ 不能除去尾气中的H2(或可能会倒吸)
(3)5Fe2+ + MnO- 4 +8H+ =5Fe3+ +Mn2+ +4H2O 98%
模拟演练
1.碘酸钾(KIO3)是重要的食品添加剂。某化学兴趣小组设计下列步骤制取KIO3,并进行产品的纯度测定。
制取碘酸(HIO3)的实验装置如图2所示。
有关资料如表1所示。
回答下列问题:
步骤Ⅰ:用Cl2 氧化I2 制取HIO3。
(1)装置A 中发生反应的化学方程式为_____。
(2)装置B 中的CCl4 可以加快反应速率,原因是_____。
(3)反应结束后,获取HIO3 溶液的操作中,所需玻璃仪器有烧杯、_____和_____。
步骤Ⅱ:用KOH 中和HIO3 制取KIO3。
(4)该中和反应的离子方程式为_____。中和之前,应将上述HIO3 溶液煮沸至接近无色,否则中和时易生成_____(填化学式)而降低KIO3 的产量。
(5)往中和后的溶液中加入适量_____,经搅拌、静置、过滤等操作,得到白色固体。
(6)为验证产物,取少量上述固体溶于水,滴加适量SO2 饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的SO2 饱和溶液过量,则无蓝色出现,原因是_____。
步骤Ⅲ:纯度测定。
(7)取0.100 0 g产品于碘量瓶中,加入稀盐酸和足量KI溶液,用0.100 0 mol·L-1Na2S2O3溶液滴定,接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失(I2+2S2O23- =2I-+S4O26-)。进行平行实验后,平均消耗Na2S2O3 溶液的体积为24.00 mL。则产品中KIO3 的质量分数为_____。[M (KIO3)=214.0 g·mol-1]
2.阿司匹林(乙酰水楊酸)是世界上应用最广泛的解热、镇痛药。乙酰水杨酸在128 ℃~135 ℃受热易分解。水杨酸与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下。
制备流程如下。
有关数据如表2所示。
(1)图3所示制备装置中,仪器b的名称是_____。合成阿司匹林时,最合适的加热方法是_____。
(2)本实验中副产物的结构简式为_____(只写一种)。
(3)装置中仪器a起到冷凝回流的作用,目的是。
(4)将粗产品转至250 mL 圆底烧瓶中,安装好回流装置,向烧瓶内加入100 mL 乙酸乙酯和2粒沸石,加热回流、溶解。趁热过滤,冷却至室温,抽滤,用少许乙酸乙酯洗涤,干燥后得乙酰水杨酸1.8 g。
①烧瓶内加入乙酸乙酯的作用是_____,加热回流时间不宜过长,原因是_____。
②“趁热过滤”的原因是_____。
③乙酰水杨酸的产率为_____。
3.硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂、媒染剂。常温下该物质在空气中会水解,受热时易分解。以废铜屑(表面沾有油污)为原料制备[Cu(NH3)4]SO4·H2O的实验步骤如下。
Ⅰ.CuSO4 的制备。
(1)步骤①中采取“碱煮水洗”,目的是_____。
(2)步骤②在常温下进行,需要加入的试剂是_____。
Ⅱ.晶体的制备。
将上述制备的CuSO4 溶液加入如图4所示的装置A中,滴加6 mol·L-1氨水时,有浅蓝色沉淀Cu2(OH)2SO4 生成;继续滴加氨水,沉淀消失,得到深蓝色[Cu(NH3)4]SO4 溶液。将装置A 中溶液转移至B 中,析出[Cu(NH3)4]SO4·H2O 晶体;将B中混合物转移至装置C 中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
(3)用离子方程式表示装置A 中“沉淀消失”的原因:_____。
(4)抽滤时,抽气泵处于工作状态,活塞需(填“打开”或“关闭”),作用是_____。
(5)晶体采用冷风吹干而不用加热烘干的原因是_____。
Ⅲ.废液回收。
减压过滤后的废液中含有[Cu(NH3)4]SO4、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得CuSO4 和(NH4)2SO4 的混合溶液。
(6)向废液中加入硫酸的作用是_____。(答出两条)
(7)(NH4)2SO4 溶液受热易分解,则回收乙醇的实验方法为_____。
4.某学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1)铜与浓硝酸反应的装置如图5所示,仪器 A的名称为_____,装置B的作用为_____。
(2)铜与过量H2O2 反应的探究如图6所示。
实验② 中,Cu 溶解的离子方程式为_____;产生的气体为_____。比较实验①和②,从氧化还原角度说明H+ 的作用:_____。
(3)用足量NaOH 处理实验②新制的溶液得到沉淀X,元素分析表明X 为铜的氧化物,提纯干燥后的X在惰性氛围下加热,m gX完全分解为n g黑色氧化物Y,n/m =5/6。X的化学式为_____。
(4)取含X 粗品0.050 0 g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.100 0 mol·L-1Na2S2O3 标准溶液滴定,滴定终点时消耗 Na2S2O3 标准溶液15.00 mL(已知:2Cu2+ +4I- =2CuI↓ +I2,I2 +2S2O23- =2I- +S4O26-)。标志滴定终点的现象是_____。粗品中X的相对含量为_____。
参考答案:1.(1)KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(2)I2 和Cl2 易溶于CCl4,增大了反应物浓度
(3)分液漏斗 玻璃棒
(4)HIO3+OH- =IO- 3 +H2O KIO4
(5)乙醇(或“酒精”“C2H5OH”)
