海南中北部地区牛体表蜱种鉴定及蜱携带无形体属病原体情况调查研究
2024-05-27邓宛心彭箬岩王高玉贾毅博尹飞飞
邓宛心,李 鲲,黄 艺,彭箬岩,王高玉,贾毅博,牛 毅,尹飞飞
(1.海南医学院基础医学与生命科学院,海南 海口 571199;2.海南医学院-香港大学热带传染病联合实验室,海南 海口571199;3.中国疾病预防控制中心传染病预防控制所,北京 102206)
蜱虫是一种专性吸血的体外节肢动物,能够从各种宿主身上吸取血液,包括哺乳动物、鸟类和爬行动物,从而传播各种疾病,被认为是仅次于蚊子的重要传播媒介[1]。在我国目前已发现的蜱共有10个属,119 种,包括软蜱13 种,硬蜱100 余种[2]。蜱可传播多种病原,包括病毒、立克次体、原虫等[3,4]。其中微小扇头蜱(Rhipicephalus microplus)在全球范围普遍存在,特别是在热带与亚热带地区更为常见[5]。此类蜱虫被认为是最主要的牛体外寄生虫之一,对乳制品和肉类产业造成巨大的经济影响[6]。无形体(Anaplasma)属于立克次体目(Rickettsiales)无形体科(Anaplasmataceae)无形体属(Anaplasma),是经由蜱媒传播的一种革兰氏阴性、专性细胞内寄生的细菌。无形体主要感染动物,但偶尔也会感染人类,因此在兽医学和人类公共卫生领域均具有重要的研究意义。目前常见的无形体有7 种,分别是嗜吞噬细胞无形体(Anaplasma phagocytophilum)、牛无形体(Anaplasma bovis)、绵羊无形体(Anaplasma ovis)、扁平无形体(Anaplasma platys)、边缘无形体(Anaplasma marginale)及中央无形体(Anaplasma centrale)和新发现的山羊无形体(Anaplasma capra)。具有人畜共患的特征,而其他类型的无形体则表现出明显的宿主特异性,它们主要侵染动物血细胞,引发无形体病。其主要临床表征包括发热、贫血、黄疸、流产、体弱和消瘦等,且在急性期可能导致动物死亡[7]。
候选博莱无形体(Candidatus Anaplasma boleense)是一种新发现的暂定无形体种,最早于2014年中国新疆的亚洲璃眼蜱(Hyalommma asiaticum)中发现[8],目前已有研究证明在我国牛和山羊体表的微小扇头蜱中发现该无形体[9-11]。边缘无形体是牛无形体病的病原体,在热带和亚热带地区广泛存在,它能够引起牛的流产、减产、溶血性贫血和死亡[12]。研究表明,牛体表蜱虫中普遍存在无形体病原,对牛体表蜱虫中的无形体病原感染情况进行深入研究是至关重要的,然而,关于海南地区牛体表蜱虫中无形体病原的研究还相对不足。因此,本研究旨在调查海南牛体表蜱虫中的无形体属病原体感染情况,以期为无形体的防治提供理论支持,减少其对畜牧业及公共卫生所造成的经济损失和健康风险。
海南作为我国唯一全域位于热带的岛屿省份,全年高温多雨植被茂盛,为蜱类的生长提供了理想环境。迄今为止,海南省已报告发现6 属20 种硬蜱,并且被认为是斑点热群立克次体的流行源地[13]。然而,关于海南地区牛体表蜱虫携带的病原体研究仍然较少。鉴于人们对牛肉及其制品的广泛消费,牛的养殖规模不断扩大,导致人接触牛体表蜱虫携带的病原体风险增高,因此,研究海南地区牛体表蜱种及其携带的无形体病原体显得尤为重要。本研究在海南中北部地区9 个县市采集牛体表蜱虫,首先对其进行形态学与分子生物学鉴定,随后采用PCR 方法对蜱携带的无形体属病原体进行检测,并对获得的阳性样本进行病原体核酸片段测序和序列的系统进化分析,旨在为该地区无形体病的防控提供科学的理论基础。
1 材料与方法
1.1 样本来源
2020~2022 年,在海南屯昌、临高、海口、儋州、琼中、定安、万宁、琼海、澄迈9 个县市的牛体表进行蜱虫样本采集,共采集335 只蜱虫。样本采集过程主要采用宿主体表检查法,着重检查牛体易被蜱虫叮咬的部位,如颈部、腋下、腹部、脚踝下方等部位,发现蜱虫后,用镊子夹住蜱虫的头部取下后,放置于2 mL 冻存管,记录蜱虫采集时间和地点等信息,并存于-80 ℃冰箱中。
1.2 主要试剂
Go Taq®colorless MasterMix 购 自 美 国Promega 公 司;E.Z.N.A.Mollusc DNA Kit 试 剂 盒 购 自美国Omega 公司;GoodViewTM核酸染料购自北京赛百盛公司;琼脂糖购自上海Baygene Biotechnnlogy 公 司;6×PCR Loading Buffer、D2000 DNA Marker 购自北京天根生化科技有限公司。
1.3 蜱的形态学鉴定
借助体视显微镜,根据蜱虫的形态学差异,参照《医学蜱螨学》鉴定蜱虫种类并拍摄相应照片。
1.4 DNA 提取
根据形态学的鉴定结果,将蜱虫样本单只放入1.5 mL 离心管中,加入500 μL PBS 进行漂洗,每只蜱虫漂洗3 次,以确保将蜱虫的体表清洗干净,加入300 μL PBS 进行破碎,5 000 r/min 离心5 min 后,取上清后使用Omega E.Z.N.A.Mollusc DNA Kit 试剂盒提取样本的DNA,并以其作为模板进行PCR检测。
1.5 PCR 检测
蜱种鉴定参照参考文献[14]ITS2基因的引物序列,委托北京擎科生物科技股份有限公司海南分公司进行引物合成。PCR 反应体系(25.0 μL):Go Taq®colorless Master Mix 12.5 μL,上、下 游 引 物(10 μmol/L)各1 μL,模板DNA 2 μL,用ddH2O 补足体系体积。PCR 反应程序: 94 ℃ 预变性 5 min;94 ℃ 变性 30 s,58 ℃ 退火 1 min,72 ℃ 延伸 1 min,35 个循环;最后72 ℃延伸10 min。PCR 产物经 1%琼脂糖凝胶电泳检测,阳性样本取10 μL PCR 产物送至北京擎科生物科技股份有限公司海南分公司进行Sanger 测序。
为检测蜱虫样本中无形体属病原携带情况,首先用nest-PCR 扩增16S rRNA基因的部分保守区,以检测蜱样品中的无形体,检测无形体属病原所用引物参照参考文献[10,15]。为进步鉴定无形体的种,将nest-PCR 检测到的阳性样本用16S rRNA基因(1 278 bp)、gltA基因(745 bp)和groEL基因(1 080 bp)保守区引物进行扩增。经琼脂糖凝胶上电泳分析,阳性结果克隆到pMD19-T 克隆载体(Ta-KaRa)中,进行克隆和Sanger 测序。本研究使用的引物信息见表1。

表1 相关引物信息Tab 1 The information of relevant primers
1.6 系统发育分析
从NCBI 基因库中下载蜱虫和无形体属病原的参考株序列,与本实验中获得的样本序列一起构建系统进化树。使用MEGA Ⅹ软件的Clustal W 进行比对,使用最大似然法(maximum likelihood, ML),LG Model,1 000 次重复构建系统进化树,以分析海南牛体表蜱虫携带无形体病原的系统发育关系。
2 结果
2.1 样本分布及蜱种鉴定
2020~2022 年,在海南9 个县市的牛体表采集蜱虫335 只,其中临高40 只、澄迈35 只、海口20 只、定 安25 只、屯 昌70 只、琼 中65 只、万 宁45 只、琼 海20 只、儋州15 只。经过形态学鉴定,所采集蜱种为血红扇头蜱(Rhipicephalus sanguineus)和微小扇头蜱,蜱虫外部形态如图1 所示。基于蜱虫ITS2 基因设计引物,进行PCR 扩增,血红扇头蜱和微小扇头蜱获得扩增条带大小均为1 414 bp,与预期符合。PCR 产物测序后在NCBI 数据库中进行BLAST 比对,与形态学鉴定结果相符。本研究在澄迈、海口、琼中、万宁、琼海、儋州采集的蜱虫均为微小扇头蜱,临高、定安、屯昌采集的蜱虫包括血红扇头蜱和微小扇头蜱2 种。335 只蜱虫中血红扇头蜱为44只,占13.13%,微小扇头蜱为291 只,占86.87%。

图1 蜱种形态学鉴定Fig 1 Morphological of tick sample
基于ITS2 基因用MEGA-X 软件选择本实验中获得的代表性蜱种基因序列构建系统发育树见图2。分析结果表明,本实验的蜱种鉴定序列处于两个大分支上面,其中样本QZLH-T101 与DAHLT177、CM-T170 与QZLD-T197、GLY-T51 与TCT6、DZ-T73 与TCXFX-T131 的亲缘关系较近,与已知的来自中国河南的微小扇头蜱(JF758640.1)处于同一分支上面;LG-T27 与LG-T42、LG-T134 与DAHL-T182 亲缘关系较近,与已知来自中国浙江的血红扇头蜱(JQ625707.1)处于同一分支上。

图2 海南蜱类之间的系统发育关系Fig 2 Phylogenetic relationships between ticks found in Hainan
2.2 无形体属病原的检测结果
针对本项目采集的335 只蜱虫,利用无形体属病原16S rRNA、groEL和gltA基因的特异性引物进行PCR 检测,阳性样本进行Sanger 测序,并对获得的基因序列在NCBI 数据库中进行blast 比对分析。结果表明,在定安采集的11 只微小扇头蜱中有2 只蜱虫携带候选博莱无形体,阳性率为18.18%;在儋州采集的15 只微小扇头蜱中有3 只携带边缘无形体,阳性率为20.00%;在临高、澄迈、海口、屯昌、琼中、万宁、琼海中的蜱虫中均未检测到无形体属病原。335 只蜱虫中检测到候选博莱无形体、边缘无形体两种无形体属病原,阳性率分别为0.60%(2/335),0.90%(3/335)。 各 县 市 阳 性 率 情 况见表2。
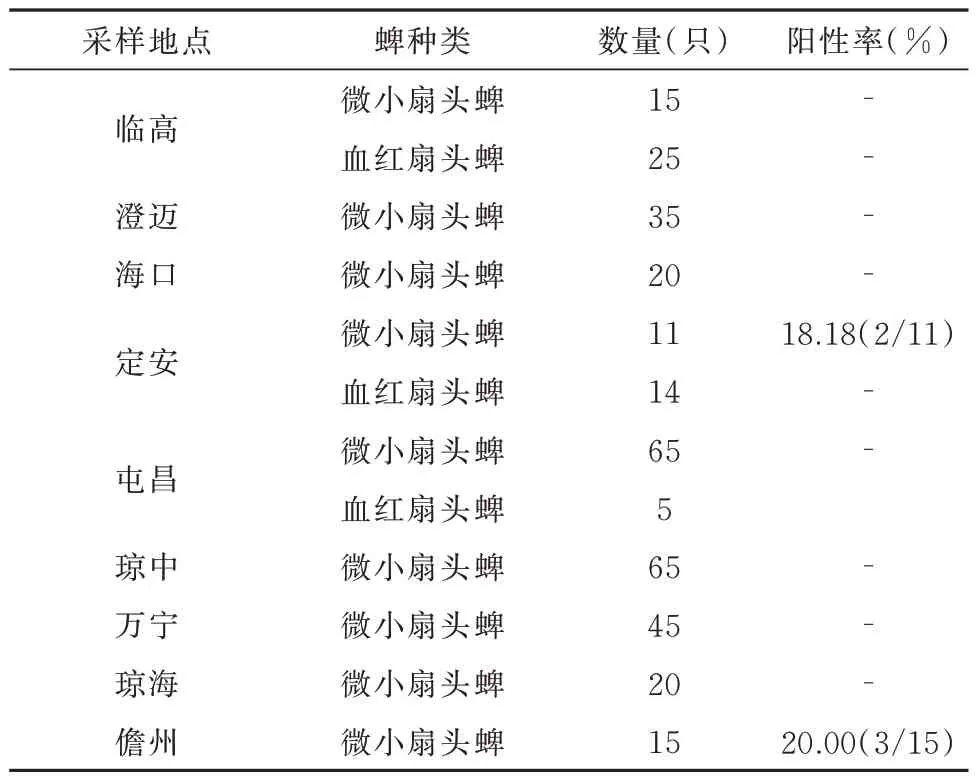
表2 各县市蜱虫携带无形体属病原检测结果Tab 2 Detection results of Anaplasma pathogens carried by ticks in various counties and cities
2.3 系统发育分析
通过NCBI 下载基于16S rRNA、groEL和gltA3 个基因的参考株序列,与从蜱虫筛查到的阳性样本序列一起放在MEGA X 中制作进化树。基于16S rRNA基因序列的系统发育树分析与比对分析结果表明,在定安微小扇头蜱中检测到的2 条候选博莱无形体的核苷酸相似度达到99.8%,与在中国武汉微小扇头蜱中发现的两条序列C.Anaplasma boleensestrain WHBMXZ-139(KX987335.1)和C.Anaplasma boleensestrain WHBMXZ - 151(KX987333.1)在同一支上,而与在中国武汉牛体表微小扇头蜱C.Anaplasma boleenseisolate 126(OP748985.1)序列亲缘关系较远;在儋州微小扇头蜱中检测到的3 条边缘无形体的核酸相似度在99.99%~100%之间,与在乌干达地区牛中发现的A.marginalestrain Uganda MT27(KU686794.1)在同一支上,与在中国浙江三带喙库蚊中发现的A.marginale(KU586072.1)序列亲缘关系较远(图3)。

图3 基于无形体16S rRNA 基因核苷酸序列的系统发育树Fig 3 Phylogenetic tree based on the nucleotide sequences of 16S rRNA genes of Anaplasma strains
基于gltA基因序列的系统发育树分析结果表明,在定安微小扇头蜱中检测到的2 条候选博莱无形体的核苷酸相似度达到97.6%,与在中国武汉白腹丛蚊(Armigeres subalbatus)中发现的C.Anaplasma boleenseisolate WHARSP-38(KU586324.1)在同一支上,并且核酸相似度99.58%,与在中国江西白腹丛蚊中发现的C.Anaplasma boleenseisolate JXARSA-5(KU586314.1)序列亲缘关系较远(图4)。基于groEL基因序列的系统发育树分析结果表明,在儋州微小扇头蜱中检测到的3 条边缘无形体的核酸相似度在100%,与在中国武汉微小扇头蜱中发现的A.marginale strainWHBMXZ-130(KX987398.1)在同一支,并且核酸相似度100%,与在中国武汉微小扇头蜱中的A.marginalestrain WHBMXZ-90-2(KX987395.1)序列亲缘关系较远;在定安微小扇头蜱中检测到的1 条候选博莱无形体的核苷酸序列,与中国武汉微小扇头蜱中发现的两条序列C.Anaplasma boleensestrain WHBMXZ-139(KX987392.1)和C.Anaplasma boleensestrain WHBMXZ-151(KX987390.1)在同一支上(图5)。
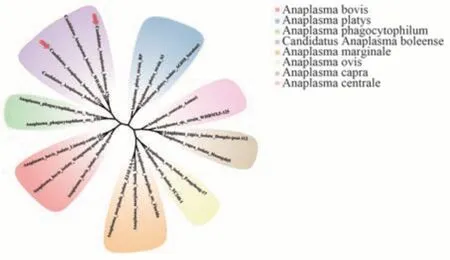
图4 基于无形体gltA 基因核苷酸序列的系统发育树Fig 4 Phylogenetic tree based on the nucleotide sequences of gltA genes of Anaplasma strains
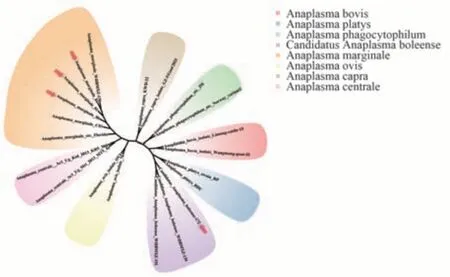
图5 基于无形体groEL 基因核苷酸序列的系统发育树Fig 5 Phylogenetic tree based on the nucleotide sequences of groEL genes of Anaplasma strains
3 讨论
3.1 牛体表蜱种
蜱虫是牛体表的常见寄生虫。多项研究表明,牛蜱属、扇头蜱属、血蜱属、璃眼蜱属等多种蜱类可在牛体表寄生[16],并且,不同地理环境下的优势蜱种存在显著差异。对泰国东北部牛体表蜱种的研究发现,微小扇头蜱是优势种[17]。同样,在中国的广东、广西、云南、陕西汉中市、福建龙岩地区的研究中,也发现微小扇头蜱是牛体表的主要寄生蜱种[18-22],而在青海、新疆、东北三省份的牛体表并未发现微小扇头蜱[23-26]。呼伦贝尔地区牛体表优势蜱种为草原革蜱[27],而新疆牛优势蜱种为璃眼蜱属、扇头蜱属和血蜱属[28]。在海南澄迈地区,牛体表采集的蜱为微小扇头蜱[29]。本研究采用形态学结合分子生物学的方法,准确鉴定出海南中北部地区牛体表寄生蜱为血红扇头蜱和微小扇头蜱,并且发现微小扇头蜱是该地区的优势种,与国内广东、广西、云南、陕西汉中市、福建龙岩地区的研究发现一致。本研究基于ITS2 基因构建的系统进化树分析表明,本研究所获得的蜱虫序列处于两个大分支上,与已知的序列高度相似,揭示了它们之间较为紧密的亲缘关系。前期研究报道,微小扇头蜱携带包括牛巴贝斯虫(Babesia bovis)、边缘无形体、反刍埃立克体(E.ruminantium)和普氏立克次体(Rickettsia parkeri)等多种病原体,显示其在人畜共患病病原传播中的关键作用[30-32]。该种蜱虫在华中和西南地区广泛分布,在中国多达665 个县区有记录,尤其适应南部气候温暖潮湿、季节性温度变化小的环境[33]。海南岛炎热的气候条件为微小扇头蜱提供了良好的生存环境,因此,对海南微小扇头蜱进行深入研究具有重要的实际意义。
本研究中采集的样本仅限于海南岛中北部的9个县市,这可能在一定程度上影响了研究结果的普遍性和代表性。为全面掌握海南省内牛体表蜱虫的种类分布,未来研究应当扩展采样范围,增加样本量。同时,对不同牛种体表蜱虫种类的差异性分析也是获得更全面数据的关键,对于有效防控蜱虫传播的疾病具有重大意义。
3.2 牛体表蜱虫携带无形体属病原体
国内外关于蜱虫携带无形体属病原的报道有很多。Hosseini-Chegeni 等[34]从伊朗3 个地区采集130只蜱虫,包括亚洲璃眼蜱、单峰驼璃眼蜱(Hyalomma dromedarii)、血红扇头蜱和牛蜱(Rhipicephalus/Boophilus),并在牛蜱和血红扇头蜱中分别获得一条边缘无形体序列和2 条绵羊无形体序列。对泰国东北部的12 个省采集的牛体表蜱虫的研究表明,微小扇头蜱是优势蜱种,此外还有血红扇头蜱和Haemaphysalis bispinosa等蜱种,在微小扇头蜱中发现边缘无形体、扁平无形体、和未鉴定的无形体,阳性率分别为19.08%、1.97%和0.66%[17]。Xu 等[6]在湖南岳阳牛体表采集465 只蜱虫均为微小扇头蜱,经过PCR 检测发现边缘无形体、候选博莱无形体、立克次体暂定种(C.Rickettsia xinyangensis)、扁平无形体和牛无形体,阳性率分别为0.6%,1.9%,1.5%,1.3%,1.17%。本实验通过对海南9 个县市牛体表采集的蜱虫进行无形体属病原16S rRNA和gltA和groEL基因的PCR 检测,结果发现候选博莱无形体和边缘无形体阳性率分别为0.60%(2/335),0.90%(3/335),并未检测到嗜吞噬细胞无形体,与现有研究相一致。研究报道,边缘无形体能够引起牛无形体病,导致牛的溶血性贫血、流产、减产和死亡等[12,35]。本次研究中携带边缘无形体的微小扇头蜱均采自牛体表,目前尚不确定这些牛的感染和致病情况。因此,未来工作中我们需要加强对牛携带的病原体及其致病情况进行更加深入的研究。
微小扇头蜱虽然通常被视为牛的主要寄生蜱种,然而,研究显示其同样能够寄生于多种家畜和野生动物,包括羊、狗、猪、鹅、兔子、猫、马、鹿等[9,30,36-40]。值得注意的是,一些研究报告还提到,在特定情况下,微小扇头蜱可能会叮咬人类[41]。特别是在牧区,由于牧民与家畜间存在频繁的接触,人类被微小扇头蜱叮咬的风险相应增加。这意味着微小扇头蜱作为病原体的潜在传播者,其影响范围不仅局限于家畜,还可能扩展至人类。鉴于此,为有效降低蜱虫叮咬及蜱传疾病的风险,牧民应采取更为严格的卫生管理措施,包括加强牛圈的卫生条件,定期对牛群进行驱虫处理,以及实施有效的防蜱灭蜱等策略。通过这些措施,可以在一定程度上减少微小扇头蜱与牲畜及人类的接触机会,从而降低病原体传播的可能性。最后,加强对蜱种及其携带病原体的监测和控制,对于保障公共卫生安全和动物健康具有重要意义。
在海南中北部县市的牛体表采集蜱虫,通过形态学与分子生物学鉴定发现,微小扇头蜱为优势种,其次为血红扇头蜱。此外,采用PCR 方法对蜱虫进行无形体属病原体的检测,结果显示牛体表蜱虫携带候选博莱无形体和边缘无形体,阳性率分别为0.60%(2/335),0.90%(3/335)。
作者贡献度说明:
邓宛心:实验操作并撰写论文;李鲲:负责论文审阅与修改;黄艺、彭箬岩、王高玉、贾毅博、牛毅:负责样本收集、分装及数据整理;尹飞飞:全程参与、指导实验操作并修改论文。
所有作者声明不存在利益冲突关系。
