基于证据推理促进化学概念深度学习
2024-05-26杨文月
杨文月

化学概念的深度学习是基于学生已有知识经验,通过基于证据的推理分析等学习活动,进行概念的提取、归纳和初步构建,在此基础上理解与运用,并批判性地接收和学习新知识,建立新旧知识问的联系,进行深度高阶思维的学习。该文围绕素养为本,以人教版《选择性必修1化学反应原理》“反应热”教学为例,聚焦以证据推理为抓手,以高质量对话为依托,寻求促进学生关于化学概念的深度学习的教学策略。
一、教学内容分析
人教版《化学选择性必修1》中,本章包括2节内容:第一节“反应热”,介绍了反应热的概念、叶,和反应反应热的测定、焓變、热化学方程式和燃烧热等;第二节“反应热的计算”,介绍了盖斯定律和反应热的计算。
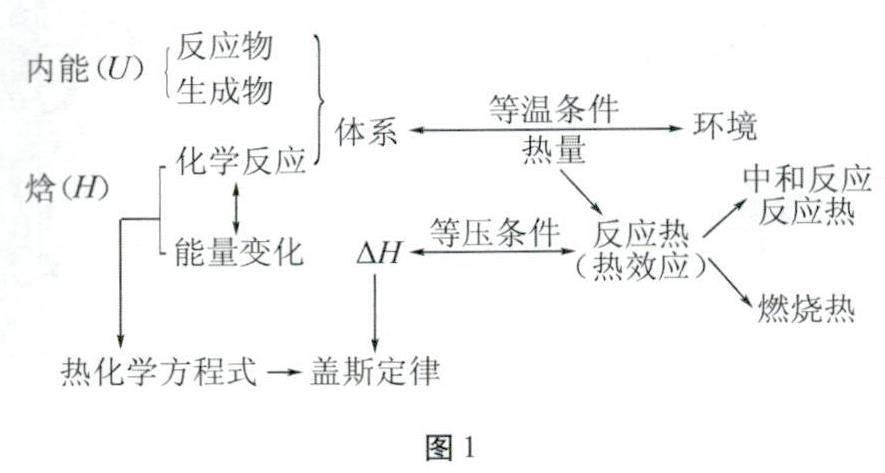
“反应热”是化学学科核心概念,教材中存在许多概念与其构成直接或者间接的联系(如图1所示)。
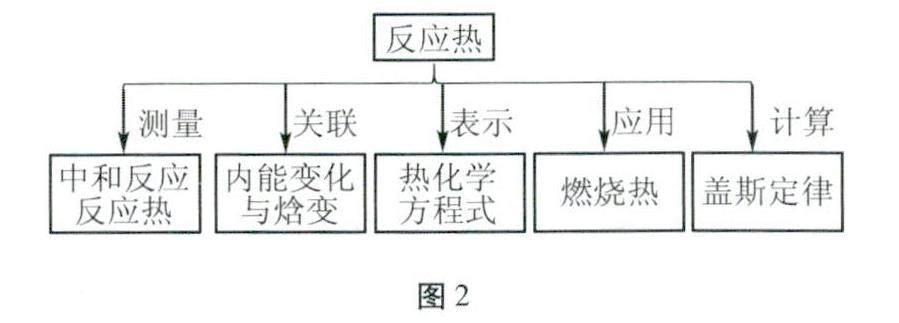
人教版教材中呈现图1所示概念时思路清晰明了。体系与环境的引入首先帮助学生认识研究“反应热”的前提条件;接着通过测定中和反应反应热,研究反应热的含义;最后从能量角度,引出内能、焓,再通过限定恒温恒压的条件引出焓变,符合学生的认知发展规律。反应热又是整个概念系统的核心,该章内容具体编排如图2所示,内容之间的逻辑顺序极为清晰。
二、教学目标
1.能通过认识体系与环境的概念,掌握反应热的概念。
2.分析中和反应反应热的测定原理,并根据实验结果计算反应热,培养综合能力与计算能力。
3.从体系内能的视角出发,了解焓变与反应热的概念关系,培养对问题多角度分析的能力,
4.了解燃烧热及热化学方程式的书写规则,熟练掌握以符号表征为核心的表达方式。
5.能够分析发现反应的能量关系,体会盖斯定律的意义,在化学学习中渗透化学学科的价值
三、单元教学流程
依据“反应热”的相关概念的逻辑关系,以人教版新教材为基础并结合学情,笔者设计的促进学生深度学习的单元教学流程如图3所示。
四、核心概念教学过程
以下教学过程为3个课时,本文只展示课时1的部分师生对话。
课时1:
1.能量变化、体系与环境、反应热
[教师](展示一盒自热火锅)自热锅发热原理是什么?从能量角度,生产商需要考虑什么问题?从能量安全角度,使用者要考虑什么问题?
[学生]自热锅原理是生石灰与水反应放热?厂商需要考虑加热包中生石灰的量、米饭的量、加热的时间等。不能随便丢弃加热包,有着火的可能,且碱性强,污染环境。
[教师]人们利用化学反应提供的能量,在实际生产生活中往往需要定量。刚才同学们说的保护环境是我们熟悉的“环境”。在定量研究化学反应能量变化时,需要明确的2个概念——“体系与环境”中也有“环境”。如何理解这2个概念呢?(演示实验:盐酸和氢氧化钠溶液在试管中混合发生反应,用手摸试管壁。)我们以盐酸和氢氧化钠溶液反应为例,研究体系是什么?环境是什么?
[学生]体系包括盐酸、氢氧化钠溶液中的微粒,还有中和反应本身以及反应产生的微粒。环境包括体系之外所有的东西。
[教师]老师的手也算是环境的一部分,我刚刚用手触摸试管壁,感受到外壁温度升高,有同学可以解释一下产生这种感觉的原因吗?
[学生]因为该反应放热,使体系温度升高。老师的手作为环境,温度较低,能量(热量)由体系传递给环境。
[教师]假如我的手是温度计,体系放出的热全部被我感知到,那我能知道这部分能量是多少吗?你能根据物理学知识解释说明吗?
[学生]根据Q=c×m×△T,△T取最高温度与反应前的温度差。
[教师]等温条件下(即反应后体系温度恢复至反应前),化学反应体系向环境释放或者吸收的热量,称之为化学反应的热效应,简称反应热。给“反应热”下定义时,为什么规定始末态温度相同?
[学生]只有规定体系的始末态温度相同,才能保证反应热全部传给环境,便于测量。
设计意图:从学生较为熟悉的生活情境引入,作为探索定量研究化学反应能量变化的起点,激发学生学习兴趣,在体系与环境的概念教学中,将课本的图片变成了眼前的实验。由学生熟悉的概念出发,进行新概念的构建。在引入反应热概念时,教师对实验条件进行假定,学生通过推理分析,真正理解“等温”在反应热定义中的意义,也为接下来测量反应热的原理做铺垫。
2.中和反应反应热、内能与焓、焓变
[教师](展示实验仪器及用品)现在请同学们根据提供的实验用品,设计实验方案测定中和反应的反应热。
请讨论实验原理,细化实验细节,制定实验步骤。
[学生]讨论,汇报:(1)根据物理公式Q=c×m×△T。(2)用水的比热容近似处理c。(3)用量取体积的方法求得溶液质量m。(4)用同1只温度计分别测量反应前后溶液的温度变化,求算温度差△T。
[教师]请同学们思考如下几个问题:实验过程使用的量热计有什么特点?实验操作注意什么?温度传感器记录的数据图(图略),该读取哪个点的数据?依据是什么?盐酸与氢氧化钠溶液中和反应前后温度发生变化,所计算的热量还能称为“反应热”吗?
[学生]讨论,汇报:(l)隔热层和杯盖主要作用是尽可能防止热量散失。(2)要注意反应时快速混合溶液,并用玻璃搅拌器搅拌。(3)记录最高点的温度,体系放出的热量使温度升高,温度最高点代表体系中酸和碱完全中和时所放出的热量:
[数据处理]学生根据相关数据,计算该中和反应的反应热。
[教师]在这组实验中,你计算得到的中和反应放出的热量Q的大小与什么有关?如果有一个数据能够代表中和反应:
H+(aq)+OH -( aq)=H2O(1)
生成lmol水,我们对于中和反应反应热的定量研究可能会更为方便,清你进行换算。
设计意图:打破传统教学的验证性实验模式,让学生分析实验原理这个过程比学生按照课本步骤做实验,这种探究要有趣得多。并且可以加深学生对反应热概念的理解,促进学生概念内化,在讨论论证过程中充分将思维外显,形成完整的思维体系。实验过程中使用温度传感器能将数据外显,学生更直观地观察到温度的变化曲线,通过分析,确定最高点的意义。数据处理的最后,教师的问题推进,加深了学生对化学反应计量关系与能量变化的理解,为学生之后学习热化学方程式和歸纳Q与AH的关系做铺垫。
[教师]化学反应为什么会产生反应热?能量从何而来?内能(U)是体系内物质各种能量的总和,根据水有三态,结合微观角度讨论物质的内能包含哪些具体能量?哪些因素会引起内能的变化?
[学生]反应前后体系内能发生变化,就会产生反应热。内能受温度、压强、物质的聚集状态影响,包括分子动能和势能之和。
[教师]焓(H)是与内能相关的物理量。在等压等温条件下的化学反应,反应热可视为焓变(△H)单位为kj/mol。焓和内能都是状态函数,状态函数的变化规定为末状态减去初状态。请根据课本图1-4,归纳△H的“正负”与吸热或放热反应的关系。
[学生]△H>0,吸热反应;△H<0,放热反应。
[教师]还可以从体系的角度来认识,体系放热,焓减少。体系吸热,焓增大。
[教师]展示课本图1-5能量变化示意图及相关数据。
[学生]化学反应中能最变化的本质,是化学键断裂和形成时的能量变化。
设计意图:内能是物理学科的重要概念,是学生的已有概念,在此基础上引出焓这个新的概念。强调“恒温恒压”条件下反应热可视为焓变,说明“反应热”与“焓变”并非同一概念,有助r避免学生产生“反应热即焓变”的迷思概念。结合图示,并通过状态函数的变化规定以及从体系出发,说明清楚△H>0或△H<0的规定,让学生进一步理解体系与环境的关系。
课时2:
3.热化学方程式,燃烧热
[教师]25℃时,101 kPa,1 mol H+和OH-反应产生1mol液态H2O时,放出57. 3kJ的热量。请用化学符号用语表示该反应的物质变化和能量变化情况。为什么热化学方程式要标明状态、温度、压强等?请根据你之前测定中和反应反应热的实验数据,归纳Q和△H的关系。
设计意图:通过中和反应热化学方程式的表达,引导学生认识化学用语是对自然规律的理解、尊重和表达。学生亲身经历的实验及数据更有真实感,明白热化学方程式中要标明的内容不是强制的规定,而是由于“焓”与内能一样都与物质的种类、数量、聚集状态、温度、压强有关,△H自然也会随影响因素的改变而改变。
[教师]燃烧热是一种反应热。几种常见燃料的燃烧热见表1。
[讨论]根据燃烧热的定义,以甲烷为例说明表述其燃烧热需要注意哪些问题?写出甲烷燃烧的热化学方程式,在此基础上进一步归纳书写热化学方程式的注意事项,
[讨论]根据表1燃烧热的数据,计算相同质量的碳、氢气、甲烷在25℃、101 kPa时完全燃烧放出的热量。请你根据计算结果说明氢气作为能源的优点。请你判断相同质量的甲烷、乙烷、丙烷完全燃烧,热值最大的是哪种?
设计意图:热化学方程式只是化学特有的符号语言,它背后的反应热才是人类真正关注的焦点。通过数据计算比较,学生切实体会到能源的发展在社会生活中的重要性。学生在数据计算的过程中,通过已知数据,再由计算结果运用质量守恒进行推断,能够培养学生迁移运用的思维能力。
课时3:
4.盖斯定律
[教师]如果物质都能够完全燃烧,人类就可以有效使用地球上有限资源。然而,燃烧不充分是常见的。C不完全燃烧会产生CO,测量这个反应的反应热是有难度的,很难做到在反应中控制条件全部生产CO而不生产CO2。盖斯定律是基于科学家大量实验数据归纳总结出的客观规律,你能以我们熟悉的碳的燃烧为例(如图4所示),从理论[二证明盖斯定律吗?
设计意图:引导学生继续深入理解“焓”作为状态函数的特点。当状态确定,H确定,△H只与反应的始末状态有关,跟反应途径无关。图4相比于人教版课本第15页的图,更利于学生从本质上理解盖斯定律。
[教师]某同学通过实验测量了放热反应
Fe(s)+CuSO4(aq)=Cu(s)+FeSO4(aq)的焓变△H。在用同样方法测量反应
Fe(s)+Fe2(SO4)3(aq) =3 FeSO4( aq)
焓变的时候,发现把铁粉加入Fe2( SO4)3溶液中,有气体产生,用量热计无法测定其反应热,为什么?如何获得反应
Fe(s)+Fe2(SO4)3(aq) =3 FeSO4( aq)的焓变呢?请设计实验方案。
设计意图:盖斯定律的最大价值在于可以利用实验测定的少量反应热数据,推算大量实验难以测定的其他焓变数据,从而知道其他反应的反应热。此任务以实验为依托,制造冲突,有气体产生,说明副反应的存在。学生深切感受有无法测定的反应热,要设计一个实验往铜粉中加入Fe2( SO4)3溶液,测反应
Cu(s)+Fe2( SO4)3(aq)=CuSO4( aq) +2FeSO4的反应热。需要学生学会综合利用已有知识,熟练掌握迁移概念的本领,灵活运用盖斯定律解决实际问题。
五、化学概念深度学习的教学反思(略)
(收稿日期:2023 -10 - 17)
