基于真实情境“工业脱硫法”的二氧化硫教学设计
2024-05-26孙丽
孙丽
新课标指出,学生能否应对和解决陌生的、复杂的和开放性的真实问题情境,是检验其核心素养水平的重要方面。以往的教学中对于二氧化硫的教学设计的情境通常从“食品”“酸雨”“功与过”的角度,本文则是以实际工业生产中常用的脱硫法为情境载体,从工业脱硫法的应用中探寻二氧化硫的性质,进而从物质类别以及元素价态的角度对二氧化硫进行学习和分析。
一、教学内容分析
该节课的内容选自苏教版必修1专题4“硫与环境保护”,该专题的教学内容将围绕硫及其化合物的性质、应用及相互转化介绍了硫元素及其化合物的知识。本单元主要介绍二氧化硫、亚硫酸、浓硫酸的有关知识,让学生认识硫及其化合物的转化,了解学习元素化合物的一般方法,帮助学生建构元素及其化合物的知识网络。基于物质的类别、核心元素价态以及物质的特性视角去预测二氧化硫的性质,提供给学生认识元素化合物的一般方法和认识视角。该部分教学内容承接“氯、钠”元素化合物知识的从物质类别视角学习物质,又从核心元素价态新的视角认识其氧化性和还原性,从而为后面“氮、铁”等变价元素物质的学习做铺垫,因此该内容在整个教学过程中起到承上启下的作用。
二、教学目标
1.通过二氧化硫物质的辨别,能够预测二氧化硫的性质,形成基于物质类别预测物质性质的视角。
2.通过二氧化硫还原性和氧化性的实验探究,能够设计实验并且验证其性质,形成基于元素价态预测和验证物质性质的视角。
3.通过二氧化硫漂白作用的实验,能够认识到二氧化硫的特性,形成基于物质特性认识典型物质性质的视角。
4.能概括和运用典型物质性质的一般认识框架,分析和预测物质可能具有的化学性质。
三、教学思路
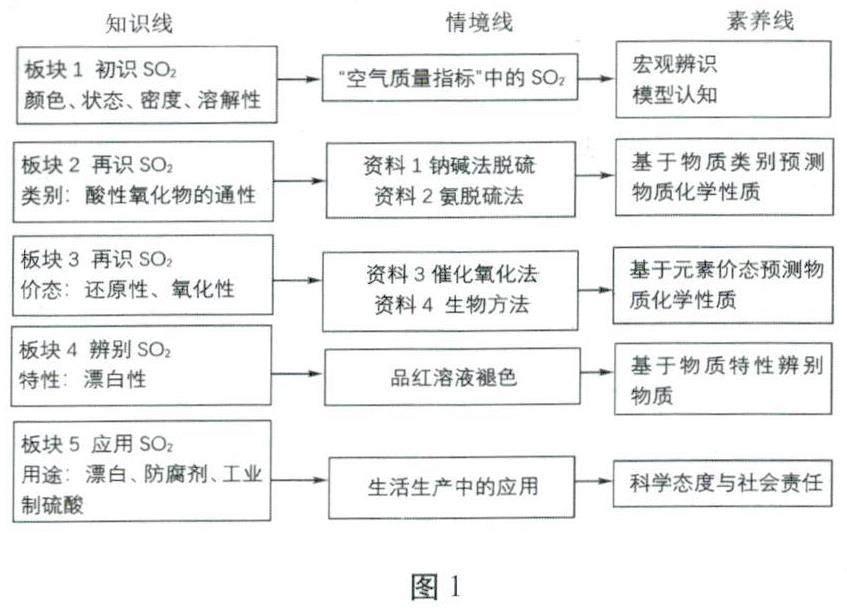
该教学设计以“知识线”、“情境线”、“素养线”贯穿整节课,具体如图1所示。
四、教学过程
板块一:初识二氧化硫
[展示图片]二氧化硫是空气质量检测报告中必不可少的一项指标,那么二氧化硫是什么?请同学们跟随老师的脚步一起走进对于二氧化硫的认识。
[實验展示](1)装在矿泉水瓶中的SO2气体。(2)扇闻。(3)加水溶解,并迅速盖上瓶盖,观察。与另一瓶气体对比。(4)根据相对分子质量确定收集方法。
[PPT展示]展示:初识SO2
颜色、状态、气味、密度、溶解性、毒性
[过渡]二氧化硫是有毒气体,空气中含量过多会引起呼吸道疾病、形成酸雨腐蚀建筑等危害。从生态环境部发布的二氧化硫1981 - 2018年的平均浓度变化以及今年九月全国空气质量报告中可以看到二氧化硫的浓度在持续减少。
板块二:基于物质类别的视角再识二氧化硫
[讲解]想要减少二氧化硫的排放,除了减少化石燃料的使用外,对于生产中产生的二氧化硫废气进行处理或回收利用也是十分重要的一个环节。我们看一下现在主要的几种工业脱硫法。
[PPT]工业上烟气脱硫的方法
钠碱液吸收法、氨脱硫法、催化氧化法、碱性氧化铝法。
[资料卡片1]钠碱液吸收法:主要利用氢氧化钠溶液吸收二氧化硫可以转变为亚硫酸钠。应用:得到的亚硫酸钠用于造纸工业。
[任务1]根据资料卡1书写化学方程式,判断二氧化硫的物质类别并且预测二氧化硫的性质。
[书写]书写化学方程式:
SO2 +2NaOH =Na2SO3+H2O
[总结]二氧化硫属于酸性氧化物。预测二氧化硫的性质为:
(1)与碱反应生成亚硫酸盐和水。
(2)与水反应生成亚硫酸。
(3)与碱性氧化物反应。
[过渡]但是烧碱溶液的价格成本较高。展示原料价格,因此工业生产往往采用价格较低廉的碱性物质。思考应用选用哪些物质?
[生]工业生产考虑成本,首先考虑应用生石灰或碱石灰。
[PPT展示]传统工业应用最为广泛的是石灰石一石膏法,但是现在处于“碳达峰”和“碳中和”的大背景下,时代赋予我们新的使命,从低碳的角度考虑,石灰石-石膏法产生CO2较多,因此现在工业转用氨脱硫法,请同学们阅读资料卡片2。
[资料卡片2]氨脱硫法:将二氧化硫通到足量浓氨水中得到亚硫酸铵,然后通入氧气即可制得硫酸铵可用于农业化肥。
[任务2]①根据资料卡2书写化学方程式;②并且分析硫元素的价态变化;③基于元素化合价态预测二氧化硫的性质。
[书写]书写化学方程式
SO2 +2NH3·H2O=(NH4) 2SO3+H2O
2( NH4) 2SO3+ O2 =2( NH4 )2SO4
[讲解]硫的化合价:+4、+6。化合价升高,作为还原剂,具有还原性(+4价的硫有二氧化硫、亚硫酸以及亚硫酸盐);从价态角度分析S处于中间价态,可以降低,应该具也有氧化性。
板块三:基于元素价态的视角再识二氧化硫
[实验探究]利用桌面上的实验试剂和仪器,设计实验方案,去验证二氧化硫的性质。
(硫化氢的水溶液、二氧化硫水溶液、高锰酸钾水溶液)
[生]设计实验方案:
1.根据高锰酸钾溶液具有强氧化性,将其与二氧化硫水溶液混合,可以发现高锰酸钾溶液褪色。从而表现出二氧化硫具有还原性。
2.将硫化氢溶液与二氧化硫水溶液混合,发现产生了黄色的单质,猜测可能产生硫单质(黄色的固体),因此二氧化硫具有氧化性。
[展示视频]二氧化硫和硫化氢气体燃烧产生硫单质的反应。
[展示PPT]1.SO2的还原性2.SO2的氧化性
[问]工业上也可以利用二氧化硫的氧化性和还原性脱硫,根据资料卡片3和4分别判断是应用二氧化硫的什么性质?
[资料卡片3]催化氧化法:在五氧化二钒的催化剂作用下,二氧化硫可以与空气中的氧气作用生成三氧化硫。这种处理方法条件高,且为可逆反应,效率低。但工业上利用这一原理来生产硫酸。
[PPT]展示反应原理:
[资料卡片4]碱式氧化铝法:将强碱与氧化铝制成球形,可以吸收废气中的二氧化硫,其程度可高达90%,如果这种装置吸收达到饱和,可在150 - 350℃的范围内回收。其产生的二氧化硫可在650℃时和一氧化碳反应,得到固体硫。回收的二氧化硫可以生产高纯度的硫
[问]根据资料卡片3和4,写出脱硫的反应原理并且分析利用了二氧化硫的什么性质?
[讲解]二氧化硫的去除方法还有很多,对于工业生产的选择要考虑多方面的因素,比如说成本、原料以及工艺设备要求等。
板块四:基于物质特性的视角辨别二氧化硫——漂白性
[过渡]以上我们基于物质类别视角和元素价态视角,探究并认识了二氧化硫的性质。那么二氧化硫还有没有其他性质呢?接下来我们一起观看这样一个视频。
[视频]观看二氧化硫与品红溶液的反应。观察现象,思考你能得到什么结论?
[讲解]二氧化硫通人品红溶液中品红褪色,加热后恢复颜色、二氧化硫可以漂白,并且这个过程是可以恢复的。
[PP展示]二氧化硫的漂白性原理:二氧化硫与有色物质化合生成无色物质,无色物质不稳定,加热后又恢复成原来的颜色。
[PPT展示]漂白性的工业应用。漂白纸张、草帽等。对比漂白原理:(1)吸附型漂白;(2)氧化型漂白;(3)化合型漂白。
[提升任务]二氧化硫过多排放到空气中会形成硫酸型酸雨,根据你所学到的知识,写出二氧化硫形成硫酸型酸雨的2种途径。
四、教学反思(略)
(收稿日期:2023-11-02)
