基于“证据推理与模型认知”的化学课堂教学实践探索
2024-05-26李明鲁静
李明 鲁静

电解池作为新课程“化学反应原理”的重点知识,其相关概念和原理较为抽象,需要学生结合宏观、微观等多个层次进行理解,具有较强的系统性和抽象性。因此,需要通过建构相关概念关系的模型以形成可视化的认知路径去促进学生的理解、提高学生分析并解决问题的能力。该设计以电解FeCl2溶液为载体,以电解池的模型重构为主旨,依据学情设计环环相扣的探究活动,并辅以数字化实验直观化的展示,以期学生在解决问题的过程中建构学科知识、掌握科学方法、提升关键能力,为课堂上实现学生核心素养的发展做了初步探索。
一、课标与教材分析
1.课标要求
新课程标准对于“电解池”部分的内容要求为:“了解电解池的工作原理,认识电解在实现物质转化和储存能量中的具体应用。”而教学提示部分则细化并突出了电化学部分的教学要求,如创设真实情境,组织学生开展分析解释、推论预测、设计评价等学习活动,加深学生对电解池工作原理的认识,转变偏差认识,建立系统分析思路,提高学生对本质的认识。
2.教材分析
该节内容是复习人教版选择性必修Ⅰ《化学反应原理》第四章第二节“电解池”。
从知识的角度看,该节部分将关注重点置于学生已有电解池模型的修正,提高其对电解池本质的科学认识,加强电解池模型与真实情境的有效联系。上承原电池与电解池,有助于加深理解电化学本质,下启金属的腐蚀与防护,即包含电解池的应用,是分析理解电化学现象的基础。
从方法的角度看,该部分的学习方法以实验探究为主,承接了对于“原电池”和“电解池”的探究,且再探“电解原理”所涉及的多元化思维与方法也对后续金属腐蚀与防护的学习具有一定的指导作用。
二、教学与评价目标
1.教学目标
(1)通过创设电解FeCl2溶液这一工业废水处理的问题情境,分析电解过程中基本要素的变化特点,发现自身已有认知模型存在问题,并自主修正为氧化还原反应核心视角下的电解分析新模型,提高问题意识和敢于质疑的精神。
(2)通过对电解FeCl2溶液问题的解决与追问,积极探究实验事实对理论进行证实或证伪,进一步明确电解过程中离子浓度的差异会影响离子的放电顺序。
(3)通过对电解模型的修正和重构,能认识到科学的认知是不断发展、进步的;通过离子放电能力影响因素的分析,认识到化学反应的复杂性,并能有意识地避免出现绝对化、简单化的规律总结,明白实践是检验真理的唯一标准。
2.评价目标
(1)通过对一定条件下电解FeCl2溶液的交流与点评,诊断并发展学生对于电解本质即氧化还原反应视角分析电解过程的认识水平。
(2)通过对电解FeCl2溶液阴、阳极情况的讨论与点评,诊断并发展学生对于放电顺序的认识水平,以及实验探究与问题解决的能力水平。
(3)通过对已修正模型的迁移应用,诊断发展学生对重构的电解模型的认识进阶和认识思路的结构化水平,以及对化学价值的认识水平。
三、教学过程
1.教学思路
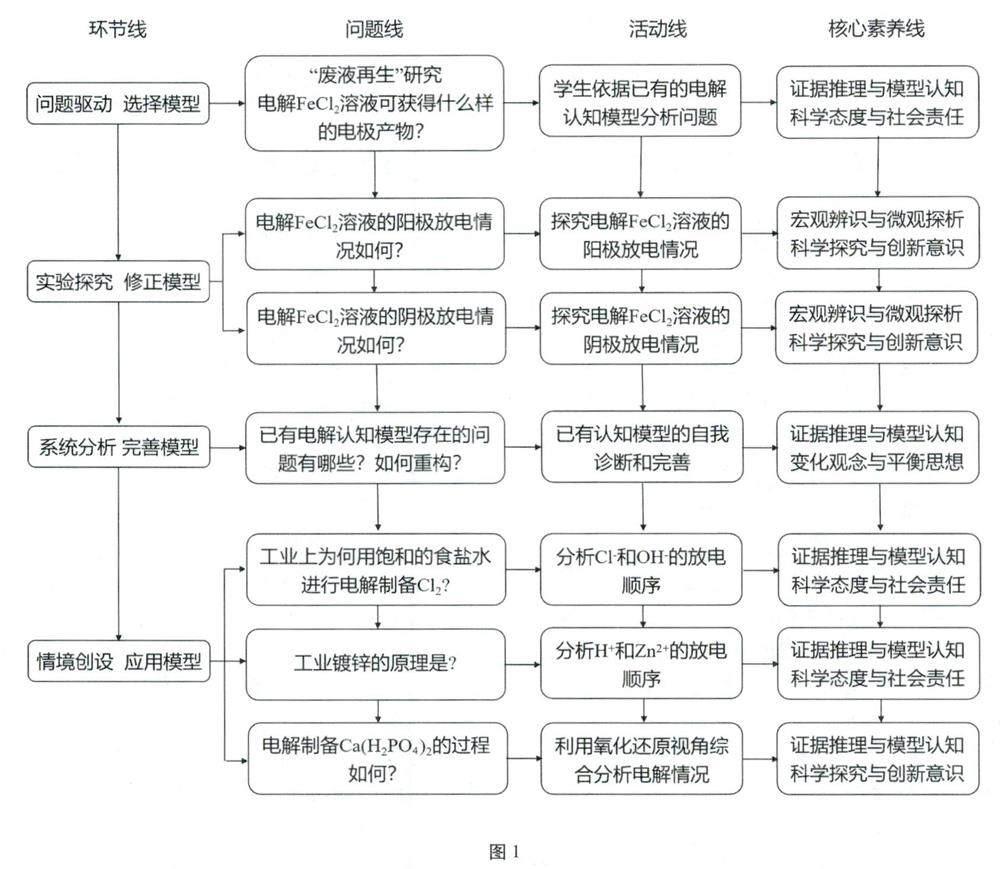
教学思路如图1所示。
2.具体教学过程
环节一:问题驱动选择模型
[微课]通过播放微课视频回顾电解池內容,包括电解池的反应原理、放电顺序及反应类型等。
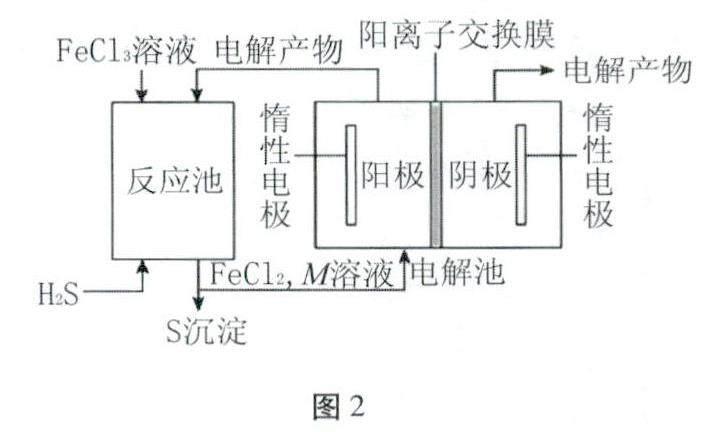
[情境创设]用FeCl3酸性溶液脱除H2S后的废液,通过控制条件电解得以再生(如图2所示)。
[问题1]一定条件下用石墨电极电解FeCl2溶液,可得到什么电极产物?
[设计意图]该环节以微课展开,促进学生对于已有认知模型的调用,并尝试以此解决后续问题,培养学生的证据推理与模型认知素养;通过高考题创设废液再生情境,并引导学生积极思考如何解决问题,培养学生的科学态度与社会责任。
环节二:实验探究修正模型
[过渡]同学们上述的猜想都能明确说出自己的道理,那么到底事实是如何的呢?
[问题2]基于同学们的猜想,阳极可能有哪些产物?如何验证?
[演示实验]用U型管盛装一定量pH =3. 50的0.1 mol·L-1 FeCl2溶液,通过2V电压的直流电源进行电解。一段时间无明显现象,在阳极附近滴入KSCN溶液(考虑到Fe2+易被氧化,故选择在阴极处也滴加等量KSCN溶液,避免因Fe2+自身氧化而带来的颜色变化),观察溶液颜色变化情况。
[追问1]观察到什么现象?说明什么?
[追问2]Fe3+一定是通过放电生成的吗?
[数字化实验]那如何验证呢?我们来认识一个新的实验仪器——氯离子浓度传感器。其可以测定一段时间内氯离子浓度的差异,通过实验发现,氯离子浓度无明显变化。
[总结]结合前期现象及传感器数据,最终确定阳极的产物为Fe3+。
[设问]电解产物的结果唯一吗?下面请看实验(增加原演示实验的电压)。
[解释说明]播放后续视频,随着电压的增强,阳极开始有气泡产生,且通过湿润的淀粉碘化钾试纸检验为氯气。即在电压的影响下,氯气是可以生成的,这可能是因为电压的增强一方面提高了放电离子的迁移速率,另一方面也提高了氯离子的失电子能力。
[追问3]如何解释对应产物的生成?
[评价]对于正确思路给予肯定评价,巩固学生这一认识;对于可能有学生提及“异性相吸原理”,及时以阳极现象作为引导,转变学生的错误观念。
[总结]通过以上实验探究,充分体现电极上离子的放电顺序不是绝对的或唯一的,应从氧化还原反应视角,即微粒的得失电子能力去分析电解放电过程。
[问题3]通过对阳极的分析,阴极应该有哪些产物,先得到什么?如何验证?
[学生]可能是Fe2+被还原成Fe,可以选择将其置于稀盐酸中,观察是否有气泡产生;也可能是水电离出的H+被还原成H2。
[演示实验]回到刚刚的电解实验,用U型管盛装一定量pH=3.50的0.1mol·L-1 FeCl2溶液,通过2V电压的直流电源进行电解。
[追问1]观察到什么现象?说明什么?
[学生]观察到先产生微弱的金属光泽,且将阴极石墨置于稀盐酸中,有大量气泡产生。
[解释说明]根据分析,应该有体系中的H+先放电。但我们知道,当溶液中只有H+和一些金属离子时,体系中浓度较大位于氢前面不远的金属(如Zn、Fe等)离子能够先放电。如在这一体系下,Fe2+浓度为10-1mol·L-1,而H+仅为10-3.5mol·L-1,离子浓度具有较大差异,故Fe2+优先放电。换句话说,离子浓度也会影响离子在电极的放电顺序。
[辅助实验]同时,配合pH=1.00时的实验现象,可以看到这一体系一通电即有大量气泡产生,充分论证这一结论,即电解过程中的放电顺序受离子浓度的影响。
[归纳总结]总结电解FeCl2溶液所解决的核心问题及其结论。
[设计意图]这一环节为该节课的核心环节,通过阴、阳极分析层层递进地探究,由实验现象引发认知冲突,再由实验现象分析验证,在结合数字化实验逐步推理的过程中,培养学生的证据推理与模型认知、科学探究与创新意识等素养。
环节三:系统分析完善模型
[情境回归]回归电解FeCl2溶液的废液再生情境,呈现相应的结果。再次强调离子浓度对于放电顺序的影响。
[问题4]通过本节课的学习,相信很多同学都对于电解池有r不一样的认识,那么现在大家能否重构电解模型呢?
[学生讨论与交流]画出自己目前所认知的电解模型。
[评价]通过画出电解模型(如图3所示)的方式,外显学生修正后的认知模型并进行适当评价。
[设计意图]诊断学生该节课的思维发展情况,通过画图外显学生的认知模型,并及时评价,真正意义上完善模型,充分完成模型的重构,关注课堂生成的意义,发展学生的核心素养。
环节四:情境创设应用模型
[过渡]接着,我们来应用这一模型解决一些日常生产生活中的问题。
[情境1]氯碱工业——电解饱和食盐水
[问题5]工业上为什么选用饱和食盐水电解制备Cl2?稀溶液是否可以?
[学生]考虑到离子浓度对于放电顺序的影响,不可以。
[追问]如何影响?
[解释说明]主要关注阳极失电子的两大还原性粒子,即Cl-和OH-的失电子能力比较。当氯离子浓度足够大时,其可以在阳极先放电。
[情境2]工业镀锌和电解制备Ca(H2PO4)2
[学生]基于该节课内容,迁移教师分析饱和食盐水的思路,自主从氧化还原反应视角分析能够得失电子的离子,及其放电顺序较为特别的原因,关注阴极的两大氧化性粒子,即H+与Zn2+的比较。
[总结升华]当然,影响电解放电顺序的因素还有很多,我们后续可以继续拓展,也正因如此,才让电解真正融入到了我们的日常生活生产中,为人类所用。
[设计意图]该环节围绕3个非常重要的问题情境展开,前2个对于学生来说是非常熟悉但却很少深究的情境,此处将其呈现并要求学生自主交流、深入分析,能够有效促进学生认知模型的进阶化发展,对于学生证据推理与模型认知、科學态度与社会责任素养的培养具有重大意义。电解制备Ca(H2PO4)2的出现则是在综合应用已有认知模型,突出膜电极的基础上,充分培养学生系统分析的思维。并通过关注电化学与生产、生活的联系,培养学生的科学态度与社会责任。
(收稿日期:2023-10-15)
