环介导等温扩增技术在农业病害检测中的应用综述
2024-05-22王一波孙泓希史普想孙继军韩宁任亮张丽丽王海新
王一波 孙泓希 史普想 孙继军 韩宁 任亮 张丽丽 王海新
王一波,孙泓希,史普想,等. 环介导等温扩增技术在农业病害检测中的应用综述[J]. 江苏农业科学,2024,52(7):17-24.
doi:10.15889/j.issn.1002-1302.2024.07.003(辽宁省沙地治理与利用研究所,辽宁阜新 123000)
摘要:环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是一种新型核酸等温扩增技术,其原理是当温度为60~65 ℃时,DNA处于动态平衡状态,DNA双链打开,此时依赖Bst DNA聚合酶的链置换活性,使DNA可以在60~65 ℃的恒温下进行合成。其扩增引物是基于靶基因的6个特异性区域设计的,扩增阶段需要引物与样品DNA完全结合,才可以进行扩增,所以LAMP技术具有高特异性与高灵敏性。其反应温度恒定,不需要额外的控温设备,理想条件下仅需保温杯,即可进行DNA扩增。在田间检测时,只需提取样品总DNA,即可于田间进行病害检测,缩短了检测流程及时间,使病害检测更高效更便捷。在反应前或反应后加入特定染色剂,即可通过染色剂的变色情况进行反应结果的判定,使反应结果可视化。目前该技术已凭借其特异性高、灵敏性高、所用仪器简单(恒温水浴锅或保温杯即可)、检测效率高和检测结果可视化等优点,广泛应用于临床病原微生物检测、食品微生物检测、环境微生物检测、植物或微生物基因鉴定等领域。在农业病害的病原微生物(真菌、细菌、病毒、线虫)快速检测和诊断领域,已有很多研究针对各种病害建立了相应的LAMP检测技术。本文简要综述了LAMP技术原理、反应结果判定、优缺点和该技术目前在农业常见病原物检测中的应用,并对LAMP技术的应用前景进行了进一步的展望。
关键词:环介导等温扩增技术;农业病害;检测;应用
中图分类号:S431.9;S432.4 文献标志码:A 文章编号:1002-1302(2024)07-0017-07
传统的病害检测和鉴定,主要依据科赫法则,对病原菌进行分离回接鉴定,但这种方法会耗费大量的时间和人力,同时要求实验人员具有很高的操作技能和知识储备[1]。随着分子生物学的发展,在聚合酶链式反应(polymerase chain reaction,PCR)技术基础上发展出多种病害鉴定技术,比如荧光定量PCR、巢氏PCR、多重PCR等[2-4]。原理是使用特异性引物进行DNA扩增,以PCR反应结果鉴定病害,但这些基于PCR原理的检测方法都需要依赖昂贵的控温设备,反应时间较传统检测虽然大大缩短,但仍然需要较长的时间,并且对实验人员的操作技能也有一定要求,这些原因限制了PCR检测在基层的大范围应用。因此,各种不需要依赖控温设备的恒温扩增技术被发明出来,目前成熟的恒温扩增技术有很多,比如基于核酸序列的扩增(NASBA,也称为转录介导的扩增,TMA)、解旋酶依赖性扩增(HDA)、重组酶聚合酶扩增(RPA)、滚环扩增(RCA)、多重置换扩增(MDA)、环介导等温扩增(loop-mediated isothermal amplification,LAMP)和链置换扩增(SDA)[5-11]。恒温扩增技术的普遍优点是操作简单、检测费用相对低廉、对DNA质量要求低。但是,NASBA技术的检测时间一般在2 h左右[12];HDA技术因为解旋酶的扩增速度和连续性限制,只能扩增相对小的片段[13];RPA技术有时会有非特异性扩增[14];RCA技术的灵敏性也较低,同时反应进行前需要热变性步骤[15];MDA技术对基因中的高GC区域敏感,容易造成扩增不均匀,同时嵌合体和非特异扩增现象也比较严重[9];SDA技术也是只能扩增较短的片段,同时也需要热变性步骤[16]。而LAMP技术因其高特异性、高灵敏性、检测时间适当、可以扩增较长的基因片段等综合优势,已广泛应用于临床病原微生物检测、食品微生物检测、环境微生物检测、植物或微生物基因鉴定等领域[11]。在农业领域中,该技术已经应用于农业病害的病原生物快速检测和诊断,具有广阔的应用前景。本文就该技术的原理、方法及已有的应用研究进展综述如下。
1 环介导等温扩增技术简介
1.1 LAMP 技术特点及原理
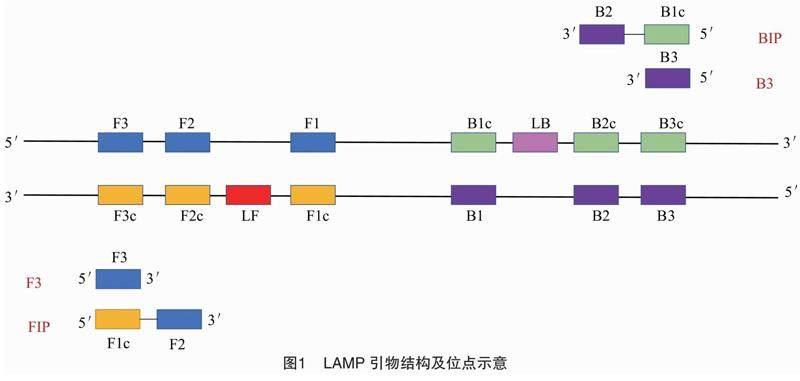
2000年,日本学者报道了一种新型的核酸等温扩增技术——环介导等温扩增技术,其原理是DNA在60~65 ℃的环境内处于动态平衡状态,在这种环境下,DNA双链打开,依赖Bst DNA聚合酶的链置换活性和特异性引物,使DNA可以在60~65 ℃进行合成并不停地自我循环[17]。其特异性引物是基于靶基因序列的6个不同位点特殊设计而成的2对引物(内、外引物),其中2条内引物分别是由2个DNA片段链接而成的。此外还可以设计额外的环引物,其通过在反应过程中与中间产物的颈环结构杂交,进而加快反应速率(图1)[18]。
LAMP反应过程可以分为3个阶段:首先起始物合成阶段,DNA在所有引物和Bst聚合酶的作用下,合成并形成哑铃状DNA,作为下一阶段的模板;随后进入环扩增阶段,在内引物和聚合酶的作用下,合成并形成发卡状DNA,并作为下一阶段的模板;最后进入延伸和循环扩增阶段,由之前形成的DNA模板,在内引物和聚合酶的作用下,最终合成长短不同的茎环状DNA组成的混合物。
1.2 LAMP技术的引物设计
LAMP技术的关键在于靶基因的选择和筛选特异性引物。根据检测目标的不同,选择不同保守程度的靶基因。例如,检测同属不同种的病害,选择在种内高度保守而在种间有足够差异的靶基因;检测同属同种但是不同亚种的病害,则需要选择各个亚种间有足够差异的靶基因。引物设计一般采用由日本荣研株式会社开发的PrimerExplorer v5(http://primerexplorer.jp/e/)在線设计引物,若输入的DNA片段超过2 000 bp会报错。LAMP技术反应过程中主要扩增的DNA片段是F2位点的5′末端到B2位点的5′末端,引物设计要求这段DNA片段一般是在120~160 bp,因此LAMP引物设计完成后,反应最长扩增片段(F3位点5′末端到B3位点5′末端)约为300 bp。靶基因一般不超过 500 bp,即可获得多套引物。若靶基因过长(1 000 bp),会生成过多套引物,增加引物筛选的难度及试验工作量。引物分别为双向内引物(FIP、BIP)和双向外引物(F3、B3)。其中正向内引物FIP由F2区和F1c区组成,反向内引物BIP由B1c(B1区反向互补序列)和B2区域组成。相比于PCR引物设计,LAMP引物要考虑的因素更多,要求更高。一般要求F1c和B1c的Tm值相较于F2、F3、B2、B3的Tm值高 5 ℃ 较好。引物末端的稳定性由自由能改变值(ΔG)来衡量,一般要求引物末端的ΔG小于或等于-4 kcal/mol,其中F2、B2、F3、B3为3′端,F1c、B1c为5′端。另外,设计的引物自身或引物间要求不能形成2级结构。
Nagamine等发现,在LAMP反应体系中加入环引物(LF、LB)能够明显加快反应速度,提高检测效率[18]。因此,若对检测效率有较高要求,可以通过PrimerExplorer v5另行设计环引物,并加入反应体系中。
1.3 LAMP反应条件优化
LAMP反应体系中一般涉及引物、Bst DNA聚合酶、DNA扩增缓冲液、dNTP、甜菜碱、Mg2SO4和水等条件要素。通常需要对引物及其浓度、反应温度、反应时间、甜菜碱和Mg2+最适浓度等反应条件进行优化。引物设计的不同、DNA质量差异等因素,均会对LAMP体系中各组分的最优浓度、反应温度及时间造成影响,所以对以上这些条件均需要逐一优化。
1.4 LAMP 反应结果的判定
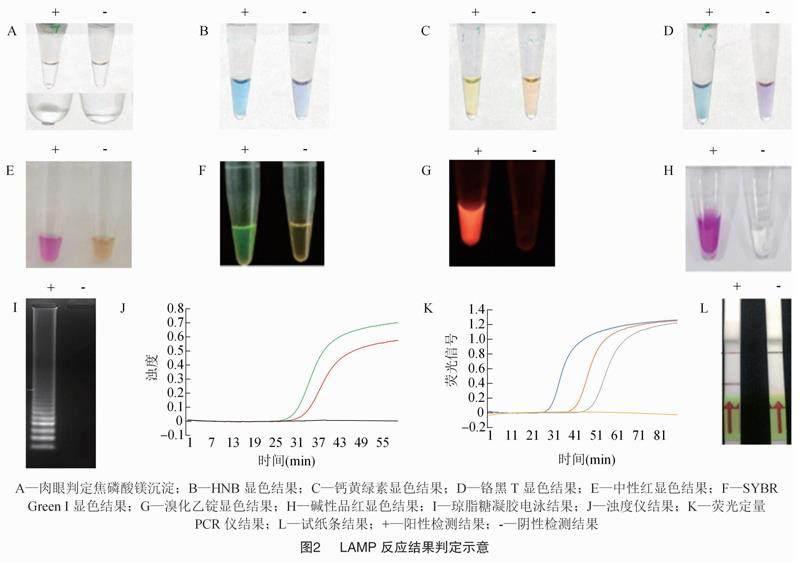
1.4.1 肉眼观察法
LAMP反应过程中,从dNTP析出的焦磷酸根离子,会与反应溶液中的Mg2+结合,从而产生乳白色焦磷酸镁沉淀(图2-A)。所以在理想的条件下,可以通过用肉眼观察反应管中是否有白色沉淀来判断结果。若能观察到白色沉淀,则反应结果为阳性,否则为阴性。但大多数情况下,检测过程并不能达到最理想的条件,导致焦磷酸镁沉淀较少,白色沉淀不明显,通过肉眼判定反应结果会造成较大的人为误差,所以一般通过其他方法来判断反应结果[19]。
1.4.2 染色检测法
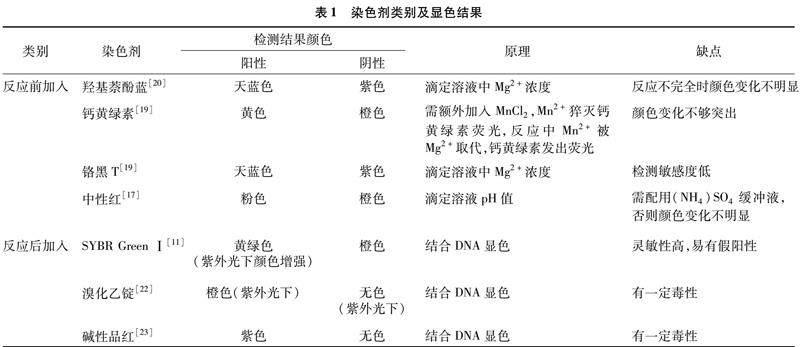
该方法是LAMP反应结果判定最常用的方法,依据染色剂颜色变化判定反应结果(图2-B至图2-H)。根据染色剂是否会干扰LAMP反应过程,染色剂可分为反应前加入和反应后加入2类。最常使用的染料SYBR Green Ⅰ,通过结合双链DNA发出绿色荧光,普遍认为如果在反应前加入到反应体系中,会抑制反应的进行,若模板DNA含量过低,有可能造成假阴性结果,所以SYBR Green Ⅰ一般于反应后加入。目前常用的染色剂类别及显色结果见表1。
1.4.3 琼脂糖凝胶电泳法
LAMP反应的最终产物是多种长短不一的茎环状DNA组成的混合物,在经过琼脂糖凝胶电泳后,会呈现典型的梯型状条带,所以可以通过琼脂糖凝胶电泳后典型条带的有无(图2-I),判断反应结果是否为阳性[21]。
1.4.4 仪器检测法
目前已经有实时监测LAMP反应过程中产生的焦磷酸镁沉淀的仪器,通过对体系中浊度的实时检测和记录,实现对反应过程的实时监控,根据浊度变化绘制扩增曲线(图2-J),可以据此判断反应结果[24]。
另外,还可以在LAMP反应体系中加入对反应影响较小的荧光染料,例如EvaGreen(Biotium),使用实时荧光定量PCR仪进行反应,即可得到LAMP反应的实时扩增曲线(图2-K),据此判断检测结果[25]。这种方法的缺点是,所用的仪器设备价格昂贵,也无法应用于现场检测。
1.4.5 试纸条法
将LAMP引物进行修饰,结合侧流层析试纸条,即可以实现检测结果的试纸条可视化(图2-L)。但是试纸条价格昂贵,并且对引物进行进一步修饰的价格也很昂贵。因此,试纸条法判定反应结果在LAMP技术中使用得较少[26]。
1.5 LAMP技术的优缺点
最主要的优势在于反应在等温条件下进行,并具有以下优点:(1)特异性强:引物设计是基于靶标基因的6个不同区域设计出特异性引物,检测时,2对引物必须全部匹配才能够进行扩增,从而避免了非特异扩增;(2)灵敏度高:一般情况下,LAMP技术的检测灵敏度比PCR高10倍;(3)仪器设备简单:一般不需要PCR仪等控温设备,仅用能维持恒温的设备(水浴锅等)即可实现核酸扩增;(4)检测效率高:通常LAMP反应在1 h内完成;(5)结果可视化:检测结果可通过加入各种显色剂,通过颜色改变进行结果判定。
但是也存在不足:
(1)易造成假阳性:当通过琼脂糖凝胶电泳判定结果,或者开盖加入荧光染料观察结果时,极易产生气溶胶污染,影响后续的检测结果,使假阳性的概率变高;(2)引物要求高:靶基因选择及引物筛选极为繁琐;(3)不能进行后续试验:LAMP扩增产物为不同片段大小的茎环DNA混合物,因此不能进行测序和克隆等试验。
2 LAMP技术在农业病害检测中的应用
2.1 真菌检测
植物中78%~80%病害是真菌病害,真菌病害危害重、分布广,快速检测植物病原真菌的技术能有助于大大提高植物真菌病害的防治效率同时降低农业成本。目前关于植物真菌病害相关的LAMP检测技术蓬勃发展,每年都有大量的真菌病害LAMP检测技术被报道。
比较常见的是通过染色检测法,直接于田间进行病害检测,达到快速检测的目的。例如针对曲霉(Aspergillus spp.)建立的特异性LAMP检测技术,结合了便携设备并使检测结果可视化,一个反应最低能够检测到10个分生孢子的病菌[27];针对疫霉(Phytophthora spp.)建立的特异性LAMP检测技术,以HNB作为染色剂,并且最低能够检测到 1 μg/L 的病原菌DNA[28];针对腐霉(Pythium spp.)建立的玉米茎腐病LAMP检测技术,同样以HNB为染色剂,且最低能檢测到10 μg/L的病原菌DNA[29];针对小麦白粉菌(Erysiphales)建立的特异性LAMP检测技术,以钙黄绿素为染色剂,最低能检测到 0.3 μg/L 的病原菌DNA[30]。这些LAMP检测技术完成现场检测无需分离真菌与植物的DNA,直接进行总DNA粗提后即可进行病害检测,且检测限可达到10-9 mg级甚至10-12 mg级,其灵敏度远高于普通PCR方法。
但是在田间检测时,很多植物组织提取DNA时常常带有很多杂质,这些杂质会降低DNA质量,也有的杂质会干扰LAMP反应进程,最终会导致检测结果不准确,这是限制LAMP检测效率的一大难题。因此有些LAMP技术会配套合适的DNA提取方法,提高检测结果的准确性。例如针对苹果树腐烂病菌的LAMP检测技术同样配套了田间快速DNA提取方法,能够在田间得到纯度较高的DNA,进而得到准确的检测结果;以SYBR Green Ⅰ为染色剂,最低能够检测到1 mg/L的病原菌DNA,一个反应最低能检测到10个分生孢子的病菌[11]。
2.2 细菌的检测
针对细菌病害建立LAMP检测技术相对简单,因为革兰氏阴性菌在环境温度过高时,细菌就会死亡进而裂解,其DNA会自然暴露出来;在针对革兰氏阳性菌建立LAMP检测时,也需考虑DNA提取问题,为了提高方法的灵敏度,核酸仍然需要分离和纯化。
目前针对不同的细菌病害,已经建立了很多对应的LAMP检测技术。例如针对马铃薯黑胫病菌建立的LAMP检测技术,以SYBR Green Ⅰ为染色剂,最低能够检测到10 CFU/mL 病原菌或0.1 μg/L的病原菌DNA[31];针对瓜类细菌性果斑病菌(Acidovorax avenae subsp. citrulli,Aac)和番茄细菌性溃疡病菌(Clavibacter michiganensis subsp. michiganensis,Cmm)的环LAMP检测技术,[JP3]以SYBR Green Ⅰ为染色剂,最低分别能够检测到1.72×102 fg/L[JP]的Aac和0.126 μg/L的Cmm[32];针对猕猴桃细菌性溃疡病建立的LAMP检测技术,分别对猕猴桃叶片、树皮、[JP2]花粉等样品进行快速检测,以SYBR Green Ⅰ为染色剂,最低能够检测到100 CFU/mL[JP]的猕猴桃细菌性溃疡病病原菌[33];针对方中达迪克氏菌建立的LAMP检测技术,以SYBR GreenⅠ为染色剂,最低能够检测到0.1 μg/L的病原菌DNA,而且能够在多种植物上进行该细菌的检测[34]。
2.3 病毒的检测
RNA病毒占植物病毒绝大多数,常规逆转录PCR需先进行逆转录,再进行PCR检测。而LAMP技术可以通过在反应体系内加入逆转录酶,从而同步进行逆转录及LAMP反应,所以LAMP技术在植物病毒病害的检测中有更广泛的使用。最早于2003年,Fukuta等以RNA为模板,通过在反应体系中加入逆转录酶,使逆转录反应和LAMP反应同时进行,实现了对日本红薯花叶病毒的RT-LAMP检测技术,通过观察焦磷酸镁沉淀来判断反应结果[35]。随着各种不同染色剂的应用,RT-LAMP技术得到了更广泛的应用,如2020年,针对马铃薯卷叶病毒(potato leafroll virus,PLRV)建立了RT-LAMP检测技术,以SYBR Green Ⅰ为染色剂,最低能够检测到5 μg/L的病原菌DNA[36];2021年,针对玫瑰莲座丛病毒(rose rosette virus,RRV)建立了RRV的RT-LAMP检测技术,以HNB为染色剂,最低能够检测到 1 μg/L 的病原菌DNA[37]。
2.4 线虫的检测
农业线虫病害一般是土传病害,造成多种植物的根结线虫病。在林业上也有线虫侵害树体,导致树木无法成材,进而造成经济损失,因此建立线虫的LAMP检测技术在生产上有很重要的意义。LAMP检测技术具有便捷性及高效性,能够随时进行土壤检测,及时发现病害并进行防治。
2016年,魏洪岩等建立了可以检测苹果根结线虫(Meloidogyne mali)的LAMP检测技术,以SYBR Green Ⅰ为染色剂和试纸条判定检测结果,最低能够检测到1/20 000条线虫DNA[38];2019年,张磊等建立了一种可以快速检测M. fallax和M. chitwoodi 2种根结线虫的LAMP检测方法,以SYBR Green Ⅰ为染色剂,最低能够检测到10 μg/L的线虫DNA[39]。
3 总结与展望
LAMP 技术最显著的优势在于恒温扩增,不用依赖于昂贵的控温设备,而且其反应速度快(1 h以内完成反应)、特异性高、灵敏性高、反应结果判定简单,对DNA质量要求不高,田间植物样品中粗提的DNA即可进行反应,已经被广泛地应用于地各个领域的病原生物检测和监控[40-41]。
对于LAMP技术被广泛诟病的气溶胶污染问题,目前已有一种比较常用的解决办法,可以在反应体系中加入矿物油,用于控制PCR反应后的气溶胶污染,因为其密度比水小,而且不會参与反应,加入反应体系后会浮在反应体系的最上面,从而达到封闭反应的作用[11]。因此,在加入矿物油的LAMP体系,即使反应结束后开盖加入荧光染料,也不会造成气溶胶污染。
LAMP技术是一种多用途的技术,在其基础上稍加修改,就可以达到不同的检测目的,如加入逆转录酶即可进行病毒检测(reverse transcriptase loop mediated isothermal amplification,RT-LAMP),加入荧光染料即可进行实时LAMP检测(real-time LAMP)和多套引物联用检测多种病害的多重LAMP检测(multiplex LAMP)。CRISPR/Cas12a是一种RNA引导的核酸内切酶,广泛应用于基因编辑中,能够特异性识别DNA靶序列,并对其进行切割。Wang等通过联用CRISPR/Cas12a和LAMP技术,设计高特异性的引物,使CRISPR/Cas12a能快速切割LAMP反应中间产物,得到单链DNA,并结合侧流层析试纸条,可视化检测结果,使检测效率得到进一步提升[42]。总之,LAMP技术用途广泛,并可以与多种技术结合使用,可以根据科研任务的不同,设计不同的LAMP检测体系,以达到科研目的。
农业病害检测技术的应用,还要考虑一个很重要的因素就是价格。LAMP检测技术相较于其他检测技术的优势就是成本低廉。首先,LAMP检测技术相较于传统PCR检测,不依赖昂贵的控温设备,仅需恒温水浴锅或者保温杯即可完成反应,大大降低了检测成本。其次,相较于其他恒温扩增技术,LAMP技术仅需1种Bst聚合酶,检测体系中没有昂贵的成分,引物中仅内引物需要将2个DNA片段连接起来,不需要添加额外的荧光基团和猝灭基团来修饰引物,相比于其他恒温扩增技术,LAMP检测技术单次检测的成本更低。最后,检测结果可以依靠加入的染色剂颜色变化判定,虽然不同的染色剂价格不同,但因为每次染色剂所用量很少,所以无论使用何种染色剂,平均单次检测所需的成本仍然十分低廉。
检测技术正朝着操作简单、准确性高、能够更广泛应用的方向发展。随着LAMP技术的广泛应用,有很多可以进一步使LAMP技术更广泛應用的产品被开发出来。如最近报道了一种基于LAMP技术开发的可折叠微型检测设备,用于检测大米种子中的Magnaporthe oryzae和Sarocladium oryzae[23]。同时还有很多的便携的LAMP检测设备被发明出来,如 ESE-Quant tube scanner (Qiagen,Netherlands)和 Bio-Rad CFX96 Real-Time PCR system,可以用于进行实时LAMP检测[43]。更有一种超便携的检测设备(point-of-care kit for the entire test,POCKET),可以使用于LAMP检测中,这种设备仅使用手机作为加热源来维持LAMP反应所需的温度,同时手机可以作为信号采集设备和结果读取设备[44]。以上这些设备的出现,大大提升了LAMP技术的田间应用性,进一步降低了LAMP技术的使用要求,为该技术的更广泛的应用提供了可行性。
总之,LAMP技术作为一种特异性高、灵敏性高、检测效率高、检测结果可视化的新型核酸扩增检测技术,已经发展为能够与多种新技术联用,配合各种便携设备,进行更简便、更快速、更准确的田间快速检测,LAMP技术的发展符合市场的需求,在农业病害检测领域具有非常广阔的应用前景。
参考文献:
[1]An X Y,Cheng G H,Gao H X,et al. First report of Cladobotryum verticillatum (Ascomycota,Hypocreaceae) causing cobweb disease on Paxillus involutus[J]. Biodiversity Data Journal,2022,10:e87697.
[2]Tang M X,Liao N B,Tian P,et al. Use of bentonite-coated activated carbon for improving the sensitivity of RT-qPCR detection of norovirus from vegetables and fruits:the ISO 15216-1:2017 standard method extension[J]. Food Microbiology,2023,110:104165.
[3]Zang R,Yin Z Y,Ke X W,et al. A nested PCR assay for detecting Valsa mali var. mali in different tissues of apple trees[J]. Plant Disease,2012,96(11):1645-1652.
[4]van Halsema J,Jansen R,Heineken A,et al. Validation of a multi-species-specific PCR panel to diagnose patients with suspected postoperative bacterial endophthalmitis[J]. Acta Ophthalmologica,2022,100(3):e827-e832.
[5]Zhai L G,Liu H X,Li J J,et al. A duplex real-time NASBA assay targeting a serotype-specific gene for rapid detection of viable Salmonella paratyphi C in retail foods of animal origin[J]. Canadian Journal of Microbiology,2022,68(4):259-268.
[6]Kim U,Lee S Y,Oh S W. Thermophilic helicase-dependent amplification-based CRISPR/Cas12a system:detection of stx2 in Escherichia coli O157:H7 by controlling primer dimers[J]. Analytica Chimica Acta,2023,1239:340679.
[7]Ma W D,Duan X Y,Tian Y Y,et al. Recombinase polymerase amplification assay for sensitive and rapid detection of southern rice black-streaked dwarf virus in plants[J]. Journal of Virological Methods,2022,301:114467.
[8]Tang C L,Liu H N,Pan W J,et al. Naked-eye detection of food-borne pathogens using multiplex hyperbranched rolling circle amplification and magnetic particles[J]. Biosensors,2022,12(12):1075.
[9]Sobol M S,Kaster A K. Back to basics:a simplified improvement to multiple displacement amplification for microbial single-cell genomics[J]. International Journal of Molecular Sciences,2023,24(5):4270.
[10]Xu L S,Wang Y B,Zhu S,et al. Development and application of a LAMP assay for the detection of the latent apple tree pathogen Valsa mali[J]. Plant Disease,2021,105(4):1065-1071.
[11]Yao Y P,Li S S,Cao J Q,et al. Development of small molecule biosensors by coupling the recognition of the bacterial allosteric transcription factor with isothermal strand displacement amplification[J]. Chemical Communications,2018,54(38):4774-4777.
[12]Sharma A,Balda S,Apreja M,et al. COVID-19 diagnosis:current and future techniques[J]. International Journal of Biological Macromolecules,2021,193(Pt B):1835-1844.
[13]Zasada A A,Mosiej E,Prygiel M,et al. Detection of SARS-CoV-2 using reverse transcription helicase dependent amplification and reverse transcription loop-mediated amplification combined with lateral flow assay[J]. Biomedicines,2022,10(9):2329.
[14]Cao X Y,Chang Y B,Tao C Q,et al. Cas12a/guide RNA-based platforms for rapidly and accurately identifying Staphylococcus aureus and methicillin-resistant S.aureus[J]. Microbiology Spectrum,2023,11(2):e0487022.
[15]Husain U,Verma P,Suvirya S,et al. An overview of mycetoma and its diagnostic dilemma:time to move on to advanced techniques[J]. Indian Journal of Dermatology,Venereology and Leprology,2023,89(1):12-17.
[16]Gill P,Ghaemi A. Nucleic acid isothermal amplification technologies:a review[J]. Nucleosides,Nucleotides & Nucleic Acids,2008,27(3):224-243.
[17]Notomi T,Okayama H,Masubuchi H,et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research,2000,28(12):e63.
[18]Nagamine K,Hase T,Notomi T. Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]. Molecular and Cellular Probes,2002,16(3):223-229.
[19]Neshani A,Zare H,Sadeghian H,et al. A comparative study on visual detection of Mycobacterium tuberculosis by closed tube loop-mediated isothermal amplification:shedding light on the use of eriochrome black T[J]. Diagnostics,2023,13(1):155.
[20]Thoraneenitiyan N,Choopara I,Nuanualsuwan S,et al. Rapid visual Candidatus Liberibacter asiaticus detection (citrus greening disease) using simple alkaline heat DNA lysis followed by [JP3]loop-mediated isothermal amplification coupled hydroxynaphthol blue (AL-LAMP-[JP]HNB) for potential local use[J]. PLoS One,2022,17(10):e0276740.
[21]Sedaghatjoo S,Forster M K,Niessen L,et al. Development of a loop-mediated isothermal amplification assay for the detection of Tilletia controversa based on genome comparison[J]. Scientific Reports,2021,11:11611.
[22]Chandrashekar B S,Prasannakumar M K,Parivallal P B,et al. Host range and virulence diversity of Pectobacterium carotovorum subsp.brasiliense strain RDKLR infecting radish in India,and development of a LAMP-based diagnostics[J]. Journal of Applied Microbiology,2022,132(6):4400-4412.
[23]Prasannakumar M K,Parivallal P B,Pramesh D,et al. LAMP-based foldable microdevice platform for the rapid detection of Magnaporthe oryzae and Sarocladium oryzae in rice seed[J]. Scientific Reports,2021,11:178.
[24]Hao X G,Wang L C,Zhang X D,et al. A real-time loop-mediated isothermal amplification for detection of the wheat dwarf virus in wheat and the insect vector Psammotettix alienus[J]. Plant Disease,2021,105(12):4113-4120.
[25]Quoc N B,Xuan N T T,Nghiep N M,et al. Loop-mediated isothermal amplification (LAMP) assay for detection of sesame phyllody phytoplasmas in Vietnam[J]. Folia Microbiologica,2021,66(2):273-283.
[26]Lu H X,Tang J T,Sun K,et al. Identification of a new badnavirus in the chinaberry (Melia azedarach) tree and establishment of a LAMP-LFD assay for its rapid and visual detection[J]. Viruses,2021,13(12):2408.
[27]Ferrara M,Logrieco A F,Moretti A,et al. A loop-mediated isothermal amplification (LAMP) assay for rapid detection of fumonisin producing Aspergillus species[J]. Food Microbiology,2020,90:103469.
[28]Kong L,Wang H B,Wang S S,et al. Rapid detection of potato late blight using a loop-mediated isothermal amplification assay[J]. Journal of Integrative Agriculture,2020,19(5):1274-1282.
[29]趙媛媛,沈丹宇,于 佳,等. 基于环介导等温扩增技术检测由强雄腐霉引起的玉米茎腐病[J]. 植物保护学报,2019,46(3):626-633.
[30]薛敏峰,龚双军,杨立军,等. 开发基于田间可应用的环介导等温扩增方法快速检测小麦白粉病菌[C]//中国植物病理学会2018年学术年会论文集.北京:中国农业科学技术出版社,2018:175.
[31]Domingo R,Perez C,Klair D,et al. Genome-informed loop-mediated isothermal amplification assay for specific detection of Pectobacterium parmentieri in infected potato tissues and soil[J]. Scientific Reports,2021,11:21948.
[32]吴秀芹,杨樱子,罗金燕,等. 利用环介导等温扩增方法快速检测瓜类细菌性果斑病菌和番茄细菌性溃疡病菌[J]. 植物保护学报,2018,45(6):1235-1241.
[33]王一波,祝 山,郭文通,等. 猕猴桃细菌性溃疡病可视化LAMP检测方法的建立与应用[J]. 西北农业学报,2021,30(5):761-766.
[34]DeLude A,Wells R,Boomla S,et al. Loop-mediated isothermal amplification (LAMP) assay for specific and rapid detection of Dickeya fangzhongdai targeting a unique genomic region[J]. Scientific Reports,2022,12:19193.
[35]Fukuta S,Iida T,Mizukami Y,et al. Detection of Japanese yam mosaic virus by RT-LAMP[J]. Archives of Virology,2003,148(9):1713-1720.
[36]高彦萍,吕和平,张 武,等. 马铃薯卷叶病毒RT-LAMP检测方法的建立[J]. 核农学报,2020,34(9):1943-1950.
[37]Salazar A,Ochoa-Corona F M,Olson J D,et al. Probing loop-mediated isothermal amplification (LAMP) targeting two gene-fragments of rose rosette virus[J]. PLoS One,2021,16(11):e0256510.
[38]魏洪岩,王 暄,李红梅,等. 采用环介导等温扩增法(LAMP)快速检测苹果根结线虫[J]. 植物保护学报,2016,43(2):260-266.
[39]Zhang L,Gleason C.Loop-mediated isothermal amplification for the diagnostic detection of Meloidogyne chitwoodi and M.fallax[J]. Plant Disease,2019,103(1):12-18.
[40]Gomez-Gutierrez S V,Goodwin S B. Loop-mediated isothermal amplification for detection of plant pathogens in wheat (Triticum aestivum)[J]. Frontiers in Plant Science,2022,13:857673.
[41]戴婷婷,陸辰晨,郑小波. 环介导等温扩增技术在病原物检测上的应用研究进展[J]. 南京农业大学学报,2015,38(5):695-703.
[42]Wang Y,Li J Q,Li S J,et al. LAMP-CRISPR-Cas12-based diagnostic platform for detection of Mycobacterium tuberculosis complex using real-time fluorescence or lateral flow test[J]. Microchimica Acta,2021,188(10):347.
[43]Cao Y Y,Wang L F,Duan L P,et al. Development of a real-time fluorescence loop-mediated isothermal amplification assay for rapid and quantitative detection of Ustilago maydis[J]. Scientific Reports,2017,7:13394.
[44]Xu H,Xia A Y,Wang D D,et al. An ultraportable and versatile point-of-care DNA testing platform[J]. Science Advances,2020,6(17):7445.
基金项目:辽宁省科技项目(编号:2021JH/10400034、2022JH2/101300164) 。
作者简介:王一波(1994—),男,辽宁沈阳人,硕士,研究实习员,从事花生栽培及病害防控研究研究。E-mail:465910393@qq.com。
通信作者:王海新,研究员,从事花生栽培研究和推广工作。E-mail:wanghaixin99@163.com。
