短期服用蛹虫草对不同状态小鼠的免疫调节作用
2024-05-20张美娜赵南南廖思晴王升厚
张美娜,赵南南,廖思晴,王升厚,王 泽,3,*
(1.沈阳师范大学生命科学学院,辽宁 沈阳 110034;2.辽宁省功能性蛹虫草重点实验室,辽宁 沈阳 110034;3.沈阳市功能性蛹虫草产业技术研究院,辽宁 沈阳 110034)
机体的健康状态取决于免疫功能是否能保持相对的平衡稳定,免疫力低下会增加患侵袭性真菌感染、癌症和艾滋病等疾病的风险[1-2],免疫力过强则容易导致过敏反应、系统性红斑狼疮、重症肌无力、类风湿等自身免疫性疾病[3]。因此,针对不同的机体状况,免疫系统通过正、负双向的调节机制,产生匹配的免疫应答,保证机体维持正常健康的状态。免疫调节剂是指具有增强或调节免疫功能的一大类物质,在临床上广泛用于感染性疾病、某些自身免疫病及肿瘤的辅助治疗。研究显示,食药用真菌及其免疫调节蛋白、多糖等可以通过多途径、多层面对免疫系统发挥作用,同时具有良好的食用安全性,被认为是具有医疗潜力的天然免疫调节剂。
蛹虫草(Cordycepsmilitaris)是一种食药用真菌和新资源食品,其含有丰富的虫草素、喷司他丁及多糖等生物活性成分,具有增强机体免疫力、抗肿瘤及抗炎活性[4-6]。大量实验研究证实,蛹虫草对免疫抑制小鼠具有良好的免疫激活作用,可提高其免疫器官指数、白细胞数量、迟发性变态反应程度和血清溶血素含量[7],具有促进脾脏T淋巴细胞和B淋巴细胞增殖的作用,能够促进免疫球蛋白(immunoglobulin,Ig)G、IgM分泌[8]。蛹虫草胞外多糖可提高免疫抑制小鼠的肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-6的水平[9]。同时,蛹虫草对正常机体免疫状态是否存在影响,目前主要集中在体外实验评估层面。研究显示,蛹虫草可增强自然杀伤细胞的体外细胞毒性[10],蛹虫草多糖可通过抑制PD-L1/PD-1轴,促进免疫抑制性巨噬细胞转化为杀伤性巨噬细胞[11],蛹虫草的免疫调节蛋白可激活Toll样受体(Toll-like receptor,TLR)4/核因子(nuclear factor,NF)-κB通路,增加F-肌动蛋白表达,促进小鼠单核巨噬细胞白血病细胞RAW264.7对大肠杆菌的吞噬作用[12]。因此,本研究从体液免疫、细胞免疫及胃肠免疫3 个角度揭示蛹虫草对正常小鼠免疫应答的影响,同时,辅以环磷酰胺小鼠免疫抑制模型,进一步探究蛹虫草对免疫力低下机体的调节作用,以期为蛹虫草在免疫调节剂方面的应用提供理论基础。
1 材料与方法
1.1 动物、材料与试剂
SPF级KM系小鼠(生产许可证号:SCXK(辽)2020-0002),中国食品药品检定研究院检疫合格,雌雄各半,体质量18~22 g,于室温(24±2)℃、相对湿度(55±5)%、自然光照条件下饲养;小鼠及鼠粮均购自辽宁长生生物技术股份有限公司。
蛹虫草子实体由辽宁省功能性蛹虫草重点实验室提供,60 ℃烘干后粉碎,过80 目筛网,获得蛹虫草干粉,-20 ℃密封保存待用。灌胃前,用蒸馏水充分溶解制备蛹虫草水溶液,现配现用。
小鼠IL-2、IL-10定量酶联免疫吸附测试(enzyme linked immunosorbent assay,ELISA)试剂盒 上海酶联生物科技有限公司;小鼠血清IgG、IgM定量ELISA试剂盒 武汉博士德生物工程有限公司;藻红蛋白(phycoerythrin,PE)标记的抗小鼠CD4单克隆抗体、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的抗小鼠CD3单克隆抗体、PerCP-Cy5.5标记的抗小鼠CD8a单克隆抗体 美国BioLegend公司;RNAiso Plus 日本TaKaRa公司;GoScriptTM逆转录系统、GoTaq®qPCR Master Mix试剂盒 美国Promega公司。
1.2 仪器与设备
F50型酶标分析仪 瑞士帝肯公司;BD FACSCanto IIL流式细胞仪 美国碧迪医疗器械有限公司;ABI Q6实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)仪 赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 正常小鼠的蛹虫草灌胃处理
KM系小鼠适应性饲养2 d后,随机分为空白组(ZC组)、低倍组(DB组)及高倍组(GB组),每组10 只。按中华人民共和国卫生部公告(2009年第3号)中正常成人蛹虫草推荐服用剂量2 g/60 kgmb计算[13],根据Meeh-Rubner公式计算小鼠服用基础剂量,DB组灌胃剂量为0.61 g/kgmb,GB组为1.52 g/kgmb,蛹虫草水溶液连续灌胃21 d,0.5 mL/只,ZC组灌胃同等体积的蒸馏水。
1.3.2 小鼠的日常状态观察及解剖
每天观察记录小鼠的毛发、精神、活动等日常状态,记录小鼠体质量、日饮水量及日进食量。末次灌胃结束后,各组小鼠眼球取血,分离血清,于-20 ℃保存备用。解剖并称取肝脏、肾脏、脾脏及胸腺的质量,按下式计算脏器指数:
1.3.3 小鼠血清细胞因子和Ig含量的检测
随机选用小鼠血清样本(n=3),分别设置实验孔和空白孔,3 个复孔,其中IL-2和IL-10血清样本按体积比1∶1稀释至50 μL加入实验孔,IgG和IgM血清样本1∶1稀释至100 μL加入实验孔,空白孔为等体积的样本稀释液,按照试剂盒要求进行ELISA检测操作,酶标仪450 nm波长处测定各孔的OD值。
1.3.4 小鼠外周血T淋巴细胞亚群的检测
取小鼠抗凝血100 μL,加入1 mL红细胞裂解液,4 ℃裂解10 min;用磷酸盐缓冲液洗2 次,取1×106个/mL细胞悬液500 μL,依次加入1 μL PE标记的抗小鼠CD4单抗、2 μL FITC标记的抗小鼠CD3单抗、3 μL PerCP-Cy5.5标记的抗小鼠CD8a单抗,避光染色30 min,流式细胞仪上机检测CD3+CD4+和CD3+CD8+T淋巴细胞亚群数量。
1.3.5 小鼠肠道菌群多样性的高通量检测
分别取ZC组、DB组和GB组盲肠内新鲜粪便,置于无菌冻存管中,-80 ℃冰箱中保存。采用QIAGEN DNA提取试剂盒提取各组盲肠内容物样本总DNA,并通过核酸定量荧光计进行总DNA质检;以通用上游引物(5’-3’)CCTACGGGNGGCWGCAG和下游引物(5’-3’)GACTACNVGGGTATCTAAT对各样本肠道菌群16S rRNA V3~V4区进行扩增,纯化后的PCR产物通过Illumina平台进行Paired-End测序;利用Usearch软件聚类分析并注释操作分类单元(operational taxonomic unit,OTU);R语言计算样本组间共有和特有OTU,并进行样本间的主坐标分析(principal coordinates analysis,PCoA),α多样性指数图由QIIME软件绘制。不同分类水平肠道菌群组成分析通过LEfSe软件选取各组小鼠肠道重要菌群,并对优势菌群进行线性判别分析(linear discriminant analysis,LDA)。
1.3.6 小肠TLRs/NF-κB通路相关因子的检测
取ZC组、DB组和GB组小鼠空肠组织,采用试剂盒提取总RNA,超微量分光光度计检测其浓度和纯度,取1 μg进行电泳检测,-80 ℃保存样品。按照GoScript™逆转录系统试剂盒步骤得到cDNA,反转录反应条件:25 ℃孵育5 min;42 ℃孵育1 h;70 ℃孵育15 min,终止反应。以β-actin为内参基因,扩增目的基因TLR2、TLR4、髓样分化因子88(myeloid differentiation factor,MyD88)、NF-κB的mRNA序列,其中引物见表1,realtime PCR体系:2×GoTaq®qPCR Master Mix 10 μL、10 μmol/L上下游引物各0.4 μL、cDNA 1 μL、DEPC水8.2 μL。real-time PCR扩增程序:每个样品设置3 个重复,95 ℃预变性10 min;95 ℃变性15 s;60 ℃退火1 min;共40 个循环。

表1 引物序列Table 1 Primer sequences used in this study
1.3.7 免疫抑制小鼠的蛹虫草灌胃与检测
KM系小鼠随机分为空白组(CK组)、模型组(MD组)和蛹虫草灌胃组(MDY组),每组10 只,MD组和MDY组分别腹腔注射80 mg/kgmb环磷酰胺溶液(0.5 mL/只),连续3 d,诱导小鼠免疫抑制[14]。基于对正常小鼠灌胃实验结果,MDY组采用DB组灌胃剂量标准,0.61 g/kgmb蛹虫草水溶液连续灌胃21 d(0.5 mL/只),CK组和MD组灌胃同等体积蒸馏水。在灌胃0、7、14、21 d分别开展免疫相关指标的检测,具体操作见1.3.2~1.3.4节。
1.4 数据处理
实验数据采用Excel 2019软件进行整理,采用SPSS 20.0软件中单因素方差分析法对数据进行统计分析,数据以±s表示,显著性检验水平α=0.05。
2 结果与分析
2.1 不同剂量蛹虫草对正常小鼠免疫状态的影响
2.1.1 对基础免疫状态的影响
如图1所示,相较于ZC组,GB组进食量、饮水量出现显著降低的情况,各组小鼠体质量、脏器指数之间均无显著差异(P>0.05)。蛹虫草灌胃第21天,小鼠血清IgG和IgM水平出现较为明显的升高,其中DB组血清IgG水平由ZC组的(105.63±15.31)ng/mL上升为(136.26±20.41)ng/mL,GB组上升至(120.95±10.97)ng/mL,但均未达到显著水平(P>0.05)。与ZC组相比,DB组外周血CD3+CD4+和CD3+CD8+T淋巴细胞亚群含量小幅度升高,但无显著差异(P>0.05),各组间CD4+/CD8+值也无显著差异(P>0.05)。各实验组IL-2和IL-10血清水平均未产生明显改变(P>0.05)。
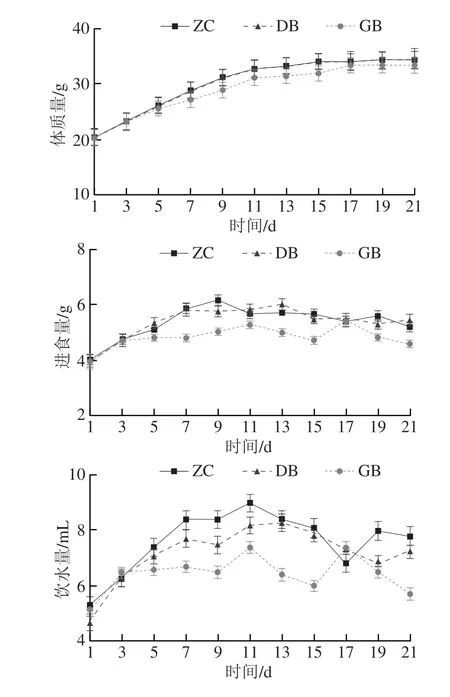
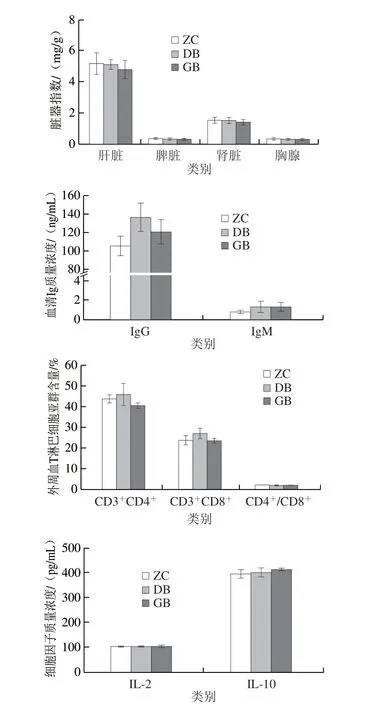
图1 不同剂量蛹虫草对正常小鼠基础免疫状态的影响Fig.1 Effects of different doses of C.militaris on the basal immune status of normal mice
2.1.2 对小鼠肠道菌群的影响
α多样性分析显示,ZC组Shannon指数及Chao1指数最低,ZC、DB、GB 组的Chao 1 指数分别为317.11±18.54、330.27±13.13、355.36±6.31,Shannon指数分别为6.17±0.24、6.66±0.22、6.76±0.07,蛹虫草灌胃处理后小鼠肠道菌群丰富程度和多样性均上升(图2A、B)。PCoA结果显示,各组样本位于不同的象限,相对于组间距离,组内距离较小,3 组小鼠肠道菌群的组成结构存在明显差异(图2C)。3 组共有OTU 328 个,其中ZC组特有OTU 1 个、DB组3 个、GB组10 个(图2D),GB组与ZC组间OTU数量存在显著差异。测序所得OTU主要分布在7 个门、12 个纲、15 个目、20 个科、38 个属,Firmicutes、Bacteroidetes及Proteobacteria为各组丰度最高的三大菌门;与ZC组相比,DB组和GB组Firmicutes丰度显著下降,DB组和GB组Bacteroidetes丰度显著升高(图2E、F)。图2G为各组相对丰度>1%的前20 名菌属,其中Lactobacillus、ClostridiumXIVa、Lachnospiracea_incertae_sedis、Alistipes、Helicobacter为各组相对丰度最高的5 个菌属,各实验组中Lactobacillus和Alistipes相对丰度均显著升高(P<0.05),ClostridiumXIVa、Helicobacter及Lachnospiracea_incertae_sedis显著降低(P<0.05)。依据LDA得分>2,共获得5 个对组间肠道细菌差异具有显著影响的菌属,其中,Helicobacter为3 组的共有菌属,各实验组小鼠肠道Helicobacter的丰度显著降低(P<0.05),GB组出现Bifidobacterium、Ruminococcus和Turicibacter的富集,未检测到Clostridium_sensu_stricto(图2H)。

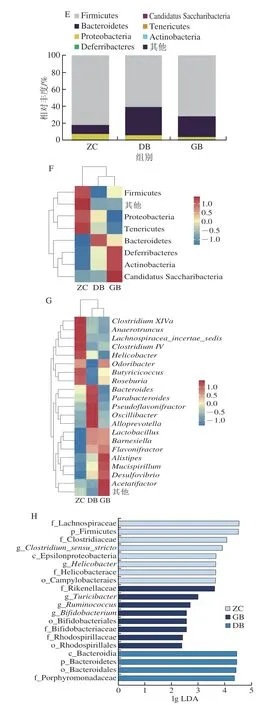
图2 不同剂量蛹虫草对正常小鼠肠道菌群的影响Fig.2 Effects of different doses of C.militaris on the intestinal flora of normal mice
2.1.3 对肠道TLRs/MyD88/NF-κB信号通路的影响
如图3所示,相较于ZC组,不同剂量蛹虫草灌胃均引起小鼠空肠TLR4mRNA表达量的显著降低(P<0.05),DB组TLR2、MyD88mRNA表达水平极显著上调(P<0.01),说明低剂量蛹虫草显著激活TLR2/MyD88信号通路;但GB组TLR2表达处于抑制状态(P<0.01),MyD88表达量未发生显著改变(P>0.05)。同时,DB组和GB组NF-κBmRNA的表达量均处于下调状态,GB组显著低于DB组(P<0.05),并具有剂量依赖性。

图3 不同剂量蛹虫草对正常小鼠肠道TLRs/NF-κB信号通路的影响Fig.3 Effects of different doses C.militaris on the intestinal TLRs/NF-κB signaling pathway in normal mice
2.2 蛹虫草对免疫抑制小鼠免疫状态的影响
2.2.1 对免疫抑制小鼠基础生理状态的影响
如图4A~C所示,环磷酰胺导致小鼠体质量、进食量、饮水量显著下降,毛发明显稀疏,脾脏和胸腺指数显著减小(P<0.05)。蛹虫草灌胃期间,MD组和MDY组小鼠体质量、进食量、饮水量一直显著低于CK组。至21 d,MDY组毛发状态接近CK组,MD组毛发稀疏仍然明显(图4D)。如图4E~H所示,相对于MD组,MDY组各脏器指数更接近CK组。灌胃第7天,MD组和MDY组肝脏及脾脏指数显著上调(P<0.05),并达到峰值。此后MD组和MDY组肝脏指数、脾脏指数均呈现降低的趋势,至灌胃第14天,MDY组和MD组小鼠脾脏、肾脏和胸腺指数与CK组无显著差异(P>0.05);灌胃21 d,MD组小鼠肝脏指数仍显著高于CK组(P<0.05),MDY组已恢复正常水平。
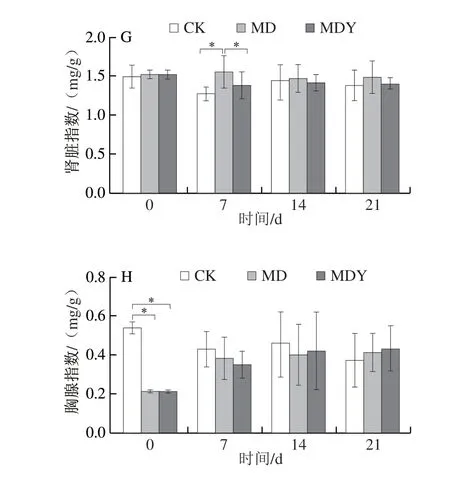
图4 蛹虫草对免疫抑制小鼠基础生理状态的影响Fig.4 Effects of C.militaris on the basic physiological state of immunosuppressed mice
2.2.2 对免疫抑制小鼠免疫状态的影响
如图5所示,环磷酰胺处理导致正常小鼠血清IgG、IgM和IL-2含量,及外周血CD3+CD4+、CD3+CD8+T淋巴细胞亚群数量和CD4+/CD8+值显著降低(P<0.05),血清IL-10含量显著升高(P<0.05),小鼠处于典型的免疫抑制状态。灌胃期间,MDY组和MD组的小鼠血清IgG及IgM含量均呈现缓慢上升的状态,灌胃第7天,均与CK组已无显著差异(P>0.05),至灌胃第21天,MDY组IgG质量浓度由CK组的(78.40±32.82)ng/mL上升至(118.39±15.31)ng/mL,IgM质量浓度由CK组的(1.86±0.26)ng/mL上升至(2.67±0.40)ng/mL,显著高于其他两组(P<0.05)。蛹虫草灌胃期间,MDY组外周血CD3+CD4+和CD3+CD8+T细胞亚群数量始终高于MD组,并早于MD组恢复至CK组的水平。灌胃14 d开始,MD组IL-2质量浓度持续降低,由CK组的(103.62±9.15)pg/mL下降至(88.61±2.28)pg/mL,MDY 组I L-2 含量在灌胃第7 天与CK 组无显著差异(P>0.05)。至灌胃结束,各实验组血清IL-10含量始终高于CK组(P>0.05)。
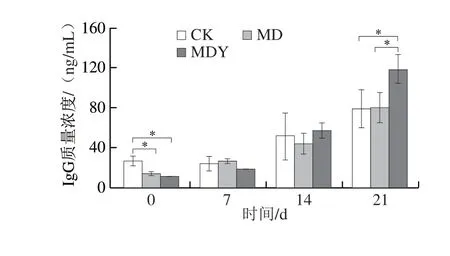
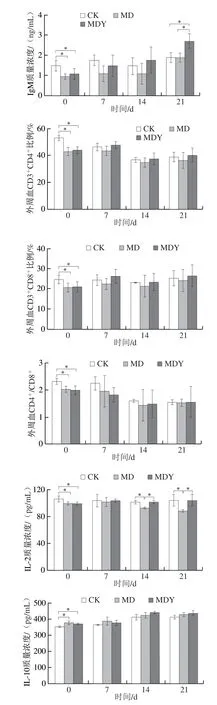
图5 蛹虫草对免疫抑制小鼠免疫状态影响Fig.5 Effect of C.militaris on immune status in immunosuppressed mice
3 讨论与结论
免疫应答是由免疫器官、免疫细胞、体液因子和细胞因子组成的、相互协作的功能网络。本实验首先从脏器指数、血清IgG、IgM、IL-2和IL-10水平及外周血CD3+CD4+和CD3+CD8+T淋巴细胞数量几个方面评价了蛹虫草对正常小鼠免疫应答的影响,研究结果显示,虽然不同剂量蛹虫草对上述检测指标均未产生显著影响(P<0.05),但是检测到DB组小鼠血清IgG及IgM水平、外周血CD3+CD4+及CD3+CD8+T淋巴细胞亚群数量均出现不同程度的升高。这说明低剂量蛹虫草从某种程度上可以影响正常机体的抗体分泌和T淋巴细胞增殖,但是不会引起机体免疫状态的失衡。因此,选用DB组蛹虫草灌胃剂量开展后续实验。
为了进一步探讨蛹虫草对机体免疫应答的调节机制,本研究利用环磷酰胺建立了小鼠免疫抑制模型[15]。结果显示,环磷酰胺导致小鼠肝脏、脾脏以及胸腺均受到明显的损伤,血清IgG和IgM水平及T淋巴细胞含量显著降低(P<0.05),小鼠处于典型的免疫抑制状态。灌胃期间MDY组CD3+CD4+和CD3+CD8+T淋巴细胞亚群数量始终高于MD组,灌胃第14天开始,蛹虫草已有效抑制了环磷酰胺导致的IL-2水平持续降低;灌胃结束,MDY组IL-2含量已恢复至CK组水平(P>0.05)。CD3+CD4+T淋巴细胞又称辅助性T细胞,其分泌的IL-2不仅可以正反馈刺激T淋巴细胞的持续增殖,同时能够促进B细胞向浆细胞分化和抗体分泌[16]。李丹等[17]发现蛹虫草可提高正常小鼠脾脏CD3+CD4+、CD3+CD8+T淋巴细胞含量,显著促进免疫调节因子IL-2的表达。蛹虫草发酵液不仅能够有效提高环磷酰胺抑制小鼠的脾细胞增殖活性,同时能够恢复环磷酰胺诱导的IL-2、干扰素(interferon,INF)-γ、TNF-α和IL-10水平的下降,发挥免疫激活的作用[18]。蛹虫草胞外多糖可明显增强T淋巴细胞的增殖,提高血清IL-6,IL-2,IFN-γ及TNF-α的水平,其免疫调节效果显著[9]。此外,本实验证实了蛹虫草对免疫抑制小鼠Ig的分泌具有明显的促进作用。MDY组小鼠IgG和IgM水平早于MD组接近CK组状态;在灌胃21 d,两种Ig水平出现大幅上升,IgG质量浓度上升至(118.39±15.31)ng/mL,IgM上升至(2.67±0.40)ng/mL,远高于CK组水平(P<0.05)。Ig是体液免疫的主要功能执行分子,血清IgG和IgM水平的降低是判断体液免疫功能缺陷的常用标准[19],Yu Yue等[8]研究发现,蛹虫草胞外多糖AESP-II可以促进免疫抑制小鼠T、B细胞的增殖,促进B淋巴细胞IgA、IgG和IgM的分泌,日粮中添加蛹虫草菌丝体可促进大鼠血清IgG、IgM水平的提升[20],与本实验的研究结果一致。因此,结合蛹虫草对正常小鼠免疫状态的影响分析可知,蛹虫草可以促进IL-2、B淋巴细胞IgG和IgM的分泌。蛹虫草对机体的体液免疫和细胞免疫均具有激活作用,参与机体免疫抑制状态的修复。
代谢和免疫是肠道菌群的两大核心功能,肠胃存在人体约70%的免疫细胞和最大密度的微生物菌群,参与机体的免疫防御、物质代谢等重要生理过程,被广泛用于预测肠道健康与免疫状态[21-23]。服用蛹虫草后小鼠肠道菌群多样性及丰富度都显著升高,并呈剂量依赖性,同时菌群组成结构发生明显改变,如Firmicutes/Bacteroidetes显著降低。通过对各组相对丰度最高的前5 个菌属进行筛选比较,发现蛹虫草增加了肠道Lactobacillus和Alistipes相对丰度,降低了Clostridium XIVa、Lachnospiracea_incertea_sedis和Helicobacter相对丰度。Lactobacillus是临床常用益生菌制剂的来源菌属,可以帮助人体消化吸收营养物质,通过抑制有害菌的繁殖维护肠道健康,进而提高机体免疫力[24],Alistipes主要存在于健康人体的肠道中,在结肠炎、自闭症谱系障碍、各种肝脏和心血管纤维化疾病中具有促进健康的作用[25]。而ClostridiumXIVa、Lachnospiracea_incertea_sedis和Helicobacter均与肠道炎症的发生具有一定正相关性[26-27],ClostridiumXIVa能够促进Th17的增殖及IL-17、IL-22等免疫因子的分泌,直接诱导肠道炎症的发生[28],本实验进一步分析了对组间肠道菌群差异具有显著影响的标志性菌属,高剂量蛹虫草引起小鼠肠道富集了Bifidobacterium、Ruminococcus和Turicibacter3 个新的菌属,同时抑制了具有潜在致病性Clostridium_sensu_stricto菌群的出现。蔡玟等[29]研究显示,Bifidobacterium补充剂的使用可以增强小鼠的细胞免疫、体液免疫功能及NK细胞活性。在结肠炎诱导模型中,野生型小鼠模型肠道中Turicibacter的比例明显高于Tnf-/-小鼠,这表明Turicibacter与TNF参与的抗炎过程有关[30]。蛹虫草可以通过优化肠道菌群参与肠道的免疫防御。
TLRs在炎症反应及免疫细胞调控方面发挥着关键作用,TLR2和TLR4可以特异性识别大部分已知的病原体相关分子模式,对于维持肠道黏膜完整性、调控肠道功能及菌群组成等具有积极的作用[31]。实验结果显示,蛹虫草对空肠组织的TLR2和TLR4具有不同的激活模式,低剂量蛹虫草激活了TLR2/MyD88信号通路,高剂量则呈现抑制作用。对TLR4的表达则具有稳定的抑制作用。但整体而言,小鼠空肠NF-κB的表达量受到了明显的抑制。研究显示,TLR4是介导蛹虫草免疫调节蛋白CMIMP诱导巨噬细胞分化的真正受体,而非TLR2[12]。蛹虫草多糖CMPB90-1则通过与TLR2结合,导致与M2肿瘤相关巨噬细胞向M1表型极化[10]。由于蛹虫草生物活性成分的多样性,TLR2和TLR4产生了不同的应答效果。脂多糖诱导的RAW264.7细胞炎症反应模型经虫草酸和虫草素处理24 h,TLR4、NF-κB的表达量均受到显著抑制(P<0.05)[32]。Zheng Hongmei等[33]研究结果显示,蛹虫草可下调猪结肠TLR4/MyD88/NF-κB信号通路关键蛋白的表达,显著下调炎症因子TNF-α、IL-12水平(P<0.05),改善猪十二指肠免疫屏障功能。NF-κB是TLRs信号通路的效应分子,广泛参与炎性介质和前炎性介质的调控,拮抗NF-κB的活化或活性可起到有效抗炎的效果[34-35]。综上,蛹虫草可以通过影响机体肠道菌群改善肠道免疫功能,对于机体避免肠道炎症发生具有积极的意义。
