具有不同芳基取代的6种水杨醛亚胺基二氟化硼配合物力致荧光变色性能研究
2024-05-20徐山祖王甫鹏李先杨艳华高树林
徐山祖 王甫鹏 李先 杨艳华 高树林

摘要:为进一步探究影响分子力致荧光变色性能的因素,合成了6种具有不同芳基取代基团的水杨醛亚胺二氟化硼配合物1-6。结果表明,六种配合物都具有弱的分子内电荷转移过程,除配合物5外,其余五种配合物具有聚集诱导发光特性。进一步研究显示,在这一系列的配合物中,配合物6具有较好的力致荧光变色性能。量子化学计算结果显示,配合物的力致荧光变色行为受到分子空间效应和偶极矩的影响。
关键词:二氟化硼配合物;芳基取代基;聚集诱导发光;力致荧光变色
中图分类号:O626.3文献标志码:A文献标识码
Research on the Mechanofluorochromism properties of six salicylaldimine difluoroboron complexes with different aryl substitutions
XU Shanzu,WANG Fupeng,LI Xian,YANG Yanhua*,GAO Shulin
(School of Chemistry and Chemical Engineering,Kunming University,Kunming,Yunnan 650214,China)
Abstract: To further exploring the factors affecting the molecular machanofluorochromism performance, six salicylaldehydimine difluoroboron complexes (1-6) with different aryl substituent groups were synthesized. The results indicated that all complexes exhibited weak intramolecular charge transfer processes, and except for complex 5, the other five complexes displayed aggregation-induced emission properties. Further research showed that complex 6 exhibited well machanofluorochromism performance in this series of complexes. The quantum chemical calculation results illustrated that the machanofluorochromism behaviors of the complexes were influenced by molecular spatial effects and dipole moments.
Key words: difluoroboron complexes;aryl substituent groups;aggregation-induced emission;machanofluorochromism
唐本忠院士[1]在2001年首次報道具有聚集诱导发光(aggregation-induced emission,简称AIE)特性的分子染料以来,研究人员致力于设计新的分子结构并探索其在液晶材料、细胞成像、荧光探针、有机发光二极体和非线性光学材料等方面的应用。近年来,在AIE分子染料基础上发展起来的智能响应材料,在应力传感器、安全防伪纸和发光器件等领域,有潜在的应用前景[2]。其中,通过研磨、碾压、拉扯、敲打等机械力刺激,染料分子固体粉末或晶体的发射波长和发光颜色发生的变化力致荧光变色(machanofluorochromism,简称MFC)材料,受到越来越多的关注。
在MFC性能的研究中,吉林大学卢然课题组报道了一系列具有叔丁基团的水杨醛亚胺基二氟化硼配合物,研究表明,叔丁基不仅影响了配合物的凝胶性能,而且也可以通过调控π-π相互作用的强度,进而影响MFC性能[3-4]。日本京都大学Kazuo Tanaka课题组发现,在二氟化硼配合物的末端引入氟原子、氯原子、溴原子、氰基、二甲胺基和三甲基硅基团后,小取代基由于空间位阻较低,使得配合物在结晶态下的堆积结构较为致密,导致配合物具有高平面性和强的π-π分子间相互作用,MFC行为蓝移。而体积较大的末端取代基扰乱了致密堆积,MFC行为红移。同时,含有卤素作为端基的二氟化硼配合物具有性能更加优异的MFC行为,这主要是形成了分子间卤键导致的[5]。随着研究的不断深入,研究人员发现,在二氟化硼配合物中保留端基卤素原子,而将分子骨架换成四苯基乙烯等大体积的分子基团后,增加了分子的扭曲结构,不能形成分子间卤键。优异的MFC行为主要是研磨过程改变了配合物的初始分子构象,并完全降低固体的结晶度导致的[6]。由此可见,分子结构的变化对MFC性能的影响还需深入研究。在设计具有AIE特性的MFC分子时,会考虑在分子结构中引入具有空间位阻效应的大体积芳香基团[7]、烷烃链基团[8],或具有不同电荷特性的取代基团或原子[9-10],以期获得性能更加优异的MFC材料。通过调控空间位阻效应和电荷特性,影响固体或晶体的堆积模式[11]、分子间作用力[12]、偶极矩[13]、分子迁移率[14]和晶体类型[15]等,进一步探究分子结构与材料性能间的关系。
因此,我们设计了6种含有水杨醛亚胺基团部分的二氟化硼配合物,通过引入甲氧基苯基、甲基苯基、吡啶基和苯基取代基,调控分子的空间构型,进一步探究不同芳基取代基对分子MFC行为的影响,为设计性能更加优异的MFC分子材料奠定基础。
1 材料与方法
1.1 试剂与仪器
3,5-二叔丁基水杨醛(98%)、邻甲氧基苯胺(98%,GC)、对甲氧基苯胺(99%,AR)、邻甲基苯胺(98%)、对甲基苯胺(99%,RG)、2-氨基吡啶(99%)、苯胺(99%)、三乙胺(99%,AR)和三氟化硼乙醚溶液(47.0%~47.7%,AR),均购置于上海柏卡化学技术有限公司。先用无水CaCl2预除水,再用CaH2蒸馏,得到无水CH2Cl2试剂;其他化学试剂均为分析纯,未进一步处理。
Bruker Avance II-400型核磁共振仪测试化合物的1H、13C和19F NMR;RY-1G熔点仪测试化合物的熔点;岛津UV-2450型紫外-可见分光光度计和安捷伦Carry Eclipse型荧光分光光度计,分别测试物质的紫外-可见光谱和荧光发射光谱;Bruker D2 PHASER型X-射线衍射仪测试二氟化硼配合物固体粉末在不同状态下的XRD衍射图。
1.2 化合物的合成
6种二氟化硼配合物的合成路线,如图1所示。
1.2.1 配体的合成
2,4-二叔丁基-6-(((2-甲氧基苯基)亚氨基)甲基)苯酚(
s-1) 氮气保护下,在100 mL三口烧瓶中依次加入3,5-二叔丁基水杨醛(2.36 g,10 mmol)、邻甲氧基苯胺(1.23 g,10 mmol)和无水乙醇(60 mL),70 ℃下反应8 h。冷却至室温,有橘黄色结晶生成,抽滤,烘干,得2.37 g(产率69.9%)化合物s-1(C22H29NO2),熔点:110 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 14.37(s,1H,-OH),8.95(s,1H,-CH=N-),7.47(d,J=2.4 Hz,1H),7.42~7.38(m,2H),7.31(dt,J=1.6 Hz,6.8 Hz,1H),7.15(dd,J=1.2 Hz,8.4 Hz,1H),7.05~7.01(m,1H),3.87(s,3H,-OCH3),1.43(s,9H,-CH3),1.30(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 164.5,158.4,153.0,140.3,136.8,136.3,128.4,127.7,127.6,121.4,119.8,118.9,112.6,56.3,35.1,34.4,31.8,29.8。
其余5种席夫碱类化合物的步骤合成与
s-1相同,只是将2-甲氧基苯胺依次换成相同物质的量的4-甲氧基苯胺、2-甲基苯胺、4-甲基苯胺、2-氨基吡啶和苯胺,此处不再赘述。
2,4-二叔丁基-6-(((4-甲氧基苯基)亚氨基)甲基)苯酚(s-2)(C22H29NO2),熔点:105 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 14.07(s,1H,-OH),8.96(s,1H,-CH=N-),7.47(d,J=2.4 Hz,1H),7.45(d,J=9.2 Hz,2H),7.37(d,J=2.4 Hz,1H),7.03(d,J=9.2 Hz,2H),3.80(s,3H,-OCH3),1.42(s,9H,-CH3),1.30(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 163.2,158.9,157.8,141.0,140.5,136.2,127.8,127.3,123.0,118.9,115.1,55.9,35.1,34.4,31.8,29.8。
2,4-二叔丁基-6-(((2-甲基苯基)亚氨基)甲基)苯酚(s-3)(C22H29NO),熔点:78 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 14.07(s,1H,-OH),8.90(s,1H,-CH=N-),7.52(d,J=2.4 Hz,1H),7.41(d,J=2.4 Hz,1H),7.36-7.28(m,3H),7.2(t,J=7.2 Hz,1H),2.35(s,3H,-CH3),1.43(s,9H,-CH3),1.30(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 165.1,158.2,147.2,140.6,136.3,132.1,131.0,128.1,127.7,127.6,127.2,118.9,118.6,35.1,34.4,31.8,29.7,18.3。
2,4-二叔丁基-6-(((4-甲基苯基)亞氨基)甲基)苯酚(s-4)(C22H29NO),熔点:110 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 14.03(s,1H,-OH),8.98(s,1H,-CH=N-),7.49(d,J=2.4 Hz,1H),7.39(d,J=2.4 Hz,1H),7.36(d,J=8.0 Hz,2H),7.28(d,J=8.4 Hz,2H),2.34(s,3H,-CH3),1.42(s,9H,-CH3),1.30(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 164.5,158.0,145.6,140.6,136.8,136.2,130.4,128.0,127.6,121.7,118.8,35.1,34.4,31.8,29.8,21.1。
2,4-二叔丁基-6-((吡啶-2-氨基)甲基)苯酚(s-5)(C20H26N2O),熔点:105 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 14.02(s,1H,-OH),9.52(s,1H,-CH=N-),8.55(d,J=4.8 Hz,1H),7.96(t,J=7.6 Hz,1H),7.61(d,J=2.0 Hz,1H),7.50(d,J=7.6 Hz,1H),7.45(s,1H),7.39(t,J=4.8 Hz,1H),1.44(s,9H,-CH3),1.31(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 166.6,158.8,157.5,149.5,140.9,139.6,136.4,129.1,128.7,123.4,120.0,118.4,35.1,34.4,31.7,29.7。
2,4-二叔丁基-6-((苯基亚氨基)甲基)苯酚(s-6)(C21H27NO),熔点:110 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 13.94(s,1H,-OH),8.99(s,1H,-CH=N-),7.51-7.43(m,5H),7.41(d,J=2.4 Hz,1H),7.34-7.29(m,1H),1.43(s,9H,-CH3),1.30(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 165.6,158.0,148.2,140.6,136.3,130.0,128.1,127.8,127.3,121.8,118.7,35.1,34.4,31.8,29.7。
1.2.2 配合物的合成
6,8-二叔丁基-2,2-二氟-3-(2-甲氧基苯基)-2H-2λ4,3λ4-苯并[e][1,3,2]氧杂硼化物(1) 50 mL三口烧瓶中依次加入化合物s-1(0.35 g,1.0 mmol)、无水CH2Cl2(30 mL)和三乙胺溶液(1 mL,7.5 mmol),室温搅拌10 min后,加入三氟化硼乙醚溶液(1 mL,8.0 mmol),继续搅拌24 h。饱和NaHCO3溶液萃取(3×20 mL),收集的有机层用无水Na2SO4干燥过夜,抽滤,旋干滤液。柱层析柱提纯(淋洗剂:V二氯甲烷/V正己烷=1/2),得0.19 g(产率49.1%)配合物1(C22H28BF2NO2),熔点:195 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 9.01(s,1H,-CH=N-),7.70(d,J=2.4 Hz,1H),7.62(d,J=2.4 Hz,1H),7.48~7.43(m,2H),7.30(d,J=7.6 Hz,1H),7.12(dt,J=0.8 Hz,7.6 Hz,1H),3.82(s,3H,-OCH3),1.43(s,9H,-CH3),1.30(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 170.5,156.0,152.9,142.3,138.2,133.7,130.6,130.4,127.7,126.4,120.9,115.9,113.5,56.7,35.2,34.5,31.5,29.6.19F NMR(376 MHz,DMSO-d6,ppm) δ -134.22。
其余五种二氟化硼配合物的步骤合成与配合物1相同,只是将化合物s-1依次换成相同物质的量的s-2、s-3、s-4、s-5和s-6,此处不再赘述。
6,8-二叔丁基-2,2-二氟-3-(4-甲氧基苯基)-2H-2λ4,3λ4-苯并[e][1,3,2]氧杂硼化物(2)。柱层析柱提纯(淋洗剂:V二氯甲烷/V正己烷=1/8),得0.166 g(产率42.9%)配合物2(C22H28BF2NO2),熔点:185 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 9.07(s,1H,-CH=N-),7.67(s,2H),7.62(d,J=8.8 Hz,2H),7.12(d,J=9.2 Hz,2H),3.83(s,3H,-OCH3),1.42(s,9H,-CH3),1.31(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 165.8,156.0,155.6,142.2,138.0,135.6,133.0,127.9,125.1,116.5,115.0,56.0,35.2,34.5,31.5,29.6.19F NMR(376 MHz,DMSO-d6,ppm) δ -134.00,-134.07。
6,8-二叔丁基-2,2-二氟-3-(2-甲基苯基)-2H-2λ4,3λ4-苯并[e][1,3,2]氧杂硼化物(3)。柱层析柱提纯(淋洗剂:V二氯甲烷/V正己烷 = 1/8),得0.168 g(产率45.3%)配合物3(C22H28BF2NO),熔点:160 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 8.99(s,1H,-CH=N-),7.71(d,J=2.4 Hz,1H),7.63(d,J=2.4 Hz,1H),7.44-7.30(m,4H),2.25(s,3H,-CH3),1.44(s,9H,-CH3),1.30(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 168.8,155.0,141.1,140.6,137.1,132.6,131.8,130.5,128.1,126.7,125.9,125.1,114.7,34.1,33.4,30.4,28.5,16.6。19F NMR(376 MHz,DMSO-d6,ppm) δ -134.42。
6,8-二叔丁基-2,2-二氟-3-(4-甲基苯基)-2H-2λ4,3λ4-苯并[e][1,3,2]氧雜硼化物(4)。柱层析柱提纯(淋洗剂:V二氯甲烷/V石油醚 = 1/12),得0.159 g(产率42.9%)配合物4(C22H28BF2NO),熔点:164 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 9.10(s,1H,-CH=N-),7.68(s,2H),7.56(d,J=8.4 Hz,2H),7.37(d,J=8.4 Hz,2H),2.38(s,3H,-CH3),1.42(s,9H,-CH3),1.31(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 166.5,155.8,142.2,140.1,139.0,138.0,133.3,130.3,128.0,123.7,116.5,35.2,34.5,31.5,29.6,21.1。19F NMR(376 MHz,DMSO-d6,ppm) δ -133.78,-133.85。
6,8-二叔丁基-2,2-二氟-3-(吡啶-2-基)-2H-2λ4,3λ4-苯并[e][1,3,2]氧杂硼化物(5)。柱层析柱提纯(淋洗剂:V二氯甲烷/V正己烷 = 1/10),得0.117 g(产率32.7%)配合物5(C20H25BF2N2O),熔点:160 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 9.78(s,1H,-CH=N-),8.66(dd,J=0.8 Hz,4.4 Hz,1H),8.12(dt,J=1.6 Hz,8.0 Hz,1H),7.89(d,J=2.4 Hz,1H),7.84(d,J=8.4 Hz,1H),7.74(d,J=2.4 Hz,1H),7.61(q,J=4.8 Hz,1H),1.44(s,9H,-CH3),1.32(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 165.6,156.7,151.5,149.7,142.7,140.1,138.1,134.9,129.3,125.2,118.6,116.0,35.2,34.6,31.4,29.5。19F NMR(376 MHz,DMSO-d6,ppm) δ -131.75,-131.82。
6,8-二叔丁基-2,2-二氟-3-苯基-2H-2λ4,3λ4-苯并[e][1,3,2]氧杂硼化物(6)。柱层析柱提纯(淋洗剂:V二氯甲烷/V石油醚 = 1/4),得0.175 g(产率49.3%)配合物6(C21H26BF2NO),熔点:118 ℃。1H NMR(400 MHz,DMSO-d6,ppm) δ 9.14(s,1H,-CH=N-),7.69(t,J=6.0 Hz,4H),7.59(t,J=7.2 Hz,2H),7.52(t,J=7.2 Hz,1H),1.43(s,9H,-CH3),1.31(s,9H,-CH3)。13C NMR(101 MHz,DMSO-d6,ppm) δ 166.1,154.9,141.5,141.2,137.0,132.4,128.8,128.2,127.1,122.9,115.4,34.1,33.5,30.4,28.5。19F NMR(376 MHz,DMSO-d6,ppm) δ -133.58,-133.66(图1)。
2 结果与讨论
2.1 合成与表征
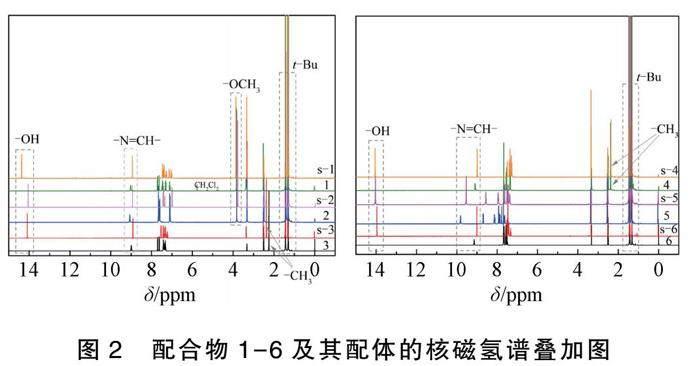
3,5-二叔丁基水杨醛与六种氨基化合物经缩合反应分别得到6种席夫碱类化合物,如图2所示。
生成的席夫碱类化合物中,-OH的化学位移(δ)在14.00 ppm左右,-CH=N-的δ在9.00 ppm左右,-OCH3的δ在3.80 ppm左右,叔丁基团的δ在1.30 ppm和1.45 ppm左右,而苯基取代基上-CH3的δ在2.35 ppm左右。其中,含有吡啶取代基的席夫碱化合物s-5中,含有孤对电子的氮原子不参与吡啶环的共轭,且氮原子的电负性大于碳原子,导致吡啶环上的电子云密度比苯环低,对与之相连的-CH=N-屏蔽效应降低,共振信号向低场方向移动,因此,s-5中-CH=N-的δ(9.52 ppm)比含有苯基取代基的s-6(8.99 ppm)大。苯基取代基上的-OCH3和-CH3都具有供电子特性,使得与苯环相连的-CH=N-电子密度增加,共振信号向高场移动,因此,席夫碱类化合物s-1、s-2、s-3和s-4的中-CH=N-的δ比s-6的小。而-OCH3的供电子特性强于-CH3,所以,s-1和s-2中-CH=N-的δ(8.95 ppm和8.96 ppm)比s-3和s-4(8.90 ppm和8.98 ppm)的小。此外,位于-CH=N-邻位的-OCH3和-CH3影响了各向异性,导致其共振信号向高场移动,因此,具有邻位-OCH3和-CH3取代的s-1和s-3的δ(8.95 ppm和8.90 ppm)比
s-2和s-4(8.96 ppm和8.98 ppm)的小。-OCH3和-CH3也受此影响,δ发生移动。在三乙胺作用下,席夫碱类化合物与三氟化硼乙醚发生配位反应,得到6种二氟化硼配合物1-6后,-OH的δ消失。由于硼为缺电子体,导致-CH=N-周围的电子密度下降,磁屏蔽减小,共振信号向低场方向移动,6种二氟化硼配合物中-CH=N-的δ都变大。此诱导效应被相邻的苯环阻隔,对t-Bu基本无明显影响。
2.2 紫外-可见光谱和荧光发射光谱
为了测试二氟化硼配合物的溶剂效应,将六种二氟化硼配合物分別溶于正己烷、CH2Cl2、CH3CN和CH3OH等4种极性不同的有机溶剂中,测试其紫外-可见光谱和荧光发射光谱。如图3所示,配合物6和其余4种配合物在300和380 nm左右都有两个明显的吸收峰。前者来源于分子共轭体系中的π-π*跃迁,后者由分子中-CH3、t-Bu等弱供电子基团与BF2核吸电子基团间的电荷跃迁导致。配合物2在280、325和380 nm左右有3个吸收峰,前者为π-π*跃迁引起,其余两个峰由电荷跃迁引起。根据Laportes宇称选择定则,325 nm左右的吸收峰受到S0,0→S1,1跃迁的影响,380 nm左右的吸收峰受到S0,0→S1,0跃迁的影响[16]。随溶剂极性的增加,吸收光谱的峰形和波长基本不变,这说明在平衡态与Frank-Condon激发态间的偶极矩差异不大[17]。
如图4所示,随着溶剂极性的增加,配合物的荧光发射波长出现蓝移或红移现象,这表明合成的6种二氟化硼配合物存在分子内电荷转移过程。在CH2Cl2中,苯基取代基上无其他烷烃取代的配合物6的发射波长为494 nm,配合物1-5的发射波长分别为475、484、476、490和506 nm。由于配合物5中的吡啶基团上氮原子含有孤对电子,参与了分子体系中的π电子共轭,拓展了整个分子的π共轭体系,使其发射波长发射红移。苯基取代基上的-OCH3和-CH3,增加了分子间空间位阻,扰乱了分子平面性和刚性,导致配合物1-4的发射波长蓝移。其中,邻位取代的-OCH3和-CH3对分子平面性的影响比对位取代大,相比较于配合物1和3,配合物2和4的发射波长蓝移更多。-OCH3的空间位阻效应强于-CH3,配合物1和2的发射波长分别比配合物3和4的小。测试结果表明,6种二氟化硼配合物都具有分子内电荷转移(intramolecular charge transfer,简称ICT)过程,且具有扭曲的分子构象,这可能导致配合物具有固态发光特性。
2.3 AIE特性
为了进一步探究配合物的光学性能,将6种二氟化硼配合物分别溶于THF/H2O的混合溶剂中,测试其AIE特性。以配合物1为例(图5),随着THF/H2O的混合溶剂中含水量(fw,%)从0%增加到50%时,荧光强度逐渐减弱,这主要归因于溶剂极性的增加,ICT效应导致[18]。当fw从60%增加到90%时,发射强度从弱变强,这是由于不良溶剂的增加导致配合物1分子团簇在一起并形成聚集体,限制了分子内旋转,导致发射强度增加,即AIE特性。配合物2测试结果与配合物1相同,且fw为90%时的强度比fw为0%时的更强。-OCH3为亲水基团,而-CH3为疏水基团[19],导致配合物3和4在fw达到90%时,发射强度减弱。这主要是在高的fw下,疏水基团使混合溶剂中的分子易于形成更大的颗粒,出现无定形聚集体,导致系统中荧光物种减少,发射强度下降[18]。含有吡啶取代基团的配合物5表现出典型的聚集导致荧光猝灭(aggregation-caused quenching,ACQ)现象。含有苯环取代基团的配合物6在fw达到30%时,发射最强,随着fw的增大,强度逐渐减弱。以上结果表明,除配合物5外,其余五种二氟化硼配合物都具备AIE特性。这可能是由于配合物5中的吡啶基团对分子聚集体的形成有影响造成的。
2.4 MFC特性
由于6种二氟化硼配合物都具有ICT特性,且在固态都具有荧光发射行为,因此,探究其MFC特性。如图6所示,在固态时,6种二氟化硼配合物的荧光发射波长分别为449、478、461、482、487和475 nm。在研钵中使用研杵研磨10 min后,测试的荧光发射波长分别为454、482、458、481、491和482 nm,除配合物6的固体荧光颜色从碧蓝色变为淡绿色外,其余配合物的固体荧光颜色变化不明显。5种二氟化硼配合物的力致荧光发射变化趋势为配合物6(7 nm)>1(5 nm)>2=5(4 nm)>3(3 nm)。这表明,除配合物4外,其余五种配合物都具有一定的MFC特性。用CH2Cl2蒸气熏蒸研磨后的配合物5 s后,只有配合物3的发射保持不变,配合物1、2、4和5的发射波长分别为447、447、484和480 nm,发射波长都没有返回到初始固态波长。配合物3在研磨后,发射蓝移,而其余四种配合物发射红移,这可能是分子堆积类型不同造成的[20]。以上测试结果表明,具有苯基取代的配合物6具有较好的MFC特性,这可能与其空间效应和电荷特性有关,将在后续的量子化学计算部分深入讨论。
为了进一步解释力致荧光发射变化,对机械力刺激具有荧光发射响应的5种二氟化硼配合物进行XRD测试,测试结果如图7所示。研磨前,各配合物的固体粉末XRD衍射图都显示尖锐而强烈的衍射峰,表明其固态是具有有序排列的晶相。研磨后,配合物的XRD衍射峰减弱或消失。这表明外力刺激下,分子的有序堆积被破坏,显示无序的无定形态。CH2Cl2蒸气熏蒸后,减弱的衍射峰变强,消失的衍射峰重新出现。这说明粉末的无定形态恢复为初始的晶态。XRD测试结果说明,固体粉末中晶态和非晶态间的转变,是导致力致荧光发射变化的原因。配合物6在熏蒸后,2θ = 20°处出现一个强度增大的衍射峰,说明CH2Cl2蒸气可能影响了固态分子的堆积。
2.5 量子化学计算结果
所有分子的基态和激发态分别在B3LYP/6-31G(d)和TD-CAM-B3LYP/6-31G(d)水平下[21],进行构型全优化,得到各分子的稳定几何构型及能量,并在相同水平上进行频率计算确认是势能面局域最小点。电子结构计算采用Gaussian 16程序包完成[22],分子轨道绘制采用Multiwfn 3.8(dev)软件完成[23]。计算得到二氟化硼配合物1-6分别在基态和激发态时的最高占据分子轨道(highest occupied molecular orbitals,简称HOMO)和最低未占据分子轨道(lowest unoccupied molecular orbitals,简称LUMO),结果如图8所示。无论在基态还是激发态,HOMO和LUMO能级都覆盖在整个分子平面,电子云从HOMO到LUMO的迁移差异不明显,这主要是6个配合物中电子供体部分的供电子能力较弱,且电子供体与电子受体基团相似导致的[24]。在HOMO与LUMO上的电子云分离不明显,这可能是导致图4测试结果中分子内的电荷跃迁能力较弱的原因。激发态时,HOMO与LUMO间的能级差比基态时小,表明激发态更有利于电荷跃迁的发生。
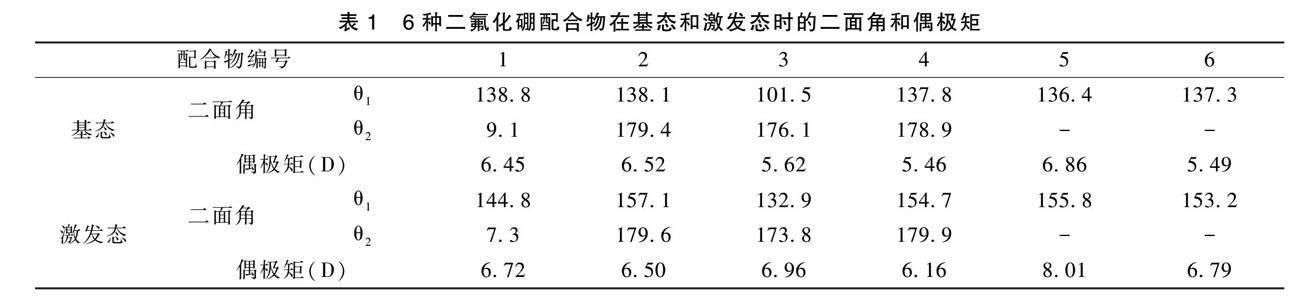
如图9所示,基态时,N^O配位BF2六元环与芳基取代基间的二面角(θ1)都在100~140°间,芳基取代基与烷基(-OCH3和-CH3)间的二面角(θ2)具体数据如表1所示。除配合物1中芳基取代基与邻位-OCH3间的二面角变小外,其余五种配合物在激发态时,二面角都比基态时大。无论是基态还是激发态,分子的平面性较好,扭曲空间构象程度较小。机械外力刺激时,外力对配合物1的分子构象改变程度强于其余五种配合物,显示出MFC行为。此外,配合物的MFC行为还受到偶极矩的影响。无论是基态还是激发态,配合物3和5的偶极矩都比较大,分子极性较强,高的分子极性使其表现出较少的MFC行为[13],且配合物5无AIE特性,不能作为MFC材料的候选。含有对位烷基取代基-OCH3和-CH3的配合物2和4,无论在基态还是激发态,苯基与烷基间的二面角都趋向于与苯环共面,延伸了分子的平面性,相较于邻位取代的配合物1和3,在CH2Cl2中的荧光发射都红移,且MFC性能没有配合物6的好。即便如此,对位烷基也对分子的空间构象有影响,而无任何烷基取代基的配合物5和6分子刚性结构最强,荧光发射波长最长。总的来说,六种二氟化硼配合物基态和激发态的偶极矩变化都不大,这与图3的测试结果相符。而配合物6在基态时偶极矩较小、基态和激发态间的偶极矩差异又较大,如此大的分子极性变化可能对MFC特性产生了影响。
3 结论
综上所述,我们合成了6种含有不同芳基取代基的二氟化硼配合物,通过紫外-可见光谱、荧光发射光谱、AIE和MFC测试,探究其光学性能,并通过量化计算进行解释。结果表明,配合物5具有ACQ特性,其余五种二氟化硼配合物表现出AIE行为。具有苯基取代的配合物6具有较好的MFC性能。配合物3和5受分子极性影响,MFC性能较差。而配合物1受空间构象的影响,也表现出MFC性能。配合物2和4受苯基取代基團的对位烷基影响,MFC性能没有配合物6的好。而配合物4无MFC行为,这可能与分子的堆积模式或分子间作用力有关,在后续的研究中,将进一步对其进行探究。
参考文献(References)
[1] 唐本忠,董宇平,秦安军,等著.聚集诱导发光[M].北京:科学出版社,2020.
[2] HUANG X,QIAN L,ZHOU Y,et al.Effective structural modification of traditional fluorophores to obtain organic mechanofluorochromic molecules[J].Journal of Materials Chemistry C,2018,6(19):5075-5096.
[3] GONG P,YANG H,SUN J,et al.Salicylaldimine difluoroboron complexes containing tert-butyl groups:nontraditional π-gelator and piezofluorochromic compounds[J].Journal of Materials Chemistry C,2015,3(39):10302-10308.
[4] SUN J,SUN J,MI W,et al.Carbazole modified salicylaldimines and their difluoroboron complexes:effect of the tert-butyl and trifluoromethyl terminal groups on organogelation and piezofluorochromism[J].New Journal of Chemistry,2017,41(2):763-772.
[5] YOSHII R,SUENAGA K,TANAKA K,et al.Mechanofluorochromic materials based on aggregation-induced emission-active boron ketoiminates:Regulation of the direction of the emission color changes[J].Chemistry-A European Journal,2015,21(19):7231-7237.
[6] GARCIA-GONZALEZ M C,NAVARRO-HUERTA A,RODRIGUEZ-MUNOZ F C,et al.The design of dihalogenated TPE monoboronate complexes as mechanofluorochromic crystals[J].Cryst Eng Comm,2021,23(34):5908-5917.
[7] LIU X,YANG J,LIU H,et al.Pyromellitic diimide-based luminophors:Tunable aggregation-induced emission (AIE) and reversible mechanofluorochromism characteristics[J]. Journal of Photochemistry & Photobiology,A:Chemistry,2021,417:113344.
[8] XU K,JIA Y R,GAO G L,et al.Vinyl-dependent multicolor solid-state emission and different mechanofluorochromic activity on 1,2,4,5-tetraarylimidazole series[J].Dyes and Pigments,2023,211:111071.
[9] GUO S,ZHANG G,KONG L,et al.Molecular packing-controlled mechanical-induced emission enhancement of tetraphenylethene functionalized pyrazoline derivatives[J].Chemistry-A European Journal,2020,17(26):3834-3842.
[10] CHEN Y,ZHOU Y,WANG Z,et al.Enhanced mechanofluorochromic properties of 1,4-dihydropyridine-based fluorescent molecules caused by the introduction of halogen atoms[J].Cryst Eng Comm,2019,21(29):4258-4266.
[11] ZHANG L,MA L L,WANG X,et al.Dependence of mechanofluorochromic property at room temperature on alkyl chain structure for β-diketone boron complex and its polymer blend film[J].Journal of Luminescence,2019,214:116560.
[12] GAO G L,JIA Y R,JIANG H,et al.Bright mechanoluminescence and dramatically different mechanofluorochromic behaviors of tetraarylimidazoles by slight modulation of substituent structure[J].Dyes and Pigments,2021,186:109030.
[13] MA C,ZHANG X,YANG L,et al.Alkyl length dependent mechanofluorochromism of AIE-based phenothiazinyl fluorophenyl acrylonitrile derivatives[J].Dyes and Pigments,2017,136:85-91.
[14] XUE P,YAO B,LIU X,et al.Reversible mechanochromic luminescence of phenothiazine-based 10,10-bianthracence derivatives with different lengths of alkyl chains[J].Journal of Materials Chemistry C,2015,3(5):1018-1025.
[15] SUN X,YANG Q,ZHOU W,et al.Exactly opposite luminescence behaviors of aggregated diketopyrrolopyrrole derivatives depending on different molecular conformations[J].The Journal of Physical Chemistry C,2022,126(19):8499-8510.
[16] KUBOTAY,NIWA T,JIN J,et al.Synthesis,absorption,and electrochemical properties of quinoid-type bisboron complexes with highly symmetrical structures[J].Organic Letters,2015,17(12):3174-3177.
[17] XU M, TIAN J, YANG Y, et al. Reversible mechanofluorochromic and data security protection of a triphenylamine-based difluoroboron luminescent compound[J]. Chinese Journal of Organic Chemistry, 2023, 43(5): 1824-1831.
[18] KONG L,TIAN Y P,CHEN Q Y,et al.Self-assembly of metal ions induced highly emissive fluorophore-triphenylamine nanostructures:enhanced two-photon action cross-section for bioimaging application[J].Journal of Materials Chemistry C,2015,3(3):570-581.
[19] SINGH R S,GUPTA R K,PAITANDI R P,et al.Morphological tuning via structural modulations in AIE luminogens with the minimum number of possible variable and their use in live cell imaging[J].Chemical Communications,2015,51(44):9125-9128.
[20] ZHAO J,LI L,WANG W,et al.Modulation of mechanofluorochromism based on carboxylic acid esters compounds bearing triphenylamine and pyrene with different substituents[J].Journal of Luminescence,2022,241:118495.
[21] YANAI T,TEW D,HANDY N C. A new hybrid exchange-correlation functional using the Coulomb-attenuating method (CAM-B3LYP)[J].Chemical Physics Letters,2004,393(1-3):51-57.
[22] FRISCH M J,TUCKS G W,SCHLEGEL H B,et al.Gaussian 16 Rev.A.03[J].Wallingford,CT;Gaussian,Inc,2016,21(3):27-31.
[23] ZHANG J,LU T.Efficient evaluation of electrostatic potential with computerized optimized code[J].Physical Chemistry Chemical Physics,2021,23(36):20323-20328.
[24] MA C,ZHANG X,YANG Y,et al.Effect of alky length dependent crystallinity for the mechanofluorochromic feature of alkyl phenothiazinyl tetraphenylethenyl acrylonitrile derivatives[J].Journal of Materials Chemistry C,2016,4(21):4786-4791.
(責任编辑:编辑唐慧)
