3种药用甘草对重金属镉的生长响应、镉耐性及富集特征
2024-05-20张迦得陆嘉惠李新刘梦楠徐可
张迦得 陆嘉惠 李新 刘梦楠 徐可


摘要:通過3种药用甘草对重金属镉(Cd)生长响应、镉耐受性差异和镉积累特征的研究,为药用甘草种植和药材安全控制提供理论依据。本研究采用水培法育苗,分析不同浓度镉(0、50、100、150 μmol·L-1)胁迫对生长30 d的3种药用甘草的生长指标、生物量和丙二醛(MDA)含量的影响,并用石蜡切片法制片观察根解剖结构;采用耐镉系数法和隶属函数值法对药用甘草的耐镉性差异进行评价;同时,利用电感耦合等离子体光谱仪(ICP)测定根、茎和叶中镉离子的含量,并计算镉富集系数和转移系数,分析镉富集特性。镉处理下3种药用甘草的株高、根长、叶片数和生物量显著下降,根横截面积显著减小,维管柱面积占根总面积比例上升,根部MDA含量升高,氧化胁迫加重;以生物量下降至75 %时的镉浓度为适宜生长阈值,胀果甘草为12.462 μmol·L-1,乌拉尔甘草为14.715 μmol·L-1,光果甘草为1.952 μmol·L-1;综合耐镉系数和隶属函数综合评价结果显示乌拉尔甘草的耐镉性最强,光果甘草最弱;镉富集系数在1.960~8.683之间,转运系数远小于1,镉主要富集在根中。在50 μmol·L-1处理下,胀果甘草根中镉含量是叶中的7.5倍,乌拉尔甘草为21.3倍,光果甘草为16.5倍,均超过国家标准GB/T 19618—2004。镉胁迫显著抑制了3种药用甘草根和叶片生长,药材根生物量显著下降,其镉耐受性表现为乌拉尔甘草>胀果甘草>光果甘草;镉主要积累在根部,在50 μmol·L-1镉处理下,3种药用甘草根中镉含量均超国家标准。因此,应关注野生甘草采挖和人工栽培地的土壤镉监测,以保证甘草药材生产的安全性;同时也应重视药材Cd2+含量的抽检,进行甘草药材的安全性控制管理。
关键词:药用甘草;镉胁迫;解剖结构;富集系数;隶属函数
中图分类号:中图分类号Q945.78文献标志码:A文献标识码
Growth response, cadmium tolerance and enrichment characteristics of three
medicinal licorice species to heavy metal cadmium
ZHANG Jiade1,LU Jiahui1,2*,LI Xin1,LIU Mengnan1,XU Ke1
(1 College of Life Sciences, Shihezi University/Key Laboratory of Xinjiang Phytomedicine Resource and Utilization ,Ministry of Education,
Shihezi,Xinjiang 832003, China; 2 Institute of Licorice, Shihezi University,Shihezi,Xinjiang 832003,China)
Abstract: By studying the growth response, cadmium tolerance differences, and cadmium accumulation characteristics of three medicinal licorice species to heavy metal cadmium (Cd),a theoretical basis is provided for the cultivation and safety control of medicinal licorice. This study used hydroponic method for seedling cultivation and analyzed different concentrations of cadmium (0, 50, 100 and 150 μmol·L-1) stress on the growth indicators, biomass, and malondialdehyde (MDA) content of three medicinal licorice species grown for 30 days, and the root anatomical structure was observed using paraffin sectioning method. The differences in cadmium tolerance of medicinal licorice were evaluated by cadmium tolerance coefficient and membership function value method. Meanwhile, inductively coupled plasma spectrometer (ICP) was used to measure root, stem, and leaf cadmium (Cd2+) ion content, and the calculate Cd enrichment coefficients and transfer coefficients were calculated to analyze the cadmium enrichment characteristics. Under cadmium treatment, the plant height, root length, leaf number, and biomass of the three medicinal licorice species significantly decreased, the root cross-sectional area decreased significantly, the proportion of vascular column area to total root area increased, the root MDA content increased, and oxidative stress worsened. The cadmium concentration at the time of biomass decline to 75% as the appropriate growth threshold was 12.462 μmol·L-1 for Glycyrrhiza inflata, 14.715 μmol·L-1 for Glycyrrhiza uralensis, and 1.952 μmol·L-1 for Glycyrrhiza glabra. Combining the results of cadmium tolerance coefficients and affiliation function indices showed that Glycyrrhiza uralensis was the most cadmium tolerant and Glycyrrhiza glabra was the weakest; The cadmium enrichment coefficient was between 1.960~8.683, and the transfer coefficient was much less than 1. Cadmium was mainly enriched in the roots, Under the treatment of 50 μmol·L-1, the content of cadmium in the roots of Glycyrrhiza inflata was 7.5 times higher than that in the leaves, Glycyrrhiza uralensis was 21.3 times, Glycyrrhiza glabra was 16.5 times, all of which exceeded the minimum cadmium content stipulated by the national standard GB/T 19618—2004 of the Peoples Republic of China. Cadmium stress significantly inhibited the root and leaf growth of the three medicinal licorice species, and the root biomass of the herbs decreased significantly, The order of cadmium tolerance is manifested as Glycyrrhiza uralensis > Glycyrrhiza inflata > Glycyrrhiza glabra; cadmium was mainly accumulated in the roots, and its absolute cadmium content already far exceeded the national standard at a low concentration of 50 μmol·L-1 treatment. Therefore, in the excavation and artificial cultivation of wild licorice, soil cadmium should be monitored to ensure the safety of medicinal licorice herb production. It is also necessary to carry out sampling inspection of Cd2 + content in the harvested medicinal materials, and carry out control management of medicinal licorice herbs.
Key words: medicinal licorice;cadmium stress;anatomical;bioconcentration factor;membership function
0 前言
甘草属(Glycyrrhiza L.)属于豆科(Leguminosae)蝶形花亚科山羊豆族,乌拉尔甘草(Glycyrrhiza uralensis)、胀果甘草(Glycyrrhiza inflata)、光果甘草(Glycyrrhiza glabra)被《中国药典2020版》作为药用甘草收录[1]。在我国,乌拉尔甘草广泛分布于西北、华北、东北;胀果甘草则主要分布于新疆,向东分布可到甘肃西北部;光果甘草仅在新疆分布[2]。在药用价值上,3种药用甘草均有抗菌、抗病毒、降血糖、调血脂等方面的作用[3]。最新研究报道[4],甘草酸制剂在抗新冠病毒感染上具有潜在的临床应用价值。3种药用甘草也有着各自独有的优势作用,乌拉尔甘草作为道地药材,是甘草药材的主要来源[5];胀果甘草耐盐性强于其他两种药用甘草,在光温条件充足的盐碱弃耕地种植时更具有优势,是盐碱地改良和防风固沙的重要药用植物[6];光甘草定是从光果甘草中提取出来的异黄酮类物质,具有抗氧化、预防色素沉着、清除自由基等生物活性,可以在高端美白化妆品中添加使用[7]。
人工种植中药材面临着有效成分含量低、农药残留、重金属和二氧化硫超标等诸多问题[8],而重金属污染是影响我国中药材安全和绿色出口的原因之一。陈雅丽等[9]对我国不同地区土壤重金属污染的来源进行分析,结果显示镉是我国东北、华北、西北地区土样中主要的重金属污染元素,药用甘草主产区存在土壤镉污染隐患。马鸣等[10]通过文献整理发现甘草、淫羊蕾、鱼腥草等中药材中存在镉含量超标问题,表明我国药用甘草安全性存在风险。中草药中镉超标不仅会通过食物链、食物网转移到人体,严重损害肝脏、肾脏、脾脏、骨骼和生殖系统[11],而且还极大地阻碍了我国中草药产业的发展。目前在人参[12]、三七[13]、黄芪[14]等药材已有关于镉影响药材生长、品质以及镉富集特征的报道,但有关药用甘草对镉胁迫的生长响应、镉耐受性差异及富集特征尚未见报道,在甘草药材重金属安全控制方面缺乏基础资料。
因此,本研究以中药材“甘草”的3种基源植物(乌拉尔甘草、胀果甘草、光果甘草)为材料,通过不同浓度的镉胁迫试验,生长指标、生物量、根解剖结构、镉离子吸收运转及分配特征分析、镉耐受性评价,探究不同药用甘草对镉的生长响应、镉耐受能力差异和镉富集特征,进而为指导药用甘草安全种植、保障药材品质和安全奠定基础。
1 材料和方法
1.1 试验材料
胀果甘草和光果甘草种子采自新疆巴楚县,乌拉尔甘草种子由石河子大学甘草研究所提供。
1.2 植物培养与处理
挑选籽粒饱满且大小一致的乌拉尔甘草、胀果甘草、光果甘草种子,用85%的H2SO4溶液浸泡处理30min,打破休眠;0.1% HgCl2消毒10 min后,再用无菌水冲洗3~5次。将种子置于蒸馏水中吸胀4 h后播种于盛有蛭石的培养钵中,播种深度1 cm,培养钵置于含14Hoagland营养液的1L水培箱中。在光照培养箱中,白天/夜晚温度为28 ℃/22 ℃,光照强度280~420 μmol·m-2·s-1,昼夜光照周期14 h/10 h[15]。培养7d后,转入12Hoagland营养液培养,待幼苗长出两片真叶时,分别用含0、50、100、150 μmol·L-1的CdCl2·2.5H2O Hoagland营养液继续培养30 d,共4个处理,每个处理10个重复,每3天换一次营养液。
1.3 测定方法
1.3.1 幼苗株高、叶片数、根长、生物量测定
镉胁迫30 d后收获,测量株高、叶片数、根长。将根用20 mmol·L-1Na2-EDTA溶液浸泡15 min,以去除附着在根表面的镉离子,然后用去离子水冲洗根3遍,滤纸吸干多余的水分;将幼苗分为叶、茎、胚轴、主根和幼根5部分,分别称鲜重后放入105℃烘箱中杀青15 min,70℃烘至恒重,称干重,计算各器官干重和为总生物量。
1.3.2 MDA含量测定
硫代巴比妥酸法测定MDA含量。
1.3.3 根解剖结构的观察
用刀片在距离根尖1 cm处向上切取0.5 cm 的根段,使用FAA固定液固定24 h以上。将固定好的根段经梯度酒精脱水、二甲苯透明、石蜡包埋后使用莱卡切片机进行切片,切片厚度为14 μm,用番红固绿双重染色法对切片进行染色,使用光学显微镜观察、拍照。用Digimizer V5.4.7软件计算根横切面面积和维管柱面积。
1.3.4 镉耐受浓度范围的确定与耐镉系数
以不同镉处理浓度为自变量,相对生物量为因变量,建立拟合曲线,以生物量下降至75%时对应镉浓度作为3种药用甘草能忍耐的最大镉浓度,以此为标准判断3种药用甘草镉耐受程度。
单项指标的耐镉系数=该项指标不同浓度处理下的平均测定值/对照组测定值。
1.3.5 镉耐受性综合评价
以不同镉胁迫程度下各指标的相对值(各指标的相对值=某镉浓度处理组值/对照组值)为镉耐受性评价值。
运用隶属函数指数进行标准化处理[16],
Uij=Xij-XiminXimax-Ximin,(1)
Uij=Ximax-XijXimax-Ximin。(2)
式中,Uij為i物种j指标的隶属函数值;Xij为i物种j指标的相对值;Ximax为所有物种中此指标的最大值;Ximin为所有物种中此指标的最小值。若所测指标与镉耐受性呈正相关,则采用式(1)计算隶属值,负相关则用式(2)。
权重的确定:采用标准差系数法,先由公式(3)计算出标准差系数Vj,再由公式(4)归一化,从而得到各项指标的权重系数Wj。
Vj=∑ni=1Xij-Xj2Xj,(3)
Wj=Vj∑nj=1Vj。(4)
综合评价值
D=∑nj=1(Uij·Wj),(5)
式中D为各供试材料的综合评价值。
1.3.6 不同器官镉离子含量的测定
称取烘干的叶、茎、胚轴、主根和幼根样品50 mg,加入10 mL体积比为9∶1均为优级纯的HNO3和浓度为30%的H2O2,置于微波消解仪中消解40 min后,将消煮管放置于仪器配套的电热板上赶酸至1~2mL,再定容至25 mL,用ICP测中Cd2+浓度。计算Cd2+富集系数、转运系数[17]。
富集系数=植物中镉含量/环境中镉含量。
转运系数=转出器官或部位镉离子含量/转入器官或部位镉离子含量。
1.4 数据处理与评价方法
采用SPSS 19.0软件对数据统计分析; 采用one-way ANOVA法对数据方差分析(P<0.05),Duncan法多重比较检验;使用Origin 2019软件进行耐镉系数与镉浓度的非线性曲线拟合法进行曲线拟合,建立拟合公式,并绘图。
2 结果与分析
2.1 镉胁迫下3种药用甘草幼苗株高、根长和叶片数目的差异
由图1可知镉胁迫抑制了胀果甘草、乌拉尔甘草和光果甘草的生长,株高降低,叶片数减少,叶色发黄。与对照相组比3种药用甘草镉处理组的株高、根长、单株叶片数量都随着镉胁迫浓度的增加而显著下降。胀果甘草各处理组株高与对照组相比分别下降了40.2%、56.0%、62.3%,根长分别下降32.3%、35.2%、40.1%,葉片数分别下降46.6%、52.8%、59.1%。乌拉尔甘草株高分别下降24.6%、32.6%、50.6%,根长分别下降24.2%、38.0%、42.0%,叶片数分别下降22.0%、37.9%、53.3%。光果甘草株高分别下降了41.2%、53.0%、55.5%,根长分别下降31.9%、40.1%、40.7%,叶片数分别下降49.6%、57.5%、62.2%。
说明镉胁迫对3种药用甘草的生长有着强烈的抑制作用,尤其是100、150 μmol·L-1的镉处理下抑制作用更强。
2.2 镉胁迫对3种药用甘草幼苗生物量的影响
3种药用甘草整株、地上部、地下部的相对生物量都随着镉浓度的增加而下降。乌拉尔甘草和光果甘草地上部分受到的抑制作用要高于地下部分,而胀果甘草地上部受到的抑制作用小于地下部分。将3种药用甘草相对生物量下降幅度进行比较后发现,乌拉尔甘草生物量下降幅度要小于其他2种药用甘草,在150 μmol·L-1时,胀果甘草整株生物量相比于对照组下降73.1%,乌拉尔甘草下降68.0%,光果甘草下降80.4%(图2)。
2.3 镉胁迫下3种药用甘草幼苗丙二醛含量的变化
不同浓度镉胁迫显著影响3种药用甘草根系中MDA的含量(P<0.05)。随着镉处理浓度的增加,MDA含量均呈上升趋势(图3),由此可知,镉胁迫加剧了药用甘草膜脂过氧化程度。将各处理组与对照组相比,胀果甘草MDA含量分别增长了78.06%、149.01%、160.95%;乌拉尔甘草分别增长了29.39%、57.41%、109.27%;光果甘草分别增长了72.10%、132.45%、180.06%。
2.4 镉胁迫下根解剖结构的变化
如图4A—L所示,镉胁迫对3种药用甘草根组织和细胞形态无显著影响,结构完整,未出现细胞破损现象,但对根总面积、皮层面积、维管柱面积进行测定,发现胀果甘草和乌拉尔甘草根总面积在50 μmol·L-1浓度下与对照组无显著性差异,在100 μmol·L-1和150 μmol·L-1时显著低于对照组,而光果甘草根总面积从50 μmol·L-1时就已经显著小于对照组。
胀果甘草各处理组比对照组根总面积分别下降10.67%、38.99%、55.17%,乌拉尔甘草分别下降19.68%、32.64%、40.52%,光果甘草分别下降26.34%、66.67%、72.14%(图4M),说明镉处理会抑制根的横向生长,且光果甘草相比于胀果甘草和乌拉尔甘草更容易受到镉胁迫的影响。由图4N可知,随着镉浓度的增加,3种药用甘草皮层面积均显著下降,胀果甘草各处理组比对照组根皮层面积分别下降10.91%、39.74%、55.75%,乌拉尔甘草分别下降20.05%、33.47%、41.58%,光果甘草分别下降27.73%、66.83%、72.30%(图4M)。随着镉浓度的增加,胀果甘草和乌拉尔甘草维管柱面积占根总面积比例逐渐增大,在100 μmol·L-1和150 μmol·L-1时显著高于对照组,而光果甘草在50 μmol·L-1浓度下显著高于对照组,此后占比迅速下降,但仍高于对照组,说明高浓度的镉处理促进了3中药用甘草根维管组织的发育。
2.5 镉耐受浓度范围的确定与耐镉系数
本研究以生物量下降到75% 时的镉浓度作为适宜3种药用甘草生长的最高阈值。根据镉浓度与相对生物量的拟合方程可以得出, 适宜3种药用甘草生长的最高镉浓度分别为8.56 μmol·L-1、18.16 μmol·L-1、2.55 μmol·L-1 (图5)。
由表1,以株高为指标的耐镉系数由大到小顺序为乌拉尔甘草、光果甘草、胀果甘草,但以叶片数、根长、生物量为指标的耐镉系数由大到小顺序为乌拉尔甘草、胀果甘草、光果甘草;且同一种药用甘草不同指标下的耐镉系数之间也存在差异。因此,基于单一指标的耐镉系数对药用甘草的耐镉性进行评价由局限性,应运用多项指标进行综合评价。
2.6 3种药用甘草耐镉性综合评价
采用标准差系数赋予权重法,计算3种药用甘草幼苗的综合评价D值(表2),根据各个药用甘草的D值结果可以看出,3种药用甘草中乌拉尔甘草的综合评价最优,其次是胀果甘草,最后是光果甘草。由此可以推断3种药用甘草的镉耐受能力为乌拉尔甘草>胀果甘草>光果甘草。
2.7 Cd2+在3种药用甘草不同部位富集特征
随着镉胁迫浓度的增加,3种药用甘草幼苗地上部的Cd2+含量显著上升,而地下部则呈现先上升后下降的趋势,且3种药用甘草幼苗地下部分Cd2+含量均大于地上部分(表3)。进一步对地下部分胚轴、主根、幼根各部位的Cd2+含量的分析表明(图6A),3种药用甘草幼苗的幼根中Cd2+含量最大,其次是主根,最后是胚轴。随着镉浓度的增加,3种药用甘草幼苗幼根中的Cd2+含量均呈现先上升后下降的趋势;在胚轴和主根中,脹果甘草和乌拉尔甘草Cd2+含量呈现上升趋势,而光果甘草各处理组之间Cd2+含量无显著性差异。Cd2+含量代表单位重量内所含有的Cd2+量,而镉离子积累量则可以表示植株中所含有的镉离子的绝对值,通过计算,计算出了平均每株药用甘草幼苗地上部和地下部所含有的镉离子积累量(图6B),结果显示3种药用甘草幼苗都在根部积累了大量的镉离子。
随着Cd2+浓度的上升,3种药用甘草对Cd2+的富集系数均表现为先上升后下降,说明3种药用甘草对50 μmol·L-1和100 μmol·L-1Cd污染环境的富集效应大于150 μmol·L-1的Cd污染环境。通过对3种药用甘草的富集系数进行比较可以发现,胀果甘草和乌拉尔甘草对Cd2+的富集能力基本相同,且均大于光果甘草。
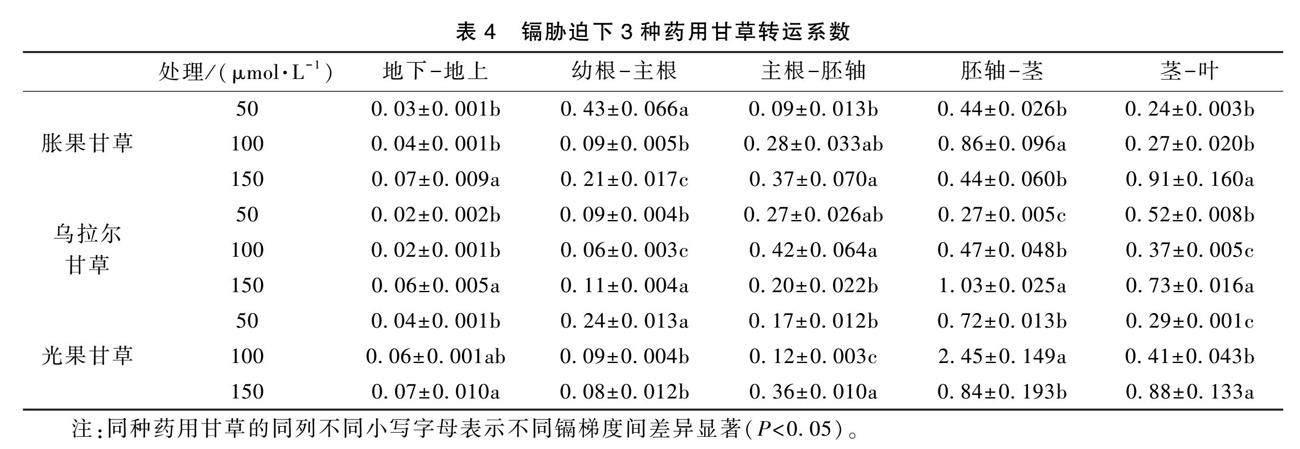
2.8 镉胁迫下3种药用甘草幼苗对Cd2+的转运系数
随着Cd2+浓度的上升,3种药用甘草幼苗的地下-地上转运系数均呈现出上升趋势,但50 μmol·L-1和100 μmol·L-1时转移系数不具有显著性差异,当浓度上升至150 μmol·L-1时显著上升(表4),这说明Cd2+浓度升高促进根部将更多Cd2+的向地上部分运输。对各器官之间进行转运系数的计算后发现,3种药用甘草幼苗地上各器官之间(胚轴-茎、茎-叶)的转运系数均大于地下部各器官之间(主根-胚轴、幼根-主根)的转运系数。乌拉尔甘草的转运系数小于其他2种药用甘草,说明乌拉尔甘草对Cd2+的转运能力较弱。
3 讨论与结论
3.1 3种药用甘草幼苗对镉胁迫的生长响应
重金属镉是植物生长发育的非必需元素,具有强烈的毒性,往往低浓度的镉处理后就会影响植物的生长发育[18]。生长指标的变化是植物对镉胁迫的综合体现,本试验中3种药用甘草的株高、根长、叶片数量和干重均随着镉胁迫浓度的升高,呈现逐渐降低的趋势(图1),表明镉处理抑制了3种药用甘草的生长,这与任红菲等[12]对人参的研究结果一致。但通过解剖结构观察,镉处理后3种药用甘草根部未出现细胞解离现象,细胞形态完整(图5A—L),说明3种药用甘草均具有一定的耐镉性。
膜脂过氧化最终分解产物是MDA,其含量越高说明膜脂过氧化程度越高,膜受到的损伤越大[19]。
植物在受到重金属胁迫时,会导致活性氧积累,损伤细胞膜,致使膜脂过氧化产物的增加,从而导致MDA含量上升[20]。本研究中,相比对照组,3种药用甘草镉处理组根中MDA含量均显著上升,说明镉处理加剧了甘草根的氧化胁迫。比较3种药用甘草MDA含量的增加倍数,乌拉尔甘草根中MDA含量增长量最小,说明乌拉尔甘草受到的氧化胁迫要低于其他2种药用甘草。
根对镉吸收和运输,主要通过根的表皮、皮层,到达维管柱,再通过木质部导管向上运输[21],因此,镉胁迫下根皮层和维管组织结构的变化会影响镉离子的积累和转运。本研究结果表明,随着镉浓度的增加,根皮层面积显著减少,乌拉尔甘草根受影响程度最小,其次是胀果甘草,光果甘草受影响程度最大。相关研究表明[22],在镉处理后,植物吸收的Cd主要在细胞壁和液泡中沉积浓缩,本研究中,在相同镉浓度处理下,根皮层面积越大,根中Cd2+含量也越高(图7),这可能与皮层薄壁细胞对镉的储存和滞留有关,根皮层越厚,储存Cd2+的空间越大,有助于将Cd2+隔离在地下部,使地上部的幼嫩组织免受重金属的毒害。在镉浓度为150μmol·L-1时,相比于其他2种药用甘草,乌拉尔甘草根皮层面积最大,镉积累量最多,体现了其镉耐受性较强的特性。另外,相关研究表明[23],根薄壁细胞也是甘草酸和黄酮类物质积累的部位,皮层面积和薄壁细胞减少也会影响药用甘草根中甘草酸、黄酮等次生代谢物质的贮存,从而影响药用甘草的药用品质。因此,镉胁迫下,维持根皮层面积也有助于保障药用甘草的品质,乌拉尔甘草显然优于其他2种药用甘草。维管柱是输导组织,维管柱面积占根总面积的比例上升,能够加强根向上运输植物生长所必须的水和矿质元素的能力。本研究发现,镉处理后,乌拉尔甘草根部维管柱面积占根总面积百分比值上升最多,其次是胀果甘草,光果甘草上升最少,表明乌拉尔甘草在镉胁迫下,根具有更积极的响应和更强的维持水和矿质元素运输的能力。
3.2 3种药用甘草幼苗的耐镉阈值与镉耐受性评价
陆嘉惠[23]以生物量下降到75% 时的盐浓度作为适宜胀果甘草幼苗生长的最高阈值,找出了适宜胀果甘草生长的最高盐浓度,此耐盐适宜范围在生产上具有较大的实践意义。因此本研究以生物量下降到75%时的镉浓度作为药用甘草镉适应生长的最高阈值。根据相对生物量与镉处理浓度拟合方程确定适应生长的最高镉浓度值,胀果甘草为12.462 μmol·L-1、乌拉尔甘草为14.715 μmol·L-1、光果甘草为1.952 μmol·L-1。该值可为药用甘草种植土壤镉含量的阈值确定和安全性评价提供参考。张杨杨等[24]研究发现,在10 mg·kg-1即43.79μmol·L-1镉处理下,紫花苜蓿的生物量与对照组无显著性差异,百脉根的生物量显著高于对照组,说明紫花苜蓿和百脉根的镉耐受性阈值要远大于药用甘草,即3种药用甘草的镉耐受性弱于紫花苜蓿和百脉根。
耐镉系数可以评价植物对镉的耐受性,但单一指标耐镉系数评价具有局限性。本研究中,以株高为指标时的耐镉系数大小关系为乌拉尔甘草>光果甘草>胀果甘草,而其他指标下的耐镉系数大小关系为乌拉尔甘草>胀果甘草>光果甘草,因此用耐镉系数去评价具有片面性。为了准确、客观地评价3种药用甘草的耐镉能力,本研究运用标准差系数赋予权重法对株高、根长、叶片数和干重进行镉受耐性综合评价,得出3种药用甘草幼苗中镉耐受性最强的是乌拉尔甘草,其次是胀果甘草,光果甘草镉耐受性最弱。
3.3 3种药用甘草幼苗不同营养器官对镉的富集特征
李子唯等[13]对镉胁迫下三七的生理响应和富集特性进行了研究,结果显示在土壤镉浓度为10 μmol·L-1时须根镉富集系数就已经达到50.22,马月花等[14]对黄芪镉胁迫的生理响应机制进行研究,当镉处理浓度为50 μmol·L-1时,经计算富集系数约为37.38,而本研究同镉浓度处理下即50μmol·L-1时,胀果甘草富集系数为2.737,乌拉尔甘草为3.100,光果甘草为3.488,远小于三七、黄芪的富集系数,说明与三七、黄芪相比,药用甘草对镉的富集能力较弱,这为药用甘草土壤镉污染治理和安全控制提供了可能。
根作为药用甘草主要的药用部位,根据《中华人民共和国国家标准GB/T 19618—2004》要求[25],药材中Cd含量不得超过0.2 μg·g-1,李伟等[26]对土壤平均镉含量为0.15 mg·kg-1的内蒙古正蓝旗地区采集的野生药用甘草样本进行重金属含量检测时发现,根中的镉含量为0.48 mg·kg-1,是此标准的2.4倍。本研究中,胀果甘草根中镉含量是此标准的19~33倍,乌拉尔甘草是19~95倍,光果甘草是27~35倍,说明即使在较低浓度镉含量的土壤中种植药用甘草,也存在根镉含量超标问题,保障药材的安全性,避免镉污染风险,是甘草产业未来发展要解决的重要问题。
叶片是药用甘草收获后的副产物,近年来的研究表明,药用甘草地上部也富含黄酮类化合物和茶多酚等多种物质[27],黄酮类化合物能够抑制多种癌细胞的活性,也能够作为天然抗菌剂[28],有着极大的需求量。茶多酚是茶叶中含有的多羟基酚类化合物,具有抗氧化、抗衰老、清除自由基、降低血脂等作用[29]。本研究中,3种药用甘草在镉浓度为50~150μmol·L-1时,镉由地下-地上的转运系数为0.018~0.071,远小于1。说明药用甘草根吸收的Cd2+向地上部转运少。其转运系数也远小于三七0.026(10μmol·L-1)[21]和黄芪0.055~0.157(25~200μmol·L-1)[22],这为以药用甘草叶为原材料制作甘草茶等提供可能性和安全性保障。
综上所述,镉处理抑制了3种药用甘草幼苗根和叶片的生长发育,导致药用甘草产量大幅下降;3种药用甘草镉耐受性存在差异,表现为乌拉尔甘草>胀果甘草>光果甘草;3种药用甘草幼苗镉富集系数大于1,但转运系数远小于1,镉主要积累在根部,对药材根的安全性影響较大。因此,应关注野生甘草采挖和人工栽培地的土壤镉监测,以保证甘草药材生产的安全性;同时也应重视药材Cd2+含量的抽检,进行甘草药材的安全性控制管理。
参考文献(References)
[1] 国家药典委员会. 中华人民共和国药典[S]. 北京:中国医学科学出版社, 2020: 1088.
[2] 李学禹, 陆嘉惠, 阎平, 等. 甘草属(Glycyrrhiza L.)分类系统与实验生物学研究[M].上海:复旦大学出版社, 2015:3-50.
[3] 李娜,张晨,钟赣生, 等.不同品种甘草化学成分、药理作用的研究进展及质量标志物(Q-Marker)预测分析[J].中草药,2021,52(24):7680-7692.
LI N, ZHANG C, ZHONG G S, et al.Research progress on chemical constituents and pharmacological effects of different varieties of Glycyrrhizae Radix et Rhizoma and predictive analysis of quality markers[J].Chinese Traditional and Herbal Drugs, 2021,52(24):7680-7692.
[4] 林少梅,万金玉,廖婉婷, 等.基于网络药理学的甘草酸二铵干预新型冠状病毒肺炎机制研究[J].中国处方药,2021,19(9):6-9.
LIN S M, WAN J Y, LIAO W T, et al. Study on mechanism of diammonium glycyrhizinate intervention in novel coronavirus pneumonia based on network pharmacology[J]. Journal of China Prescription Drug, 2021, 19(9):6-9.
[5] 张晨,李娜,钟赣生, 等.十八反中甘草物种的本草考证[J].中草药, 2021, 52(20):6425-6430.
ZHANG C, LI N, ZHONG G S, et al. A textual study on varieties of licorice in "eighteen antagonisms"[J].Chinese Traditional and Herbal Drugs, 2021, 52(20):6425-6430.
[6] 陆嘉惠,吕新,吴玲,等.三种药用甘草种子对盐渍环境的萌发响应及其适宜生态种植区[J].草业学报, 2013, 22(2):195-202.
LU J H, LYU X, WU L, et al. Germination responses of three medicinal licorices to saline environments and their suitable ecological regions[J]. Acta Prataculturae Sinica, 2013, 22(2):195-202.
[7] LANERI S. The new challenge of green cosmetics: natural food ingredients for cosmetic formulations[J]. Molecules, 2021, 26(13):3921.
[8] 王春丽,高月红,黄瑶庆等.中国中药行业格局及未来展望[J]. 中国新药杂志, 2020, 29(16):1845-1850.
WANG C L, GAO Y H, HUANG Y Q, et al. Current situation and future prospect of traditional Chinese medicine industry[J].Chinese Journal of New Drugs, 2020, 29(16):1845-1850.
[9] 陈雅丽, 翁莉萍, 马杰, 等. 近十年中国土壤重金属污染源解析研究进展[J]. 农业环境科学学报, 2019, 38(10): 2219-2238.
CHEN Y L, WENG L P, MA J, et al. Review on the last ten years of research on source identification of heavy metal pollution in soils[J]. Journal of Agro-Environment Science, 2019, 38(10): 2219-2238.
[10] 马鸣, 卢建中. 中药材中重金属含量超标的现状调研[J]. 中国中医药咨讯, 2010, 2(34): 9-10.
MA M, LU J Z. Investigation on the current situation of excessive heavy metal content in traditional Chinese medicine[J]. Journal of China Traditional Chinese Medicine Information, 2010, 2(34): 9-10.
[11] 朱美霖,朱新忠,冯宁川.重金属在甘草中的健康风险评估及限量浓度测定[J].中成药, 2016, 38(8):1771-1776.
ZHU M L, ZHU X Z, FENG N C. Evaluation of health risks and determination of limited concentrations of heavy metals in Glycyrrhizae Radix et Rhizoma[J].Chinese Traditional Patent Medicine, 2016, 38(8):1771-1776.
[12] 任紅菲, 梁尧, 姜晓莉, 等. 人参生长与生理特性对镉胁迫的响应[J]. 中草药, 2016, 47(4): 661-665.
REN H F, LIANG R, JIANG X L, et al. Effects of cadmium stress on growth and physiological characteristics of Panax ginseng[J]. Chinese Traditional and Herbal Drugs, 2016, 47(4): 661-665.
[13] 李子唯, 杨野, 崔秀明,等. 三七对镉胁迫的生理响应及富集特性研究[J]. 中国中药杂志, 2015, 40(15):2903-2908.
LI Z W, YANG Y, CUI X M, et al. Physiological response and bioaccumulation of Panax notoginseng to cadmium under hydroponic[J]. China Journal of Chinese Materia Medica, 2015, 40(15):2903-2908.
[14] 马月花, 郭晓瑞, 杨楠,等. 黄芪幼苗对镉胁迫的生理响应机制[J]. 植物研究, 2019, 39(4):497-504.
MA Y H, GUO X R, YANG N, et al. Physiological mechanisms in Astragalus membranaceus seedlings responding to cadmium stress[J]. Bulletin of Botanical Research, 2019, 39(4):497-504.
[15] 陆嘉惠,吕新,梁永超,等.新疆胀果甘草幼苗耐盐性及对NaCl胁迫的离子响应[J].植物生态学报, 2013, 37(9):839-850.
LU J H, LYU X, LIANG Y C, et al. Salt tolerance of Glycyrrhiza inflata seedlings in Xinjiang and its ion response to salt stress[J].Chinese Journal of Plant Ecology, 2013, 37(9):839-850.
[16] 周福平, 史红梅, 张海燕, 等. 应用模糊隶属函数法对高粱种质资源的农艺性状和品质性状进行综合评价[J]. 种子, 2022, 41(1): 94-98.
ZHOU F P, SHI H M, ZHANG H Y, et al. Comprehensive evaluation of agronomic and qualitative traits of sorghum germplasm resources based on fuzzy membership function method[J]. Seed, 2022, 41(1): 94-98.
[17] 严莲英, 范成五, 刘桂华, 等. 阿哈水库底泥基质中3种绿化植物的生长及Cd的富集特征[J]. 草业学报, 2019, 28(4):203-212.
YAN L Y, FAN C W, LIU G H, et al. Growth and Cd accumulation characteristics of three representative plant species in artificial soils incorporating sediment substrate of the Aha Reservoir[J]. Acta Prataculturae Sinica, 2019, 28(4):203-212.
[18] SARASWAT S, RAI J P N. Phytoextraction potential of six plant species grown in multimetal contaminated soil[J]. Chemistry and Ecology, 2009, 25(1):1-11.
[19] ABEED A H A, SALAMA F M. Attenuating effect of an extract of Cd-Hyperaccumulator Solanum nigrum on the growth and physio-chemical changes of Datura Innoxia under Cd stress[J]. Journal of Soil Science and Plant Nutrition, 2022, 22:4868-4882.
[20] 林琳,旦增卓嘎,吴玲玲.铅、镉单一及复合胁迫对生菜幼苗抗氧化酶及亚细胞结构的毒性效应[J].生态毒理学报,2022,17(2):337-348.
LIN L, TENZIN D, WU L L. Toxicity of single and combined Pb and Cd stress on antioxidant enzymes and subcellular structure of lettuce[J].Asian Journal of Ecotoxicology, 2022, 17(2):337-348.
[21] ZHANG D Z, ZHOU H, SHAO L L, et al. Root characteristics critical for cadmium tolerance and reduced accumulation in wheat (Triticum aestivum L.)[J]. Journal of Environmental Management, 2022, 305:114365.
[22] WEI W, PENG H, XIE Y H, et al. The role of silicon in cadmium alleviation by rice root cell wall retention and vacuole compartmentalization under different durations of Cd exposure[J]. Ecotoxicology and environmental safety,2021, 226:112810.
[23] 陆嘉惠. 三种药用甘草耐盐性及耐盐机制研究[D].石河子:石河子大学,2014.
[24] 张杨杨,李希铭,高鹏, 等. 不同浓度镉胁迫下6种草本植物的耐性及富集特征的比较[J].草地学报, 2021, 29(6):1265-1276.
ZHANG Y Y, LI X M, GAO P, et al. Comparison of tolerance and enrichment characteristic for six herbaceous plant under different levels Cd stress[J].Acta Agrestia Sinica, 2021, 29(6):1265-1276.
[25] 国家质量监督检验检疫总局. 甘草:GB/T 19618—2004[S]. 北京:中国标准出版社, 2004: 4.
[26] 李伟, 陈贵林, 于倩, 等. 内蒙古不同产地甘草和土壤中重金属含量与评价[J]. 内蒙古大学学报(自然科学版), 2014, 45(6): 661-669.
LI W, CHEN G L, YU Q, et al. Heavy metal contents and evaluation of soil and root of Glycyrrhiza Uralensis Fisch.in different producing regions in inner mongolia[J]. Journal of Inner Mongolia University(Natural Science Edition), 2014, 45(6): 661-669.
[27] YI D, ZHAO M, ZHAO T, et al. Bioactive profiles, antioxidant activities, nitrite scavenging capacities and protective effects on H2O2-injured PC12 cells of Glycyrrhiza Glabra L. leaf and root extracts[J]. Molecules, 2014, 19(7):9101-9113.
[28] ZHANG Z, YANG L, HOU J, et al. Molecular mechanisms underlying the anticancer activities of licorice flavonoids[J]. Journal of Ethnopharmacology, 2021, 267:113635.
[29] 周方,歐阳建,黄建安, 等.茶多酚对肠道微生物的调节作用研究进展[J].茶叶科学,2019,39(6):619-630,616.
ZHOU F, OU Y J, HUANG J A, et al. Advances in research on the regulation of tea polyphenols and effects on intestinal flora[J].Journal of Tea Science, 2019, 39(6):619-630,616.
(责任编辑:编辑郭芸婕)
