光激活大鼠中脑腹侧被盖核投射至臂旁核多巴胺能通路促进全麻苏醒
2024-05-20贾磊习羽殷洁婷殷姜文李燕
贾磊 习羽 殷洁婷 殷姜文 李燕
摘要:目的 本研究通过光遗传学技术特异性激活雄性Sprague-Dawley(SD)大鼠中脑腹侧被盖核投射至臂旁核多巴胺能通路(VTADA-PBN),探究该通路在丙泊酚麻醉苏醒中的作用。方法 将32只雄性SD大鼠随机分为ChR2+Light on组、ChR2+Light off组、mCherry+Light on组和mCherry+Light off组,每组8只。各组大鼠经尾静脉以11 mg·kg-1剂量进行丙泊酚麻醉诱导,以48 mg·kg-1·h-1剂量麻醉维持30 min,记录翻正反射消失(LORR)和翻正反射恢复(RORR)时间;通过免疫荧光染色验证病毒注射部位;通过在体脑电(EEG)记录麻醉诱导和苏醒期间的皮层脑电变化。结果 光遗传学激活VTADA-PBN通路,LORR时间无统计学差异(P>0.05),RORR时间缩短(P<0.001);与mCherry组相比,ChR2组VTA中c-Fos蛋白表达明显更高(P<0.001);EEG结果显示:RORR期间,光激活组β波功率百分比高于光对照组(P<0.05),而δ波功率百分比低于光对照组(P<0.01)。結论 VTADA-PBN通路参与调控丙泊酚麻醉苏醒阶段,激活这一通路起到促觉醒作用。
关键词:中脑腹侧被盖核;臂旁核;多巴胺;丙泊酚;光遗传学
中图分类号:中图分类号R614.1文献标志码:A文献标识码
Optogenetic activation of dopaminergic neurons in the ventral tegmental area facilitates general anesthesia via projections to the parabrachial nucleus
in Rats
JIA Lei1,2,XI Yu1,2,YIN Jieting1,2,YIN Jiangwen1,2,LI Yan1,2*
(1 The First Affiliated Hospital/NHC Key Laboratory of Prevention and Treatment of Central Asia High
Incidence Diseases, Shihezi University,
Shihezi,Xingjiang 832000, China; 2 Ministry of Education Key Laboratory of Xinjiang Endemic and
Ethnic Disease, Shihezi University, Shihezi,Xinjiang 832000, China)
Abstract: Objectives In this study, we specifically activated the dopaminergic pathway from the ventral tegmental nucleus projecting to the parabrachial nucleus (VTADA-PBN) in the midbrain of male Sprague-Dawley rats by optogenetic techniques to investigate the role of the pathway in the emergence from propofol anesthesia. Methods 32 male SD rats were randomly divided into ChR2+Light on group, ChR2+Light off group, mCherry+Light on group and mCherry+Light off group, with 8 rats in each group. Rats in each group were induced with propofol anesthesia at a dose of 11 mg·kg-1 via the tail vein, and anesthesia was maintained at a dose of 48 mg·kg-1·h-1 for 30 min, and the time of loss of righting reflex and recovery of the righting reflex were recorded. Immunofluorescence verified viral injection sites. The electroencephalogram (EEG) was used to record the changes of during induction and recovery of anesthesia. Results Optogenetic activation of the VTADA-PBN pathway showed no statistically significant difference in LORR time (P>0.05) and a shortened RORR time (P<0.001). Compared with the mCherry group, c-Fos expression was significantly higher in the VTA of the ChR2 group (P<0.001); The EEG results showed that the percentage of β-wave power was higher in the light-activated group than in the light-control group during RORR (P<0.05), while the percentage of δ-wave power was lower than in the light-control group (P<0.01). Conclusion The VTADA-PBN pathway are involved in the regulation of the emergence stage of propofol anesthesia, and activation of this pathway may play a pro-arousal role.
Key words: ventral tegmental area;parabrachial nucleus;dopamine;propofol;optogenetic
全身麻醉自應用于临床以来,麻醉患者的苏醒方式还未发生过根本性改变,目前尚无有效方法主动逆转全麻苏醒。研究表明,控制觉醒的大脑区域参与调控全身麻醉[1],激活脑内的促觉醒核团,能够缩短全身麻醉苏醒时间[2-3]。此外,不同的觉醒区域通过神经元的投射和连接形成复杂的神经环路[4],从而实现麻醉状态的逆转及意识的恢复[5-6]。
中脑腹侧被盖核(VTA)的多巴胺(DA)能神经元参与调控生理性睡眠—觉醒的作用已被证实[7]。近年来的研究表明,VTA DA能神经元对全麻苏醒具有促进作用[8-9]。此外,VTA投射至下游核团形成的神经环路亦调控全身麻醉。据报道,通过光遗传学和化学遗传学特异性激活VTA投射到伏隔核的DA能神经元,延长麻醉诱导时间并促进麻醉苏醒,抑制这一通路则产生相反的作用[10]。此外,激活VTA投射至前边缘皮层DA能通路,能够延长大鼠七氟醚麻醉的诱导时间,并缩短苏醒时间[11]。
臂旁核(PBN)是促进和维持觉醒的关键核团,在产生和维持脑电(EEG)觉醒和行为觉醒方面发挥不可或缺的作用[12-13]。有研究通过荧光示踪技术发现,VTA和PBN之间形成相互投射[14]。通过病毒示踪技术研究发现,VTA 多巴胺能神经元的轴突末梢在PBN内高密度表达,VTA投射到PBN的神经元约50%是DA能的,通过光遗传学操纵VTA投射到PBN的DA能神经元能抑制进食相关行为[15]。本研究通过光遗传学特异性激活VTA投射至PBN的 DA能通路(VTADA-PBN),结合翻正反射行为学实验、c-Fos免疫荧光染色及在体脑电记录探究VTADA-PBN通路在丙泊酚麻醉中的作用。
1 材料与方法
1.1 实验动物及分组
280~320g雄性SD大鼠购于济南朋悦实验动物繁育有限公司,许可证编号:SCXK(鲁)20190003。大鼠安置在石河子大学动物实验室中心分部管理的动物饲养中心,光/暗周期为12 h,环境温度为(23±2)℃,相对湿度为(55%±2%),随意获取食物和水。所有实验程序经由石河子大学动物伦理委员会批准(编号:A2018-025-01)。为观察VTADA-PBN通路在丙泊酚麻醉中的作用及光刺激影响,将32只大鼠随机分为4组:光激活组(ChR2+Light on组)和光激活对照组(ChR2+Light off组),病毒对照组(mCherry+Light on组和mCherry+Light off组),每组各8只。
1.2 实验试剂
丙泊酚注射液购自Fresenius Kabi Austria GmbH (Graz, Austria) 兔抗酪氨酸羟化酶抗体、小鼠抗c-Fos抗体购自Abcam公司(批号:#ab137869,#ab302667)。二级抗体为与Alexa 488偶联的山羊抗兔抗体、山羊抗小鼠抗体购于北京中杉金桥有限公司(批号:ZF-0511,ZF-0512)。
1.3 脑立体定位病毒注射
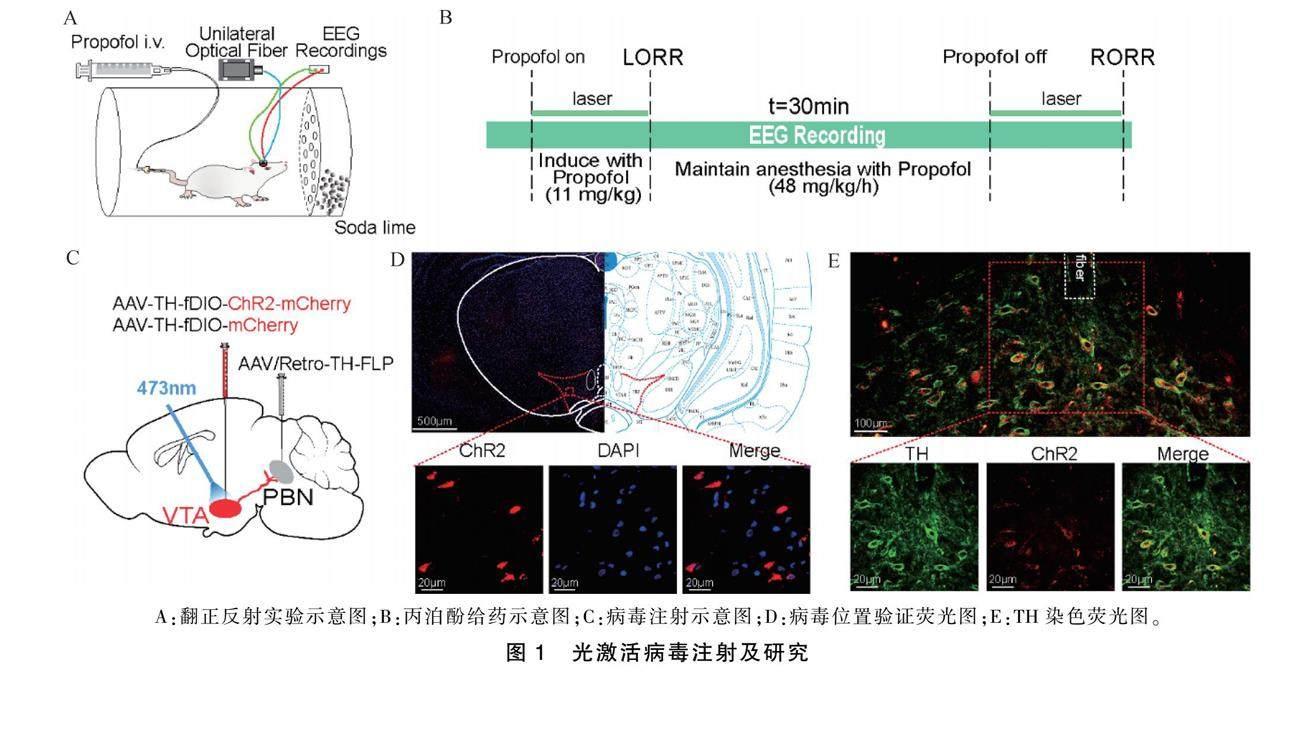
使用2%戊巴比妥钠进行麻醉,按照50 mg·kg-1剂量对大鼠进行腹腔注射麻醉。待大鼠意识消失后,固定于脑立体定位仪。头皮下注入1%利多卡因进行局部浸润麻醉后剪开头皮,暴露颅骨表面并进行调平,使前后囟门处于同一水平面,高度差小于0.03 mm。根据第五版大鼠脑图谱《The Rat Brain in Stereotaxic Coordinates》确定VTA(前后-5.0 mm,左右±0.9 mm,深度-8.3 mm)和PBN(前后-8.9 mm,左右±1.9 mm,深度-6.8 mm)的注射位点。用颅骨钻在相应核团位点的颅骨表面钻孔,挑破硬脑膜暴露脑组织。
将500 nL rAAV2/9-TH-DIO-hChR2-mCherry-WPRE或rAAV2/9-TH-DIO-mCherry-WPRE注射到单侧VTA,将500 nL逆行腺相关病毒rAAV2/Retro-TH-Cre-WPRE注射到同侧PBN。注射速度为80 nL·min-1,注射完毕后针尖停留10 min,药物充分扩散后缓慢退针。病毒转染3周后行在体脑电电极植入。
1.4 EEG电极植入
使用2%戊巴比妥钠(50 mg·kg-1)腹腔麻醉后,用颅骨钻在大鼠颅骨表面钻孔,植入四颗连有导丝的脑电螺钉,用于连接脑电电极监测脑电信号。EEG螺钉分布位置:两颗螺钉植于前额叶位置上方,Bergma点向前3.9 mm,左右相距2 mm。另外两颗螺钉植于Bergma点向后4 mm,相互间隔5 mm。然后将大鼠电极放置颅骨表面,电极底座上的四根导丝与螺钉上的导丝相连,四组导丝互不接触。通过牙科丙烯酸树脂(牙科水泥)将颅骨、螺钉和脑电电极固定在一起。实验后,连续3 d肌注青霉素20 U减少感染。植入脑电电极大鼠单独饲养1周后,尾静脉置管进行翻正反射实验。进行脑电电极植入的同时,在VTA上方100 μm处放置陶瓷插芯。
1.5 翻正反射实验
各组大鼠以11 mg·kg-1丙泊酚尾静脉泵入,将开始给药到大鼠处于四肢向上且无法主动恢复正常姿势的这段时间,记为LORR,代表麻醉诱导时间;为评估翻正反射恢复时间,持续尾静脉泵入丙泊酚(48 mg·kg-1·h-1)30 min,确保大鼠处于足够的麻醉深度。停药后到大鼠自主恢复俯卧位并四肢着地的这段时间,记为RORR,代表麻醉苏醒时间。在LORR和RORR期间,为了评估翻正反射,每15 s将行为箱翻转90°,并全程记录脑电信号。
1.6 光遗传学实验
病毒转染3周后植入EEG电极和陶瓷插芯。翻正反射实验前连接脑电前置信号放大器,将光纤跳线一边和植入的插芯通过套管相连,另一边连接473 nm蓝光激发器。使用蓝光激发器对VTADA-PBN通路进行光刺激。使用AFG1022波形发生器设置激光脉冲参数。通过功率计测试光纤尖端光强度,校正为10~15 mW。麻醉诱导期和苏醒期,应用473 nm蓝光(频率20 Hz、波宽10 ms)对大鼠进行光激活。记录LORR和RORR时间及脑电信号。
1.7 免疫荧光实验
行为学实验结束后光激活各组大鼠VTA区15 分钟后,灌注取脑,冰冻切片。冰冻脑组织用Triton X-100渗透(0.2%, 3 min)。在37℃下用10% BSA封闭1 h。然后滴加一级抗体(anti-c-Fos antibody, 1∶250; anti-tyrosine hydroxylase antibody)并在4℃过夜。PBS漂洗3次后,滴加对应二级抗体(goat anti-rabbit conjugated to Alexa 488, goat anti-Mouse conjugated to Alexa 488, 1∶75 dilution, ZSGO-BIO, China),室温下避光孵育2 h。PBS再次漂洗后,切片用0.5μg·mL-1 DAPI标记细胞核后,用抗荧光衰减封片剂封片,荧光显微镜下观察。
1.8 EEG记录及分析
整个实验过程中,使用Pinnacle 8200(Pinnacle Technology,USA)记录系统采集脑电图信号,采样率为400Hz,并用MATLAB 2016a(MathWorks,Cambridge,UK)对麻醉诱导期和苏醒期的数据进行功率谱分析,使用Lunion Stage系统绘制脑电时频图(http://www.luniondata.com, Shanghai, China)。滤除50 Hz工频干扰,分离出0.25~60Hz数据进行分析。通过平均每个频带频率范围内的信号功率(δ: 0.25~4 Hz, θ: 4~8 Hz, α: 8~13 Hz, β: 13~25 Hz, γ: 25~60 Hz),除以0.25~60 Hz的总功率,计算出不同频带的功率百分比。
1.9 统计学分析
使用Graphpad prism 8.0进行统计分析。所有数据均经过正态性检验。分析组间c-Fos蛋白表达的比较采用非配对t检验。LORR和RORR时间的比较采用单因素方差分析。EEG频带百分比差异的比较采用双因素方差分析,并进行Bonferroni检验。数据表示为均数±标准差,认为P<0.05具有统计学差异。
2 結果
2.1 光激活病毒的表达及验证
光激活病毒的表达及验证见图1。
在雄性SD大鼠的上游核团VTA中单侧注射含有ChR2的重组腺相关病毒,在下游核团PBN中同侧注射特异性标记多巴胺能神经元的逆行示踪病毒。下游FLP元件逆行至VTA中与fDIO结合后,使得病毒标记的多巴胺能神经元带有mCherry红色荧光。通过免疫荧光实验验证病毒表达位置,TH染色证实VTA中被转染的神经元是多巴胺能神经元(图1)。
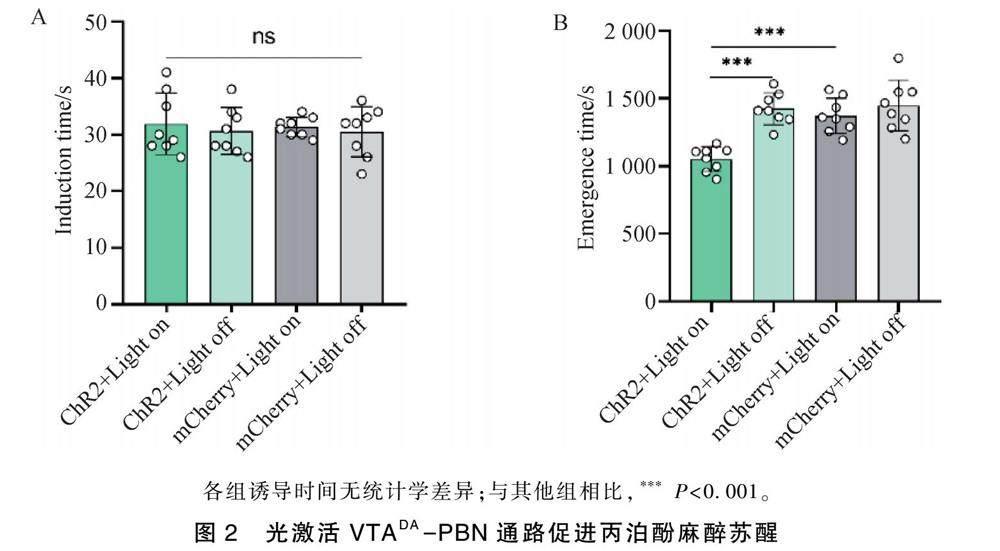
2.2 光激活VTADA-PBN通路引起丙泊酚麻醉苏醒时间缩短
翻正反射行为学实验结果显示各组间丙泊酚麻醉诱导时间无统计学差异(ChR2+Light on vs ChR2+Light off:31.88±5.44 s vs 30.63±4.14 s,P=0.9305,n =8;ChR2+Light on vs mCherry+Light on:31.88 ± 5.44 s vs 31.38±1.69 s,P=0.9305,n=8)。
翻正反射行为学实验结果显示丙泊酚麻醉苏醒时间明显缩短(ChR2+Light on vs ChR2+Light off:1052.0±91.02 s vs 1423.0±117.46 s,P<0.0001,n =8;ChR2+Light on vs mCherry+Light on:1052.0±91.02 s vs 1372.0±129.74 s,P=0.0003,n =8)(图2)。
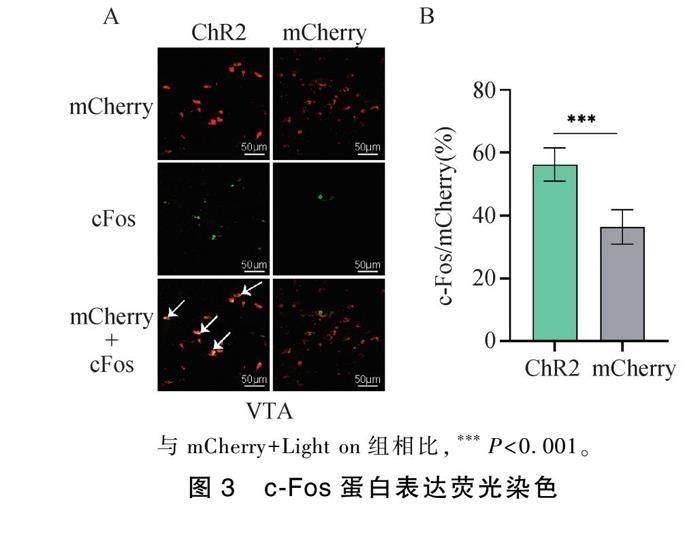
2.3 VTA区c-Fos蛋白表达
c-Fos蛋白在被刺激后能够快速诱导表达,代表神经元被激活的标志。VTA中c-Fos蛋白免疫荧光结果显示,ChR2+Light on组c-Fos蛋白和mCherry红色荧光病毒共表达数量明显高于对照组(ChR2+Light on vs mCherry+Light on:56.31±5.26 vs 36.33±5.48,P<0.0001,n =6),本研究通过统计c-Fos蛋白和多巴胺能神经元共表达数量,证明了光遗传学有效激活VTADA-PBN通路;此外,激活组大鼠在丙泊酚麻醉苏醒期间VTA区多巴胺能神经元活性明显增强(图3)。
2.4 光激活VTADA-PBN通路引起皮层脑电觉醒
光激活VTADA-PBN通路,RORR期间EEG信号分析结果显示,δ波段功率百分比(ChR2 + Light on vs mCherry + Light on:22.72%±1.86% vs 29.12%±1.38%,P=0.0008,n=6)降低,β波段百分比(ChR2 + Light on vs mCherry + Light on: 31.16%±2.84% vs 26.22%±3.36%,P=0.0134,n=6)升高。频谱图也表现出相应趋势,表明在丙泊酚麻醉苏醒期,激活VTADA-PBN通路,能够引起皮层脑电觉醒(图4)。
3 讨论
越来越多的报道表明,全麻引起意识可逆性的消失和恢复是多种神经环路间互相调节的结果[16]。通过光遗传学和化学遗传学激活VTA投射到伏隔核的多巴胺能神经元,延长麻醉诱导时间并促进麻醉苏醒[10]。Tokita等[17]通过荧光示踪发现,VTA和PBN之间形成相互投射关系。此外,VTA中多巴胺能神经元和PBN形成的神经环路,动态调控动物饱食感有效抑制食物的摄入,同时,还发现增强下游核团臂旁外侧核中的多巴胺D1受体的活性,能够产生终止觅食行为的效果[15]。本研究通过光遗传学方法特异性激活VTADA-PBN上行通路,发现能够缩短丙泊酚麻醉苏醒时间,并发生皮层脑电觉醒。这些研究结果表明VTADA-PBN通路参与调控丙泊酚麻醉苏醒,且激活这一通路能够促进麻醉苏醒。
我们的研究发现,光遗传学激活VTADA-PBN通路,对麻醉苏醒阶段起调控作用,诱导时间无显著变化。这与EEG结果相一致,LORR期间,脑电图各波段几乎无明显差异。有研究也观察到类似结果,6-OHDA选择性毁损VTA DA神经元仅延长了丙泊酚苏醒时间[18]。另有研究表明在丙泊酚和异氟醚麻醉中,PBN神经元的激活并未延长诱导时间,EEG结果显示在麻醉期间大脑皮层活动没有差异[19]。越来越多的研究支持这样的观点,即全身麻醉诱导和苏醒的两个过程可能不是镜像,而是由不同的神经环路控制[20]。此外,有观点认为睡眠诱导不仅需要睡眠系统的激活,还需要关键唤醒回路的失活,而行为觉醒只需要唤醒系统的激活[13]。全身麻醉苏醒和自然睡眠的觉醒有很多相似之处,而VTA和PBN在全身麻醉和睡眠-觉醒中均起到重要作用,因此,我们推测VTA和PBN在丙泊酚全身麻醉的诱导和苏醒两个阶段中,可能由不同的神经通路所调控。
此外,VTA多巴胺能神经元在解剖定位和功能意义上都具有高度异质性[21-22]。投射到PBN和伏隔核的VTA多巴胺能神经元是两个非重叠神经元的队列,大多数投射到PBN的VTA神经元多数位于尾侧VTA[15]。有研究通过化学遗传学和光遗传学激活或抑制VTA投射至伏隔核的多巴胺能神经环路,能够调节七氟醚麻醉的诱导和苏醒[10]。有趣的是,本研究通过光遗传学特异性激活VTA投射至PBN中的多巴胺能通路发现丙泊酚麻醉诱导时间并无统计学差异,而麻醉苏醒时间缩短,表明VTADA-PBN通路只调控了丙泊酚麻醉的苏醒阶段。因此,我们推测VTA中两组非重叠的DA神经元群体可能在调控全身麻醉中均起到关键作用,但这两组多巴胺神经元在调控麻醉诱导和苏醒两个阶段中所参与的神经通路可能有所差异。
本研究将光纤陶瓷插芯置入上游核团VTA中,光激活多巴胺能神经元胞体,能够缩短丙泊酚麻醉苏醒时间。而课题组先前研究将光纤陶瓷插芯置入下游核团PBN中,光激活或抑制VTA投射至PBN中的多巴胺神经末梢,发现这一通路能够调控丙泊酚麻醉苏醒阶段,光激活VTADA-PBN通路,丙泊酚麻醉苏醒时间缩短;光抑制VTADA-PBN通路,丙泊酚麻醉苏醒时间延长[23]。其他研究表明無论光刺激神经元胞体或直接刺激神经元轴突末梢,均会对神经环路起到直接调控作用[24]。
总之,我们通过光遗传学技术结合c-Fos蛋白染色和在体脑电记录发现,激活VTADA-PBN通路能够缩短丙泊酚麻醉苏醒时间,表明VTADA-PBN通路在丙泊酚麻醉苏醒阶段可能发挥关键作用。
参考文献(References)
[1] MOODY O A, ZHANG E R, VINCENT K F, et al. The neural circuits underlying general anesthesia and sleep[J]. Anesth Analg, 2021,132(5):1254-1264.
[2] BAO W W, JIANG S, QU W M, et al. Understanding the neural mechanisms of general anesthesia from interaction with sleep-wake state: a decade of discovery[J]. Pharmacol Rev, 2023,75(3):532-553.
[3] YANG Q, ZHOU F, LI A, et al. Neural substrates for the regulation of sleep and general anesthesia[J]. Curr Neuropharmacol, 2022,20(1):72-84.
[4] LEUNG L S, LUO T, MA J, et al. Brain areas that influence general anesthesia[J]. Prog Neurobiol, 2014,122:24-44.
[5] LUO M, FEI X, LIU X, et al. Divergent neural activity in the VLPO during anesthesia and sleep[J]. Adv Sci (Weinh), 2023,10(2):e2203395.
[6] MONTUPIL J, CARDONE P, STAQUET C, et al. The nature of consciousness in anaesthesia[J]. BJA Open, 2023,8:100224.
[7] WANG H, YU L, QIN Y J, et al. Restoring VTA DA neurons excitability accelerates emergence from sevoflurane general anesthesia of anxiety state[J]. Biochem Biophys Res Commun, 2021,565:21-28.
[8] TAYLOR N E, VAN DORT C J, KENNY J D, et al. Optogenetic activation of dopamine neurons in the ventral tegmental area induces reanimation from general anesthesia[J]. Proc Natl Acad Sci U S A, 2016,113(45):12826-12831.
[9] 李健楠, 李慧明, 张欣欣, 等. 大鼠腹侧被盖区多巴胺能神经元介导食欲素促进全麻后觉醒效应[J]. 神经解剖学杂志, 2021,37(1):1-7.
LI J N, LIU H M, ZHANG X X, et al. Dopaminergic neurons in the ventral tegmental area of the rat mediate the effect of orexin in promoting arousal after general anesthesia[J]. Chin J Neuroanat, 2021,37(1):1-7.
[10] GUI H, LIU C, HE H, et al. Dopaminergic projections from the ventral tegmental area to the nucleus accumbens modulate sevoflurane anesthesia in mice[J]. Front Cell Neurosci, 2021,15:671473.
[11] SONG Y, CHU R, CAO F, et al. Dopaminergic neurons in the ventral tegmental-prelimbic pathway promote the emergence of rats from sevoflurane anesthesia[J]. Neurosci Bull, 2022,38(4):417-428.
[12] CHEN J, GANNOT N, LI X, et al. Control of emotion and wakefulness by neurotensinergic neurons in the parabrachial nucleus[J]. Neurosci Bull, 2023,39(4):589-601.
[13] QIU M H, CHEN M C, FULLER P M, et al. Stimulation of the pontine parabrachial nucleus promotes wakefulness via extra-thalamic forebrain circuit nodes[J]. Curr Biol, 2016,26(17):2301-2312.
[14] BOUGHTER JD J R, LU L, SAITES L N, et al. Sweet and bitter taste stimuli activate VTA projection neurons in the parabrachial nucleus[J]. Brain Res, 2019,1714:99-110.
[15] HAN Y, XIA G, HE Y, et al. A hindbrain dopaminergic neural circuit prevents weight gain by reinforcing food satiation[J]. Sci Adv, 2021,7(22):8719.
[16] MELONAKOS E D, MOODY O A, NIKOLAEVA K, et al. Manipulating neural circuits in anesthesia research[J]. Anesthesiology, 2020,133(1):19-30.
[17] TOKITA K, INOUE T, BOUGHTER J D JR. Afferent connections of the parabrachial nucleus in C57BL/6J mice[J]. Neuroscience, 2009,161(2):475-488.
[18] ZHOU X, WANG Y, ZHANG C, et al. The role of dopaminergic VTA neurons in general anesthesia[J]. PLoS One, 2015,10(9):138187.
[19] WANG T X, XIONG B, XU W, et al. Activation of parabrachial nucleus glutamatergic neurons accelerates reanimation from sevoflurane anesthesia in mice[J]. Anesthesiology, 2019,130(1):106-118.
[20] TARNAL V, VLISIDES P E, MASHOUR G A. The neurobiology of anesthetic emergence[J]. J Neurosurg Anesthesiol, 2016,28(3):250-255.
[21] MORALES M, MARGOLIS E B. Ventral tegmental area: cellular heterogeneity, connectivity and behaviour[J]. Nat Rev Neurosci, 2017,18(2):73-85.
[22] LAMMEL S, STEINBERG E E, FLDY C, et al. Diversity of transgenic mouse models for selective targeting of midbrain dopamine neurons[J]. Neuron, 2015,85(2):429-438.
[23] 賈磊. 中脑腹侧被盖核投射至臂旁核多巴胺能通路在大鼠丙泊酚麻醉苏醒中的作用研究[D].石河子:石河子大学,2023.
[24] LI L, ZHANG L Z, HE Z X, et al. Dorsal raphe nucleus to anterior cingulate cortex 5-HTergic neural circuit modulates consolation and sociability[J]. Elife, 2021,10:67638.
(责任编辑:编辑唐慧)
