以胎儿生长受限为首发症状子痫前期的临床特征及危险因素
2024-05-16李秀芳高伟娜赵先兰
李秀芳,高伟娜,赵先兰
(郑州大学第一附属医院 产科,河南 郑州 450052)
胎儿生长受限(fetal growth restriction,FGR)是指受母体、胎儿、胎盘等病理因素影响,胎儿应有的生长潜力受损,估测胎儿体重小于相应胎龄的第10百分位数,发病率约为3%[1]。子痫前期(preeclamsia,PE)是妊娠中晚期特有的疾病,病因复杂多样,不仅临床表现存在异质性,首发症状也呈多样性,发病率为2%~8%,是引起孕产妇及围产儿死亡的主要原因[2]。FGR与子痫前期两者密切相关,被认为是由妊娠早期异常胎盘着床引起的,FGR合并子痫前期患者母儿妊娠结局更差,因此充分认识以FGR为首发症状的子痫前期发生的高危因素,给予及时有效的预防,从而保障母婴安全成为临床关注的热点。本研究对40例以FGR为首发症状子痫前期患者的临床特征及危险因素进行分析,旨在为产前咨询、处理和改善母胎结局提供参考依据。
1 资料与方法
1.1 一般资料
统计整理郑州大学第一附属医院2018年1月至2023年1月在产科住院的40例以FGR为首发症状的子痫前期患者为研究对象,孕妇年龄(30.55±4.57)岁,诊断FGR孕周(28.16±3.31)周;随机选取同期住院的未发生子痫前期的80例FGR患者作为对照组,孕妇年龄(29.37±4.88)岁,诊断FGR孕周(32.03±1.90)周。纳入标准:(1)FGR和子痫前期符合第9版《妇产科学》教科书的诊断标准[3];(2)临床资料完整。排除标准:(1)多胎妊娠;(2)胎儿染色体异常、胎儿结构畸形。
1.2 研究方法
应用回顾性研究方法对120例患者的一般特征、妊娠期合并症、母体及围产儿妊娠结局进行比较分析。
1.3 统计学方法
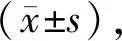
2 结果
2.1 两组患者一般特征的比较
研究组与对照组患者的年龄、初产妇所占比、有无规律产检、是否辅助生殖、有无不良孕产史比较,差异无统计学意义(P>0.05)。两组患者的孕前体重指数、诊断FGR时孕周比较,差异有统计学意义(P<0.05)。见表1。
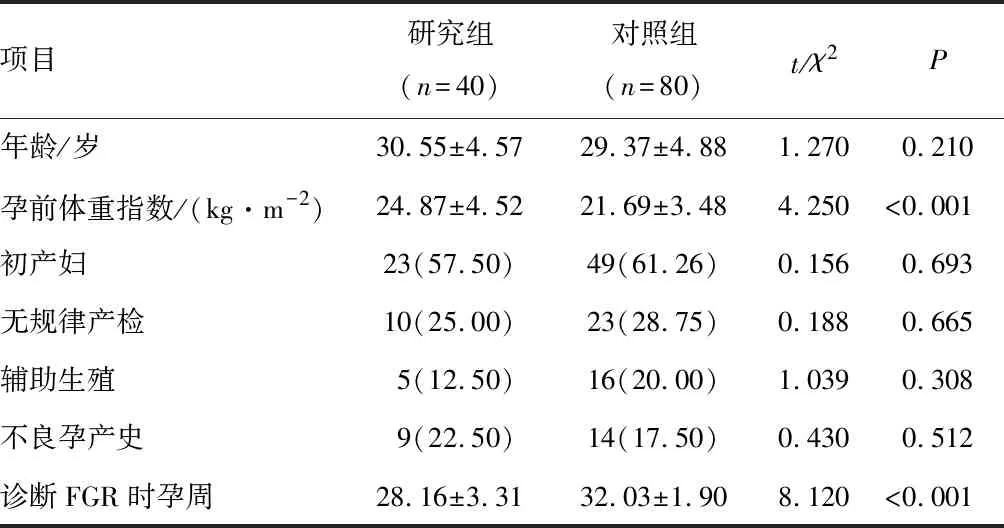
表1 两组患者一般特征比较
2.2 两组患者妊娠期合并症情况比较
研究组与对照组妊娠高血糖、甲状腺功能减退、脐带扭转、子宫畸形、羊水少、贫血占比比较,差异无统计学意义(P>0.05)。但对照组中有8例患者子宫畸形,研究组中无子宫畸形患者。研究组与对照组蛋白尿、抗磷脂抗体阳性率比较,差异有统计学意义(P<0.05)。见表2。
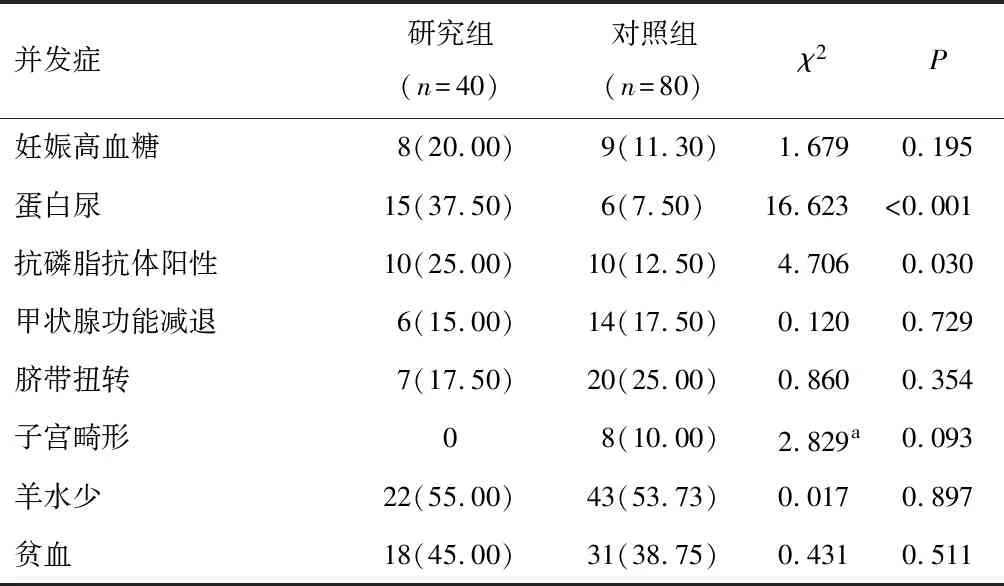
表2 两组患者妊娠期合并症情况比较[n(%)]
2.3 两组患者母体妊娠结局比较
研究组与对照组患者的妊娠并发症总和、住院天数、剖宫产率比较,研究组均高于对照组,差异有统计学意义(P<0.05)。其中研究组中有1例患者发生子痫抽搐,2例患者发生心功能衰竭,对照组中未发生。见表3。
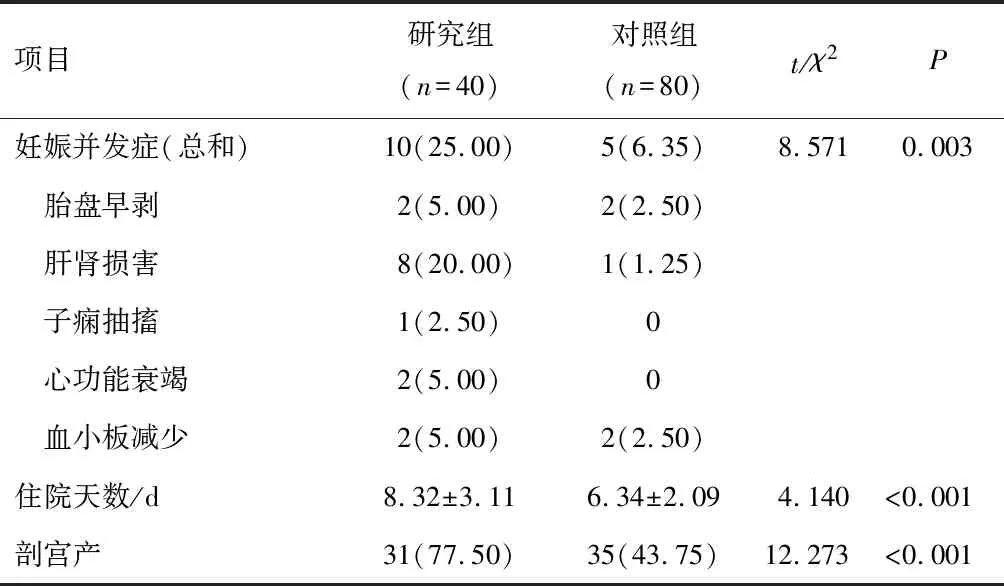
表3 两组患者母体妊娠结局比较
2.4 两组患者新生儿结局比较
因死胎、母体病情等原因,研究组中医疗性引产6例,对照组4例。两组患者产时存活新生儿中早产、分娩孕周及新生儿体重比较,差异有统计学意义(P<0.05) 。研究组中新生儿并发症脑室出血、新生儿窒息、呼吸窘迫综合征、代谢性酸中毒的发生概率高于对照组,差异有统计学意义(P<0.05),但两组围产儿出生后死亡率比较,差异无统计学意义(P>0.05)。见表4。
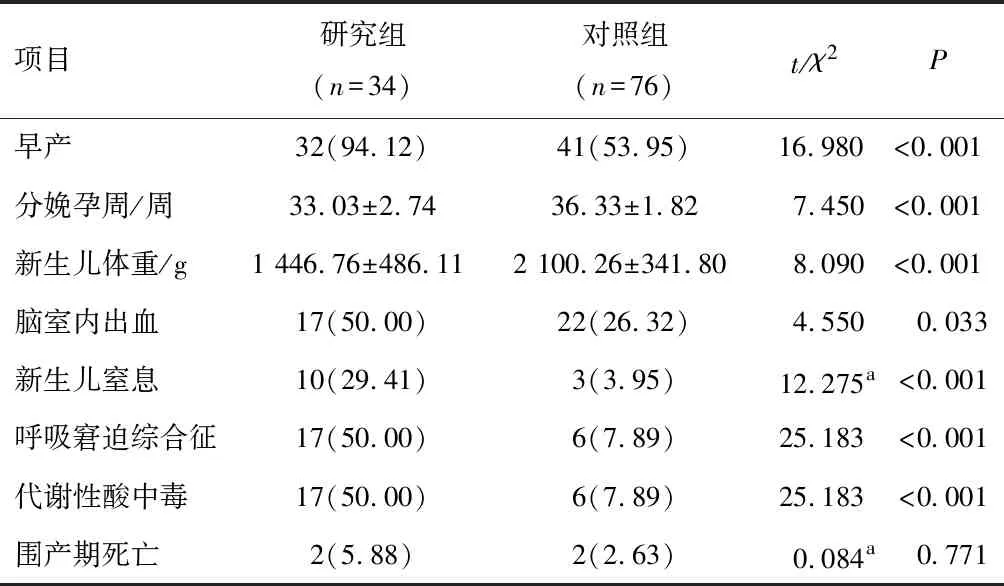
表4 两组患者产时存活新生儿结局比较
2.5 以FGR为首发症状子痫前期的危险因素logistic回归分析
以FGR是否并发子痫前期作为因变量(否=0,是=1),以临床资料差异有统计学意义的因素作为自变量,进行多因素logistic回归分析,结果显示,诊断FGR时孕周、孕前体重指数是以FGR为首发症状子痫前期的独立危险因素。见表5。
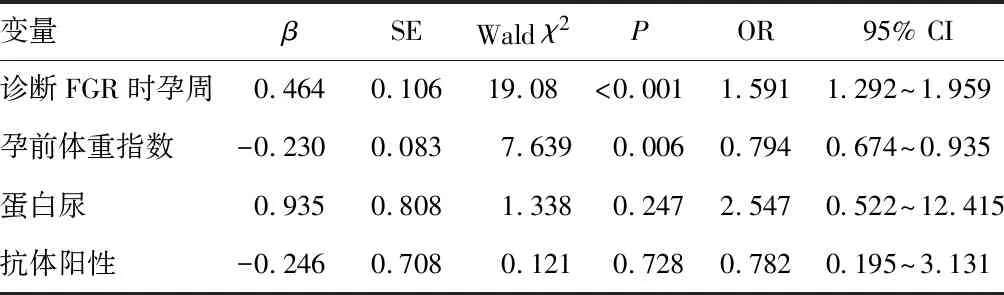
表5 以FGR为首发症状子痫前期的危险因素logistic回归分析
2.6 以FGR为首发症状子痫前期危险因素的预测临床效能ROC曲线分析
ROC曲线分析结果显示,诊断FGR时孕周(AUC=0.817,95% CI为0.723~0.911)和孕前体重指数(AUC=0.714,95% CI为0.621~0.807)可用于以FGR为首发症状子痫前期的风险预测,且两者联合预测(AUC=0.860,95% CI为0.785~0.934)的效能优于单一指标。见图1。

FGR为胎儿生长受限。
3 讨论
子痫前期是孕产妇及围产儿病死率升高的主要原因之一,已证实与妊娠早期绒毛外滋养细胞浸润能力受损,造成胎盘浅着床和子宫螺旋动脉重铸不足有关,流向子宫胎盘床的血流量减少,从而导致整个妊娠期间胎盘灌注减少持续缺血缺氧[4]。为了应对这种缺氧状态,胎盘会释放一些抗血管生成因子进入母体循环,从而导致广泛的内皮功能障碍[5],正是这种内皮功能障碍产生了子痫前期的临床特征,即高血压、肝肾功能不全、蛋白尿、血小板减少和血管通透性增加。类似的胎盘变化也见于FGR而没有并存子痫前期的患者[6],这些发现与长期以来的观点一致,即FGR和子痫前期可能属于相似的病理生理学改变,即妊娠早期的胎盘浅着床。
FGR通常是由一种或多种因素干扰调节胎儿生长发育的正常机制所导致的结果,主要包括母体、胎儿或胎盘等三大方面原因[7]。研究建议,根据诊断时的胎龄将FGR大致分为早发型FGR(<32 周)和晚发型FGR(≥32周),早发型FGR通常更严重,潜在的胎盘病理学与早发型子痫前期病例中观察到的相似[8],这进一步验证了早发型FGR与子痫前期具有类似的病理生理变化。FGR并发子痫前期是一种严重疾病,可导致母儿不良妊娠结局增加。本研究通过对两组患者妊娠结局的分析,发现研究组患者病情复杂且更为严重,母体发生胎盘早剥、肝肾功能损害、子痫抽搐、心功能衰竭及血小板减少的风险均高于对照组,患者剖宫产率高、产后恢复慢,住院天数明显延长。两组患者活产分娩新生儿中早产率、分娩孕周、新生儿体重差异有统计学意义,与对照组相比,研究组增加了医源性早产的发生,出生体重低于对照组,使得新生儿结局更差。国内也有研究显示子痫前期是新生儿低出生体重的独立高危因素[9],子痫前期发病孕周越小,对母体全身脏器功能和早期胎盘形成均会造成不良的影响,导致胎盘血流灌注不足,胎儿宫内缺血缺氧,出现FGR、胎儿宫内窘迫、窒息甚至死胎等不良妊娠结局[10]。
子痫前期是一种多因素,多机制及多通路致病的疾病,临床首发表现存在明显的异质性,可以是单一的头痛、上腹部不适、血压升高、蛋白尿、水肿、胎儿生长受限等,也可以在还没有发现高血压和蛋白尿时就已经出现血小板减少[11]。鉴于子痫前期的首发临床表现的异质性,以及病理生理学可能不同,对这些人群进行单独研究非常重要。目前认为FGR与子痫前期均为胎盘源性疾病,螺旋小动脉重塑障碍致子宫胎盘循环不足、胎盘缺血缺氧,FGR趋势是子痫前期发病前的预警之一[12]。
本研究通过多因素logistic回归模型分析得出,诊断FGR时孕周、孕前体重指数是以FGR为首发症状子痫前期的独立危险因素。ROC曲线分析结果显示,诊断FGR时孕周(AUC=0.817,95% CI为0.723~0.911)和孕前体重指数(AUC=0.714,95% CI为0.621~0.807)可用于以FGR为首发症状子痫前期的风险预测,且两者联合预测(AUC=0.860,95% CI为0.785~0.934)的效能优于单一指标。有文献报道,在所有被诊断为FGR的女性中,约有15%的患者随后发展为子痫前期,早发型FGR与子痫前期有类似的病理生理学变化[13]。Mitani等[7]的研究结果也表明诊断FGR孕周越早,并发子痫前期的概率越高,FGR并发子痫前期组诊断FGR时孕周为(28.8±4.4)周,未并发子痫前期组诊断FGR时孕周为(32.7±4.6)周,结果与本文研究结果一致。有大量证据表明超重使子痫前期的风险增高2~4倍[14],超重被称为慢性低度炎症状态,低度炎症可通过免疫介导机制诱导内皮功能障碍和胎盘缺血,进而导致炎症介质的产生,从而导致母体炎症反应过度和子痫前期的发展[15]。充分认识以FGR为首发表现的子痫前期发生的危险因素,有助于早期识别子痫前期,对改善母儿预后具有深远意义。
4 小结
子痫前期是导致孕产妇及围产儿死亡的重要原因,早期预防、及时诊断和使用标准化方案进行管理,以确定适当的监测和分娩时间可以降低死产风险并改善子痫前期妊娠的围产期结局。虽然这是一项回顾性研究,但发现FGR是子痫前期的一种首发临床表现形式,可以为临床医生的预防和治疗子痫前期提供一些证据,但由于本研究病例数较少,仍需临床大样本量进行前瞻性的研究证实。对于存在FGR趋势者,注意追查原因,加强FGR的监测,早期筛查子痫前期风险人群,并采取相应措施干预,对改善母儿结局有重要意义。
