血管栓塞用明胶海绵微球的制备及表征
2024-05-16谭奕勋云晓王春曼吴芬敏杨顶建海南百迈科医疗科技股份有限公司海南定安571200
谭奕勋 云晓 王春曼 吴芬敏 杨顶建 海南百迈科医疗科技股份有限公司 (海南 定安 571200)
内容提要: 目的:制备一种可用于血管栓塞的明胶海绵微球,表征其理化性能,并通过动物试验初步验证其用于体内栓塞的安全性和有效性。方法:在制备明胶海绵微球时,将含有明胶的水相,添加到含有乳化剂的油相中,构建油包水的乳化体系,随后加入交联剂固化得到明胶海绵微球;对制得的微球开展了包括显微外观、粒径、溶胀率、弹性在内的理化性能表征;将制得的明胶海绵微球通过微导管注入猪肾脏血管,观察栓塞效果以及术后的并发症等情况以验证微球用于体内栓塞的安全性和有效性。结果:以此法制得的明胶海绵微球,表面光滑,呈规则球形;溶胀后的粒径呈类正态分布,粒径范围50~2000μm,平均溶胀率为355%,通过质构仪对微球施加粒径50%的压缩形变后,微球不破碎,不变形;猪肾脏栓塞动物试验表明,微球能够有效栓塞靶血管,引起靶组织的缺血梗死,体内降解时长约为28d,降解后血管可复通,试验过程中未见与明胶海绵微球相关的并发症。结论:该方法制得的明胶海绵微球呈完整球形,形状规则,粒径分布范围广,经筛分后具有可用于不同尺寸血管栓塞的潜力。微球具有适中的溶胀率与良好的弹性,便于在术中通过导管进行输送并能够与靶血管紧密嵌合;猪肾脏栓塞动物试验的结果亦表明制得的明胶海绵微球安全性和有效性良好,降解时长适中,运用于血管栓塞具有较大的市场前景。
血管内栓塞术是指通过导管向靶血管内注入栓塞材料,使靶血管闭塞,从而达到预期治疗目的的一种技术[1]。目前血管内栓塞术在临床上被广泛应用于阻塞靶血管治疗各种原因导致的出血、消除器官功能、治疗血管畸形及动静脉瘘等血管病,栓塞肿瘤供血血管和血流改道等多个方面[2-4]。栓塞材料的性质在很大程度上决定了栓塞血管的层次、持续时间以及栓塞效果。栓塞材料有可吸收和不可吸收两类,临床常用的可吸收材料包括明胶海绵、海藻酸等,不可吸收材料主要是聚乙烯醇[5-7]。其中,明胶材料因其生物相容性好,有成熟的临床应用经验,可生物降解且容易获得等特性,被广泛应用于血管栓塞领域[8]。然而,目前国内临床主要应用明胶海绵颗粒栓塞剂,或者通过手工剪碎明胶海绵片的方式简易制得明胶栓塞材料,这类栓塞材料具有形状不规则,粒径分布不均一,尺寸不可控,易团聚且机械性能不佳等缺点,增大了栓塞过程中栓塞剂漂移至体内其他正常器官造成异位栓塞的风险[9]。为了克服不规则颗粒型栓塞剂存在的不足,越来越多的微球型栓塞剂被开发出来,其具有规则的球形与均一的粒径,血管顺应性更好,栓塞时能到达更为远端的血管。国内尚未有明胶海绵微球型栓塞剂上市,因此,开发一种具有市场应用潜力的明胶海绵微球型栓塞剂,并验证其用于血管栓塞的安全性和有效性具有重大的意义。本文基于乳化交联法,开发了一种可用于工业化生产明胶海绵微球的方法,并对制得的明胶海绵微球的显微外观、粒径、溶胀率、弹性性能进行了考察。随后,使用猪肾脏模型对明胶海绵微球用于血管栓塞的安全性和有效性进行了验证。
1.材料与方法
1.1 一般材料
试验起止时间:2021年6月~2023年2月。
试验动物:12只普通白猪,体重47~61kg,按照试验周期分为2d、14d、28d和42d组,每组3只。
试剂:药用明胶(25kg/袋,西安天正药用辅料有限公司);二甲基硅油(500mL/瓶,上海麦克林生化科技有限公司);司盘80(500mL/瓶,上海麦克林生化科技有限公司);丙酮(500mL/瓶,西陇科学股份有限公司);戊二醛(AR,50%水溶液500mL/瓶,上海麦克林生化科技有限公司);注射用水(海南中玉药业有限公司)。
仪器设备:恒温水浴锅(B-220);循环水式多用真空泵(SHB-Ⅲ);反应釜(JBP-20-2M);低温冷却液循环水泵(DLSB-5/20);离心机(PS300);超声波清洗机(XC-1200);电热恒温鼓风干燥箱(9425A);质构仪(CTA-10HD);工业显微镜(SK2610B);场发射扫描电子显微镜(ZEISS SIGMA)。
1.2 方法
1.2.1 明胶海绵微球的制备
在37°C下,将400g明胶充分溶解于去离子水中形成30%明胶水溶液。随后,在37°C、200r/min转速的搅拌条件下,将30%明胶水溶液逐滴添加入含有16g司盘80的2000mL二甲基硅油中,持续搅拌30min形成油包水的乳化体系。接下来,调整温度至2°C,并逐滴添加15mL戊二醛,在搅拌环境下保温交联反应5h。反应完成后,过滤得到微球,并依次使用丙酮和去离子水分别洗涤微球3次。最后,将微球通过筛网筛分(如必要)并冷冻干燥。
1.2.2 明胶海绵微球性状与功能考察
1.2.2.1 明胶海绵微球显微外观考察
取适量冻干微球以及在0.9%生理盐水中充分溶胀的微球,分别使用场发射扫描电子显微镜以及工业显微镜对微球的显微外观形态进行观察。
1.2.2.2 明胶海绵微球粒径分布考察
分别取未经筛分的冻干明胶海绵微球以及在0.9%生理盐水中充分溶胀的微球,使用光学显微镜在30x放大倍数下观察并测量微球粒径,计算平均粒径并使用SPSS分析软件绘制粒径分布图。
1.2.2.3 明胶海绵微球溶胀率考察
取50mg冻干微球,将其浸泡于0.9%生理盐水5mL中,分别在浸泡2、5、10、30、60min后取出,用滤纸吸干表面水分,迅速称重并计算溶胀率,重复3次。根据下列公式计算明胶海绵栓塞微球在上述三种溶胀介质下的溶胀率(SR)见公式(1):
式中:m0—为溶胀前的质量(单位:mg);m1—为溶胀后的质量(单位:mg)。
1.2.2.4 明胶海绵微球弹性考察
取在0.9%生理盐水中充分溶胀的微球1粒,用滤纸吸除表面水分后,置于质构仪的样品台上。选择直径为5mm的圆柱形探头,触发点为0.5g,测试模式为“压缩保持”。测试过程中,探头首先下降(速度为5mm/min)至微球压缩形变至直径的50%,保持静止10s,随后探头回升(速度为5mm/min)。记录压缩、静止及回升过程中探头和微球之间的作用力,并观察压缩后微球的形态变化。
1.2.2.5 明胶海绵微球猪肾脏栓塞试验
测试手术全程使用无菌操作,对所有试验白猪进行镇静及诱导麻醉后,切开左侧或右侧股动脉后置入血管鞘。在数字减影血管造影机引导下,将明胶海绵微球通过微导管注射至肾下极三级动脉及其所有下游动脉,直至栓塞完全,即栓塞靶血管显影全部消失。术后2d、14d、28d和42d分别对计划解剖的动物再次行造影观察肾动脉血流分布情况,随后处死相应动物,解剖观察肾组织的梗死情况,并行组织病理学检查。
2.结果
2.1 明胶海绵微球显微外观
冻干微球在电子显微镜下观察的形态如图1所示,微球呈现规则球形,表面基本光滑,略有褶皱,分散性好,没有粘连。充分吸水溶胀后的微球在光学显微镜下观察,如图2所示,微球呈规则圆形,无破碎,表面光滑,呈透明,颗粒大小均匀,分散性好,无粘连。

图1.冻干微球扫描电子显微镜图

图2.溶胀微球的光学显微镜图
2.2 明胶海绵微球粒径分布
经光学显微镜下观察及测量,冻干微球的粒径范围在30~1200μm,平均580μm,粒径分布结果如图3所示;在生理盐水中充分溶胀的微球粒径范围在50~2000μm,平均840μm,粒径分布结果如图4所示。

图3.冻干微球的粒径分布直方图
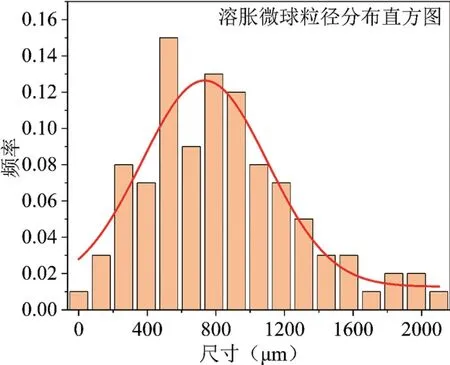
图4.溶胀微球的粒径分布直方图
2.3 明胶海绵微球溶胀率
微球溶胀率随时间的变化如图5所示。冻干微球在生理盐水中迅速吸水溶胀,在约10min时达到溶胀稳态,稳态时的溶胀率约为355%。

图5.微球溶胀趋势
2.4 明胶海绵微球弹性
微球弹性测定过程中,其受力随测试时间变化以及随微球形变变化的情况分别如图6所示。测试结果如图7所示,在探头向下压缩微球的过程中,微球的负载随形变的增加而增加,直至达到设置的形变压缩量50%。在保持压缩的10s内,微球负载保持基本恒定,处于“平台期”,说明微球在压缩过程中无破裂,有较好对抗外界压力的能力。在探头下降和上升过程中,微球负载的变化曲线基本对称,说明压缩微球时发生的是弹性形变,微球结构在压缩过程中无明显变化,弹性良好。

图6.微球压缩形变过程
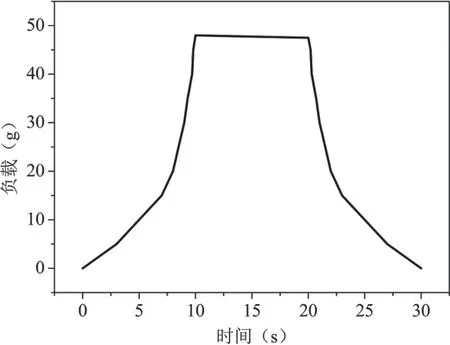
图7.弹性测试曲线图
2.5 明胶海绵微球猪肾脏栓塞
术中栓塞前后猪肾脏血流造影如图8所示,明胶海绵栓塞微球注入后,猪肾脏下极三级及以下血管基本无可见血管造影信号,显示血管被完全栓塞。肾脏上极血流信号栓塞前后无明显差异,没有微球漂移形成异位栓塞的迹象。
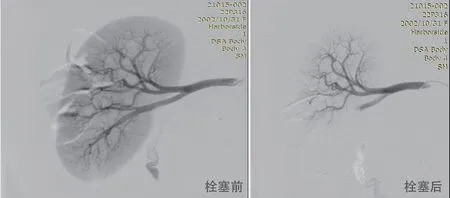
图8.术中栓塞前后猪肾脏血流造影图
术后2d、14d、28d和42d动物解剖前造影结果及术后栓塞即刻的对比结果(图9)显示,2d和14d时栓塞血管均未观察栓塞靶血管明显复通;28d时,栓塞血管近端可见一定程度的复通;42d时,血管进一步复通,远端终末小血管仍处于栓塞状态。各时间组动物解剖后肾脏大体观察见图10,2d组被栓塞的肾脏下极明显缺血坏死,呈鲜红色;14d组肾脏下极组织梗死进一步加重,呈黄色夹杂暗红色斑片,体积减少,发生萎缩;28d组和42d组肾脏下极可见组织梗死现象进一步加重,肾脏下极萎缩程度加深,梗死区域整体呈黄褐色伴有不规则斑块。各时间组肾脏上极均未见明显异常及梗死灶。

图9.术后即刻及解剖前肾脏造影图

图10.术后不同时间点解剖前肾脏大体观察图
组织病理学检查(图11)发现,2d组肾下极各级动脉均可见栓塞微球,微球形态基本保持球形,内部可见轻微变形和细小的裂缝,微球大小无明显减少。肾脏下极呈现严重的血管损伤及广泛的肾组织缺血坏死,多形核细胞显著升高;14d时,微球降解现象明显,在部分弓状及小叶间动脉中可见蓝黑色块状微球降解物,多数前期受损血管在微球降解或血栓形成的基础上进一步引发机化过程,组织缺血坏死加重,纤维组织轻度增生;28d时,微球已基本降解,未见残留物,肾下极坏死钙化范围广,慢性炎性细胞进一步增加,纤维组织增生更为明显;42d组,未见微球,肾下极血管可见部分或全部闭塞,多数肾小球纤维化,肾小管萎缩,间质中大量纤维组织增生,肾盂周围有较明显的脂肪浸润。

图11.术后不同时间点栓塞血管病理检查图
3.讨论
本文开发了一种适用于工业化批量生产明胶海绵微球的方法,合成步骤简便,反应条件易于控制。明胶水溶液首先在含乳化剂的油相中充分分散,形成油包水的乳化体系,随后明胶与交联剂甲醛反应,在明胶分子间形成化学键,固化为微球。
由该方法制得的微球呈现规则的圆球形,表面光滑且分散性好,无粘连,利于注射输送及栓塞靶血管。冻干后的微球在生理盐水中能够快速溶胀,溶胀后的微球具有良好的弹性,在临床上通过导管输送时,经压缩后能够快速恢复原形,与血管壁紧密嵌合,起到良好的栓塞效果。
临床上常规所需的栓塞微球范围在50~2000μm,不同粒径大小的微球适用于不同尺寸血管的栓塞[10]。本文制备的微球溶胀后粒径在50~2000μm,落在临床常用的范围内,具有较大的临床实际应用价值。
微球猪肾脏动脉栓塞试验表明,微球在体内降解完全的时间约为28d,能够实现对靶血管的致密栓塞,有效阻断血液流动。明胶微球属于可吸收栓塞剂,动物试验的结果表明,在微球降解过程中,部分血管复通,也有部分血管因微球引发显著的血栓及机化过程发生永久闭塞,但栓塞靶部位均发生不可逆的缺血坏死。解剖大体观察及组织病理学检查均表明,栓塞靶部位的组织梗死以及纤维化程度随着时间的延长而不断加深,这意味着可降解的明胶海绵微球能够实现靶部位的有效栓塞,不会出现栓塞部位随着微球降解而恢复正常的情况。此外,肾脏上极未见梗死灶及异常,意味着微球栓塞后并未发生向其他部位漂移造成非靶部位异位栓塞的并发症,明胶微球的安全性良好。
本文制备的明胶海绵微球具有形状规则、颗粒大小均匀、分散性及弹性好等特性,初步的动物试验表明微球在体内降解时长适中,实现靶部位栓塞的有效性及安全性良好。
