机械解脱弹簧圈生产环节风险因素及现场体系核查关注点
2024-05-16周敏靓上海市医疗器械化妆品审评核查中心上海200020
周敏靓 上海市医疗器械化妆品审评核查中心 (上海 200020)
内容提要: 机械解脱弹簧圈是治疗动脉瘤的有效手段之一,但手术过程中不良事件时有发生,究其原因其中产品质量问题占有较大的比例。通过分析此类产品生产人员、机器设备、原材料、过程方法、生产环境等方面在产品实现过程中可能存在的风险因素,文章针对性地提出机械解脱弹簧圈产品现场体系核查的关注重点,对医疗器械检查员在检查该类产品时有一定的指导作用。
1.机械解脱弹簧圈产品概述
1.1 产品作用机制
无论何种解脱形式的弹簧圈,主要作用机制即利用弹簧圈材料诱发血栓形成。通过微创介入手术,推送的弹簧圈占据了瘤腔空间,改变了瘤腔内血流动力学,减轻了血流对瘤壁的直接冲击力。如果弹簧圈填塞得比较充分、致密,瘤腔内的血液在短时间内就基本处于停滞状态,血液的滞留易于诱发血栓形成,从而闭塞整个瘤腔,降低了动脉瘤破裂出血的可能性。
1.2 结构组成
目前不同企业生产的机械解脱弹簧圈结构组成各有不同,但一般由弹簧圈和推送杆(输送系统)组成。
1.2.1 弹簧圈部分
弹簧圈的绕丝通常采用铂钨、铂铱合金等金属材料制成,部分弹簧圈表面可能含有聚酯纤维等高分子材料的纤毛,内部连接有抗解旋丝。弹簧圈根据临床需要,一般有3D(三维)立体结构和2D(一维)螺旋结构等(图1)。

图1.弹簧圈示意图
1.2.2 推送杆(输送系统)部分
推送杆主要作用为传递近端到远端的推送力,输送植入弹簧圈,推送杆和弹簧圈之间有解脱区(解脱机构)(图2)。推送杆一般选用304不锈钢材料,远端带有显影环,可带有高分子材料外层或涂层。产品一般配套的附件为导入鞘,主要起到将弹簧圈系统导入微导管中的作用。不同解脱形式的弹簧圈系统最大区别之一即在解脱区的样式上。机械解脱弹簧圈的解脱区本质上是一种特殊的挂钩/脱钩机械结构,通常由316不锈钢或镍钛合金材料制成,仅通过纯机械方式,如旋转推送杆、回撤解脱丝等便可释放弹簧圈部分。不同企业产品的解脱机构构造、原理各不相同,通常为企业产品的核心设计并获得专利保护。
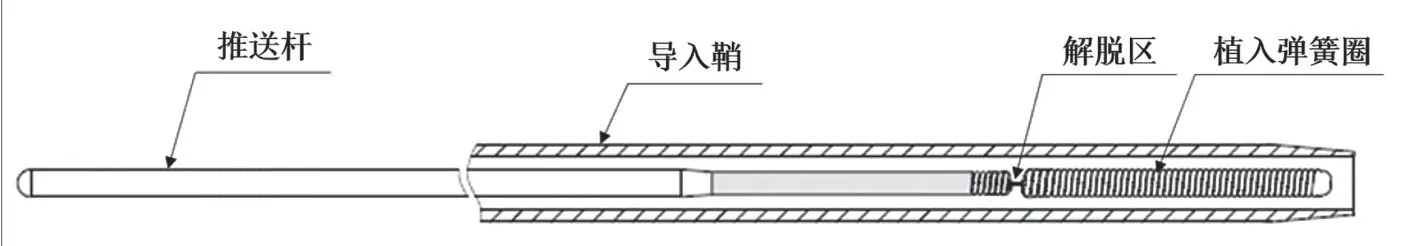
图2.弹簧圈推送杆(输送系统)示意图
1.2.3 性能指标
机械解脱弹簧圈技术性能指标一般可包含以下内容[4]:①弹簧圈性能(如材料要求、尺寸、外观、抗解旋强度、磁共振兼容性、化学性能等);②推送杆性能(如外观、尺寸、破裂试验、弯曲试验、腐蚀、化学性能等);③弹簧圈系统性能(如匹配性、解脱区连接强度、模拟使用等);④微粒控制;⑤可视性;⑥生物相容性等。
没过两天,美之厦房地产有限公司的齐眉就打来电话,高潮一看来电显示,就嗯嗯啊啊地边接电话边走出办公室,到了罕有人至的楼梯拐角处接听。齐眉说,我公司媒体见面恳谈会将于明天上午十时,在市政府附近的常青树大酒店八楼多功能会议厅举行,请吴先生务必拨冗,参加我们的会议。高潮压低声音说,感谢贵公司对“焦点调查”网站的信任和关注,我一定会准时参加的。心里却嘀咕道,来吧,你们来吧,即使要到各媒体走访,老子也不怕了,要来你们就来卓木文化传媒吧。
2.机械解脱弹簧圈的生产工艺
前文已经叙述了不同企业生产的机械解脱弹簧圈结构组成各不相同,解脱机构构造、原理也各有差异,从而导致生产工艺也各有区别。现以某品牌机械弹簧圈的典型工艺流程为例(图3)。

图3.机械解脱弹簧圈典型生产工艺框图
其中,弹簧圈/部件清洗、弹簧圈热定型、解脱机构组装、推送杆焊接、内包装封口、灭菌等为关键控制点,其主要工序(虚线框)均在万级净化车间内进行。
3.机械解脱弹簧圈生产环节风险分析
作为一款植入性医疗器械,影响产品生产环节质量的因素有许多,但归根结底还是离不开“人、机、料、法、环”5个因素,这也是企业生产所需要遵循的重要法则之一。以下就从这5个因素并结合《医疗器械生产质量管理规范》及相关附录的要求,来重点分析机械解脱弹簧圈系统生产环节的主要风险防控因素。
3.1 人的风险因素
在产品生产中,人是整个生产流程的实施者,人的因素贯穿于整个生产活动的始终[5]。对于产品生产来说,首先应配备与产品相适应的生产人员。机械解脱弹簧圈生产过程中需要涉及多道生产工序、众多生产设备,这就需要生产人员具有高度的责任心、充分的培训度,严格按照设备工艺作业参数操作。在整个生产流程中,某些环节需要靠纯手工进行完成,如解脱机构的组装,这更考验操作人员的培训效果和技能水平,如果解脱机构装配有误,可能会直接造成在手术过程中弹簧圈无法解脱或提前断开,引起严重的后果。其次,对于产品检验来说,应当配备与产品质量控制相适应的专职检验人员。检验是产品质量控制关键环节之一,如果相关检验人员对操作流程不熟、检验方法不准、判定标准不清,可能导致检验结果失控,造成产品非预期放行。再次,作为植入性医疗器械,接触产品的人员健康状况也是可能存在风险的方面之一,如果生产或检验人员患有传染性疾病,可能造成产品的生物污染危害,存在潜在的生物安全影响。
3.2 机器(设备)的风险因素
生产过程离不开必要的设施、设备,这是生产活动得以进行的必备条件。为此,首先企业应当配备与生产工艺、规模相适应的生产设备、工艺工装,与检验规程相匹配的检验设备等,并保证生产设备的加工精度、可靠性,检验设备的检验范围、精度等均能满足要求。例如热定型(热处理)工序需要使用到热处理炉,而一旦热处理炉存在温控精确度漂移或温度波动离散较大,极有可能引起产品成篮效果差、弹簧圈过硬或过软,植入人体后造成急性血栓或动脉瘤破裂等风险。
3.3 材料的风险因素
材料是生产制造的先天要素之一,也是产品组成的基础。作为植入性医疗器械,弹簧圈本体、其他与血液直接或间接接触的组件,均应选择无毒、与人体相容性好且能满足预期用途的原材料。为此,企业首先应制定明确的物料质量标准,材料如有对应的国、行标要求,企业自定的物料质量标准应不低于国、行标要求;如无对应的国、行标,企业应明确材料指标并进行相关验证,以满足预期设计用途或性能。其次,在实施采购时,应严格执行物料进货验收制度,保证采购品满足物料质量标准的要求。再次,应制定合格供方名录,执行严格的供应商审核制度,以保证物料有合法、长期、稳定的来源。比如植入弹簧圈材质不达标,化学稳定性差,或与已通过生物学验证的材料不一致,可能造成手术后引起免疫反应或感染发生,危及患者生命。
3.4 过程方法的风险因素
过程方法可包含工艺流程及检验规程等,是稳定生产和产品质量最重要的保证。人、机、料作为制造过程中的三大实体因素,过程方法便是把这三大因素串联起来的重要纽带。可以说没有好的过程方法,也就不可能生产出质量稳定的产品。为此,首先企业应制定弹簧圈生产的工艺流程,编制生产作业指导文件,识别关键和特殊工序,在生产加工的适当节点设置检验点,编制检验规程,以保证生产有法可参、检验有规可循。其次,关键、特殊工序应进行相应验证及确认工作,包括验证参数的范围、公差极限等,以保证工艺的可行性、可靠性、稳定性。检验规程内容完整全面,方法明确可操作,为产品放行把好质控关。
3.5 环境的风险因素
环境因素可以说是整个生产流程支撑保障。作为一款植入性医疗器械,一个洁净受控的生产环境是十分重要的。《医疗器械生产质量管理规范 附录植入性医疗器械》中明确规定了该类产品的主要工艺流程生产环境应不低于10000级[6]。企业应严格按照GB 50457-2019《医药工业洁净厂房设计标准》、YY/T 0033-2000等标准要求建立洁净厂房、制定相关规定、执行相应流程,确保洁净室(区)空气洁净度级别各项指标符合生产所对应的环境级别要求,以减少微粒、微生物等对产品造成的污染风险影响。
4.机械解脱弹簧圈体系核查关注点
综合机械解脱弹簧圈产品风险防控因素的分析,根据产品生产特点、工艺流程,并再次结合《医疗器械生产质量管理规范》、《医疗器械生产质量管理规范附录植入性医疗器械》的条款要求,对企业日常生产环节体系检查时,重点应关注以下几个方面:
4.1 人员方面
①企业应制定关键、特殊生产岗位人员、专职检验员的任职要求,并形成文件。实际人员的学历、经历、能力等应符合任职文件要求。如弹簧圈热处理岗位、激光焊接岗位、解脱机构装配岗位等都是十分重要的岗位,人员资质水平应保证能完全胜任岗位职责。②建立人员培训制度,执行定期人员培训计划,培训不仅涉及日常产品生产、检验方面,也应包含卫生学、微生物学、洁净区作业、安全防护等要求。培训应有效果评价记录。③应建立人员健康的管理要求,直接或间接与产品接触的人员应定期进行体检。体检人员应但不仅限于一线生产、检验、技术研发、仓管等,还应包括如可能进入洁净室内的如设备维护、保洁人员等其他辅助人员。
4.2 厂房设施、设备方面
①企业应明确产品末道清洁处理、组装、初包装、封口等生产环境应为万级净化环境,工艺布局和厂房条件是否与工艺文件规定一致,人流/物流尽量不要有重叠和往复,日常应按YY/T 0033-2000的要求定期进行环境监测。②企业应根据产品的生产特点、工艺流程配备必要的生产设备,依据各节点的检验规程配备与检验要求相适应的检验仪器。如生产设备主要有绕丝机、激光焊接机、热处理炉、定型工装、封口机等。检验设备主要有数显卡尺/激光测径仪、万能试验拉力机、气相色谱仪、试验工装(破裂、弯曲试验)等。③企业应能提供生产、检验仪器台账,生产设备应有设备操作规程、定期维护保养记录,以便生产人员能正确操作,并持续生产出质量稳定、符合要求的产品。检验仪器应有检验操作规程,并按规定的周期进行定期检定/校准,委外送检机构应有承检资质和承检范围,自校仪器也应参照JJG、JJF等系列标准制定相应的自校规程。
4.3 材料方面
①企业采购的原辅材料有适用的国家标准或行业标准的,企业采购品不低于对应标准要求;如无相应适用的国家标准或行业标准,企业需自己明确需采购品的技术指标、质量要求。如推送杆主材304不锈钢一般符合GB/T 1220-2007《不锈钢棒》、解脱机构主材镍钛合金应符合GB 24627-2009《医疗器械和外科植入物用镍-钛形状记忆合金加工材》等标准。而弹簧圈主材铂钨合金或铂依合金目前暂无可引用的国、行标,故企业应自行明确铂钨或铂依合金的质量标准,如主要元素的成分比例、有害元素的限值、材料理化性能、生物学评价要求等。②企业应建立合格供方名录并与主要供方签订质量技术协议,植入部分弹簧圈原丝或弹簧圈半成品(如适用)、解脱机构等材质应能提供原厂质保单证,包含材质成分、理化性能、炉号/批号信息等。
4.4 生产过程方面
①企业应按照实际产品生产流程,制定作业指导书,严格执行关键、特殊过程工艺验证和过程确认工作,并根据验证和确认的结果输出关键、特殊过程控制文件,明确作业参数及公差范围。主要工序包括弹簧圈热处理、弹簧圈/部件清洗、解脱机构组装、推送杆激光焊接、内包装封口、环氧乙烷灭菌等。现场应做到生产设备显示参数、作业指导书输出参数和验证/确认报告验证/确认的参数三者保持一致。②企业应根据实际生产检验点,编制相应的检验规程(进货、过程、成品检验等),尤其对于成品检验规程来说,是否能覆盖产品技术要求中所有技术指标、检验规则如检验频次、抽样数量等是否明确均应重点关注。
4.5 设计开发方面
除以上列举的几点关注方面外,现场核查时还应特别关注设计开发方面。产品的质量首先是设计出来的,其次才是制造出来的[7]。良好的设计开发活动可以从本质上发现并消除引起产品缺陷的根源,减少后续生产过程中引起质量波动的因素。除常规关注项目如设计文档是否完整、设计图纸是否齐全,性能验证是否充分外,还可进一步关注弹簧圈机械解脱结构设计是否合理、解脱操作是否方便、风险分析是否全面,并经过确认以保证机械解脱机构的可靠性[8]。
5.小结
本文从机械解脱弹簧圈的结构组成、性能指标、工艺特点等方面入手,通过分析人、机、料、法、环等方面在产品实现过程中存在的风险因素,对医疗器械检查员在此类产品的体系检查过程中,快速了解该类产品的整体结构特点及体系核查的关注重点,具有重要的指导作用。
